Tobias Revold1, Takele Abayneh1,2, Hege Brun-Hansen1, Signe L. Kleppe1,3, Ernst-Otto Ropstad1,
Robert A. Hellings4 and Henning Sorum1
1 Department of Companion Animal Clinical Sciences, Norwegian University of Life Sciences (previously Norwegian School of Veterinary Science), Oslo, Norway.
2 School of Veterinary Medicine, Addis Ababa University, Debre-Zeit, Ethiopia.
3 Aktiv Dyreklinikk, Hakadal, Norway.
4 Rikstotoklinikken Bjerke, Oslo, Norway.
Введение
Listeria monocytogenes является довольно широко распространённой в природе аэробной грамположительной палочкой, возбудителем острых заболеваний, передающимся пищевым путём [1, 2, 4]. Наиболее восприимчивы к нему овцы, козы и крупный рогатый скот [3], но заразиться могут любые животные и человек [1]. Чаще всего заболевание манифестирует в виде септицемии, энцефалита и абортов [2], но также могут присутствовать и глазные симптомы. У продуктивных животных такие симптомы чаще всего вызваны инфекциями центральной нервной системы [5]. Термин «силосный глаз» относится к листериозному керато-конъюнктивиту и включает в себя увеит, гипопион и миоз [6, 7]. Судя по результатам наблюдений, в Англии «силосный глаз» является самой распространённой клинической манифестацией листериозной инфекции у молочного скота, но исследование не включало в себя бактериологический анализ [6].
У людей инфекция L. monocytogenes чаще всего проявляется именно в виде конъюнктивита. У пациентов с менингитом листериозный конъюнктивит может быть как эндо-, так и экзогенным [8]. Также в литературе можно найти описания листериозного кератита и эндофтальмита у людей [8–12], который сопровождается характерным скоплением пигментированного гноя в передней камере глаза и повышением ВГД [8, 13]. Несмотря на то, что у лошадей этот возбудитель встречается значительно реже, чем у жвачных животных, есть описания случаев внутриматочной инфекции [16, 17], абортов [2, 14, 15], менингоэнцефалитов [18–20] и септицемии [17, 18, 21–24]. Авторам удалось найти в литературе только два случая керато-конъюнктивита у лошадей, вызванного L. monocytogenes [25, 26]. Данный доклад описывает четыре случая листериозного керато-конъюнктивита, произошедших в Норвегии. Далее будут изолированно описаны все четыре случая с клиническим течением заболевания и результатами микробиологического исследования и тестов на резистентность (in vitro и in vivo).
Описание случаев
Случай №1
12-летняя стандартбредная кобыла бурой масти, в течение 12 месяцев страдающая от одностороннего рецидивирующего керато-конъюнктивита, доставлена в Норвежскую Школу Ветеринарных Наук (NSVC). Лошадь кормили силосом в пластиковой упаковке и коммерческим концентрированным кормом. Ранее дважды предпринимались попытки лечить лошадь каплями фузидиновой кислоты (Fucithalmic, Dechra Veterinary Products A/S) и глазной мазью с окситетрациклином/пимиксином В (Terramycin-Polymyxin B, Pfizer Inc), которые не принесли положительного результата.
Офтальмологический осмотр проводился с помощью сфокусированного источника света и выявил умеренный блефароспазм правого глаза и умеренное количество слизисто-гнойного отделяемого. Конъюнктива века умеренно гиперемирована и отёчна. Реакция на прямой и собирательный световой пучок была в норме, без признаков миоза или бликов жидкости. В центральной части роговицы определялись множественные серо-беловатые помутнения, неравномерно прикрытые эпителием на площади примерно 5×5 мм. Вокруг этой зоны располагался отёчный стромальный валик, покрывающий примерно половину роговицы. Из этой зоны был взят мазок, направленный в лабораторию. Тест на окраску флюоресцеином был отрицательным.
Предварительно был поставлен диагноз бактериальный керато-конъюнктивит и начато лечение глазной мазью с хлорамфениколом (Chloramphenicol, Nycomed Pharma A/S) 3–4 раза в день. Из мазка был получен рост культур бактерий Micrococcus sp. и L. monocytogenes, и последние были распознаны как потенциальный возбудитель керато-конъюнктивита. Посев на резистентность выявил чувствительность к хлорамфениколу. Тем не менее, повторный осмотр через 15 дней не выявил улучшений. В очередном мазке с роговицы были обнаружены L. monocytogenes. Схему лечения решили изменить — назначен ампициллин местно (Pentrexyl 500 mg, Bristol-Myers Squibb Company, на 5 мл дистиллированной воды), глазные капли с гентамицином (Garamycin, Schering-Plough International) и капли с диклофенаком (Voltaren Ophtha, Novartis Healthcare A/S), все по 4 раза в день. Дополнительно лошадь получала инъекции прокаин пенициллина (Penovet vet, Boehringer Ingelheim Danmark A/S; 20 000 ЕД в/м 2 р/д) и гентамицина (Genta-Kel, Kela N.V.; 6,6 мг/кг в/в 1 р/д) в течение 5 дней. Состояние лошади начало постепенно улучшаться, и лечение продолжалось приблизительно 55 дней, после чего владелец прекратил давать лекарства, поскольку решил, что лошадь выздоровела.
Однако на 69-й день у лошади появились симптомы, похожие на изначальные, и снова были обнаружены культуры L. monocytogenes и Micrococcus sp. в мазке с роговицы. Начато лечение каплями с ципрофлоксацином (Cilox, Alcon Laboratories, Inc.) и диклофенаком (Voltaren Ophtha) по 2 р/д. На 114 день лошадь госпитализировали в лошадиную клинику при NSVS.
Офтальмологический осмотр выявил патологии роговицы и конъюнктивы. Тест на окраску мазка флюоресцеином снова был отрицательным. Мазки были взяты до и после соскоба эпителия с роговицы, поскольку он легко отделялся. L. monocytogenes были найдены в обоих мазках, но их было больше в мазке, взятом до соскоба. Роста грибковых культур не было. Цитологическое исследование выявило большое количество палочек и эпителиальных клеток. Нейтрофилов и грибков также не было найдено.
Под веко была установлена система для лаважа, подключённая к инфузионной помпе (Mila International). По ней поступала смесь из раствора бензилпенициллина (Penicillin 600 mg, Actavis Group, на 5 мл дистиллированной воды) и гентамициновых глазных капель. В дополнение, лошадь получала прокаин пенициллин (Penovet vet; 20 000 ЕД в/м 2 р/д) 10 дней и ведапрофен (Quadrisol vet; 1 мг/кг после начальной дозы в 2 мг/кг 1 р/д) 15 дней.
На 118-й день было обнаружено, что основание лаважной системы вызвало образование поверхностной язвы в дорзальной части роговицы. Система была переустановлена через назальную часть нижнего века с наложением мембранной подкладки. Дефект роговицы зажил без особенностей в течение недели, что свидетельствовало о нормальной регенеративной функции роговицы.
На 128-й день лечение бензилпенициллином было прекращено, поскольку цитологический анализ мазков больше не выявлял бактерий. Через лаважную систему теперь поступал только гентамицин. В последующие дни воспаление постепенно уменьшилось. На 140-й день снова появился острый керато-конъюнктивит. Были приготовлены стекла с соскобами, на одном из которых было найдено большое количество бактерий, идентичных L.monocytogenes, а также эпителиальных клеток. Интересно то, что этих бактерий на трёх оставшихся стёклах найдено не было. Снова было начато лечение раствором бензилпенициллина с гентамицином, подаваемых через лаважную систему, но финансовые возможности владельца больше не позволяли содержать лошадь в клинике. В связи с возбуждённым состоянием лошади, энуклеация не рассматривалась в качестве тактики лечения.
Лошадь выписали из клиники на 150-й день, и владелец продолжил лечение с использованием мази с окситетрациклином/полимиксином В (Terramycin-Polymyxin B) 3 р/д. К сожалению, через 4 недели лошадь попала в автомобильную аварию и её пришлось усыпить.
Случай № 2
7-летний серый пони Коннемара, мерин, доставлен в госпиталь NSVS с клинической картиной одностороннего керато-конъюнктивита в течение последних 6 месяцев. Пони кормили сеном и коммерческим концентрированным кормом, а также сеном из пластиковой упаковки, хранившимся на земле в загоне. И, несмотря на то, что лечение мазью хлорамфеникола (Chloramphenicol) и глазными каплями с диклофенаком (Voltaren Ophtha) казалось эффективным, симптомы снова появлялись после курса терапии. У пони отмечался выраженный блефароспазм левого глаза, умеренный периорбитальный отёк с гиперемированной конъюнктивой и слизистыми выделениями. Также в центральной зоне роговицы было небольшое, диффузно ограниченное эпителиальное и субэпителиальное уплотнение примерно 2–3 мм в диаметре. Признаков увеита не было. Мазок на бакисследование был взят перед тестом на окраску флюоресцеином, который окрасил центр уплотнения на роговице. Признаков неоваскуляризации не обнаружено. Соскоб роговицы выявил отделение эпителия на участке 4×4 мм. У пони заподозрили керато-конъюнктивит вирусного генеза. Начато лечение глазной мазью с идоксиридином (Iducher, Farmigea S.p.A.) 4 р/д, глазными каплями с фузидиновой кислотой (Fucithalmic) 2 р/д и каплями с диклофенаком (Voltaren Ophtha) 3 р/д. Цитологический анализ выявил, что возбудителем возможно являются листерии. Это было подтверждено, когда на посеве был получен рост L. monocytogenes. На основании результатов тестирования антимикробной чувствительности назначенные антибиотики были заменены на окситетрациклин/полимиксин В 3 р/д, противовирусная и противовоспалительная терапия продолжена.
На 12-й день уплотнение было еле различимо, конъюнктивита и отделяемого больше не было. Лечение окситетрациклином/полимиксином В и идоксирином было продолжено на 7 дней, а диклофенак отменён.
На 29-й день был проведён повторный осмотр. Основные симптомы вернулись и владелец снова начал лечение окситетрациклином/полимиксином В. В вентродорзальной части роговицы определялся диффузный стромальный отёк, окружающий несколько белых пятен диаметром около 1 мм. Слева определялся умеренный миоз, как следствие наружного увеита, однако он легко купировался после одной капли 1% раствора атропина (Atropin Minims, Bausch & Lomb U.K. Ltd.). Снова было назначено вышеописанное лечение с тетрациклином/полимиксином В, идоксиридином и диклофенаком. Также L. monocytogenes были найдены в мазке с роговицы. На 45-й день лошадь была признана здоровой по оценке владельца, и лечение прекращено.
На 76-й день симптомы снова вернулись. Начато лечение ципрофлоксациновыми глазными каплями (Cilox), продолжавшееся 4 недели.
В телефонном разговоре 6 лет спустя владелец сообщил, что с тех пор симптомы керато-конъюнктивита больше не проявлялись. Но с тех пор он перестал хранить сено на земле в загоне.
Случай №3
10-летняя исландская лошадь, которую содержали в табуне и кормили силосом в пластиковой упаковке, доставлена в госпиталь NSVS для осмотра на предмет керато-конъюнктивита правого глаза, продолжительностью 1 месяц. Несмотря на изначальное улучшение состояния на фоне терапии фузидиновой кислотой (Fucithalmic) дважды в день в течение 10 дней, симтомы вернулись после прекращения лечения. Была повторно назначена та же терапия, на этот раз не давшая никакого результата.
При осмотре отмечался умеренный блефароспазм правого глаза, средней выраженности периорбитальный отёк с гиперемией и слизистой конъюнктивой века. Немного дистальнее центра роговицы располагалась мутная сероватая область, видимая только при осмотре фокальным светом. Мазок на бакисследование был взят описанным ранее методом. Тест на окраску флюоресцеином — отрицательный. В ожидании результатов цитологической экспертизы было начато лечение глазной мазью с хлорамфениколом (Chloramphenicol) 3–4 раза в сутки и глазными каплями с диклофенаком (Voltaren Ophtha) 2–3 раза в день.
На 6-й день посев из мазка дал рост бактерий L. monocytogenes. Хлорамфеникол был заменён на капли с ципрофлоксацином (Cilox) 4 раза в день на 4 недели. К 30-му дню все основные симптомы исчезли, однако сохранялась умеренная слёзоточивость, в связи с чем решено было продолжить курс терапии ещё на 2 недели.
Через несколько дней после прекращения лечения симптомы вновь появились. На повторном осмотре на 48-й день клинически всё выглядело так же, как и в день поступления. Новый посев мазка с роговицы выявил наличие L. monocytogenes без изменения их спектра антибиотикорезистентности. Поскольку применение ципрофлоацина не дало значительного эффекта, его было решено заменить на хлорамфеникол (Chloramphenicol) в виде глазных капель 5 раз в день (на ночь в виде мази) в течение 6 недель. К 90-му дню владелец прекратил лечение без консультации с ветеринаром, после чего симптомы вернулись в течение нескольких дней. На 104-й день лошадь госпитализирована в NSVS.
Диффузно ограниченный участок повреждённого эпителия всё так же был бледным, но теперь покрывал уже почти 50% поверхности роговицы. В дорзальной части глаза отчётливо выделялось несколько тонких поверхностных сосудов, длиной около 7 мм. Слабо воспринимающая окраску флюоресцеином область диаметром около 5 мм располагалась на 5–10 мм выше вентро-назального лимба.
Для лечения решено было установить лаважную систему под верхнее веко, по которой на конъюнктиву поступали капли с хлорамфениколом (Chloramphenicol) сроком на 14 дней; помимо этого, были назначены инъекции прокаин пенициллина (Penovet vet; 20 000 ЕД в/м 2 р/д) в течение 10 дней. На 118-й день признаков конъюнктивита не было, но всё ещё присутствовала бледная область эпителия. Лошадь была отправлена домой с рекомендациями использовать мазь с хлорамфениколом следующие 14 дней.
Согласно результатам опроса владельца по телефону на 191-й день у лошади больше не появлялось симптомов конъюнктивита после окончания курса на 132 день. Примерно на 280-й день лошадь была осмотрена ветеринаром по поводу двустороннего конъюнктивита. Из обоих глаз были взяты мазки и отправлены на микробиологическое исследование в госпиталь NSVS. По результатам посевов была полученная смешанная флора, состоящая из Staphylococcus aureus на правом глазу и Pasturella sp на левом; обе культуры оказались чувствительны к хлорамфениколу. L. monocytogenes на этом этапе обнаружено не было.
 |
|
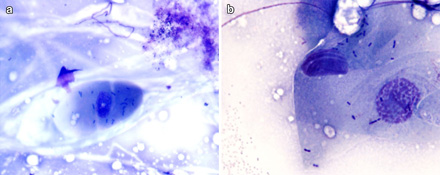
Илл. 1. а. Сквамозные эпителиальные клетки с типичными палочковидными бактериями. Обратите внимание на отсутствие клеток, участвующих в воспалительном процессе. Увеличение ×600, модифицированная окраска по Райту. b. Палочковидные бактерии очевидно являются L. monocytogenes. Увеличение ×1000, модифицированная окраска по Райту |
Случай № 4
Исландский пони, 8 лет, почти 6 месяцев страдающий левосторонним рецидивирующим керато-конъюнктивитом, представлен на осмотр в Bjerke Equine Hospital, Осло. Владелец впервые заметил изменения примерно 5 месяцев назад, когда лошадь была на пастбище, и описал симптомы блефароспазма со слизистым отделяемым из глаза. Несколько раз предпринимались попытки проводить местную терапию, не дававшие значительных результатов, однако точная симптоматика и применявшиеся препараты нам не известны. Три месяца спустя после обнаружения симптомов на роговице появилась поверхностная язва, вызванная посторонним предметом, замеченная ветеринаром при осмотре. В течение последних двух месяцев лошадь кормили сеном из пластиковой упаковки, хранившимся на земле. Постороннее тело было извлечено, проведена хирургическая обработка отслаивающегося эпителия вокруг язвы. Глаз смазывали мазью с хлорамфениколом трижды в день в течение недели.
Через 2 месяца после удаления инородного тела лошадь была доставлена в Bjerke Equine Hospital по поводу продолжающихся проблем с левым глазом. На осмотре отмечался средней степени блефароспазм с умеренной слезоточивостью. Признаков наружного увеита не было. Роговица внешне выглядела вялой, по центру располагалась неоднородная рифлёная зона эпителия. Окраска люоресцеином и Бенгальским розовым была отрицательной. Других отклонений от нормы обнаружено не было.
Была назначена местная терапия в виде сульфата неомицина, сульфата полимиксина В и дексаметазона (Maxitrol) 3 раза в день. Владелец сразу отметил улучшение состояния лошади, и на повторном осмотре через неделю явления блефарроспазма и отделяемого из глаза уже полностью регрессировали. Поверхность роговицы была блестящей и ровной. Единственной замеченной аномалией была небольшая субэпителиальная область белёсого цвета, менее 1 мм в диаметре по центру роговицы. Лечение было продолжено ещё на одну неделю.
Спустя 2–3 дня после окончания лечения владелец заметил, что лошадь испытывает дискомфорт в области левого глаза. Было начато лечение в виде местного применения
0,1% дисодиум фосфата дексаметазона (Spersadex, OmniVison AB) 3 раза в день. Это не дало положительного эффекта, и лошадь через 2 недели была доставлена на повторный осмотр, где был отмечен выраженный блефароспазм и значительная слезоточивость, а также слизистое отделяемое из-под нижнего века. В центральной части роговицы имелась поверхностная язва размерами 5×8 мм, сопровождающаяся довольно умеренным диффузным отёком. Отмечался умеренный наружный увеит и миоз зрачка. Неоваскуляризации на роговице не было. В результате теста на окраску флюоресцеином было получено слабое окрашивание краёв язвы.
Эпителий был аккуратно отделён и направлен на цитологический анализ, одновременно с удалением отслаивающегося эпителия на площади около 15×15 мм. С поражённого участка роговицы взят мазок на бактериологическое исследование.
В ожидании результатов анализов лошадь была госпитализирована и начато лечение окситетрациклином/полимиксином В (Terramycin-Polymyxin B) местно 3 раза в день. Один раз были применены капли 1% атропина (Atropin Minims), в результате чего был получен выраженный мидриаз. Дополнительно лошадь получала инъекции меглумин флуниксила (Finadyne Vet, Intervet International B.V; 1,1 мг/кг в/в 1 р/д) в течение 5 дней. Спустя 5 дней у лошади уже не отмечалось признаков дискомфорта или воспаления; язва зажила, окраска флюоресцеином было отрицательна. В этот день лошадь была выписана, и владелец продолжал антибиотикотерапию дома в течение следующих 7 дней. Цитология выявила присутствие большого количества палочковидных бактерий, собранных в короткие цепочки, идентифицированных как L. monocytogenes. Также присутствовали водянистые эпителиальные клетки (илл. 1). Посев бактерий из мазка с роговицы выявил наличие смешанной флоры с преобладанием L. monocytogenes.
Лошадь была повторно осмотрена через 5 дней после отмены антибиотиков, то есть 12 дней после выписки. При осмотре не было выявлено блефоспазма или отделяемого из глаза. Конъюнктива не воспалённая, поверхность роговицы блестящая, гладкая и здоровая. Признаков язвы на роговице, отёка или неоваскуляризации не было. Флюоресцеин и Бенгальский розовый не окрашивали роговицу. Однако под увеличением были заметны 3 небольшие, менее 1 мм, белёсые области в зоне бывшей язвы. Посевы мазков больше не давали роста бактерий. Через четыре месяца после выписки из больницы владелец сообщил, что симптомов больше не появлялось.
Краткий обзор ключевых клинических симптомов, результатов посевов и лечения во всех четырёх случаях представлен в таблице 1.
Таблица 1. Ключевые симптомы, результаты диагностики и лечения во всех четырёх случаях
Лечение до консультации у врача и краткосрочные курсы медикаментозной терапии в ожидании результатов посева не включены в таблицу.
Курсивом выделено лечение вне клиники; подчёркиванием — антибактериальная терапия; BID — 2 раза в день; TID — 3 раза в день; QID — 4 раза в день; CF — постоянная подача лекарства при помощи лаважной системы.
1 Ветеринарный диагноз, 2 По наблюдениям владельца
a В основном 3–5 дней после взятия проб; b Местно антибиотики назначали после получения результатов бакпосева
* прекращение стационарного лечения по желанию владельца; ** эвтаназия, не связанная с данным заболеванием
Бактериологический анализ
Во всех случаях материалы собирались во время первичного осмотра, повторных и контрольных осмотров. Для транспортировки в госпиталь NSVS использовались стерильные хлопковые ватные палочки в транспортной среде Эймса без угля (Copan M40 Transystem, Copan Italia S.p.A.); после доставки посев был произведён в течение нескольких часов.
Посев и инкубация
Образцы во всех случаях выращивались параллельно на двух чашках Петри с агаром (кровяной агар №1 Difco Laboratories Inc.), одна из которых выставлялась при Т 37°C и 5% содержании CO2 в атмосфере на 24 часа, а вторая — в анаэробной среде в течение 48 часов. Образцы также окунались в раствор бульона и снова помещались на кровяной агар на сутки при Т 37°C и 5% содержании CO2 в атмосфере в том случае, если после первых суток не было получено роста.
Помимо этого, образцы помещались на бромтимоловый синий агар для выявления культур Enterobacteriaceae и других грамотрицательных палочек.
Для выявления других бактерий, мазки из всех образцов подвергались окраске по Граму.
Изучение полученных культур и биохимические тесты
Полученные культур тщательно осматривались, отмечались морфологические и прочие особенности, такие, как наличие зон гемолиза. Образцы окрашивались по Граму. Потенциальные листерия-подобные бактерии высевались штрихом рядом с культурами Staphylococcus pseudintermedius и Rhodococcus equi для обнаружения CAMP-феномена.
Биохимические тесты листерия-подобных бактерий включали в себя каталазный тест, ферментацию глюкозы, разложение эскулина и H2S. Также проводились тесты на подвижность (в полужидком растворе агара при 22 и 37°С), окраску метиловым красным, тест Voges Proskauer.
Результаты всех биологических экспертиз собраны в таблице 1. Бактерии, подозреваемые в качестве L. monocytogenes, были 1 мм в диаметре, выпуклые, цветом от серого до белого с чёткой зоной гемолиза, расширяющейся на 0,5 мм от границы колонии. На бромтимоловом синем агаре роста бактерий получено не было. На образцах не было следов антибиотиков, что подтверждено контрольным выращиванием S. pseudintermedius на кровяном агаре в атмосфере CO2. Те же колонии были получены в результате инкубации после обогащения агара бульоном через 1, 2 и 3 дня. Во всех четырёх случаях было получено от малого до умеренного количества колоний в чистой культуре с характеристиками, идентичными L. monocytogenes.
Фенотипические и биохимические особенности β-гемолитических колоний
β-гемолитические колонии из мазка с роговицы состояли из бактерий, которые были грамположительными палочками одинаковых размеров. Они были каталазно положительными, выделяли глюкозу, не разлагали эскулин и гипопурат, вырабатывали H2S, и давали отрицательный результат при окраске метиловым красным и тесте Voges Proskauer. Они оставались неподвижными в полужидком агаре при 37°С, но двигались при 22°С. Они также давали слабую CAMP-реакцию с S. pseudintermedius, но по отношению к R. equi были САМР-негативными. Биохимический и фенотипический профиль подтвердили, что данные бактерии являются L. monocytogenes.
Серотипирование и тесты на антибиотикорезистентность
Выращенные образцы L. monocytogenes относились к CCUG 15527 (серотип 1) и CCUG 7995 (серотип 4), что говорит о фенотипическом сходстве этих колоний и их гемолитических зон.
Реакция агглютинации, выполненная на стёклах с антителами против Listeria O тип 1 и Listeria O тип 4 дала те же результаты. Тесты на антимикробную чувствительность выполнялись методом растворённых таблеток с пробами на 12 лекарств: пенициллин, цефалексин, амоксициллин, амоксицилин с клавулановой кислотой, сульфадиазин/триметоприм, тетрациклин, гентамицин, линкомицин, хлорамфеникол, фузидиновая кислота, энрофлоксацин и колицин. Для тестов использовался агар Мюллер-Хинтон (МН). В результате выяснилось, что во всех четырёх случаях бактерии были слабо- или нечувствительны к фузидиновой кислоте; L. monocytogenes из случаев 3 и 4 (при первом осмотре и при всех последующих) были умеренно чувствительны к энрофлоксацину. Ко всем остальным антибиотикам во всех случаях бактерии оказались чувствительны.
Обсуждение
Четыре вышеприведённых случая керато-конъюнктивита у лошадей, вызванного L. monocytogenes, являются единственными описанными в Скандинавии.
L. monocytogenes — факультативный внутриклеточный патоген, широко распространённый в окружающей среде, где большинство животных не защищены от микроорганизмов на протяжении жизни. Бактерии вызывают заболевание независимо от того, может ли иммунная система животного с ними бороться, или же они появляются в количестве, многократно превосходящем его защитные механизмы [2, 9, 11]. Хотя для них привычен оральный путь, они могут также попасть в организм через слизистую носа или через открытые раны. Конъюнктива в данном случае тоже рассматривается в качестве возможного входного пути [24, 34]. По сравнению с часто описываемыми офтальмологическими симптомами листериоза у крупного рогатого скота, у лошадей глазная листериозная инфекция кажется очень редкой — до сих пор в литературе можно было найти только 2 подобных случая.
Во всех описанных здесь случаях до обращения к специалистам у животных длительное время присутствовали симптомы повреждения роговицы. В связи с этим, достоверно выяснить, каким путём возбудитель попал в организм, не представляется возможным. Серотип O тип 1 L. monocytogenes, широко распространённый в окружающей среде, встречающийся в силосе и у системно болеющих животных [22], был бактериологически выделен во всех четырёх случаях, описанных здесь. Это согласуется с утверждением, высказанным Evans et al. [26], что силос является наиболее вероятным источником инфекции, а также что глазной листериоз вызывается теми же штаммами, которые являются причиной системных заболеваний животных.
Интактная здоровая роговица имеет высокую резистентность к бактериальным инфекциям, что обеспечивается постоянным выделением секрета слёзных желёз обладающего антимикробными свойствами, а также физическим барьером в виде здорового эпителия [27]. Тем не менее, в исследовании на морских свинках было обнаружено, что L. monocytogenes могут проникать даже через здоровый эпителий [27]. В дальнейшем в ходе экспериментов удавалось достаточно легко вызывать конъюнктивит и/или керато-конъюнктивит у морских свинок и кроликов, просто располагая L. monocytogenes непосредственно на роговице, в то время как аппликация аналогичным способом множества других бактерий не вызывала инфекцию [29]. Кстати, эта характерная особенность вызывать конъюнктивит и кератит даже была предложена в 1939 году в качестве метода идентификации культуры как L. monocytogenes [30]. Было также выявлено, что этот эффект является дозозависимым [9]. Таким образом, может ли попадание на роговицу вызывать керато-конъюнктивит у лошадей, остаётся спорным вопросом, поскольку толщина эпителия на роговице у них в 3 раза больше по сравнению с кроликами [31, 32, 33].
Существует известная и доказанная связь между кормлением силосом и заболеваемостью листериозом [5, 34–37]. У лошадей системная инфекция L. monocytogenes обычно связана с кормлением силосом, кормлением низкокачественным сеном [17] и с выпасом на пастбищах с травой и клевером, где ирригация осуществляется разбрызгиванием или наводнением [14]. Сено или силос в пластиковой упаковке часто используется для кормления лошадей в Норвегии, особенно в зимний сезон, и оно представляется наиболее вероятным источником L. monocytogenes в описанных выше случаях. Траву для силоса выращивают в холодном влажном климате, что приводит к низкому содержанию сахаров и высокому содержанию воды по сравнению с выращенной в тёплом климате травой. Это может привести к замедлению ферментации, что является наилучшими условиями для развития в траве L. monocytogenes [38]. Низкое качество сена или загрязнение сена землёй создают другие возможные способы контаминации.
Помимо этого, опасность заражения возникает, когда источник сена располагается выше головы животного. Таким образом, во время кормления падающие сверху травинки могут попадать животному в глаза, вызывая контаминацию листериями [35, 37, 39]. Такие способы кормления редко применяют для лошадей. Тем не менее, фураж часто бывает замёрзшим или плотно спрессованным, что затрудняет его доступность для животного. Выдёргивая пук сена из такого тюка, лошадь может подкинуть вырванные травинки вверх, что приводит к тем же результатам, что и высокое расположение источника пищи. Так что возможно, что способы кормления в описанных здесь случаях стали причиной развития инфекции, хотя точно это выяснить не представляется возможным.
Известно, что применение кортикостероидов повышает вероятность развития инфекии L. monocytogenes у лабораторных животных [1]. В случае листериозного кератита у лошади, описанном Sanchez et al. [25], животное получало топикальные стероиды перед появлением симптомов. В нашем случае, только одна из четырёх лошадей (№ 4) получала топикальные стероиды до выявления листерий, в остальных случаях не было отмечено признаков иммуносупрессии.
L. monocytogenes обычно обнаруживается в небольших количествах при культивации, иногда совместно с другими бактериями. Этот факт важен для бактериолога, и может свидетельствовать о внутриклеточном росте L. monocytogenes. Малое количество листерий при посеве может объясняться малым количеством задокументированных случаев. Наряду с этим, практикующие клиницисты и бактериологи редко подозревают именно эти бактерии в качестве возбудителя кератитов, и могут пропускать некоторые случаи [9, 11, 26]. Тщательное изучение образцов соскобов с роговицы может значительно помочь выявить L. monocytogenes, однако, бактерии могут быть найдены только в одном из нескольких приготовленных препаратов, как произошло в нашем первом случае.
Листериозная инфекция обычно лечится препаратами пенициллина и тетрациклина, что особенно эффективно на ранних стадиях системного заболевания. Однако если острые симптомы уже развились к моменту начала курса антибиотикотерапии, исход, скорее всего, будет фатальным [2].
Установлено, что комбинированное применение гентамицина и пенициллина является наиболее эффективным методом по сравнению с любым из них по отдельности. Такая комбинация успешно применяется как системно, так и местно при острых случаях заболевания листериозным кератитом у людей [9].
На основании этих исследований пенициллины (ампициллин или пенициллин G) применялись совместно с гентамицином системно и местно в случае № 1. И здесь требуется небольшой комментарий: дело в том, что низкая липофильность пенициллина G ограничивает его способность проникать через барьер липофильного эпителия роговицы.
И, хотя топическое применение пенициллина рекомендовано для людей, страдающих глазной формой листериоза [40], низкая проницаемость через эпителий может сильно ограничить его эффективность против внутриклеточно расположенных листерий. Интересно, что в нашем исследовании лошади в большинстве случаев имели интактный эпителий, покрывающий повреждения роговицы, что подтверждалось флюоресцеиновым тестом. Далее, аминогликозиды могут инактивироваться в плазме в течение 8–48 часов в присутствие Е-лактамов [41]. Чтобы минимизировать инактивацию, в случае № 1 была использована система постоянной подачи лекарства на роговицу. Степень инактивации аминоглизидов в таких условиях пока не изучена, однако такая комбинация методов показала себя эффективной, но, вероятно, продолжительность лечения оказалась недостаточной.
Существует много иных рекомендаций по лечению глазных листериозных инфекций. В обоих описанных ранее случаях листериозного керато-конъюнктивита у лошадей был с успехом применён кинолон (в одиночку или в комбинации [25, 26]. Основываясь на этих результатах, кинолон ципрофлоксацин применяли в случаях 1–3, но положительного результата удалось добиться лишь во 2-м случае. Это лечение проводилось владельцами, так что успешность его вполне может зависеть от их добросовестности. С другой стороны, кинолон офлоксацин не справляется с лечением листериозного кератита у людей, при том, что положительного результата удаётся добиться in vitro [10]. Интересно, что образцы из случаев 3 и 4 оказались умеренно чувствительны к единственному представленному в тесте кинолону — офлоксацину.
Описанные здесь образцы оказались чувствительны к большинству из тестированных антибиотиков, но умеренно чувствительны или даже резистентны в некоторых случаях к фузидиновой кислоте. Она в Норвегии применяется в качестве препарата первого выбора при подозрении на бактериальную природу кератита или конъюнктивита, и была использована перед обращением в госпиталь минимум в двух случаях — № 1 и № 3.
Несмотря на крайне продолжительное безуспешное лечение хлорамфениколом в случае № 3, госпитализация и интенсификация терапии с помощью постоянного поступления лекарства по лаважной системе привели к разрешению симптомов, хотя в конце было решено заменить его на системное введение пенициллина в течение 10 дней. И хотя нельзя исключать вероятность повторного заражения после полного выздоровления, мы считаем, что возвращение симптомов у этих лошадей после прекращения лечения связано с неполным устранением бактерий из организма. В пользу этой теории свидетельствует то, что симптомы всегда проявлялись только с одной стороны, вновь возвращаясь на той же самой стороне при рецидиве. В заключение, мы считаем, что некоторые антибиотики могут с успехом применяться в подобных ситуациях, но особого внимания требуют интенсивность и продолжительность лечения, если L. monocytogenes была распознана как возбудитель керато-конъюнктивита. Также важно продолжать наблюдать за пациентами в первое время после прекращения лечения. Сложности в лечении, схожие с описанными здесь, не раз были зарегистрированы и в человеческой офтальмологии [9–11, 42].
Выводы
L. monocytogenes должна рассматриваться как потенциальный возбудитель в случаях бактериального керато-конъюнктивита у лошадей, особенно, если лошадь кормили силосом.
В целях распознавания возбудителя особое внимание требуется от клиницистов, а также от бактериологов. В целом слабая реакция на предпринимаемые меры и высокая частота рецидивов свидетельствует о том, что следует особенно тщательно относиться к выбору антибиотикотерапии и продолжительности и интенсивности лечения, если L. monocytogenes определена как возбудитель кератита у лошади. Необходимо провести дальнейшие исследования, чтобы выяснить, является ли L. monocytogenes первичным возбудителем, или же она вторично присоединяется при уже существующих повреждениях роговицы.
Литература
1. Gray ML, Killinger AH. Listeria monocytogenes and listeric infections. Bacterid Rev. 1966;30:309–74.
2. Radostits OM, Blood DC, Gay CC. Diseases caused by Listeria spp. In: Veterinary medicine. 8th edition. London: Bailliere Tindall; 1994, p. 660–6.
3. Wesley IV. Listeriosis in animals. In: Ryser ET, Marth EH, editors. Listeria, listeriosis, and food safety. New York: Marcel Dekker; 1999. p. 39–40.
4. Schlech WF. Listeriosis: epidemiology, virulence and the significance of contaminated foodstuffs. J Hosp Infect. 1991;19:211–24.
5. Cullen CL, Webb AA. Ocular manifestations of systemic disease. Part 4: food animals. In: Gelatt KN, Gilger BC, Kern TJ, Ames IA (editors) Veterinary Ophthalmology. Volume 2. 5th edition. : Wiley-Blackwell; 2013. p. 2071–101.
6. Erdogan HM, Cetinkaya B, Green LE, Cripps PJ, Morgan KL. Prevalence, incidence, signs and treatment of clinical listeriosis in dairy cattle in England. Vet Rec. 2001;149:289–93.
7. Pearce JW, Moore CP. Food animal ophthalmology. In: Gelatt KN, Gilger BC, Kern TJ, Ames IA, editors. Veterinary ophthalmology. Volume 2. 5th edition. Wiley-Blackwell; 2013. p. 1610–74.
8. Eliott D, O'Brien TP, Green WR, Jampel HD, Goldberg MF. Elevated intraocular pressure, pigment dispersion and dark hypopyon in endogenous endophthalmitis from Listeria monocytogenes. Surv Ophthalmol. 1992;37:117–24.
9. Zaidman GW, Coudron P, Piros J. Listeria monocytogenes keratitis. Am J Ophthalmol. 1990;109:334–9.
10. Altaie R, Fahy GT, Cormican M. Failure of Listeria monocytogenes keratitis to respond to topical ofloxacin. Cornea. 2006;25:849–50.
11. Eiferman RA, Flaherty KT, Rivard AK. Persistent corneal defect caused by Listeria monocytogenes. Am J Ophthalmol. 1990;109:97–8.
12. Duch ST, Quintana MC, Pujol OG. Listeria monocytogenes endophthalmitis. Acta Ophthalmol. 1991 ;69:108–10.
13. Alkatan HM, Al-Dhibi HA, Edward DP, Al-Rajhi AA. Pigmented hypopyon in association with Listeria monocytogenes endophthalmitis: An interesting case report following refractive surgery procedure with literature review. Middle East Afr J Ophthalmol. 2014;21:40–3.
14. Mason RW, Brennan RG, Corbould A. Listeria monocytogenes abortion in a mare. AustrVet J. 1980;56:613.
15. Welsh RD. Eguine abortion caused by Listeria monocytogenes serotype 4. J Am Vet Med Assoc. 1983;183:291.
16. Mayer H, Kinler M, Sickel E. Listeriose in einem Reitpferdebestand. Berl Munch Tierarztl Wochenschr. 1976;89:209–11.
17. Higgins R, Goyette G, Sauvageau R, LemaireT. Septicemia due to Listeria monocytogenes in a newborn foal. Can Vet J. 1987;28:1–2.
18. PirsT, Zdovc I, Gombac M, SvaraT, Juntes P, Vengust M. Listeria monocytogenes septicaemia in a foal. Slov Vet Res. 2005;42:49–53.
19. Clark EG, Turner ES, Boysen BG, Rouse BT. Listeriosis in an Arabian foal with combined immunodeficiency. J Am Vet Med Assoc. 1978;172:363–6.
20. Rutten M, Lehner A, Pospischil A, SydlerT. Cerebral listeriosis in an Adult Freiberger Gelding. J Comp Path. 2006;134:249–53.
21. Monteiro F, Wong D, Scarratt WK, Buechner-Maxwell V, Crisman M. Listeria monocytogenes septicaemia in two neonatal foals. Eguine Vet Educ. 2006;18:27–31.
22. Gudmundsdottir KB, Svansson V, Aalbaek B, Gunnarsson E, Sigurdarson S. Listeria monocytogenes in horses in Iceland. Vet Rec. 2004;155:456–9.
23. Jose-Cunilleras E, Hinchcliff KW. Listeria monocytogenes septicaemia in foals. Eguine Vet J. 2001;33:519–22.
24. Wilkins PA, Marsh PS, Acland H, Piero FD. Listeria monocytogenes septicemia in a Thoroughbred foal. J Vet Diagn Invest. 2000; 12:173–6.
25. Sanchez S, Struder M, Currin P, Barell P, Bounous D. Listeria keratitis in a horse. Vet Ophthalmol. 2001;4:129–217.
26. Evans K, Smith M, McDonough P, Wiedmann M. Eye infections due to Listeria monocytogenes in three cows and one horse. J Vet Diagn Invest. 2004;16:464–9.
27. English R, Gilger BC. Ocular immunology. In: Gelatt KN, Gilger BC, KernTJ, Ames IA, editors. Veterinary Ophthalmology. Volume 1. 5th edition. Wiley- Blackwell; 2013. p. 273–299.
28. Racz P,Tenner K, Szivessy K. Electron microscopic studies in experimental keratoconjunctivitis listeriosa. I: Penetration of Listeria monocytogenes into corneal epithelial cells. Acta microbiol Acad Sci Hung. 1970;17:221–36.
29. Morris MC, Julianelle LA. A study of an infection induced experimentally with bacterium monocytogenes. Am J Ophthalmol. 1935;18:535–41.
30. Julianelle LA, Pons CA. Identification of Listeria monocytogenes. Proc Soc Exp Biol Med. 1939;40:362–3.
31. Ledbetter EC, Scarlett JM. In vivo confocal microscopy of the normal eguine cornea and limbus. Vet Ophthalmol. 2009;12(Supplement l):57–64.
32. Pirie CG, Alario AF, Barysauskas CM, Gradil C, Uricchio CK. Manual corneal thickness measurements of healthy eguine eyes using a portable spectral-domain optical coherence tomography device. Eguine Vet J. 2014;46:631–4.
33. Reiser BJ, IgnacioTS, Wang Y.Taban M, Graff JM, Sweet P, et al. in vitro measurement of rabbit corneal epithelial thickness using ultrahigh resolution optical coherence tomography. Vet Ophthalmol. 2005;8:85–8.
34. Braun U, Stehle C, Ehrensperger F. Clinical findings and treatment of listeriosis in 67 sheep and goats. Vet Rec. 2002;150:38–42.
35. Morgan JH. Infectious keratoconjunctivitis in cattle associated with Listeria monocytogenes. Vet Rec. 1977;100:113–4.
36. Kummeneje K, MikkelsenT. Isolation of Listeria monocytogenes Type 04 from cases of keratoconjunctivitis in cattle and sheep. Nord Vet Med. 1975;27:144–9.
37. Welchman D, Hooton JK, Low JC. Ocular disease assosiated with silage feeding and Listeria monocytogenes in fallow deer. Vet Rec. 1997;140:684–5.
38. Fenlon DR. Listeria monocytogenes in the natural environment. In: Ryser ET, Marth EH, editors. Listeria, listeriosis and food safety. 2nd edition. New York: Marcel Dekker; 1999. p. 21–37.
39. Walker JK, Morgan JH. Ovine ophthalmitis associated with Listeria monocytogenes. Vet Rec. 1993;132:636.
40. Regnier A. Antimicrobials, Antiinfalmmatory Agents, and Antiglaucoma Drugs. In: Gelatt KN, Ames IA, editors. Veterinary ophthalmology. Volume 1. 4th edition. Blackwell Publishing; 2007. p. 288–331.
41. Riff LJ, Thomason JL. Comparative aminoglycoside inactivation by B-lactam antibiotics. Effect of a cephalosporin and six penicillins on five aminoglycosides. J Antibiot. 1982;35:850–7.
42. Tay E, Rajan M, Tuft S. Listeria Monocytogenes sclerokeratitis. A case report and literature review. Cornea. 2008;27:947–9.
Источник: Acta Veterinaria Scandinavica (2015) 57:76. This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
СВМ № 1/2016