Karen Dirksen, DVM, PhD, Hille Fieten, DVM, PhD
Department of Clinical Sciences of Companion Animals, Faculty of Veterinary Medicine, Utrecht University, Utrecht, The Netherlands
Основные положения
- Медная гепатопатия собак во многом похожа на болезнь Вильсона у людей.
- Медная гепатопатия собак встречается у некоторых пород собак, и между породами существуют различия в наследовании мутации.
- Клинические проявления обычно появляются поздно, после того как произошли необратимые повреждения печени из-за длительного накопления меди.
- Самым используемым хелатором является D-пеницилламин (DPA), и эффективнее всего лечение работает на ранних стадиях.
- Диета с низким содержанием меди и высоким содержанием цинка помогает избежать накопления меди в печени у собак со сложными формами медного токсикоза.
Вступление: патофизиология накопления меди и клеточный метаболизм меди
Гомеостаз меди
Медь является ключевым элементом для множества жизненных функций организма, однако в свободной форме она является токсичной. Поэтому накопление меди, её распределение и выведение поддерживается в строгом балансе [1]. Получаемая с пищей медь всасывается преимущественно в тонком кишечнике. Всасывание меди энтероцитами опосредуется высокоаффинным транспортёром CTR1. В портальной крови медь преимущественно связывается с альбумином и доставляется в гепатоцеллюлярный цитозоль через апикально расположенный CTR1. Печень является наиболее важным органом в метаболизме меди и отвечает за её хранение, перераспределение в других тканях и органах и выведение её избытков. Небольшая часть избыточной меди выводится почками.
Клеточный метаболизм меди
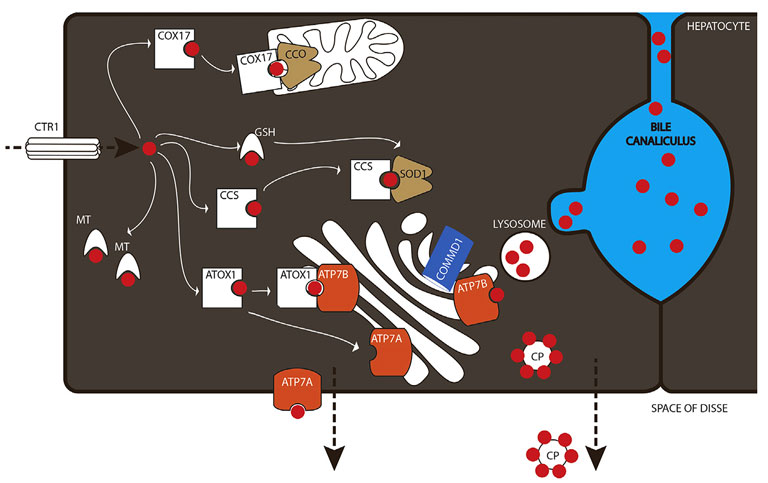
После попадания в гепатоцит, медь сразу связывается с протеинами в целях предотвращения окислительных повреждений (рисунок 1). Эту роль выполняют в основном металлотионеин (MT) и глютатионин (GSH), они связываются с медью и хранят её. Специальные белки-доставщики — шапероны меди — обеспечивают её безопасный транспорт к месту назначения [2]. Циклооксигеназа-17 (COX17) является шапероном меди для цитохром-С-оксидазы (CCO), которая располагается во внутренней митохондриальной мембране. CCO является терминальным энзимом в митохондриальной респираторной цепи и поэтому играет ключевую роль в аэробном метаболизме энергии. Шаперон меди для супероксиддисмутазы (CCS) доставляет медь к супероксиддисмутазе (SOD1), которая участвует в защите от окислительных повреждений. Антиоксидант-1 шаперон (ATOX1) является медным шапероном для транспортёров меди АТФ7А и АТФ7Б (ATP7A и ATP7B). Обе АТФазы в нормальных условиях находятся в аппарате Гольджи. Когда внутриклеточная концентрация меди возрастает, они отпочковываются от аппарата Гольджи и направляются в свои места назначения. В аппарате Гольджи АТФ7Б забирает 6 атомов меди, соединяя её с ферроксидазным церулоплазмином (CP), который выделяется в кровь. Церулоплазмин выполняет функцию транспортного протеина меди в крови. В условиях избытка меди в организме АТФ7Б перемещается к лизосомальным или апикальным мембранным компонентам и провоцирует экскрецию избыточной меди в желчь [4]. Раньше считалось, что главной ролью АТФ7А является захват меди в тонком кишечнике, однако последние исследования показали, что АТФ7А является важным звеном в цепи мобилизации и перераспределения меди из зон депонирования в печени в ткани, где возникла её острая нехватка [5]. Контроль за стабильностью и качеством работы АТФаз выполняет белок COMMD1; кроме этого он, предположительно, регулирует экскрецию меди желчью [6].
 |
| Рисунок 1. Гепатоцеллюлярный метаболизм меди. Медь попадает в клетку с помощью CTR1 и немедленно связывается с MTs и/или GSH для предотвращения окислительного повреждения. Шапероны COX17, CCS и ATOX1 переносят медь в соответствующие молекулы назначения CCO, SOD1 и ATP7A/ATP7B. ATP7A и ATP7B участвуют в экспорте меди в кровь (ATP7A и ATP7B) или в желчь (ATP7B). COMMD1 взаимодействует с обеими АТФазами |
Расстройства метаболизма желчи у людей
Болезнь Вильсона
Это аутосомальное рецессивное заболевание, при котором медь накапливается в печени и нервных волокнах. Болезнь проявляется как гепатопатия, и/или неврологические, или психические симптомы. Болезнь Вильсона может быть результатом нескольких мутаций в транспортёре меди ATФ7Б. Из-за его роли во включении меди в СР это может приводить к низкой концентрации СР в сыворотке, что является одним из диагностических критериев. Кроме того, у пациентов с болезнью Вильсона может быть увеличена экскреция меди с мочой. Обычное лечение состоит из хелатирования меди на протяжении всей жизни с приёмом D-пеницилламина [7].
Не-вильсонские формы медного токсикоза
Другие расстройства накопления меди у людей, генетическая причина которых пока не выяснена, включают индийский детский цирроз [8], эндемический тирольский детский цирроз [9] и идиопатический медный токсикоз [10]. При этих состояниях в первую очередь повреждается печень. Считается, что причина наблюдаемой клинической картины кроется в генетической предрасположенности в сочетании с неправильным питанием.
Болезнь Менкеса
Мутация в белке транспортёра меди АТФ7А приводит к сцепленной с Х-хромосомой, рецессивно наследуемой недостаточностью меди в связи с нарушением её абсорбции в тонком кишечнике. Пациенты страдают от острых неврологических нарушений и не могут нормально расти и развиваться, что обычно приводит к летальному исходу, несмотря на парентеральную заместительную терапию [11].
Наследственная медная гепатопатия у собак
Бедлингтон-терьер
Исторически бедлингтон-терьер был первой породой собак, на которой интенсивно изучалась медная гепатопатия (медь-зависимая гепатопатия) собак и у которой были выявлены ответственные за это мутации. Болезнь характеризуется циррозом печени, вызванным массивным интралобулярным накоплением меди (рис. 2А, D). Уровень меди в печени может достигать 10,000 мг на кг сухого веса. Причиной является большая делеция во втором экзоне COMMD1-гена, ведущая к аутосомальному рецессивному медному токсикозу [12]. После разработки ДНК-теста к этой мутации частота встречаемости этого заболевания среди бедлингтон-терьеров значительно сократилась. В последнее время наблюдались случаи не связанного с COMMD1 медного токсикоза у бедлингтон-терьеров. Было обнаружено, что вариации в транспортёрах металлов ABCA12 связаны с COMMD1-независимым токсикозом; однако убедительных функциональных данных, подтверждающих участие этого гена, не было [13].
Лабрадор-ретривер
Лабрадор-ретривер стал второй породой, у которой был выявлен наследственный характер медной гепатопатии. У собак этой породы в течении заболевания чётко прослеживается комплекс наследственных паттернов, и генетика, наряду с диетой, играет определяющую роль в его развитии [14–18]. Недавно проведённое обширное генетическое исследование выявило определённую связь между повышенной концентрацией меди в печени с мутацией в гене болезни Вильсона (АТФ7Б). При этом сопутствующая мутация в гене болезни Менкеса (АТФ7А) ослабляет процесс накопления печени медью, в результате у такой особи не развивается клиники дефицита меди. Примерно 12% всех наследственных явлений можно объяснить двумя определёнными мутациями. Этот пробел можно объяснить влиянием факторов окружающей среды и/или наличием ещё не выявленных мутаций. Функциональные исследования клеточных линий продемонстрировали, что мутация АТФ7Б, фиксированная в аргинине, приводила к нарушению удержания белка в эндоплазматическом ретикулуме в условиях избытка меди. Мутация АТФ7А не повлияла на транспорт протеина, но привела к снижению выведения меди в фибробластах кожи, что свидетельствует о функциональной недостаточности белка [19].
Прочие породы
Медная гепатопатия с предположительно наследственной предрасположенностью описывалась у некоторых других пород, включая добермана [20], вест-хайленд-уайт-терьера [21] и далматина [22]. Остальные доклады о связанной с нарушением транспорта меди гепатопатией описывали его на примере скай-терьера [23], анатолийской овчарки [24], вельш-корги-пемброка, вельш-корги-кардигана [25, 26] и кламбер-спаниеля [26]. Наиболее основательные исследования концентраций меди у собак с диагностированным первичным гепатитом свидетельствуют о том, что существует намного больше пород, включая смешанные, подверженных медной гепатопатии [27, 28]. При этом авторы считают маловероятным существенное влияние факторов окружающей среды, включая особенности питания, на накопление меди в печени и связанную с этим гепатопатию у генетически здоровых собак, и сходятся во мнении, что большинство описанных пород имеет генетическую предрасположенность к нарушению метаболизма меди. Генетические исследования необходимы для выявления отвечающих за это мутаций у собак этих пород.
Диагноз
Группы риска
Интенсивность накопления меди печенью и развитие связанной с этим клинической картины зависит от генетической предрасположенности и потребления меди с пищей и разнится между породами и особями внутри породы. У лабрадоров-ретриверов клиническая симптоматика представлена в возрасте от 2 до 12 лет, но чаще всего страдают собаки среднего возраста (около 6 лет). Наблюдается повышенный риск развития симптоматики у сук в послеродовом периоде. Выраженная предрасположенность наблюдается у женских особей пород лабрадор-ретривер [29] и доберман [30], в то время как среди других пород существенной разницы по половому признаку не наблюдается.
Клинические признаки
Субклиническая фаза у собак с врождённой медной гепатопатией обычно длительная по двум причинам. Во-первых, процесс накопления меди предшествует развитию гистологических изменений печени. У бедлингтон-терьеров было обнаружено, что медь начинает накапливаться в 6–12 месяцев без гистологических признаков гепатопатии [31]. Во-вторых, клинические проявления развиваются только после поражения большой части печёночной паренхимы. А поскольку печень имеет огромный компенсаторный резерв, обычно явления хронического гепатита или цирроза проявляются уже на поздних стадиях поражения печени. Вначале клиническая симптоматика неспецифична и может включать анорексию, сонливость, тошноту, рвоту и потерю веса. С развитием болезни появляются более специфические симптомы, свидетельствующие о печёночной недостаточности, такие как асцит, печёночная энцефалопатия, полиурия/полидипсия и желтуха. Встречаются редкие сообщения об остром гемолитическом кризисе у бедлингтон-терьеров в связи с массивным выбросом меди в кровоток [32].
Клиническая диагностика
Самыми широко используемыми индикаторами гепатоцеллюлярных повреждений в биохимическом анализе крови являются аланинаминотрансфераза (АЛТ) и щелочная фосфатаза (ЩФ) [33]. Тем не менее во время доклинической фазы накопления меди выраженные повреждения ткани печени не всегда присутствуют. Чувствительность ЩФ в выявлении острого гепатита, хронического гепатита и неспецифического реактивного гепатита в группе из 191 клинически здорового лабрадора-ретривера, которые поступали на факультет ветеринарной медицины университета Утрехта между 2003-м и 2015 годами, составила менее 35%. Чувствительность АЛТ в выявлении острого гепатита, хронического гепатита и неспецифического реактивного гепатита в той же группе составила соответственно 45, 71 и 5%. В эту группу вошёл 131 лабрадор-ретривер с накоплением меди в печени (Fieten и Dirksen, неопубликованные данные, 2016). У бедлингтон-терьеров с медной гепатопатией повреждения ткани печени начинают быть видимыми между 12 и 18 месяцами, в то время как рост уровней АЛТ и ЩФ начинал отмечаться только к 24 и 18 месяцам соответственно [31]. Эти наблюдения подчёркивают, что АЛТ и ЩФ не могут являться эффективными индикаторами для скрининга в субклинический период медной гепатопатии. На более поздних стадиях заболевания повышение уровней АЛТ и ЩФ может отмечаться наряду с небольшим снижением концентрации альбумина, однако значения этих показателей могут находиться и в пределах нормы [22, 29, 34]. Другими лабораторными индикаторами повреждения ткани печени являются повышение уровней желчной кислоты, аммиака, билирубина, протромбинового времени и АЧТВ и снижение гематокрита и концентрации фибриногена [29, 34]. Активность АЛТ и ЩФ в плазме и сыворотке крови тоже являются полезными показателями для выявления повреждений печени, но они не специфичны для медной гепатопатии. У собак концентрация меди в крови не коррелирует с концентрацией меди в печени. Снижение уровня ЦП является диагностическим отличительным признаком для болезни Вильсона у людей. Исследования уровней концентрации ЦП сыворотки крови у лабрадоров-ретриверов с медной гепатопатией, вызванным мутацией ATF7B, могли бы предоставить новый инструмент в диагностике этого заболевания в ветеринарии.
Синдром Фанкони
По подобию болезни Вильсона у людей, у собак с медным гепатитом наблюдается синдром Фанкони [26, 35, 36]. У таких собак наблюдается дисфункция проксимальных тубулярных канальцев вследствие накопления в их эпителии меди. У собак наблюдается снижение удельного веса мочи, протеинурия и нормогликемическая глюкозурия. Наблюдаемые изменения поддаются коррекции с помощью DPA.
Цитология
Тонкоигольная аспирационная биопсия и цитологическое исследование гепатоцитов, окрашенных специфичным чувствительным к меди красителем (рубиновой кислотой), может быть использована в качестве неинвазивного метода выявления меди в отдельных гепатоцитах [20, 37]. Ограничения этой техники заключаются в невозможности оценки зонального распределения меди, степени повреждения гепатоцитов и точного содержания меди (что необходимо для точного диагноза и выбора тактики лечения). Необходимы дальнейшие исследования отрицательной прогностической значимости, поскольку распределение меди в печени носит очаговый характер, и теоретически у собаки с медной гепатопатией можно получить отрицательные образцы.
 |
 |
| Рисунок 2. (A) Связь между тяжестью гистологических повреждений печени медью (ось Х) и численными значениями количества меди (ось Y) на примере 109 образцов печени собак, собранных на факультете ветеринарной медицины университета Утрехта, между 2010-м и 2016 гг. Горизонтальная линия обозначает нормальный уровень меди (400 мг/кг сухого веса). (В) Хорошо виден центролобулярный характер распределения меди в биоптате печени собаки с COMMD1-недостаточностью (окраска рубиновой кислотой). (C) Оценка содержания меди = 0 (окраска рубиновой кислотой) у лабрадора-ретривера (концентрация меди — 146 мг/кг). (D) Оценка содержания меди = 5 (окраска рубиновой кислотой) у бедлингтон-терьера (концентрация меди — 6540 мг/кг) |
Гистология печени
Распределение меди в тканях
Гистологическое исследование образцов биопсии является золотым стандартом в диагностике медного гепатита. Образцы берутся в ходе лапаротомии, лапароскопии или чрескожно, с помощью иглы (14–16 G) под контролем ультразвука. Поскольку медь не окрашивается обычными гематоксилин-эозиновыми красителями, для её выявления образцы окрашиваются рубиновой кислотой [38] или роданином [39]. В случаях первичной медной гепатопатии медь, как правило, начинает накапливаться в центральных отделах долей печени (зона 3; рисунок 2B) [28, 29, 40]. Насыщенные медью гепатоциты запускают процесс воспаления, образуя воспалительный инфильтрат, который может быть смешанным или мононуклеарным. Поскольку избыток меди выводится через желчь, у собак с нарушениями оттока желчи можно наблюдать повышенную концентрацию меди преимущественно в перипортальных зонах. Однако во многих случаях болезней печени, связанных с холестазом, перипортальной аккумуляции меди не наблюдается, что ставит под сомнение такую интерпретацию в достаточно редких случаях, когда такой тип накопления наблюдается [41]. На последних стадиях поражения печени, когда появляются острый цирроз, массивный некроз и долевой коллапс, бывает сложно распознать отдельные зоны в долях печени. Более того, на поздних стадиях заболевания некротизированные гепатоциты выбрасывают свой запас меди, а новые, появившиеся в процессе регенерации гепатоциты ещё не содержат медь [21, 42], так же как и рубцовая ткань, что «разбавляет» концентрацию печени по отношению к общей массе печени вплоть до конечной стадии. Ввиду такого неравномерного распределения гистологических изменений при оценке содержания меди в печени необходимо принимать во внимание результаты обоих гистологических исследований (распределение меди по объёму печени и оценка её содержания в отдельных клетках).
Гистологический анализ содержания меди
В оценке содержания меди в гепатоцитах используется полуколичественная шкала (рис. 2А) [40]. Оценка степени зависит от топологического расположения и количества гепатоцитов и макрофагов, содержащих избыток меди. По шкале от 0 до 5 оценка 2 и выше считается превышением нормальной концентрации (рис. 2A, B, D). Однако в такой оценочной шкале подразумевается перехлёст между степенями в количественном содержании меди (рис. 2А).
Количественная оценка содержания меди
Концентрацию меди в печени можно также оценить в количественном отношении, облучив её небольшие образцы и измерив индуцированную радиоактивность меди [43]. Для этого требуется дополнительный образец ткани с биопсии не менее 5 мг, который подвергается сухой заморозке. Другими методами количественной оценки являются спектрофотометрические методы, в том числе атомно-эмиссионная спектрометрия с индуктивно связанной плазмой. Нормальной концентрацией меди в печени считается значение менее 400 мг/кг сухого веса [44]. У собак с медной гепатопатией концентрация меди в печени обычно выше 800 мг/кг, но может достигать и 10 000 мг/кг. В этом отношении собаки сильно отличаются от людей, так как для человека при норме в 50 мг/кг концентрация меди при болезни Вильсона находится на уровне 500 мг/кг.
Цифровые методы оценки концентрации меди
Исследование окрашенных препаратов печени под цифровым микроскопом является более точной методикой, чем оценка содержания меди по полуколичественной шкале, в то же время позволяя оценить зональные гистологические изменения [45]. Эта техника применяется для исследования гистологических препаратов с биопсии, когда не имеется дополнительных образцов для количественного подсчёта концентрации меди.
Биомаркеры
Поскольку на данный момент единственным способом диагностики и мониторинга медной гепатопатии являются повторные гистологические исследования биоптатов печени, разработка неинвазивных биомаркеров, позволяющих оценить содержание меди по анализу крови или мочи, становится приоритетной задачей в борьбе с медной гепатопатией. Такой биомаркер позволит выявлять собак, попавших в группу риска, и проводить профилактику заболевания или начинать лечение на ранних стадиях, а также ограничить разведение больных особей. К тому же это сильно облегчит контроль концентрации меди в ходе лечения. У лабрадор-ретриверов соотношение меди/цинка в моче имеет клинически значимую корреляцию с концентрацией меди в печени, но диагностическая ценность этого фактора ограничена перехлёстом между здоровыми и больными собаками [46]. SOD1 меди/цинка и его шаперон (CCS) изучались у людей и животных на предмет их использования в качестве биомаркера при нехватке или избытке меди. Эритроцитарный CCS и соотношение CCS/SOD1 оказались значительно снижены в пилотном исследовании у лабрадоров-ретриверов с медной гепатопатией, что обещает возможность их использования в клинической практике после дальнейших исследований. Среди других потенциальных биомаркеров объектом изучения стали микроРНК — короткие некодирующие цепочки РНК, регулирующие экспрессию генов [47]. Уровень гепатоцитарной микроРНК-122 был значительно повышен у лабрадоров-ретриверов с высокой концентрацией меди в печени без гистологических повреждений печени по сравнению с нормальными лабрадорами-ретриверами, что, очевидно, отражает ранние повреждения гепатоцитов медью [48]. Анализ микроРНК-122 не имеет специфической чувствительности к медь-индуцированным повреждениям, так что дальнейшие исследования и поиски специфической микроРНК необходимы.
Лечение
Общие рекомендации
Целью лечения собак с медным токсикозом является поддержание отрицательного баланса меди в организме. Этого можно достигнуть, ограничивая её поступление в организм с пищей и усиливая её выведение с мочой путём назначения хелаторов (таблица 1). Поскольку лечение гепатопатии позволяет добиться наилучшего исхода на ранних стадиях, когда повреждения тканей печени ограниченны, очень важно начинать лечение как можно раньше, в идеале на доклинической стадии заболевания.
Увеличение концентрации меди в печени может вызвать окислительный стресс, ускоряя развитие гепатоцеллюлярных повреждений. Пока точно неизвестно, при какой концентрации этот процесс начинается и когда следует начинать проводить хелаторную терапию. У собак с повышенным содержанием меди в печени считается её концентрация выше 400 мг/кг сухого веса, что само по себе является большой концентрацией, особенно в сравнении с нормой для людей — 50 мг/кг. В целом собакам с клинической симптоматикой или с явными повреждениями гепатоцитов медью следует назначать хелаторную терапию, которая в идеале контролируется серией биопсий печени.
Собакам с гепатопатией без клинической симптоматики, с нормальными уровнями энзимов печени и умеренно повышенной концентрацией меди в печени (400–600 мг/кг), для нормализации уровня меди может быть достаточно диеты с низким содержанием меди и высоким содержанием цинка. В литературе можно встретить сообщения об индивидуальной реакции на такую диету у некоторых собак, так что в ряде случаев медь может продолжать накапливаться и после перехода на диету [16]. Поскольку индивидуальную реакцию на диету выявить у конкретного пациента на данный момент не представляется возможным, необходимо проводить контрольную биопсию через 6 месяцев диеты.
D-пеницилламин
D-пеницилламин является хорошо растворимым продуктом метаболизма пенициллина, выводящимся через почки. Он связывает один атом меди со своей сульфгильной группой и обеспечивает экскрецию меди через мочу [49]. D-пеницилламин является самым мощным хелатором меди, а также способен образовывать комплексы меньшей авидности с другими металлами, такими как цинк и железо [50, 51]. Помимо хелатирующих свойств, D-пеницилламин может обладать иммуномодуляторным и антифиброзным действием [52, 53]. Он проявил себя как эффективное средство в лечении медной гепатопатии собак и является самым используемым хелатором [29, 54–56]. Рекомендуемая доза для собак составляет от 10 до 15 мг/кг перорально дважды в день. Для достижения максимальной биоактивности препарата и его концентрации в плазме крови его следует давать отдельно от приёма пищи [57]. Побочные эффекты у собак обычно сводятся к анорексии и рвоте [55, 57]. Желудочно-кишечные побочные эффекты легко купируются временным снижением дозы или приёмом противорвотных препаратов за час до приёма D-пеницилламина [55, 57].
У людей D-пеницилламин может вызывать иммунологические побочные эффекты, но у собак это наблюдается редко. Авторы нашли сообщения о двух случаях, когда приём D-пеницилламина имел иммунологические побочные эффекты. В одном случае у 4-летней стерилизованной суки английского спрингер-спаниеля развилась острая гломерулопатия, в результате чего развились гипоальбуминемия и асцит через 4 месяца после начала приёма D-пеницилламина. Протеинурия и гипоальбуминемия полностью разрешились через 2 недели после прекращения приёма D-пеницилламина. Во втором случае у вест-хайленд-уайт-терьера вскоре после начала приёма D-пеницилламина развилась дерматологическия реакция, которая быстро прошла после отмены препарата. Хотя в обоих случаях прямую причинно-следственную связь доказать сложно, это создаёт почву для подозрений на наличие у D-пеницилламина побочных эффектов со стороны иммунной системы.
Недавно была опубликована терапевтическая модель, позволяющая рассчитать необходимую длительность приёма D-пеницилламина в зависимости от концентрации меди в печени у лабрадоров-ретриверов (врез 1) [55]. Скорее всего, эта модель применима и к другим породам собак со сложными формами медной гепатопатии и схожими концентрациями меди. Лечение следует проводить до тех пор, пока не будет достигнута нормальная концентрация меди в печени.
Продолжительный приём D-пеницилламина может привести к недостаточности меди и цинка в связи с усилением экскреции этих металлов с мочой [46, 55]. И хотя существует один доклад о клиническом случае в котором у бедлингтон-терьера развилась недостаточность меди на фоне приёма D-пеницилламина [58], собаки этой породы, заболевшие медной гепатопатией, обычно нуждаются в проведении хелаторной терапии в течение всей жизни. У многих из них терапия не позволяет достичь нормальной концентрации меди [54], но останавливает развитие заболевания. У других пород собак проведение пожизненной хелаторной терапии не рекомендуется. Курсовой режим лечения с контрольными биопсиями раз в 1–2 года позволяет избежать (повторного) накопления меди, а также недостаточности меди и цинка.
Формула для расчёта необходимой продолжительности лечения D-пеницилламином у лабрадоров-ретриверов
CuQ1 = –81,5 + 0,99 × CuQ0 1 51,0 × T — 3,92 × T2 – 0,16 × CuQ0 × T 1 0,92 × 10-2 × CuQ0 × T2
Сокращения: CuQ0 — количество меди на момент начала лечения,
CuQ1 — количество меди в определённый период лечения,
T — продолжительность лечения.
Триэтилентетрамин (2,2,2-тетрамин)
Является тетраминовым хелатором, изначально разработанным для людей, у которых развивались острые побочные реакции на приём D-пеницилламина. Как и D-пеницилламин, триэтилентетрамин эффективно стимулирует экскрецию меди с мочой, хотя может задействовать пул меди и в других органах [59]. У людей были замечены немногочисленные побочные реакции [60]; о побочных реакциях у собак сообщений нет, но по этой теме проведено достаточно мало исследований. Рекомендуемая доза для собак составляет 15 мг/кг 2 раза в день. На момент написания этой статьи цена этого препарата в США сильно ограничивает его применение для ветеринарных пациентов.
2,3,2-тетрамин
2,3,2-тетрамин — это ещё один хелатор, но, согласно отчётам исследований, он реализует экскрецию меди через мочу в 4–9 раз эффективнее по сравнению с триэтилентетрамином [61]. Эффект 2,3,2-тетрамина изучался на пяти бедлингтон-терьерах с медным токсикозом [62]. После 200 дней приёма препарата концентрация меди в печени снизилась на 55%, без развития побочных реакций. Помимо этого исследования, о 2,3,2-тетрамине доступно достаточно мало информации, и его не существует в свободной продаже.
Тетратиомолибдат аммония
Тетратиомолибдат аммония (TTM) — сильный хелатор меди, который образует тройную связь с медью и белками в кишечнике, плазме крови и тканях печени. Он снижает содержание меди, связанной с металлотионеином, путём экскреции комплексов TTM в желчь и кровь [63, 64]. Благодаря своим выраженным свойствам выведения меди, он обладает антиангиогенным действием, что также делает его хорошим средством в терапии онкологических заболеваний у людей и собак [65, 66]. На данный момент тетрамолибдат аммония ещё не применялся для лечения медной гепатопатии у собак. Одно исследование, проведённое на здоровых собаках, показало, что приём тетрамолибдата аммония (1 мг/кг) привёл к значительному увеличению концентрации меди в сыворотке крови, что подчёркивает потенциальную возможность его применения в качестве лечебного препарата [67].
Цинк
Пероральный приём солей цинка (ацетат цинка, глюконат цинка и сульфат цинка) влияет на усвояемость меди энтероцитами. Оксид цинка имеет ограниченную биодоступность. Увеличение концентрации цинка в кишечнике считается активирующим фактором для системы регуляции металлотионеина, имеющего высокую афинность к меди. При высоком уровне содержания меди, связанной с МТ, сокращается количество меди, доступной для транспорта через слизистую оболочку, что снижает её пассаж в портальный кровоток [68, 69]. Считается также, что цинк может снижать токсичность меди, стимулируя регуляцию металлотионеина в гепатоцитах [70]. У людей при расстройствах накопления меди долговременная эффективность цинка близка к эффективности D-пеницилламина, но в целом цинк вызывает меньше побочных реакций [71, 72]. Ацетат цинка, глюконат цинка и сульфат цинка успешно применяются у собак при медном токсикозе [14, 73, 74]. Ацетат и глюконат могут переноситься лучше сульфата, но существуют индивиуальные различия в ответе на их приём. Нормальная концентрация цинка в плазме составляет от 90 до 120 мг/дл. Для подавления всасывания меди в кишечнике требуется концентрация цинка не менее 200 мг/дл [73]. Рекомендуемая доза, позволяющая достичь концентрации в плазме от 200 до 300 мг/дл, составляет от 5 до 10 мг/кг цинка дважды в день или 200 мг в день. Приём солей цинка нельзя совмещать с приёмом пищи. Концентрация цинка в плазме крови более 1000 мг/дл может вызвать гемолиз. Поэтому концентрацию цинка в плазме необходимо контролировать в ходе терапии. Поскольку терапевтический эффект наступает минимум через 3 месяца от начала приёма препарата, его нельзя использовать как самостоятельное средство терапии медной гепатопатии при наличии клинической симптоматики. В таких случаях требуются более агрессивные меры, включающие приём хелаторов меди.
Диета
Особенности питания оказывают серьёзное влияние на процесс накопления меди в печени [15, 18], и коррекция диеты необходима в комплексной терапии собак с медными гепатопатиями. Диета с низким содержанием меди и высоким содержанием цинка помогает предотвратить или существенно отсрочить повторное накопление меди в печени у собак, которые принимают хелаторы [14, 17]. Не менее важна диета собакам в доклинической стадии заболевания с умеренным повышением концентрации меди. В одном исследовании, примерно в 50% случаев, концентрацию меди в печени у лабрадоров-ретриверов в доклинической стадии заболевания удалось нормализовать, лишь скорректировав их диету [16]. В некоторых отдельных случаев медь продолжает накапливаться, даже после перевода пациента на соответствующую диету. Индивидуальные реакции на диету могут быть обусловлены наследственными факторами [19]. Поскольку такие вариации ответа на диету существуют, необходимо контролировать концентрацию меди в печени путём повторных биопсий.
Таблица 1. Лечение медной гепатопатии
| Препарат | Доза | Побочный эффект | Комментарии |
| D-пеницилламин (DPA) | 10–15 мг/кг п/о 2 р./д., отдельно от приёма пищи | Анорексия, рвота, возможен иммунный ответ | Применяется чаще всего.
Возможны иммуномодулирующие Для лабрадоров-ретриверов есть прогностическая модель продолжительности лечения |
| Триэтилентетрамин (2,2,2-тетрамин) | 15 мг/кг п/о 2 р./д. | У собак не наблюдались | |
| 2,3,2-тетрамин | 15 мг/кг п/о 2 р./д. | У собак не наблюдались | Не продаётся в аптеках |
| Тетратиомолибдат аммония | Неизвестно | Анорексия, рвота | Высокий риск острой недостаточности меди, приводящий к подавлению костного мозга |
| Соли цинка
– Ацетат цинка – Глюконат цинка – Сульфат цинка
|
5–10 мг/кг п/о 2 р./д. |
В основном хорошо переносятся, но могут возникать побочные эффекты со стороны пищеварительной системы | Нельзя использовать как единственный препарат при лечении, если наблюдается клиническая симптоматика.
Долго накапливается, прежде чем появляется эффект. Необходим мониторинг концентрации цинка в плазме крови |
Литература
- Kim B.E., Nevitt T., Thiele D.J. Mechanisms for copper acquisition, distribution and regulation. Nat Chem Biol 2008;4(3):176–85.
- Palumaa P. Copper chaperones. The concept of conformational control in the metabolism of copper. FEBS Lett 2013;587(13):1902–10.
- Yanagimoto C., Harada M., Kumemura H., et al. Copper incorporation into cerulplamin is regulated by Niemann-Pick C1 protein. Hepatol Res 2011;41(5): 484–91.
- Polishchuk E.V., Concilli M., lacobacci S., et al. Wilson disease protein ATP7B utilizes lysosomal exocytosis to maintain copper homeostasis. Dev Cell 2014; 29(6):686–700.
- Kim B., Turski M.L., Nose Y., et al. Cardiac copper deficiency activates a systemic signaling mechanism that communicates with the copper acquisition and storage organs. Cell Metab 2010;11(5):353–63.
- Materia S., Cater M.A., Klomp L.W., et al. Clusterin and COMMD1 independently regulate degradation of the mammalian copper ATPases ATP7A and ATP7B. J Biol Chem 2012;287(4):2485–99.
- Roberts E.A., Schilsky M.L. Diagnosis and treatment of Wilson's disease: an update. Hepatology 2008;47(6):2089–111.
- Tanner M.S. Role of copper in Indian childhood cirrhosis. Am J Clin Nutr 1998;67(5 Suppl):1074S-81S.
- Muller T., Feichtinger H., Berger H., et al. Endemic Tyrolean infantile cirrhosis: an ecogenetic disorder. Lancet 1996;347(9005):877–80.
- Scheinberg I.H., Sternlieb I. Wilson disease and idiopathic copper toxicosis. Am J Clin Nutr 1996;63(5):842S–5S.
- Kaler S.G. ATP7A-related copper transport diseases-emerging concepts and future trends. Nat Rev Neurol 2011;7(1):15–29.
- Мan De Sluis B., Rothuizen J., Pearson P.L. et al. Identification of a new copper metabolism gene by positional cloning in a purebred dog population. Hum Mol Genet 2002;11(2):165–73.
- Haywood S., Boursnell M., Loughran M.J., et al. Copper toxicosis in non-COMMD1 bedlington terriers is associated with metal transport gene ABCA12. J Trace Elem Med Biol 2016;35:83–9.
- Hoffmann G., Jones P.G., Biourge V., et al. Dietary management of hepatic copper accumulation in labrador retrievers. J Vet Intern Med 2009;23(5):957–63.
- Fieten H., Hooijer-Nouwens B., Biourge V., et al. Association of dietary copper and zinc levels with hepatic copper and zinc concentration in Labrador retrievers. J Vet Intern Med 2012;26(6):1274–80.
- Fieten H., Biourge V.C., Watson A.L., et al. Dietary management of Labrador retrievers with subclinical hepatic copper accumulation. J Vet Intern Med 2015; 29(3):822–7.
- Fieten H., Biourge V.C., Watson A.L., et al. Nutritional management of inherited copper-associated hepatitis in the Labrador retriever. Vet J 2014;199(3):429–33.
- Johnston A.N., Center S.A., McDonough S.P., et al. Hepatic copper concentrations in labrador retrievers with and without chronic hepatitis: 72 cases (1980-2010). J Am Vet Med Assoc 2013;242(3):372–80.
- Fieten H., Gill Y., Martin A.J., et al. The Menkes and Wilson disease genes counteract in copper toxicosis in labrador retrievers: a new canine model for copper — metabolism disorders. Dis Model Mech 2016;9(1):25–38.
- Mandigers P.J., Van den Ingh T.S., Bode P., et al. Association between liver copper concentration and subclinical hepatitis in Doberman pinschers. J Vet Intern Med 2004;18(5):647–50.
- Thornburg L.P., Rottinghaus G., Dennis G., et al. The relationship between hepatic copper content and morphologic changes in the liver of west highland white terriers. Vet Pathol 1996;33(6):656–61.
- Webb C.B., Twedt D.C., Meyer D.J. Copper-associated liver disease in dalmatians: a review of 10 dogs (1998–2001). J Vet Intern Med 2002;16(6):665–8.
- Haywood S., Rutgers H.C., Christian M.K. Hepatitis and copper accumulation in skye terriers. Vet Pathol 1988;25(6):408–14.
- Bosje J.T., Van den Ingh T.S., Fennema A., et al. Copper-induced hepatitis in an anatolian shepherd dog. Vet Rec 2003;152(3):84–5.
- Rifkin J., Miller M.D. Copper-associated hepatitis in a pembroke welsh corgi. Can Vet J 2014;55(6):573–6.
- Appleman E., Cianciolo R., Mosenco A., et al. Transient acquired fanconi syndrome associated with copper storage hepatopathy in 3 dogs. J Vet Intern Med 2008; 22(4):1038–42.
- Poldervaart J.H., Favier R.P., Penning L.C., et al. Primary hepatitis in dogs: a retrospective review (2002–2006). J Vet Intern Med 2009;23(1):72–80.
- Thornburg L.P., Rottinghaus G., McGowan M., et al. Hepatic copper concentrations in purebred and mixed-breed dogs. Vet Pathol 1990;27(2):81–8.
- Hoffmann G., Van den Ingh TS, Bode P, et al. Copper-associated chronic hepatitis in labrador retrievers. J Vet Intern Med 2006;20(4):856–61.
- Speeti M., Eriksson J., Saari S., et al. Lesions of subclinical doberman hepatitis. Vet Pathol 1998;35(5):361–9.
- Favier R.P., Spee B., Schotanus B.A., et al. COMMD1-deficient dogs accumulate copper in hepatocytes and provide a good model for chronic hepatitis and fibrosis. PLoS One 2012;7(8):e42158.
- Watson A., Middleton D., Ilkiw J. Copper storage disease with intravascular haemolysis in a bedlington terrier. Aust Vet J 1983;60(10):305–7.
- Center S.A. Interpretation of liver enzymes. Vet Clin North Am Small Anim Pract 2007;37:297–333.
- Smedley R., Mullaney T., Rumbeiha W. Copper-associated hepatitis in Labrador retrievers. Vet Pathol 2009;46(3):484–90.
- Hill T., Breitschwerdt E., Cecere T., et al. Concurrent hepatic copper toxicosis and fanconi's syndrome in a dog. J Vet Intern Med 2008;22(1):219–22.
- Langlois D., Smedley R., Schall W., et al. Acquired proximal renal tubular dysfunction in 9 labrador retrievers with Copper-Associated hepatitis (2006-2012). J Vet Intern Med 2013;27(3):491–9.
- Teske E., Brinkhuis B.G., Bode P., et al. Cytological detection of copper for the diagnosis of inherited copper toxicosis in Bedlington terriers. Vet Rec 1992;131(2):30–2.
- Uzman L.L. Histochemical localization of copper with rubeanic acid. Lab Invest 1956;5(3):299–305.
- Johnson G.F., Gilbertson S.R., Goldfischer S., et al. Cytochemical detection of inherited copper toxicosis of Bedlington terriers. Vet Pathol 1984;21(1):57–60.
- Van den Ingh T.S., Van Winkle T.J., Cullen J.M., et al. Morphological classification of parenchymal disorders of the canine and feline liver. In: WSAVA Standardization Group, editor. WSAVA standards for clinical and histological diagnosis of canine and feline liver diseases. 1st edition. Philadelphia: Saunders Elsevier; 2006. p. 85–101. Updated webversion (January 2016). Available at: http://www.vetvisuals.com/home-society-of-comparative-hepatology/sch.
- Spee B., Arends B., Van den Ingh TS, et al. Copper metabolism and oxidative stress in chronic inflammatory and cholestatic liver diseases in dogs. J Vet Intern Med 2006;20(5):1085–92.
- Thornburg L.P. A perspective on copper and liver disease in the dog. J Vet Diagn Invest 2000;12(2):101–10.
- Bode P. Instrumental neutron activation analysis in a routine way. J Trace Micro- probe Tech 1990;8(1-2):139–54.
- Puls R. Mineral levels in animal health: diagnostic data. 2nd edition. Clearbrook, Canada: Sherpa International; 1994.
- Center S.A., McDonough S.P., Bogdanovic L. Digital image analysis of rhodanine- stained liver biopsy specimens for calculation of hepatic copper concentrations in dogs. Am J Vet Res 2013;74(12):1474–80.
- Fieten H., Hugen S., Van den Ingh TS, et al. Urinary excretion of copper, zinc and iron with and without D-penicillamine administration in relation to hepatic copper concentration in dogs. Vet J 2013;197(2):468–73.
- Krol J., Loedige I., Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay. Nat Rev Genet 2010;11(9):597–610.
- Dirksen K., Verzijl T., Van den Ingh TS, et al. Hepatocyte-derived microRNAs as sensitive serum biomarkers of hepatocellular injury in Labrador retrievers. Vet J 2016;211:75–81.
- Walshe J. Penicillamine, a new oral therapy for Wilson's disease. Am J Med 1956; 21(4):487–95.
- Kuchinskas E.J., Rosen Y. Metal chelates of DL-penicillamine. Arch Biochem Bio- phys 1962;97(2):370–2.
- Lenz G., Martell A. Metal chelates of some sulfur-containing amino acids. Biochemistry 1964;3(6):745–50.
- Lipsky P.E., Ziff M. The effect of D-penicillamine on mitogen-induced human lymphocyte proliferation: synergistic inhibition by D-penicillamine and copper salts. J Immunol 1978;120(3):1006–13.
- Siegel R.C. Collagen cross-linking. effect of D-penicillamine on cross-linking in vitro. J Biol Chem 1977;252(1):254–9.
- Favier R.P., Spee B., Fieten H., et al. Aberrant expression of copper associated genes after copper accumulation in COMMD1-deficient dogs. J Trace Elem Med Biol 2015;29:347–53.
- Fieten H., Dirksen K., Van den Ingh TS, et al. D-penicillamine treatment of copper- associated hepatitis in Labrador retrievers. Vet J 2013;196(3):522–7.
- Mandigers P.J., Van den Ingh TS, Bode P, et al. Improvement in liver pathology after 4 months of D-penicillamine in 5 Doberman pinschers with subclinical hepatitis. J Vet Intern Med 2005;19(1):40–3.
- Langlois D., Lehner A., Buchweitz J., et al. Pharmacokinetics and relative bioavailability of d-Penicillamine in fasted and nonfasted dogs. J Vet Intern Med 2013; 27(5):1071–6.
- Seguin M.A., Bunch S.E. Iatrogenic copper deficiency associated with long-term copper chelation for treatment of copper storage disease in a Bedlington terrier. J Am Vet Med Assoc 2001;218(10):1593–7, 1580.
- Sarkar B., Sass-Kortsak A., Clarke R., et al. A comparative study of in vitro and in vivo interaction of D-penicillamine and triethylenetetramine with copper. Proc R Soc Med 1977;70(Suppl 3):13–8.
- Walshe J. Treatment of Wilson's disease with trientine (triethylene tetramine) dihy- drochloride. Lancet 1982;319(8273):643–7.
- Allen K.G., Twedt D.C., Hunsaker H.A. Tetramine cupruretic agents: a comparison in dogs. Am J Vet Res 1987;48(1):28–30.
- Twedt D.C., Hunsaker H.A., Allen K.G. Use of 2,3,2-tetramine as a hepatic copper chelating agent for treatment of copper hepatotoxicosis in Bedlington terriers. J Am Vet Med Assoc 1988;192(1):52–6.
- Gooneratne S., Christensen D. Effect of chelating agents on the excretion of copper, zinc and iron in the bile and urine of sheep. Vet J 1997;153(2):171–8.
- Komatsu Y., Sadakata I., Ogra Y., et al. Excretion of copper complexed with thiomo- lybdate into the bile and blood in LEC rats. Chem Biol Interact 2000;124(3): 217–31.
- Brewer G.J., Merajver S.D. Cancer therapy with tetrathiomolybdate: antiangiogen- esis by lowering body copper-a review. Integr Cancer Ther 2002;1(4):327–37.
- Kent M.S., Madewell B.R., Dank G., et al. An anticopper antiangiogenic approach for advanced cancer in spontaneously occurring tumors using tetrathiomolybdate: a pilot study in a canine animal model. J Trace Elem Exp Med 2004;17(1):9–20.
- Chan C.M., Langlois D.K., Buchweitz J.P., et al. Pharmacologic evaluation of ammonium tetrathiomolybdate after intravenous and oral administration to healthy dogs. Am J Vet Res 2015;76(5):445–53.
- Fischer P.W., Giroux A, L'Abbe MR. Effects of zinc on mucosa! copper binding and on the kinetics of copper Absorption. J Nutr 1983;113:462–9.
- Cousins R.J. Absorption, transport, and hepatic metabolism of copper and zinc: special reference to metallothionein and ceruloplasmin. Physiol Rev 1985;65(2): 238–309.
- Schilsky M.L., Blank R.R., Czaja M.J., et al. Hepatocellular copper toxicity and its attenuation by zinc. J Clin Invest 1989;84(5):1562–8.
- Czlonkowska A., Gajda J., Rodo M. Effects of long-term treatment in Wilson's disease with D-penicillamine and zinc sulphate. J Neurol 1996;243(3):269–73.
- Brewer G.J., Dick R.D., Johnson V.D., et al. Treatment of wilson's disease with zinc: XV long-term follow-up studies. J Lab Clin Med 1998;132(4):264–78.
- Brewer G.J., Dick R.D., Schall W., et al. Use of zinc acetate to treat copper toxicosis in dogs. J Am Vet Med Assoc 1992;201(4):564–8.
- Hoogenraad T., Rothuizen J. Compliance in Wilson's disease and in copper toxicosis of Bedlington terriers. Lancet 1986;328(8499):170.
Авторское согласие на перевод и публикацию статьи редактором рубрики получено.
СВМ № 6/2017