Collivignarelli Francesco1,2, Vignoli Massimo2, Del Signore Francesca2, Simeoni Francesco2, Tamburro Roberto2*
1 Policlinico Roma Sud, via Pilade Mazza, 24, 00173 Rome, Italy
2 University of Teramo, Faculty of Veterinary Medicine, 64100 Piano D’Accio, Teramo, Italy
* Corresponding author: e-mail: rtamburro@unite.it
В данной статье описана техника применения перикардиального лоскута в качестве метода паллиативного лечения неоперабельных опухолей сердца и предотвращения плеврального выпота.
Все собаки прошли одинаковые диагностические процедуры, включавшие кардиологическое обследование, гематологический и биохимический анализы крови, анализ мочи, ультразвуковое исследование брюшной полости и сердца, а также рентгенографию грудной клетки. Для исключения возможных метастаз всегда проводилась компьютерная томография. Всем собакам была проведена открытая перикардэктомия: перикардиальная сумка была открыта и транспонирована (перенесена) на опухоль в соответствии с её размером. Также во всех случаях была проведена биопсия опухоли. В соответствии с данными гистопатологии две опухоли были классифицированы как гемангиосаркомы и одна — как хемодектома. Протокол химиотерапии включал еженедельное введение доксорубицина. Собаки с гемангиосаркомой прожили соответственно 65 дней и 85 дней без возникновения плеврального выпота, собака с хемодектомой умерла через 6 месяцев вследствие причин, не связанных с опухолью.
Во время ежемесячных повторных обследований сердца не было выявлено присутствия плеврального выпота.
Перикардиальный лоскут (или заплата) является возможным методом паллиативного лечения неоперабельных опухолей сердца. У трёх собак с неоперабельными опухолями сердца не было выявлено плевральных выпотов.
Ключевые слова: перикардиальный лоскут, опухоль сердца, собака
Введение
В популяции собак и кошек опухоли сердца являются нетипичными заболеваниями, и часто их обнаруживают случайно [1]. К наиболее распространённым опухолям относят гемангиосаркому и опухоли аорты (хемодектома и параганглиома), а также лимфому [2].
В идеале опухоли сердца необходимо хирургически удалять, при этом целью ставится полное удаление опухолевой ткани, а затем проведение системной химиотерапии [3]. Также недавно было описано лечение собаки с хемодектомой с помощью дистанционной лучевой терапии [4].
В случаях, когда удаление опухоли невозможно, обычно рекомендуют паллиативную перикардэктомию для предупреждения развития тампонады сердца и последующих плевральных выпотов [3–5].
Перикардэктомию связывают с увеличением продолжительности выживаемости собак с опухолями аорты, однако данный метод не сдерживает рост опухоли и не улучшает сердечно-сосудистую функцию у собак с компрессионными опухолями [6, 7].
В случае возникновения после перикардэктомии плеврального выпота к дальнейшим паллиативным методам лечения можно отнести повторный торакоцентез и установку плевральной порт-системы; также недавно было описано введение саморасширяющихся стентов в краниальную полую вену [8].
Мы предположили, что перикард может быть использован в качестве заплаты на сердечную опухоль для уменьшения плеврального выпота.
Целью данного исследования было описание применения перикардиального лоскута у трёх собак с неоперабельными опухолями сердца в качестве метода паллиативного лечения для уменьшения плеврального выпота.
 |
|
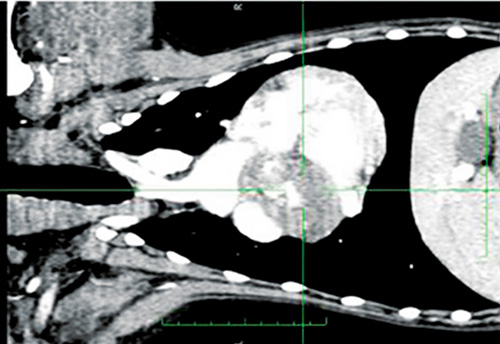
Рис. 1. 10-летняя кастрированная сука мопса. Дорзальная проекция реконструкции постконтрастного изображения КТ показывает опухоль в основании сердца |
Описание клинических случаев
Три собаки (12-летний некастрированный кобель немецкой овчарки, 10-летний некастрированный кобель лабрадора-ретривера и 10-летняя кастрированная сука мопса) были представлены на приём с признаками непереносимости физических нагрузок, вялостью, расширением яремных вен и потерей веса. На клиническом осмотре были выявлены приглушённые тона сердца.
Все собаки прошли одинаковые диагностические процедуры, включающие кардиологическое обследование, общий клинический и биохимический анализы крови, анализ мочи, ультразвуковое обследование брюшной полости и сердца и рентгенографию грудной клетки.
На основании результатов исследований подозревали опухоли сердца. Проведённая эхокардиография выявила опухоли правого предсердия у двух собак (немецкой овчарки и лабрадора-ретривера) и опухоль аорты у третьей собаки (мопс). По итогам обследования, включавшего анализы крови и мочи и компьютерную томографию всего корпуса, метастатических образований не выявлено, но все опухоли идентифицированы как неоперабельные (рис. 1).
В соответствии с предварительным диагнозом, основанным на анатомическом расположении опухоли, владельцам были предложены биопсия опухолей и перикардиальная заплата в качестве паллиативного лечения с целью уменьшения перикардиального и плеврального выпотов.
Седация собак проводилась с помощью морфина (0,2 мг/кг внутримышечно) и ацепромазина (0,05 мг/кг внутримышечно) за 20 минут до введения в наркоз. После кислородной терапии (преоксигенации) в течение 5 минут собаки были введены в общий наркоз с помощью пропофола
(4 мг/кг внутривенно). Раствор Рингера лактата (2 мл/кг/час) вводили внутривенно для поддержания нормоволемии, цефазолин (20 мг/кг внутривенно) вводили во время введения в наркоз, а затем каждые 120 минут во время операции.
Собаки были интубированы с помощью эндотрахеальной трубки с манжетой, а для поддержания наркоза использовалась смесь севофлюрана и кислорода.
 |
|
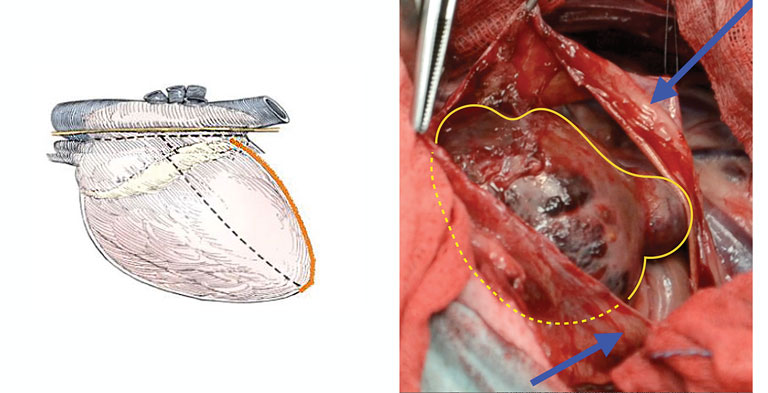
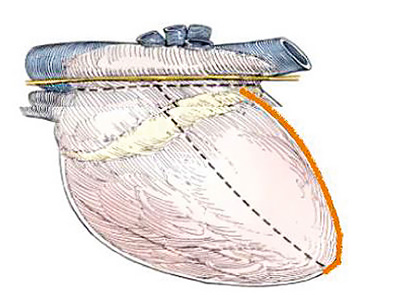
Рис. 2. Получение перикардиального лоскута путём Т-образного надреза (пунктирная линия), длинная сторона Т-образного надреза сделана краниально или каудально (красная линия) напротив расположения опухоли, чтобы освободить необходимое количество перикардиальной ткани |
Техника операции
Каждого пациента расположили на левом боку и провели правостороннюю торакотомию в области пятого межрёберного промежутка. Для получения доступа в грудную полость применяли межрёберный ретрактор. Лёгкие аккуратно раздвинули с помощью хирургических тампонов для лапаротомии.
На перикарде был сделан Т-образный разрез вентрально от диафрагмального нерва. Короткий отрезок Т-образного надреза всегда был параллелен диафрагмальному нерву, в то время как длинный отрезок делали в соответствии с расположением опухоли сердца (рис. 2).
После надрезания (рис. 3) перикардиальный лоскут перемещали так, чтобы он покрывал опухоль в соответствии с её формой, а затем пришивали к опухоли непрерывным швом с помощью монофиламентного рассасывающегося шовного материала размером 4-0 (рис. 4).
Грудную полость затем промыли тёплым стерильным физиологическим раствором. Был применён активный грудной дренаж, а область торакотомии зашили в соответствии с общеприменяемой техникой. Отрицательное давление в грудной полости было достигнуто с помощью дренажа. Вокруг груди наложили мягкую повязку.
 |
 |
|
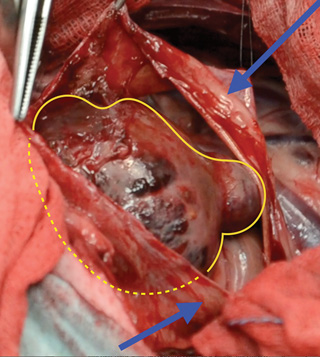
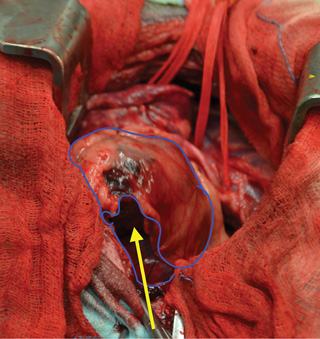
Рис. 3. 10-летняя кастрированная сука мопса. Снимок во время операции. Перикард (синяя стрелка) после первого Т-образного надреза и опухоль сердца (жёлтая линия и пунктирная жёлтая линия) |
Рис. 4. 10-летняя кастрированная сука мопса. Снимки во время операции показывают перикардиальный лоскут, наложенный на опухоль сердца (синяя линия). Натяжение шовного материала поможет полностью покрыть опухоль перикардом |
Послеоперационный уход
После операции собаки с опухолями сердца выходили из наркоза под строгим присмотром в отделении интенсивной терапии. После операции собакам были назначены следующие препараты: метадон (0,2 мг/кг внутривенно каждые 4–6 часов), цефазолин внутривенно (22 мг/кг каждые 8 часов, пока собака не была переведена на пероральные антибиотики) и внутривенные вливания 0,9% раствора хлорида натрия. Чётко отслеживали частоту дыхательных движений и дыхательное усилие.
Грудной дренаж был удалён, когда количество дренированной жидкости уменьшилось до 2 мл/кг/день.
После удаления дренажа собаки были выписаны домой с назначением пероральных препаратов, включающих амоксициллин/клавуланат (20 мг/кг каждые 12 часов) и трамадол (2–4 мг/кг перорально каждые 8 часов) курсом на 7 дней.
Не было выявлено серьёзных послеоперационных осложнений. Время, проведённое собаками в операционной, составило 40, 50 и 45 минут соответственно. Гистологическое исследование опухолей сердца выявило гемангиосаркому у немецкой овчарки и лабрадора и хемодектому у мопса.
Протокол химиотерапии включал внутривенное введение доксорубицина в дозе 30 мг/м2.
На 30-й и 60-й день после операции провели повторное рентгенографическое исследование. На рентгеновских снимках всех трёх собак не было выявлено плеврального выпота.
Выживаемость собак с гемангиосаркомой составила 65 и 80 дней без плеврального выпота соответственно, а сука мопса умерла через 6 месяцев от причин, не связанных с опухолью.
Целью паллиативного лечения собак с неоперабельными опухолями сердца является уменьшение перикардиального выпота, а также предупреждение развития плеврального выпота. Эти осложнения могут привести к ухудшению дыхательной функции, тампонаде сердца и смерти [9, 10].
Перикардэктомия — это хирургическая операция, направленная на удаление сердечной сумки. Лечение опухолевых перикардиальных выпотов может проводиться с помощью субтотальной перикардэктомии через торакотомию или с помощью торакоскопического перикардиального окна [11].
По этим причинам доступ к неоперабельным опухолям сердца в данном исследовании проводился с помощью торакотомии. Вместо полного удаления перикарда был вырезан перикардиальный лоскут и наложен на опухоль. Перикардиальный лоскут выполняет две функции: 1. лечение как перикардэктомия перикардиального выпота с помощью дорсо-каудального транспонирования перикарда и 2. уменьшение плеврального выпота с помощью механического сдавливания, достигаемого пришиванием перикарда к опухоли.
Перикардиальный лоскут всегда получали путём Т-образного надреза на перикарде. У пациентов с гемангиосаркомой правого предсердия длинный отрезок Т-образного надреза был сделан краниально, чтобы покрыть опухоль, расположенную в каудальной области сердца; а у пациента с хемодектомой длинный отрезок Т-образного надреза был выполнен каудально, чтобы покрыть опухоль, расположенную у основания сердца.
В дальнейшем повторное обследование трёх собак не выявило возникновения плевральных выпотов: собаки с гемангиосаркомой прожили 65 и 80 дней после операции (у них развились метастазы в лёгких и печени), а собака с хемодектомой через 6 месяцев после операции погибла в результате дорожно-транспортного происшествия.
Хирургическое лечение хронических плевральных выпотов включает плевроперитонеальное шунтирование, плевровенозное шунтирование, плевральные порт-системы и оментализацию плевральной полости [12–15].
Все эти процедуры требуют введения плевральных портов или второго бокового хирургического доступа в брюшную полость.
Техника перикардиального лоскута может позволить одновременное лечение перикардиального выпота и последующего плеврального выпота с помощью единственного торакотомического хирургического доступа.
Хирургическая процедура была легка в исполнении и прошла без каких-либо внутриоперационных и послеоперационных осложнений.
В соответствии с предварительными данными перикардиальный лоскут может быть использован в качестве паллиативного метода лечения неоперабельных опухолей сердца, однако, принимая во внимание малый размер исследуемой группы, необходимы дополнительные исследования для более полного понимания потенциального назначения данного метода лечения.
Авторский вклад
CF провёл все процедуры. CF, VM и TR предложили дизайн исследования, написали статью и одобрили её окончательный вариант. DSF и SF предложили идею исследования и участвовали в его дизайне и координации, а также помогали с написанием чернового варианта рукописи.
Конфликт интересов
Автор(ы) заявляют об отсутствии потенциальных конфликтов интересов в отношении исследования, авторства и/или публикации данной статьи.
Литература
1. Ware W. J., Hopper D. L. Cardiac tumors in dogs: 1982–1995. J Vet Intern Med 1999; 13: 95–103.
2. Patnaik A. K., Liu S. K., Hurvitz A. I., McClelland A. J. Canine chemodectoma (extra-adrenal paragangliomas)-a comparative study. J Small Anim Pract 1975; 16: 785–801.
3. Magestro L. M., Geiger T. L., Nolan M. W. Stereotactic body radiation therapy for heartbase tumors in six dogs. J Vet Cardiol 2018; 20(3):186–197.
4. Rancilio N. J., Higuchi T., Gagnon J., McNiel E. A. Use of threedimensional conformal radiation therapy for treatment of a heart base chemodectoma in a dog. J Am Anim Hosp Assoc 241:
472–476.
5. Kelsey K. L., Kubicek L. N., Bacon N. J., Torres T., Robertson S. A. Neuromuscular blockade and inspiratory breath hold during stereotactic body radiation therapy for treatment of heart base tumors in four dogs. J Am Vet Med Assoc 2017; 250: 199–204.
6. Vicari Ed., Brown D. C., Holt D. E., Brockman D. J. Survival times of and prognostic indicators for dogs with heart base masses: 25 cases (1986–1999). J Vet Med 2001; 219: 485–487.
7. Ehrhart N., Ehrhart E. J., Willis J., et al. Analysis of factors affecting survival in dogs with aortic body tumors. Vet Surg 2002; 31: 44–48.
8. Brooks A. C., Hardie R. J. Use of the Pleural port device for management of pleural effusion in six dogs and four cats. Vet Surg 2011; 40: 935–941.
9. Fossum T. W., Evering W. N., Miller M. W., Forrester S. D., Palmer D. R.,
Hodges C. C. Severe bilateral fibrosing pleuritis associated with chronic chylothorax in five cats and two dogs. J Am Vet Med Assoc 1992; 201:317–324.
10. Little A. A., Steffey M., Kraus M. S. Marked pleural effusion causing right atrial collapse simulating cardiac tamponade in a dog. J Am Anim Hosp Assoc 2007; 43:157–162.
11. Case J., Maxwell M., Aman A., Monnet E. L. Outcome evaluation of a thoracoscopic pericardial window procedure or subtotal pericardectomy via thoracotomy for the treatment of pericardial effusion in dogs. J Am Vet Hosp Assox 2013; 15;242(4):493–498.
12. Smeak D. D., Birchard S. J., McLoughlin M. A., et al. Treatment of chronic pleural effusion with pleuroperitoneal shunts in dogs: 14 cases (1985–1999). J Am Anim Hosp Assoc 2001; 219:1590–1597.
13. Williams J. M., Niles J. D. Use of omentum as a physiologic drain for.treatment of chylothorax in a dog. Vet Surg 1999; 28: 61–65.
14. Willauer C. C., Breznock E. M. Pleurovenous shunting technique for treatment of chylothorax in three dogs. J Am Vet Hosp Assoc 1987; 191: 1106–1109.
15. Peterson S. L. Postcaval thrombosis and delayed shunt migration after pleuro-peritoneal venous shunting for concurrent chylothorax and chylous ascites in a dog. Vet Surg 1996; 25: 228.
Источник: Acta Veterinaria-Beograd 2019, 69 (4), 461–468. Acta Veterinaria is an Open Access Journal. All articles can be downloaded free of charge and used in accordance with the Creative Commons Attribution 4.0 International (CC BY 4.0).
СВМ № 5/2020