Рутинное исследование глаз
Список оборудования, необходимого для проведения рутинного офтальмологического исследования, представлен в таблице 1. Начинать исследование глаз следует в хорошо освещённом помещении и до транквилизации. При осмотре оценивают симметрию черепа, орбит и век, наличие отделяемого из глаз (серозного, слизистого, слизисто-гнойного) и/или блефароспазм. Также оценивают черепные нервы, особенно II, III, IV, V, VI и VII пары. Для этого проверяется реакция зрачка на свет, реакция на угрозу, тест в лабиринте, оценивается положение глазного яблока и его подвижность, чувствительность глаза и смежных структур, а также положение век и их функционирование. Для более точной оценки непосредственной и непроизвольной реакции зрачка на свет часто требуется локальный источник света (3,5 В, галоген) и затемнённое помещение.
Для дальнейшего исследования требуется транквилизация, блокада региональных нервов и местная анестезия. Ксилазин (Ромпун, Haver-Lockhart) в дозе 0,5–1,0 мг/кг в/в в комбинации с буторфанолом тартратом (Torbugestic, Bristol Laboratories) в дозе 0,01 мг/кг в/в обеспечивают синергическое анальгетическое действие и упрощают исследование, отбор проб, промывание носослёзного канала, размещение лаважной системы и небольшие хирургические процедуры.
Чувствительная иннервация глазного яблока и соседних структур осуществляется за счёт тройничного нерва (V пара), а двигательная иннервация – за счёт лицевого нерва (VII пара).
Наиболее часто приходится блокировать векоушную ветвь лицевого нерва и надглазничную ветвь тройничного нерва. Блокада этих нервов обеспечивает обездвиживание и обезболивание верхнего века соответственно. Векоушной нерв блокируется в месте пересечения линии, параллельной каудальной поверхности ветви нижней челюсти, и линии, параллельной дорсальной поверхности скуловой дуги. Для инъекции требуется игла 25G, 5/8 дюйма, и 5 мл мепивакаина HCL (Carbocaine, Winthrop Laboratories). Надглазничный нерв блокируется в месте выхода из надглазничного отверстия лобной кости. Пальпируют надглазничное отверстие, в которое вводят иглу 25G, 5/8 дюйма, и вводят 2 мл мепивакаина, после чего инфильтрируют еще 2–3 мл анестетика подкожно при удалении иглы. Дополнительно блокируют чувствительные нервы: подблоковый, слёзный и скуловой (ветви тройничного нерва). С другой стороны, для обеспечения анестезии соответствующей области можно местно инфильтрировать анестетик.
Таблица 1. Основное оборудование для офтальмологического исследования лошадей
| 1. Яркий фокусный источник света – осветитель Finoff на прямом офтальмоскопе |
| 2. Прямой офтальмоскоп |
| 3. Глазные фиксирующие щипцы |
| 4. Мочевой катетер для котов – для катетеризации носослёзного протока |
| 5. Стерильные полоски с флюоресцином |
| 6. Стерильные пробирки для бактериального посева |
| 7. Шпатель Kimura – для забора пробы на цитологическое исследование |
| 8. Предметные стекла |
| 9. Стерильная глазная жидкость для промывания |
| 10. Пропоракаин (Alcain) – местный анестетик |
| 11. Тропикамид 1% (Mydriacyl) – дилятирующий препарат короткого действия |
| 12. Седация: ксилазин (ромпун), буторфанола тартрат (торбуджестик) |
| 13. Мепивакаин (Carbocaine) – для блокады нервов |
| 14. Тонопен |
| 15. Ручная щелевая лампа Heine |
| 16. Непрямой офтальмоскоп Heine |
| 17. Линза 20 диоптрий |
После блокады можно проводить полное офтальмологическое исследование. Если необходимо забрать пробы для посева на микрофлору или оценить выработку слезы, это делают до местного введения растворов или мазей. Измерение выработки слезы проводят путём использования промышленно выпускаемых тестовых полосок Ширмера (Schirmer tear test), которые держат в течение 30 секунд. В норме они должны намокнуть на 20 мм или больше. Используя яркий источник освещения, осматривают конъюнктиву, третье веко, роговицу, переднюю камеру, радужку, зрачок и хрусталик. Исследуют глазные среды (роговицы, внутриглазную жидкость, хрусталик и стекловидное тело) на ясность и прозрачность. Оценивают положение и размер хрусталика, форму и подвижность зрачка и вид corpora niger. Роговицу исследуют на наличие неравномерности, васкуляризации и пигментации. Роговицу окрашивают флюоресцином для выявления язв. Появление флюоресцина в носовом отверстии носослёзного канала свидетельствует о свободной проходимости канала. После местной анестезии (пропоракаин 0,5%, Alcain, Alcon Laboratories) проводят катетеризацию слёзного бугорка, используя французский мочевой катетер 3,5, после чего промывают носослёзную систему. Можно также промыть носослёзную систему через носовое отверстие носослёзного канала (катетер № 5). Используя хирургический пинцет, захватывают третье веко и осматривают его поверхность, как со стороны век, так и со стороны глазного яблока, оценивая наличие инородных тел или каких-либо нарушений. На фоне местной анестезии берут образец на цитологическое исследование конъюнктивы и роговицы, используя шпатель Kimura. По возможности следует определить внутриглазное давление, используя тонометр, например, Tonopen (Oculab, США).
Для исследования задних сегментов глаза (зрительный нерв, кровеносные сосуды сетчатки и дно) используют как прямую, так и непрямую офтальмоскопию. Необходимо оценить размер и цвет зрительного нерва, количество и размер кровеносных сосудов сетчатки, пигментацию дна и наличие или отсутствие гипо- или гиперрефлекторных изменений дна.
 |
| Фото 1. Анестезия глаза |
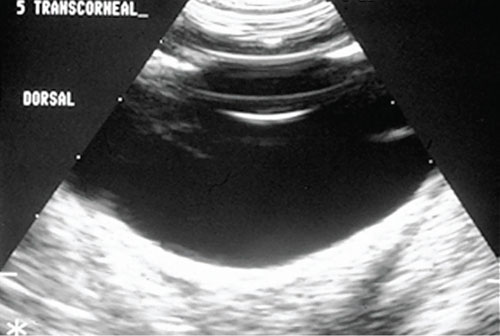 |
| Фото 2. Ультразвуковое исследование глаза |
Ультразвуковое исследование глаз
Ультразвуковое исследование глаз проводят непосредственно через роговицу, веки, либо используя насадку. Оптимальным датчиком для офтальмологического ультразвукового исследования считается датчик 10 МГц, но можно применять и датчик 7,5 МГц. Для этого требуется седация, блокада векоушного нерва и местная анестезия. В качестве контактной среды используют стерильный гель KY, но после его использования необходимо тщательно промыть роговицу.
Если не использовать насадку, роговицу и часть передней камеры рассмотреть не получится. Передняя и задняя поверхности капсулы хрусталика проявляются в виде эхогенных линий, расположенных на 12 и 6 часов, тогда как оставшаяся часть хрусталика анэхогенна. Часто можно визуализировать радужку и ресничное тело. Стекловидное тело в норме анэхогенное. Задняя стенка глаза видна как вогнутая эхогенная линия, с головкой оптического нерва, выглядящего как область повышенной эхоплотности на заднем полюсе, за которым находится анэхогенный зрительный нерв. Орбитальные структуры лучше всего исследовать датчиком 7,5 МГц, оценивая мышцы вокруг глаза, зрительный нерв и связанные с ним структуры.
Таблица 2. Характеристики структур глаза, оцениваемые при УЗИ
| Структура глаза | Характеристики |
| Глазное яблоко | Размер, подвижность, положение |
| Орбита | Положение глазного яблока, смещение назад, костные структуры |
| Веки | Положение, подвижность, чувствительность, новообразования |
| Третье веко | Положение, подвижность, новообразования |
| Роговица | Прозрачность, неравномерность поверхности, инфильтрация, задержание флюоресцина, необходимость проведения посева и цитологии |
| Конъюнктива | Воспаление, новообразования, инородные тела |
| Внутриглазная жидкость | Воспалительные продукты, новообразования, кровотечение |
| Радужка | Corpora nigera (размер, количество, цвет), цвет, синехии, размер зрачка, ответная реакция, форма |
| Хрусталик | Положение, прозрачность, синехии |
| Стекловидное тело | Воспалительные продукты, новообразования, кровотечение |
| Сетчатка | Отслоение, ослабление сосудов, кровотечение, дегенерация, ответ на угрозу |
| Зрительный нерв | Цвет |
Ультразвуковое исследование глаза показано для оценки внутриглазного содержимого, если имеет место помутнение одной или более сред: роговицы, внутриглазной жидкости, стекловидного тела и хрусталика. Основным показанием для ультразвукового исследования считается катаракта, при которой необходимо оценить отслоение сетчатки, последующее травматическое кровоизлияние в переднюю камеру, повреждения задних сегментов. Помимо этого необходимо оценить структуры орбиты при экзофтальме или травмах орбиты (табл. 2).
Литература
- Morreale R. J., Wilkie D. A., Gemensky-Metzler A. J., Wesibrode S. E., Willis M. A. Histological effect of semiconductor diode laser transscleral cyclophotocoagulation on the normal equine eye. Veterinary Ophthalmology 10:84-92, 2007.
- Fife T. M., Metzler A., Wilkie D. A., Colitz C., Bras D., Klages D. Clinical features and outcomes of phacoemulsification in 39 horses: A retrospective study (1993-2003). Veterinary Ophthalmology 9:361- 368, 2006.
- Gilger B. C., Salmon J. H., Wilkie D. A., Cruysburg L., et al. A novel bioerodible suprachoroidal cyclosporine implant for uveitis. Invest Ophthalmol Vis Sci 47:2596-2605, 2006.
- Gemensky A. J., Wilkie D. A., Kowalski J., Schmall L. M., Willis A. M., Yamagata M. Changes in equine ocular bacterial and fungal flora following experimental application of topical antibiotic and antibiotic-corticosteroid ophthalmic preparations. Am J Vet Res 66:800-811, 2005.
- Wilkie D. A., Gilger B. C. Equine Glaucoma, Vet Clinics of North America: Eq Pract 20:381-391, 2004.
- Beard W, Wilkie D. A. Partial orbital rim resection, mesh skin expansion, and second intention healing combined with enucleation or exenteration for extensive periocular tumors in horses. Vet Ophthalmol 5:23-28, 2002.
- Miller T. L., Willis A. M., Wilkie D. A., Hoshaw-Woodard S., Stanley J. R. L. Description of ciliary body anatomy and identification of sites for transsscleral cyclophotocoagulation in the equine eye Veterinary Ophthalmology 4:183-190, 2001.
Источник: материал предоставлен Конским ветеринарным объединением
СВМ № 5/2011
Вам также могут быть интересны статьи:
Oперативное лечение периодического увеита лошадей
Что каждый ветеринарный врач должен знать о лошадином глазе
Современные методы терапии глаза. Лечение внутриглазного воспаления у лошадей




