Heike Aupperle-Lellbach1, Alexandra Kehl1, Sophie Merz2, Julia Grassinger1, Corinna Hohloch1, Peter Pantke3
1 Laboklin GmbH & Co. KG, Bad Kissingen
2 Institut für Tierpathologie, Freie Universität Berlin
3 AniCura Bielefeld GmbH, Tierärztliche Klinik für Kleintiere
Адрес для корреспонденции: PD Dr. Heike Aupperle-Lellbach. Laboklin GmbH & Co. KG. Steubenstr. 4, 97688 Bad Kissingen. aupperle@laboklin.de
Резюме
В различных опубликованных исследованиях в образцах переходноклеточного рака у собак (ПКР) в 54–87% случаев обнаруживалась мутация V595E в гене BRAF со специфичностью 100%. Целью данного исследования было изучить зависимость между чувствительностью выявления мутации в образцах ПКР и породой, возрастом и полом собак. В исследовании были молекулярно-генетически проанализированы образцы ПКР мочевыводящих путей от 116 собак. Мутация BRAF была выявлена у 24 из 28 (86 %) собак — терьеров разных пород. Мутация была выявлена у 39 из 88 (44%) собак других пород. Эта разница была достоверно значимой (p < 0,01). Кроме того, у терьеров 96% случаев ПКР были классифицированы как высоко злокачественные, тогда как у других пород к ним были отнесены 69% случаев (p < 0,01). При сравнении возраста или пола не было отмечено значимых различий между породой собак и наличием мутации BRAF.
Приведённые данные дают ценную информацию в интерпретации результатов анализа BRAF — метода тестирования, который используется в рутинной молекулярно-генетической диагностике у собаки.
Введение
Переходноклеточный рак (ПКР) является наиболее распространённой злокачественной опухолью мочевыводящих путей у собак [6]. К данной опухоли описана породная предрасположенность у терьеров и половая предрасположенность у самок [обзоры 13 и 14].
В целом развитие опухолей может быть обусловлено мутациями генетического материала, которые реализуются посредством различных факторов. Mochizuki с соавт. [10, 11] удалось обнаружить мутацию в ДНК опухолевых клеток переходноклеточного рака, которая возникает в гене BRAF. Этот ген относится к семейству генов RAF (Rapidly Accelerated Fibrosarcoma — быстроразвивающаяся фибросаркома) с изоформами ARAF, BRAF и CRAF [4]. Мутация BRAF V595E у собаки соответствует мутации BRAF V600E у человека [3]. Эти мутации приводят в обоих видах к аминокислотной замене валина на глутаминовую кислоту [12] и обуславливают ненормальную пролиферацию и дифференцировку клеток [4].
В американских публикациях мутация V595E гена BRAF в переходноклеточом раке обнаруживалась в 67% [10], 75% [11] и 87% случаев [3]. С другой стороны, Maeda состав. [2017] в Японии удалось обнаружить мутацию только в 6/11 случаях (54,5%) у собак с ПКР. В первом исследовании, проведённом нашей рабочей группой, у 22/31 (71%) животных с ПРК была обнаружена мутация BRAF [1]. Первые предположения о возможной породной предрасположенности у пород терьеров с точки зрения выявления мутации BRAF можно найти у Pantke [2018].
Целью данной работы было изучение в более крупной выборке мутации BRAF V595E у собак с переходноклеточным раком в отношении возможной породной, возрастной и половой предрасположенности.
Материалы и методы
Были проанализированы 101 биоптат, 9 образцов мочи и 6 цитологических мазков от 116 собак с ПКР, которые были отправлены на рутинную диагностику за период 2013–2018 гг. Все биоптаты, полученные при эндоскопии и после проведения эксцизии, были зафиксированы в формалине. Образцы мочи были получены при самостоятельном мочеиспускании, цитологические препараты были получены методами аспирационной биопсии или центрифугирования осадка мочи.
Среди собак было 28 терьеров (согласно номенклатуре МКФ: высокорослые терьеры: 4 фокстерьера, 2 эрдельтерьера, 2 ирландских мягкошёрстных пшеничных терьера, 1 вельштерьер; маленькие терьеры: 8 джек-рассел-терьеров, 6 скотчтерьеров, 4 вест-хайленд-уайт-терьера и карликовый терьер: 1 йоркширский терьер) и 88 собак, которые не принадлежат к терьерам (из них 39 метисов, 5 биглей, 5 бернских зенненхундов, 3 кокер-спаниеля, 3 пуделя и 33 собаки различных пород). Животные имели возраст от 6 до 17 лет (средний возраст: 11 лет) и были самками (n = 29), кастрированными самками (n = 50), самцами (n = 16) и кастрированными самцами (n = 21).
Для гистологического исследования ткани были рутинным образцом заключены в парафин и окрашены гематоксилином и эозином. Если образцы были достаточно крупными (n = 98), производилась градация опухолей на низкозлокачественные/неинвазивные (высокодифференцированные) и высокозлокачественные/инвазивные (низкодифференцированные) [9]. Основными критериями для высокозлокачественных опухолей являлись, например, инвазивный рост в подслизистой и мышечный слои и инвазия сосудов, что чаще всего невозможно оценить в мелких биоптатах. Цитологические препараты были окрашены с помощью быстрого красителя Haema (фирмы Labor, Technik Eberhard Lehmann GmbH, Berlin LT 002-004).
Выделение ДНК осуществлялась с помощью коммерчески доступных тест-наборов, как описано у Aupperle-Lellbach с соавт. [1]. На наличие мутации BRAF c. 1784T>A изучался экзон 15 (дикий тип: TT, BRAF-мутация: TA) с помощью TaqMan SNP анализа (Thermo Fisher, Darmstadt) и FastStart Essential DNA Probes Master в LightCycler 480 II (Hoffmann-La Roche, Mannheim).
Статистический анализ выполнялся с помощью программы Graphpad prism (7.03). После составления таблиц сопряжённости определяли точный критерий Фишера.
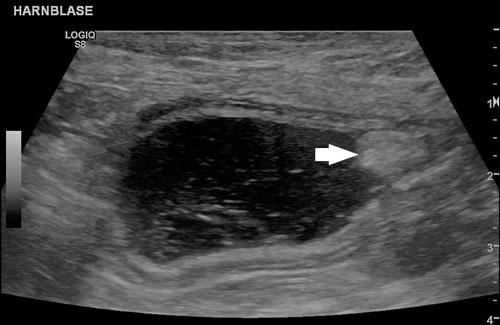 |
| Рис. 1a. Ультразвуковое изображение мочевого пузыря в продольном срезе с изображением внутрипузырного поражения (стрелка) в области шейки мочевого пузыря у 7-летней кастрированной самки породы джек-рассел-терьер с подтверждённым биопсией ПКР и положительным результатом по наличию мутации BRAF в осадке мочи |
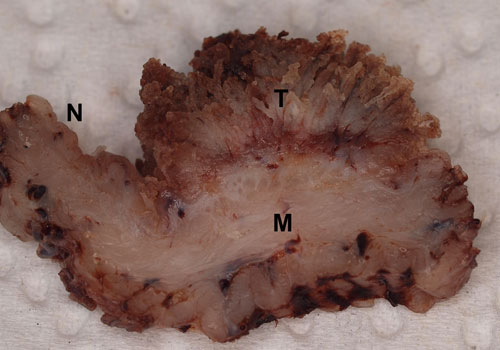 |
| Рис. 1b. Макроскопия: фиксированный в формалине резецированный из мочевого пузыря биоптат от 7-летней кастрированной самки породы метис. Хорошо заметен переход от нормальной слизистой оболочки мочевого пузыря (N) к опухолевой массе (T). Мышечный слой (М) диффузно значительно утолщён |
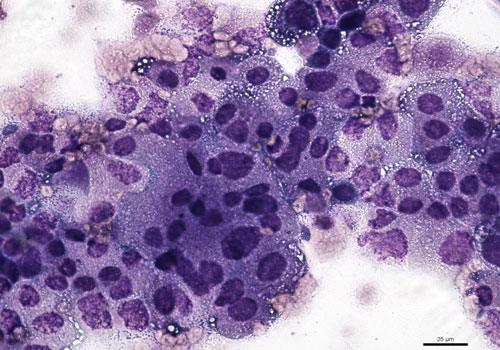 |
| Рис. 1c. Цитологическая картина: в мазке аспирационной биопсии, полученной от 8-летнего самца йоркширского терьера, представлены скопления клеток переходноклеточного рака с выраженным анизоцитозом и анизокариозом (окраска Häma, полоса = 25 мкм) |
 |
| Рис. 1d. Гистологическая картина: рядом с тонким нормальным (N) переходным эпителием представлен переходноклеточный рак мочевого пузыря у 12-летней кастрированной самки породы бигль. Обнаруживаются фокусы некроза (NK) в опухоли с папиллярным ростом (T) (окраска гематоксилином и эозином, полоса = мкм) |
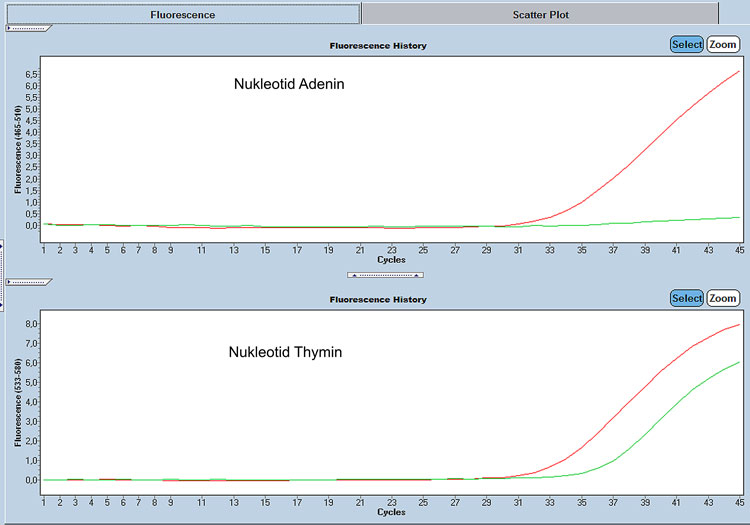 |
| Рис. 2. Обнаруженные посредством Taqman SNP Assay флуоресцентные сигналы: a — собака без BRAF-варианта (гомозиготна по тимину): представлен только один сигнал зонда дикого типа (пунктирная кривая, тимин), но нет сигнала второго зонда, который обнаруживает вариант (кривая без точек, аденин); b — собака с мутацией BRAF (гетерозигота тимин и аденин), присутствуют сигналы обоих зондов — аллель дикого типа (пунктирная кривая, тимин) и мутантный аллель (кривая без точек, аденин) |
Результаты
Переходноклеточный рак (ПКР) был часто ультрасонографически идентифицирован как интралюминальные массы в мочевом пузыре (рис. 1a). Резецированные ткани размером до 6,5×4,0×1,5 см характеризовались неравномерными объёмными образованиями и часто утолщением стенки мочевого пузыря (рис. 1b). Три биоптата меньшего объёма имели высоту до 0,5 см и крошащуюся консистенцию. Цитологически диагноз основывался на анизоцитозе эпителиальных клеток, обладавших значительной ядерной атипией (рис. 1c). Гистологически в опухолевой утолщённой слизистой оболочке выявлялись до пяти митозов в поле зрения при большом увеличении и ядерная атипия, а также инвазивный рост (рис. 1d).
У 24/28 терьеров (86%) с ПКР удалось обнаружить мутацию BRAF (рис. 2). Мутация BRAF отмечалась у терьеров достоверно чаще (p <0,001; рис. 3), чем у собак других пород (39/88, 44%). Мутация была обнаружена у 8/9 высокорослых, 15/18 низкорослых терьеров, а также у одного карликового терьера.
Из 98/101 образцов ПКР, которые могли быть гистологически градированы, 24 были низкозлокачественными и 74 высокозлокачественными. У терьеров высокозлокачественные ПКР встречались значительно чаще (p < 0,001) — в 96% случаев, чем у собак других пород (69%) (рис. 4).
Собаки в данном исследовании были в возрасте от 6 до 17 лет (средний возраст: 11 лет). Корреляция между возрастом собак и обнаружением мутации BRAF в образцах ПКР не была выявлена (рис. 5). Среди наших пациентов некастрированные (n = 29) и кастрированные (n = 50) самки встречались значительно чаще, чем некастрированные (n = 16) и кастрированные (n = 21) самцы (p < 0,001). Однако половой предрасположенности к наличию мутации BRAF установить не удалось (рис. 6).
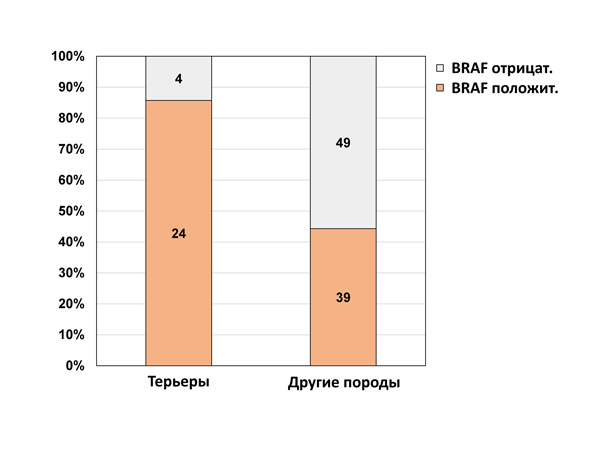 |
| Рис. 3. В переходноклеточном раке у терьеров достоверно чаще выявлялась мутация в гене BRAF, чем у собак других пород (p < 0,001) |
 |
| Рис. 4. Переходноклеточный рак у терьеров достоверно чаще градировался как высокозлокачественный (низкодифференцированный), чем ПКР у собак других пород (p < 0,001) |
 |
| Рис. 5. Большинство собак с переходноклеточным раком клеток были в возрасте от 10 до 12 лет. Частота обнаружения мутации BRAF не была ассоциирована с возрастом животного |
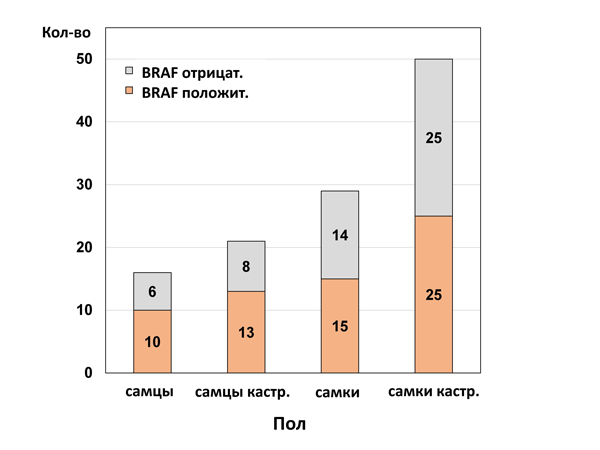 |
| Рис. 6. У некастрированных/кастрированных самок (79/116) достоверно чаще выявлялся переходноклеточный рак, чем у некастрированных/кастрированных самцов (p < 0,001). Однако частота обнаружения мутации BRAF не была ассоциирована с полом |
Выводы и обсуждения
В нашем исследовании было показано, что почти 25% собак с диагностированным ПКР относятся к высокорослым и маленьким терьерам. В наших исследованиях, прежде всего, были представлены собаки породы джек-рассел-терьер, в то время как в американских публикациях доминировали, в частности, скотчтерьеры [обзоры 13, 14]. За такие различия в частоте встречаемости различных пород собак в исследованиях в основном ответственны такие факторы, как модные тенденции и региональная популярность.
Проведённое нами на 116 собаках с ПКР исследование подтверждает предположение, основанное на исследовании Pantke [14], что терьеры имеют значительно более высокую распространённость мутации BRAF по сравнению с другими породами. В работе Decker с соавт. [3] не было выявлено предрасположенности собак пород терьеров (n = 18) по сравнению с другими породами (n = 38). В японском исследовании Maeda с соавт. [7] среди собак с ПКР (n = 11) был представлен только один терьер, и в публикациях Mochizuki с соавт. [10, 11] исследуемые породы не были описаны. В целом необходимо отметить, что только исследования с большим количеством пород собак позволяют делать какие-либо выводы.
При BRAF мутации речь идёт о мутации одного из онкогенов, которая может происходить под воздействием различных факторов в зависимости от тканевой локализации (например, УФ-излучения, химических веществ). Предположено, что у скотчтерьеров онкогенный эффект в отношении развития рака мочевого пузыря могут оказывать гербициды и инсектициды [5], а также препараты от эктопаразитов [16]. Однако связаны ли и в какой степени эти факторы с мутацией BRAF, на данный момент не изучено.
Мутация BRAF можно выявить только в опухолевых клетках (соматическая мутация), но не в других клетках организма (мутации зародышевых клеток) [3]. Таким образом, она не наследуется. Несмотря на это, данная мутация с высокой частотой возникает у предрасположенных пород терьеров, что, по всей видимости, может быть связано с наличием породоспецифических генетических полиморфизмов в гене BRAF. Такие полиморфизмы ответственны у человека за половую предрасположенность к появлению мутации BRAF при развитии меланомы [8]. Дальнейшие исследования необходимы для того, чтобы выяснить, возникают ли и насколько часто данные полиморфизмы у собак и действительно ли они делают ген BRAF более восприимчивым к мутагенным факторам.
Интересно, что почти у всех терьеров в данном исследовании встречались низкодифференцированные раки мочевого пузыря. Для выяснения прогностической значимости гистологической градации опухолей и наличия мутации BRAF в образцах ПКР мочевого пузыря у собак в настоящее время всё ещё проводятся клинические исследования. Существуют ли различия у собак пород терьеров, ещё предстоит выяснить (рукопись находится в стадии подготовки к публикации).
Обследование на наличие мутации BRAF для диагностики переходноклеточного рака рекомендуется для всех пород собак из-за высокой специфичности (100%).
Высокая чувствительность теста у высоких и низкорослых терьеров (86%) позволяет использовать данный тест даже в качестве скринингового теста, начиная с седьмого года жизни (рис. 5), когда с помощью методов визуальной диагностики опухоль ещё не обнаружена. В дальнейшем появляется возможность провести эндоскопию мочевого тракта для обнаружения опухоли на ранней стадии и удаления посредством лазера до того, как возникнет её инвазивный рост [14]. С этой целью для выявления мутации BRAF могут быть изучены образцы осадка мочи, полученные неинвазивно.
У собак других пород чувствительность анализа мутации BRAF значительно ниже (44%). Несмотря на это, тест может стать первым неинвазивным диагностическим шагом (исследование осадка мочи) в сложных диагностических случаях (пациент, владелец, техническое оснащение практики), но при учёте ограничений теста. При наличии неинформативных цитологических или гистологических образцов можно избежать повторного взятия материала, если сначала проводится мутационный анализ BRAF, который может идентифицировать около половины случаев ПКР.
В принципе, следует отметить, что диагностически значимым является только положительный результат по выявлению мутации BRAF в опухолевых клетках. При отсутствии мутации BRAF в отправленном материале опухоль либо не вызвана этой мутацией, либо в образце нет мутированных клеток, либо фактически отсутствует переходноклеточный рак.
Конфликт интересов. Авторы Aupperle-Lellbach, Grassinger, Hohloch и Köl работают в компании Laboklin, которая предлагает представленное здесь исследование коммерчески.
Литература
- Aupperle-Lellbach, H., J. Grassinger, C. Hohloch, A. Kehl, P. Pantke (2018): Diagnostische Aussagekraft der BRAF-Mutation V595E in Urinproben, Ausstrichen und Bioptaten beim kaninen Übergangszellkarzinom. Tierärztl. Prax. K 46, 289–295.
- Childress, M. O., L. G. Adams, J. A. Ramos-Vara, L. J. Freeman, S. He, P. D. Constavle, D. W. Knapp (2011): Results of biopsy via transurethral cystoscopy and cystostomy for diagnosis of transitional cell carcinoma of the urinary bladder and urethra in dogs: 92 cases (2003-2008). J. Am. Vet. Med. Assoc. 239, 350–356.
- Decker, B., H. G. Parker, D. Dhawan, E. M. Kwon, E. Karlins, B. W. Davis, J. A. Ramos-Vara, P. L. Bonney, E. A. McNiel, D. W. Knapp, E. A. Ostrander (2015): Homologous mutation to human BRAF V600E is common in naturally occurring canine bladder cancer – Evidence for a relevant model system and urine-based diagnostic test. Mol. Cancer Res. 13, 993–1002.
- Downward J. (2003): Targeting RAS signaling pathways in cancer therapy. Nat. Rev. Canc. 3, 11–22.
- Glickman, L. T., M. Raghavan, D. W. Knapp, P. L. Bonney, M. H. Dawson (2004): Herbicide exposure and the risk of transitional cell carcinoma of the urinary bladder in Scottish Terriers. J. Am. Vet. Med. Assoc. 224, 1290–1297.
- Hofer-Intewoorn, N. (2013): Tumoren des Urogenitaltraktes. Prakt Tierarzt 94, 14–25.
- Maeda, S., H. Tomiyasu, M. Tsuboi, A. Inoue, G. Ishihara, T Uchikai, J. K. Chambers, K. Uchida, T. Yonezawa, N. Matsuki (2018): Comprehensive gene expression analysis of canine invasive urothelial bladder carcinoma by RNA-Seq. BMC Cancer 18, 472
- Meyer P., C. Sergi, C. Garbe (2003): Polymorphisms of the BRAF gene predispose males to malignant Melanoma. J Carcinogen 2, http://www.carcinogenesis.com/content/2/1/7
- Meuten, D.J., T. L. K. Meuten (2017): Tumors of the Urinary System. In: Tumors of Domestic Animals, 5. Auflage, Hrsg. Meuten, D.J., T. L. K. Meuten, Wiley, Iowa, USA, S. 632–688.
- Mochizuki, H., K. Kennedy, S. G. Shapiro, M. Breen (2015a): BRAF Mutations in canine cancers. PLoS ONE 10, e0129534.
- Mochizuki, H., S. G. Shapiro, M. Breen (2015b): Detection of BRAF mutation in urine DNA as a molecular diagnostic for canine urothelial and prostatic carcinoma. PLoS ONE 10, e0144170.
- Montor, W. R., A. R. O. S. E. Salas, F. H. Machado de Melo (2018): Receptor tyrosine kinases and downstream pathways as druggable targets for cancer treatment: the current arsenal of inhibitors. Mol. Cancer 17, 55–73.
- Mutsaers, A. J., W. R. Widmer, D. W. Knapp (2003): Canine Transitional Cell Carcinoma. J. Vet. Intern. Med. 17, 136–144.
- Pantke, P. (2018): Diagnostik und Therapie des Übergangszellkarzinoms des unteren Harntraktes beim Hund. Kleintierprax. 63, 76–92.
- Pantke P., A. Kehl, H. Aupperle-Lellbach (2018): Gegenüberstellung von Hunden mit und ohne bioptisch gestützten Nachweis einer BRAF Mutation im Übergangsepithel bei Erkrankungen des unteren Harntraktes. Kleintierpraxis 63, 9/2018, S542–46
- Raghavan, M., D. W. Knapp, M. H. Dawson, P. L. Bonney, L. T. Glickman (2004): Topical flea and tick pesticides and the risk of transitional cell carcinoma of the urinary bladder in Scottish Terriers. J. Am. Vet. Med. Assoc. 225, 389–394.
Источник: Статья опубликована в журнале Kleintiermedizin 2019 №1:Р.30–35. Разрешение на перевод и публикацию в СВМ получено редактором рубрики.
СВМ № 2/2020




