Э. Мадрон
Реорганизация сердечно-сосудистой системы и активация нейрогормональных медиаторов — это два основных механизма в патофизиологии сердечной недостаточности.
Недостаточность сердца характеризуется неспособностью поддерживать дебит крови, необходимый для обеспечения в организме обменных процессов. Иными словами, недостаточность сердца проявляется низким выбросом крови, то есть неспособностью органа поддерживать физиологическое состояние организма (развивается застойная сердечная недостаточность). Следует также обратить внимание на то, что недостаточность этого органа проявляется в конечной стадии развития кардиопатии.
Несмотря на то, что кардиопатия в начале может иметь разную причину ее возникновения (недостаточность митрального клапана, дилатирующая, а также гипертрофическая кардиомиопатия, гипертироидоз, незаращение межартериального канала), в конечном итоге развития ее патогенеза отмечается определенное число общих феноменов:
- активация нейрогормональных систем, которые ускоряют или тормозят развитие сердечной недостаточности;
- изменение сосудистой системы и гемодинамики;
- реорганизация сердца и, как следствие, нарушения, возникающие в области миокарда;
- нарушение на уровне нейрогормонального и автономного регулирования;
- постепенное усиление активации нейрогормонов, которое обретает системный характер.
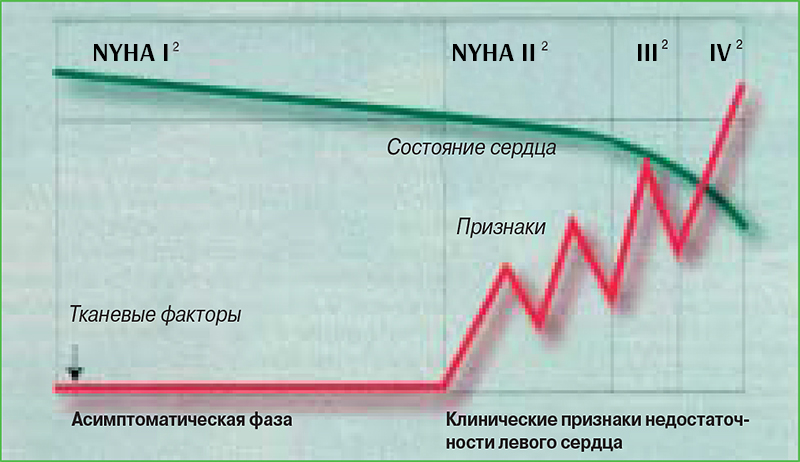
В течение определенного времени активация этих механизмов и взаимоотношение между системами агонистами (синергистами) или антагонистами дает возможность органу–сердцу в начале компенсировать появляющуюся недостаточность, что создает толерантные условия для организма (латентная асимптоматическая или компенсаторная фаза недостаточности сердца).
К сожалению, большая часть этих компенсаторных механизмов оказывает неблагоприятный эффект на миокард и функционирование самого сердца. Продолжающаяся деградация органа ведет к более выраженной активации этих механизмов и в конечном итоге завершается декомпенсацией и недостаточностью работы органа.
В последние годы знание об этих агонистических и антагонистических системах, функционирующих при сердечной недостаточности, заметно расширилось, но до сих пор остается много неясностей в отношении хронологии, конкретной роли и взаимоотношений между этими системами. Тем не менее, использование этих новых знаний позволило изменить подход к лечению кардиопатии.
Патофизиология недостаточности сердца
1. Начало развития
Начальные нарушения, ведущие к сердечной недостаточности, могут быть следующими:
– увеличение объема органа (персистенция артериального канала, артериовенозная фистула, анемия, гипертироидоз);
– потеря дебита крови вследствие рефлюкса или так называемой регургитации направляемого потока крови (недостаточность митрального клапана);
– потеря инотропизма (дилатирующая кардиомиопатия);
– нарушение функциональной деятельности сердца в фазе диастолы, которая ведет к неблагоприятному изменению условий наполнения органа (гипертрофическая кардиомиопатия, гипертензия, перикардиальный выпот).
2. Нейрогормональная активация и вазоконстрикция
Начальная фаза вазоконстрикции
Снижение дебита крови в сердце вначале ведет к падению давления крови, на которое реагируют барорецепторы, что приводит, в свою очередь, к активации симпатической нервной системы, а также к выбросу катехоламинов, ангиотензина-II, эндотелина и альдостерона.
Образование ангиотензина-II осуществляется путем активации системы ренин-ангиотензин-альдостерон (рис.1):
– снижение потока Na+ на уровне macula densa1 дистальной части тубулярной системы нефрона;
– стимуляция симпатической нервной системы.
1 Macula densa — клетки плотного пятна, яляющегося элементом юкстагломерулярного аппарата [англ. Juxtagliomerrulaire apparatus], то есть формирования клеток, подразумевающих под собой элементы, окружающие афферентную артериолу почечного клубочка (гломерула), которые секретируют ренин макулы денса, являющейся уплотнением стенки дистальной части почечного канальца, а именно в сегменте афферентной артериолы.
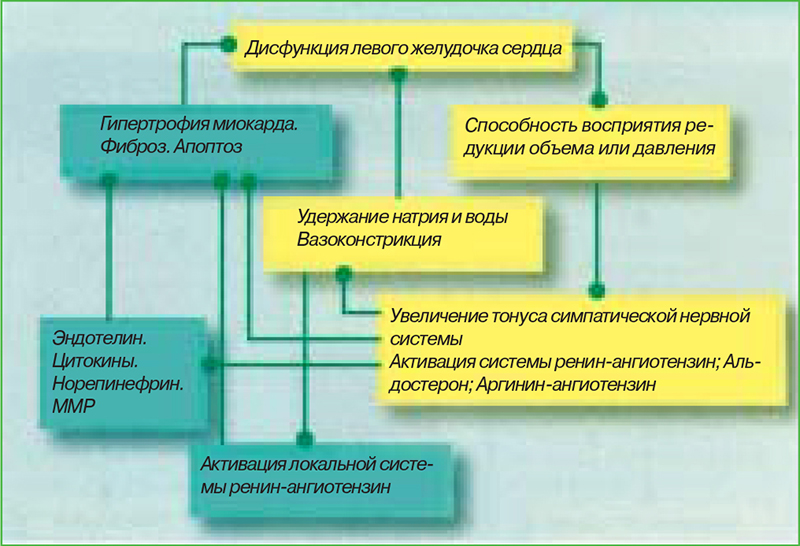 |
| Рисунок 1. Порочный круг сердечной недостаточности |
Ренин, продуцируемый эндотелиальными клетками артериол, которые располагаются близко к macula densa, превращает ангиотензиноген в ангиотензин-I, трансформирующийся затем в легких в ангиотензин-II (ECA).
Ангиотензин-II выполняет следующие функции:
– вазоконстрикция;
– стимуляция секреции альдостерона и антидиуретического гормона (ADH);
– реорганизация миокарда;
– усиление жажды (рис. 2).
 |
 |
| Рисунок 2. Роль ангиотензина-II при недостаточности сердца | Рисунок 3. Роль эндотелина при сердечной недостаточности |
Эндотелин (рис. 3) — это гормон, выделяемый паракринной и аутокринной системами эндотелиальных клеток сосудов крови. Эта секреция стимулируется ангиотензином-II, ADH, гипоксией, повреждением сосудов, тромбином, инсулином, липопротеинами и некоторыми факторами роста.
Прогормон (big-endotelin) формируется в клетках эндотелия и трансформируется в эндотелин за счет энзима превращения эндотелина (ECE). Эндотелин активирует два типа рецепторов.
Фиксация эндотелина на рецепторах ETA, локализующихся в клетках гладкомышечной ткани, провоцирует вазоконстрикцию и пролиферацию фибробластов.
Активация рецепторов ETB осуществляется в мышечных и эндотелиальных клетках и приводит, наоборот, к вазодилатации.
Во всяком случае, в целом отмечается эффект вазоконстрикции.
Эндотелин также вовлекается в процесс реорганизации миокарда и артериальной васкуляризации легких.
Уровни эндотелина (ET-1 или big-ET) возрастают в случаях гипертрофической кардиомиопатии у кошек, при дилатирующей кардиомиопатии у добермана и других пород собак как при латентном, так и клиническом течении заболевании.
Основная функция организма заключается в поддержании адекватного перфузионного давления крови в сосудах головного мозга, сердца и почек. Следовательно, генерализованная вазоконстрикция затрагивает сосуды второстепенных тканей (поперечно-полосатой мускулатуры, кожного покрова, внутренних органов). Благодаря такому типу вазоконстрикции и стимуляции сократительной способности осуществляется восстановление давления крови. Однако через 48 часов при стимуляции катехоламинами миокард теряет определенное количество β1-рецепторов. Это ослабляет позитивные инотропный и хронотропный эффекты воздействия катехоламинов, и вновь снижается уровень контрактильной (сократительной) способности.
При этом происходит увеличение выделения катехоламинов и факторов вазоконстрикции (ангиотензина-II, эндотелина, альдостерона).
В этой стадии основным действием другого компенсаторного механизма является увеличение фракции выброса за счет нарастания теледиастолического объема, благодаря резкому увеличению плазматического объема крови, что предварительно увеличивает нагрузку.
Удержание Na+ и воды
В случае сердечной недостаточности объем плазмы крови может возрасти до 30% благодаря активации системы ренинангиотензин-альдостерон.
Ангиотензин-II изменяет гемодинамику почки преимущественно за счет вазоконстрикции эфферентных артериол гломерулярного аппарата, что провоцирует увеличение фильтрационного, онкотического и снижение гидростатического (в системе общей гемоциркуляции) давлений. Основным результатом механизма этого действия является удержание в организме воды.
Альдостерон стимулирует реабсорбцию натрия и экскрецию калия, в то время как ангиотензин-II также стимулирует жажду, вызывает высвобождение АDН, что акцентируется увеличением плазматического объема крови.
Альдостерон также обладает другими эффектами, такими как стимуляция гипертрофии миокарда, что сопровождается воспалением интерстициальной ткани, развитием фиброза и некроза. Альдостерон стимулирует выброс катехоламинов и подавляет функцию барорецепторов (рис. 4).
 |
| Рисунок 4. Роль альдостерона при недостаточности работы сердца |
Механизмы действия антагонистов: ANP и BNP
Дилатация левого предсердия и увеличение частоты работы сердца вызывают выделение натрийуретических пептидов на уровне предсердия [N-концевой проатриальный натрийуретический пептид (N-terminale pro-atriale natriuretic peptide: NT-proANP, ANP)], а также желудочков сердца и головного мозга [натрийуретический пептид мозга (brain natriuretic peptide: BNP)].
Эти пептиды антагонисты эффектов воздействия системы ренин-ангиотензин-альдостерон, вызывая вазодилатацию, провоцируют экскрецию натрия с мочой. Однако их эффективность снижается при хронической сердечной недостаточности за счет преобладания системы ренин-ангиотензин-альдостерон. Постепенное увеличение уровня ANP наблюдается во время латентного течения заболевания таких форм недостаточности работы сердца как недостаточность митрального клапана, так и дилатирующая кардиомиопатия. Что касается BNP то, вероятно, появление этого пептида служит основным маркером заболеваний, которые связаны с повреждением желудочков сердца (дилатирующая и гипертрофическая кардиомиопатии).
Теледиастолическое давление левого желудочка
Увеличение теледиастолического давления желудочка сердца улучшает качество выброса фракции крови. Тем не менее, при максимальном растяжении левого желудочка возрастает его диастолическое давление. Это в свою очередь приводит к увеличению давления в левом предсердии и, как следствие, к увеличению его в венах легких, в результате чего может произойти развитие отека последних. Аналогичный феномен может вызвать нарушение в правом желудочке, проявляющееся в виде симптомов недостаточности правого сердца (плевральный выпот, застой крови в печени и асцит).
3. Реорганизация сердечно-сосудистой системы
- Дилатация желудочков вызывает стрессирование его париетальной части и провоцирует гипертрофию волокон миокарда (удвоение числа саркомеров). При этом отмечают увеличение массы сердца и не обязательно, чтобы толщина его стенок была увеличена (эксцентрическая гипертрофия). В завершение патологического процесса стенки сердца утончаются. Репликация (удвоение) саркомеров возникает, когда уровень вентрикулярного давления в состоянии теледиастолы находится в интервале 5–25 мм рт. ст. В случае, когда оно превышает уровень 25 мм рт. ст., желудочек сердца расширяется. Эта репликация отдельных саркомеров сопровождается также изменением их генетического кода, что ведет к генетически программированной смерти клеток (апоптозу) и, в свою очередь, к изменению коллагена и фиброзу. Это провоцирует снижение сократительной способности стенки желудочка, а также потерю ее эластичности.
- Медиаторов, вовлеченных в процесс реорганизации миокарда, насчитывают в большом количестве, и их взаимоотношения носят сложный характер: тканевая система ренинангиотензина, ангиотензин-II, альдостерон, эндотелин, цитокины, такие как некротизирующий фактор опухоли (TNF-альфа), интерлейкины — IL-1 и IL-6. Все эти медиаторы вызывают репликацию саркомеров, апоптоз, фиброз и некроз тканей. С другой стороны, металлопротеиназы (ферменты, которые расщепляют коллаген), находятся в активированном состоянии, что приводит к изменению природы самого коллагена.
- Последствиями этих патологических изменений сердца является потеря инотропизма в связи с исчезновением кардиомиоцитов, диастолической дисфункцией по причине развития фиброза и модификации коллагена, а также создания благоприятной почвы для развития аритмий. Такого рода последствия проявляются во всех формах кардиопатий в конечной стадии их развития (например, это характерно для дилатирующей и гипертрофической кардиомиопатии или при сильно выраженной недостаточности митрального клапана).
- Ангиотензин-II, альдостерон и эндотелин также провоцируют вазоконстрикцию и, как следствие, гипертрофию стенки сосудов. Эндотелин играет основную роль в реорганизации артериол легких и развитии их гипертензии, которая проявляется потенциальным осложнением при недостаточности митрального клапана от 3-й стадии и выше. Гипертензия лёгких может привести к недостаточности правого сердца и развитию синкопэ.
4. Нарушение автономного и нейрогормонального регулирования
При хронической сердечной недостаточности происходит ослабление активности барорецепторов, что приводит к снижению воздействия блуждающего нерва на этот орган. В результате отмечают уменьшение вариабельности частоты работы сердца (в основном она более высокая). Альдостерон при этом может быть одним из основных медиаторов нарушения регулирования.
5. Терминальная фаза
Включающиеся компенсаторные механизмы стабилизируют постепенное нарастание патологических изменений, что объясняется необратимым нарушением функциональной деятельности сердца, как в фазе систолы, так и диастолы. Медиаторы, отвечающие за вазоконстрикцию, обретают максимальную активность, при этом в клинической картине преобладают симптомы застойной недостаточности сердца и низкого дебита крови.
В случае недостаточности митрального клапана этот феномен отмечают значительно реже, потому что он, рано вовлекая в этот процесс систолическую дисфункцию, в клинической стадии заболевания проявляется поздно. При том отмечают проявления аритмий (вентрикулярная экстрасистолия, атриальная фибрилляция).
В этой стадии развития сердечной недостаточности проявляются следующие синдромы системного расстройства:
– кахексия сердца (предполагается наличие медиатора TNF-a, который максимально активируется в терминальной фазе недостаточности органа, рис. 5);
– вторичная гипопротеинемия с развитием лимфангиэктазии (связана с венозным стазом висцеральной части организма);
– гипоперфузия почек, сопровождающаяся преренальной азотемией и гиперкалиемией;
– гипотензия, которая может стимулировать высвобождение ADH, приводящая, в свою очередь, к изменению секреции ADH, характеризующаяся снижением концентрации крови (гиперволемией) и выраженной гипонатриемией.
 |
| Рисунок 5. Цитокины при недостаточности работы левого сердца |
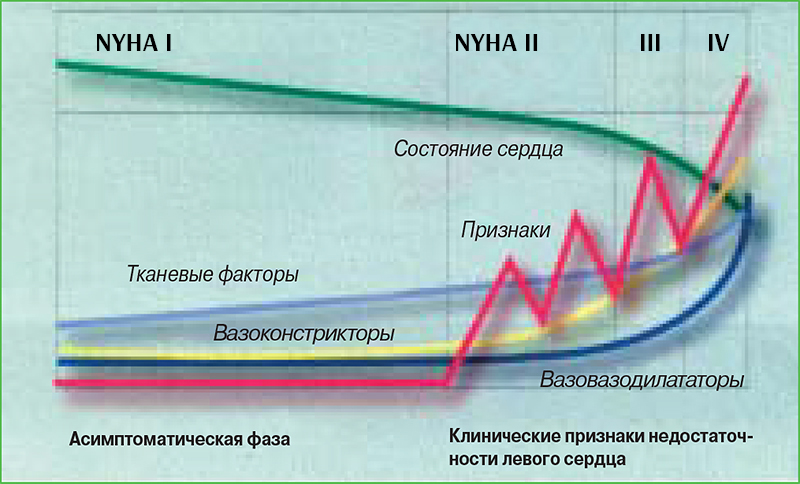
По мере снижения функциональной способности сердца ниже порога ее физиологической резистентности, отмечается постепенное усугубление тяжести проявлений симптомов его недостаточности (рис. 6). В период латентного течения заболевания органа восстанавливается слабое равновесие между системами агонизма и антагонизма и последующим развитием разных стадий клинического заболевания, проявляющихся одновременно с выраженным увеличением медиаторов, отвечающих за вазоконстрикцию (рис. 7).
6. Дифференциация недостаточности митрального клапана и дилатирующей кардиомиопатии
Недостаточность митрального клапана
Нейрогормональная активация асимптоматической фазы недостаточности митрального клапана отличается от таковой при дилатирующей кардиомиопатии.
В результате латентной недостаточности митрального клапана отмечается постепенное увеличение ANР, тогда как количественные показатели альдостерона и ангиотензина–II снижаются даже при наличии клинических признаков застойной сердечной недостаточности. Это вполне логично, потому что основным стимулом высвобождения ANР является дилатация предсердия. В этом случае функциональная способность сердца в фазе систолы сохраняется в большей части стадий развития недостаточности митрального клапана и снижается лишь в терминальной стадии развития патологического процесса.
Система ренин-ангиотензин-альдостерон (RAAS) активируется, по-видимому, значительно позже при развитии данной патологии. Косвенные подтверждения этому были получены в 14 центрах в Скандинавии (В результате исследований в SVER) (Skandinavian Veterinari Enalapril Projekt) при использовании в исследовании двойного слепого метода в сравнении с плацебо).
Было отобрано 229 собак породы кавалер-кинг-чарльз-спаниель, с недостаточностью митрального клапана, вызванного развитием эндокардиоза без проявления клинических признаков сердечной недостаточности. Эти животные были разделены на две группы:
– 1-я группа (n = 116) получала эналаприл (0,25–0,5 мг/кг в сутки);
– 2-я группа (n = 113) получала плацебо.
При оценке состояния каждого животного учитывали результаты клинических показателей, данные электрокардиографии и рентгенографии в начале исследования и затем каждый год. Количество собак, у которых развивалась сердечная недостаточность, было одинаковым в обеих группах (43 и 42% соответственно). Среднее время появления симптомов заболевания, в обеих группах оказалось сходным (1150+/– 50 дней — для первой и 1130+/– 30 дней — для второй группы), что говорит об отсутствии статистически значимых различий. С другой стороны какой-либо разницы установлено не было. В результате было показано, что эналаприл не продлевает асимптоматическое течение заболевания как при кардиомегалии, так и ее отсутствии с момента постановки диагноза. В ранее предлагаемые объяснения входит: отсутствие активации системы ренин-ангиотензин (SRA) у кавалер-кинг-чарльз-спаниелей в продромальный период недостаточности работы сердца (вероятно, в связи с активацией натрийуретических пептидов предсердия, четко дифференциируется у собак, имеющих дилатирующую кардиомиопатию), отсутствие рецепторов ангиотензина-II в тканях клапанов сердца у собак.
Исследования Vetproof (Veterinary Enalapril Trial to Prove Reduction in Onset of Failure), которые проводили по аналогичной схеме, но на нескольких породах собак, также не могли показать, что эналаприл, назначаемый животным в асимптоматической фазе заболевания способен пролонгировать время появления клинических признаков недостаточности сердца. Отсюда следует, что возможным изначальным определением нейрогормональной активации является недостаточность митрального клапана или дилатация левого предсердия. Скорее всего, это завершение развития патологического процесса, когда левый желудочек становится сильно дилатированным со сниженной функциональной способностью в фазе систолы, чем нейрогормональная активация, сходная с таковой при дилатирующей кардиомиопатии в начале ее клинического проявления.
Дилатирующая кардиомиопатия
В случае с дилатирующей кардиомиопатией было подтверждено общее прогрессирующее увеличение норепинефрина, ANP и big-эндотелина. Тем не менее, это увеличение не имело линейной характеристки, оно проявлялось дискретно, что вызывало трудности его обнаружения в период асимптоматической фазы заболевания вплоть до четкого установления постепенного подъема этих показателей во время проявления застойной сердечной недостаточности. Следовательно, пока еще трудно проводить дифференциацию нейрогормонального профиля у здоровых и находящихся в латентной стадии развития кардиопатии животных. Но BNP, все же, может служить прогнозирующим фактором, потому что было установлено увеличение этого прогормона у кошек, подверженных асимптоматической гипертрофической кардиомиопатии.
Диастолическое нарушение функциональной деятельности сердца
Диастолическое нарушение функциональной деятельности сердца связано с нарушением свойств релаксации и/или снижением эластичности стенок его желудочков. При этом отмечаются аномалии в виде вентрикулярной релаксации или ригидности. Это провоцирует увеличение диастолического давления в левом желудочке и, следовательно, повышение давления во время его наполнения, что может привести к застойной сердечной недостаточности. Причиной тому может быть гипертрофия миокарда (системная артериальная гипертензия, гипертрофическая кардиомиопатия, гипертироидоз) или фиброз миокарда (рестриктивные кардиомиопатии и констриктивные перикардиты). В целом систолическая функция при наличии гипертрофической кардиомиопатии соответствует норме, но иногда может быть сниженной при рестриктивной кардиомиопатии.
В терминальной фазе гипертрофической кардиомиопатии контрактильная способность может быть снижена, но также имеет место феномен реорганизации миокарда, описанный выше.
Одним из возможных развитий гипертрофической кардиомиопатии является проявление прогрессирующей дилатации желудочков, иногда с локальным утончением стенки (что свидетельствует о вторичной ишемии с развитием инфаркта), а также снижением контрактильной способности и фиброзом миокарда, которые изменяют характеристики диастолической дисфункции (аномалии релаксации затушевываются перед четким появлением выраженных нарушений эластичности).
Феномены, вовлеченные в развитие заболевания работы сердца, являются сложными и многофакторными. Существуют выраженные различия изначальных патофизиологических процессов при недостаточности митрального клапана и гипертрофической, а также дилатирующей кардиомиопатии. Но в конце заболевания устанавливается определенное количество общих феноменов: реорганизация миокарда и сосудов, постепенное повышение активности медиаторов, таких как ангиотензин-II, альдостерон, эндопирин; увеличение отрицательного воздействия цитокинов, вызывающих воспалительные процессы, которые становятся все более очевидными.
В связи с открытием большого количества новых молекулярных соединений, обладающих специфической способностью к блокаде медиаторов, у исследователей растет интерес в отношении изучения этих нейрогормонов. Также ведутся многочисленные исследования, направленные на клиническую оценку нейрогормонального профиля, которая может позволить лучше определить стадию заболевания, уточнить прогноз и уточнить способ лечения при отдельных формах заболевания сердца.
Основные положения
– Нейрогормоны, активированные при сердечной недостаточности, обладают способностью вызывать вазоконстрикцию, также они наделены митогенными и профибролитическими свойствами и приводят к апоптозу клеток миокарда (реорганизация миокарда).
– В период асимптоматической стадии кардиопатий степень активации нейрогормонов варьируется. Эта активация становится все более выраженной во время развития недостаточности сердца.
– Прогрессирующая дилатация левого предсердция является основным определяющим фактором активации нейрогормонов. Система ренин-ангиотензин-альдостерон (RAAS), вероятно, активируется в терминальной стадии заболевания. В случае дилатирующей кардиомиопатии система RAAS активируется значительно раньше, в отличие от других гормонов (чем, например, эндотелин и BNP).
СВМ 4/2005