А. L. Antonov,
Department of Obstetrics, Reproduction and Reproductive Disorders, Faculty of Veterinary Medicine, Trakia University, Stara Zagora, 6000, Bulgaria
Резюме
Практическое применение цитологии влагалищного мазка как в норме, так и при патологии весьма разнообразно. Цель обзора — описать применение цитологического исследования влагалищного мазка как диагностического метода в клинической репродуктологии собак.
Ключевые слова: сука, цитология влагалищного мазка
Введение
Цитологическое исследование влагалищного мазка — наиболее распространённый диагностический метод в рамках гинекологического обследования суки [13; 19; 32; 44; 45; 49; 24; 55; 52; 53; 18; 31; 56]. Он основан на определении циклических клеточных изменений, происходящих в эпителии влагалища в результате изменения уровня половых гормонов, в первую очередь — эстрогенов [57]. Метод прост и полезен даже при физиологических и патологических состояниях репродуктивной системы суки. Чаще всего он используется для определения стадий эстрального цикла для выбора оптимального времени вязки [53].
Процедуры для отбора клеток влагалища и получение мазков
Клетки влагалища для цитологического исследования могут быть собраны с использованием стерильного гинекологического зеркала и увлажнённого физиологическим раствором урогенитального зонда [58; 57; 20]. Важно не допустить контакт зонда с преддверием влагалища, потому что там клетки не так быстро реагируют на повышение уровня эстрогена в крови, как слизистая оболочка влагалища [40].
Клетки влагалища также можно собрать только зондом, без использования зеркала [17; 6; 27; 30; 3]. Ватный конец вводится во влагалище по его верхнему своду, при этом необходимо аккуратно надавливать в каудодорсальном направлении, пока зонд не пройдёт над седалищной дугой, после чего он проворачивается на полный оборот в каждом направлении и извлекается [3]. Затем ватный конец аккуратно прокатывается от одного конца предметного стекла до другого [17; 27; 30].
Клетки влагалища для цитологического исследования могут быть собраны с помощью введения в полость влагалища стерильного физиологического раствора и последующей его аспирации пластиковым катетером [36]. Жидкость наносится на предметное стекло, распределяется в виде тонкой плёнки и сушится на воздухе. Этот метод наименее инвазивен, однако иногда приводит к изменениям в морфологии клеток и снижению абсолютного числа клеток [34; 35; 21].
Мазки могут быть окрашены трихромом или красителем Папаниколау [38], но этот метод трудоёмок [16]. Многие авторы сообщали о его использовании с пропуском некоторых стадий окрашивания [4; 29; 14].
Мазки, окрашенные новым метиленовым синим (NMB), могут быть исследованы сразу после нанесения красителя, однако эритроциты при этом не окрашиваются, а мазки не сохраняются для последующего пересмотра [27]. Другие классические техники окрашивания используют такие красители, как Мэй-Грюнвальд, Берингер Маннхайм, Паппенхайм и Тестсимплетс® [19].
Дифф-Квик® или Гемаколор® (Merck KGaA), модифицированные экспресс-варианты красителя Райта-Гимзы, просты для применения в клинической практике. Мазки фиксируются метанолом и затем окрашиваются красителем Дифф-Квик® дважды. Эти мазки могут храниться долгие годы и исследоваться позднее [27; 7].
Aydin et al. [3] сравнивали прямой метод исследования влагалищных мазков с классическим окрашиванием с целью определения стадий полового цикла сук и выяснили, что метод надёжен только в определении стадии эструса.
Оценка влагалищного мазка
Влагалищный мазок исследуется с помощью световой микроскопии с увеличением от ×100 до ×400. Необходимо исследовать как минимум 10 полей зрения [51].
Существуют различные типы клеток влагалища [15]. Согласно большинству авторов, клетки стенки влагалища делятся на базальные, парабазальные, промежуточные, поверхностные и сквамозные [39; 41; 13; 21; 33; 51; 24].
В целом принято считать, что типы вагинальных клеток в мазке зависят от уровня эстрального цикла [5], что делает цитологическое исследование влагалищного мазка ценным дополнительным тестом в репродуктивной клинической диагностике [9; 15].
Базальные — мельчайшие клетки (10—20 мкм) стенки влагалища. Они практически полностью заняты ядром и редко наблюдаются во влагалищном мазке, поскольку расположены на базальной мембране [34; 57].
Парабазальные — маленькие (15—25 мкм) шарообразные или овоидные клетки с довольно большим ядром. Иногда они содержат цитоплазматические вакуоли. Парабазальные клетки могут также содержать в цитоплазме нейтрофильные гранулоциты, и тогда их называют метаэструсными клетками, хотя они могут появляться и на других стадиях цикла [57] или при вагините [35].
Промежуточные клетки значительно различаются в диаметре, поэтому разделяются на клетки двух типов, малые (20 мкм) и большие (30 мкм) [39; 13; 37; 33]. Оба типа содержат хорошо оформленное ядро. Малые промежуточные клетки имеют форму от круглой до эллиптической, но могут также быть полигональными, в то время как большие клетки отличает неправильной формы или угловатая цитоплазматическая граница [8]. Промежуточные клетки имеют заметные ядра. Большие промежуточные клетки иногда путают с поверхностными клетками, поскольку у них похожий размер [27].
Поверхностные клетки крупные, диаметром от 20 [8] до 75 мкм [10]. Они имеют неправильной формы или угловатые границы и тёмное, пикнотическое или бледное ядро. Поверхностные клетки достигают своего максимума во время эстрогенного пика [39; 8; 13; 10; 27; 33; 24].
Сквамозные клетки — это крупные ороговевшие клетки, которые перенесли дегенерацию и стали мёртвыми безъядерными клетками [43]. Обычно они окрашиваются тёмным сине-пурпурным цветом в период эструса [27].
Помимо клеток влагалища в мазках при цитологическом исследовании обнаруживаются и другие клетки: эритроциты, нейтрофилы (лейкоциты), бактерии, опухолевые клетки, эпителиальные клетки ямки клитора, сперматозоиды, гигантские трофобласты и посторонние включения [33].
 |
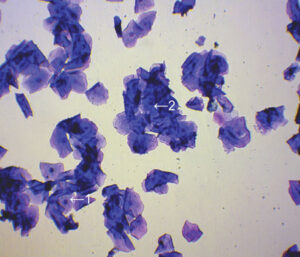 |
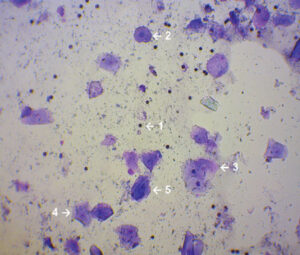
| Рис. 1. Влагалищный мазок суки в проэструсе: 1 — эритроцит; 2 — малая промежуточная клетка; 3 — большая промежуточная клетка; 4 — поверхностная клетка; 5 — сквамозная клетка (оригинальный снимок, Haemacolor®, ×100) | Рис. 2. Влагалищный мазок суки в эструсе: 1 — поверхностная клетка; 2 — сквамозная клетка (оригинальный снимок, Haemacolor®, ×100) |
Клиническое применение цитологического исследования влагалищного мазка
Определение оптимального времени для вязки или искусственного осеменения
Фертильность у сук имеет большую социально-экономическую важность [31]. Большая часть сук, поступающих на приём с бесплодием в анамнезе, являются в действительности фертильными [11]. Самая частая (40—50%) причина неудачного зачатия в описанных случаях — неверно выбранное время вязки [59; 26].
Постепенный сдвиг от парабазальных и промежуточных клеток к поверхностным происходит во время проэструса. Кроме того, в это время присутствует большое число эритроцитов (рис. 1). Оптимальное время для естественной вязки или искусственного осеменения — стадия эструса, когда доля поверхностных и сквамозных клеток (рис. 2) в мазках из влагалища приближается к 80% [42; 27; 47]. Вязка или осеменение должны быть проведены в двух- или трёхдневный промежуток времени до наступления диэструса, что становится ясным по появлению парабазальных клеток, нейтрофилов [42; 47] и снижению количества поверхностных и сквамозных клеток как минимум до 20% [22] (рис. 3). Если вязка произошла в срок от 3 до 10 дней до наступления цитологического диэструса, вероятность зачатия с первой попытки превышает 95%. Определение первого дня цитологического диэструса позволяет понять, была ли вязка проведена в подходящее время [27].
Цитологическое исследование влагалищного мазка дополнительно применяется в случаях неявной течки («белой течки»), проявляющейся без кровяных влагалищных выделений при наличии поверхностных и сквамозных клеток во влагалищных мазках [57; 20].
 |
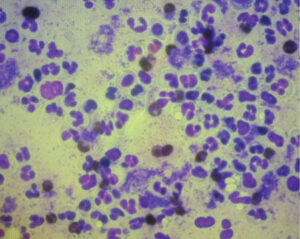 |
| Рис. 3. Влагалищный мазок суки на первый день диэструса: 1 — эритроциты; 2 — малые промежуточные клетки; 3 — большие промежуточные клетки; 4 — сквамозные клетки; 5 — нейтрофилы (оригинальный снимок, Haemacolor®, ×100) | Рис. 4. Влагалищный мазок суки с вагинитом (оригинальный снимок, Haemacolor®, ×100) |
Прогнозирование даты щенения
Если вязка или осеменение произошли в оптимальное время для высокой вероятности зачатия, взятие серии мазков из влагалища и определение первого дня цитологического диэструса позволяют с большой точностью предсказать время щенения. Ожидаемый срок родов — 56—58 дней, наиболее часто (93% сук) — на 57-й день после наступления цитологического диэструса [22; 27].
Вагинит
Мазки из влагалища собак с вагинитом (рис. 4) обычно содержат полиморфно-ядерные лейкоциты и нередко бактерии [23].
Кисты и опухоли яичников
У сук с кистами или гранулёзоклеточными опухолями яичников отмечаются гормональные нарушения: сниженная продукция эстрогена, удлинённый эструс, набухание вульвы, дерматологические изменения и кистозная гиперплазия эндометрия с персистирующими серозно-кровянистыми выделениями. Влагалищная цитология характеризуется наличием более 80—90% поверхностных и сквамозных клеток, что сходно с нормальной фазой эструса, поэтому в этом случае рекомендуется ультразвуковое исследование брюшной полости [28; 50].
Остаточный яичниковый синдром
Остаточный яичниковый синдром определяется как присутствие функционирующей яичниковой ткани, оставшейся в брюшной полости при имевшей место овариогистерэктомии суки. Клинически проявляется наличием признаков проэструса и эструса, включая набухание вульвы и кровотечение, а также поведенческие изменения, такие как мечение [54]. В результате продукции эстрогена оставшейся тканью яичника при вагинальной эксфолиативной цитологии могут быть обнаружены ороговевшие эпителиальные клетки, сходные с наблюдаемыми при нормальном проэструсе и эструсе [48].
Нежелательная вязка
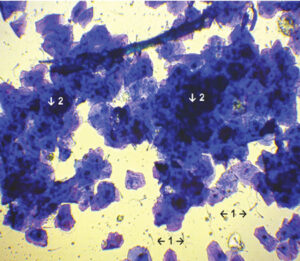
Цитологическое исследование влагалищного мазка — наилучший метод диагностики нежелательной вязки суки. Сперматозоиды могут обнаруживаться во влагалищных мазках спустя 24—36 часов после случки (рис. 5). Отсутствие спермы не исключает вязки [47]. Случается, что не удаётся обнаружить сперматозоиды, поскольку их действительно там нет в случае отсутствия вязки или же имела место копуляция без семяизвержения.
Опухоли влагалища
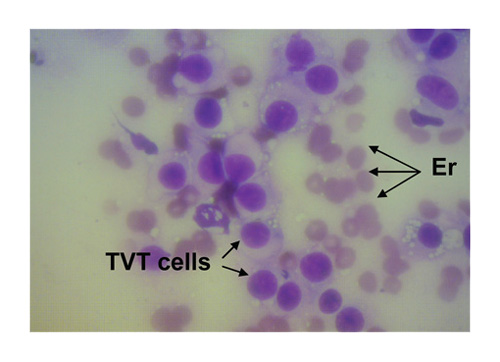
Трансмиссивная венерическая саркома является наиболее частой диагностируемой неоплазией у сук при цитологическом исследовании влагалищного мазка [47]. Влагалищные мазки (рис. 6) содержат огромное количество эритроцитов, нейтрофилов, лимфоцитов, парабазальных, промежуточных клеток и клетки округлой и овоидной формы, содержащие внутрицитоплазменые вакуоли [2].
Субинволюция плацентарных участков
Субинволюция плацентарных участков (SIPS) появляется, когда инволюция матки затягивается, и у суки появляются кровянистые маточные выделения, которые вытекают из вульвы в течение нескольких недель после щенения [27]. Обычно фетальные трофобласты у сук находятся в верхней рыхлой соединительной ткани собственной пластинки в первые 2 недели после щенения [1]. У сук с SIPS эти трофобластные клетки не дегенерируют и продолжают внедряться в эндометрий и даже в миометрий, что приводит к повреждению кровеносных сосудов и нарушению нормального тромбообразования кровеносных сосудов эндометрия [25]. Эти многоядерные и сильно вакуолизированные трофобласты могут наблюдаться в вагинальных мазках при цитологическом исследовании у сук с SIPS [12] (рис. 7).
 |
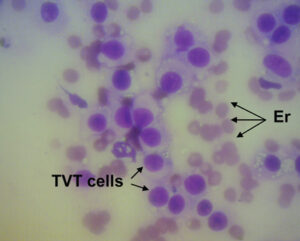 |
| Рис. 5. Цитологическое исследование влагалищного мазка суки через час после вязки: 1 — сперматозоид; 2 — сквамозные клетки (оригинальный снимок, Haemacolor®, ×100) | Рис. 6. Влагалищный мазок суки с трансмиссивной венерической саркомой. Er — эритроциты (оригинальный снимок, Haemacolor®, ×100) |
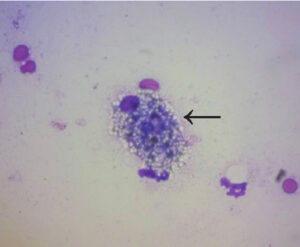 |
Рис. 7. Трофобластная многоядерная клетка в мазке из влагалища суки с субинволюцией плацентарных участков (стрелка) (оригинальный снимок, Haemacolor®, ×100) |
Заключение
Цитологическое исследование влагалищного мазка является очень полезным методом в клинической репродуктологии собак благодаря своей простоте, доступности оборудования и возможности получения быстрых результатов. Она может использоваться как ценное дополнение к любым другим репродуктивным исследованиям у сук. Несмотря на то, что этот метод является рутинным, до сих пор существуют некоторые нерешённые проблемы, например, связанные с влиянием копуляции и искусственного осеменения на динамику популяции клеток влагалища у собак.
Литература
- Al–Bassam, M., R. Thomson & L. ODonnel, 1981. Normal postpartum involution of the uterus in the dog. Canadian Journal of Comparative Medicine, 45, 217–232.
- Antonov, A., 2015. Successful treatment of canine transmissible venereal tumor using vincristine sulphate. Advances in Research, 5, 1–5.
- Aydin, I., E. Sur, T. Ozaydin & D. Dinc, 2011. Determination of the stages of the sexual cycle of the bitch by direct examination. Journal of Animal and Veterinary Advances, 10, 1962–1967.
- Barret, R., 1976. Exfoliative vaginal cytology of the dog using Wright's stain. Veterinary Medicine Small Animal Clinic, 71, 12361238.
- Bell, E., J. Bailey & D. Christie, 1973. Studies on vaginal cytology during the canine oestrus cycle. Research in Veterinary Science, 14, 173–179.
- Bowen, R., 2000. Techniques for preparing a canine vaginal smear. Fort Collins (USA). Colorado State University. http:/www.vivo.colostate.edu/hbooks/pathphys/reprod/ vc/prep.html (19 April 2016 date last accessed).
- Chatdarong, K., N. Kampa, E. Axner & C. Linde Forsberg, 2002. Investigation of cervical patency and uterine appearance in domestic cats by fluoroscopy and scintigraphy. Reproduction in Domestic Animals, 37, 275–281.
- Christie, D., J. Bailey & E. Bell, 1972. Classification of cell types in vaginal smears during the canine oestrus cycle. British Veterinary Journal, 128, 301–310.
- Christie, D. & E. Bell, 1973. A guide to vaginal cytology in the oestrus cycle of the bitch. Veterinary Annual, 14, 212–215.
- Concannon, P. & G. Digregorio, 1986. Canine vaginal cytology. In: Small Animal Reproduction and Infertility, A clinical Approach to Diagnosis and Treatment. ed T. Burke, Lea & Febiger, Philadelphia, pp. 96–111.
- Concannon, P., J. McCann & M. Temple, 1989. Biology and endocrinology of ovulation, pregnancy and parturition in the dog. Journal of Reproduction and Fertility. Supplement, 39, 3–25.
- Dickie, M. & K. Arbeiter, 1993. Diagnosis and therapy of the subinvolution of placental sites in the bitch. Journal of Reproduction and Fertility. Supplement, 47, 471–475.
- Dreier, C., 1975. Vaginal cytology: Studies on the possibility of diagnosing normal and pathological cycles in the bitch. Wiener Tierarztliche Monatsschrift, 62, 188.
- Dumon, C. & C. Morel, 1989. Use of the Diagnoestrus RAL kit for staining vaginal smears in bitces. Pratique Medicale et Chirurgicale de l'Animal de Compagnie, 24, 49–53.
- Ehlers, J., 2000. Standardisierung und Reproduzierbarkeit der Vaginalzytologie bei der Hundin und ihr Einsatz bei der Bestimmung des optimalen Belegungs– zeitraumers. Diss, Munchen.
- England, G. & P. Concannon, 2002. Determination of the optimal breeding time in the bitch: basic considerations. In: Recent Advances in Small Animal Reproduction, eds P. Concannon, G. England & J. Verstegen, International Veterinary Information Service, Ithaca, New York, Usa.
- Feldman, E. & R. Nelson, 1996. Canine and Feline Endocrinology and Reproduction. 2nd edn, W.B. Saunders Company, Philadelphia, USA.
- Groppetti, D., A. Pecile, C. Barbero & P. Martino, 2012. Vaginal bacterial flora and cytology in proestrus bitches: Role on fertility. Theriogenology, 77, 1549–1556.
- Gunzel-Apel, A. & P. Koivisto, 1984. Aktuelles zum Sexualzyklus der Hundin- diagnostische Moglichkeiten durch vaginalzytilogische Untersuchungen mittels Testimplets. Der Praktische Tierarzt, 2, 161–172.
- Gunzel-Apel, A., 1993. Fruchtbarkeitskontrolle bei der Hundin. Vet Reihe.
- Guyant, L., 1988. Canine vaginal cytology. Veterinary Techniques, 9, 513–520.
- Holst, P. & R. Phemister, 1974. Onset of diestrus in the beagle bitch: Definition and significance. American Journal of Veterinary Research, 35, 401–406.
- Johnson, C., 1991. Diagnosis and treatment of chronic vaginitis in the bitch. Veterinary Clinics of North America: Small Animal Practice, 21, 523–531.
- Johnson, C., 2006. Fortpflanzungsstorungen. In: Labordiagnostik in der Kleintierpraxis, eds M. Willard & H. Tvedten, Urban & Fischer Verlag, Munchen, pp. 377–383.
- Johnston, S., 1986. Subinvolution of placental sites. Current Veterinary Theriogenology, 9, 1231–1233.
- Johnston, S., P. Olson & M. Root, 1994. Clinical approach to infertility in the bitch. Seminars in Veterinary Medical Surgery, 9, 2–6.
- Johnston, S., M. Kustritz & P. Olson, 2001. Canine and Feline Theriogenology, 2nd edn, W. B. Saunders Company.
- Koivisto, M., I. Carvalho, J. Carreira, J. Trevizan, G. Machado, F. Sueiro, L. Ciarlini & P. Gomes, 2012. Granulosa cell tumor in a bitch–case report. In: Proceedings of the 7th International Symposium on Canine and Feline Reproduction–ISCFR, Whistler, Canada.
- Kubicek, J., 1978. A simplified vaginal smear method for hormonal cytodiagnosis in the bitch. Kleintierpraxis, 23, 259–262.
- Kustritz, M., 2006. Collection of tissue and culture samples from the canine reproductive tract. Theriogenology, 66, 567574.
- Leigh, O., L. Raji, & E . Diakodue, 2013. Detection of standing heat in bitches: Application of vaginal cytology. World Journal of Life Science and Medical Research, 3, 21–25.
- Linde, C. & I. Karlson, 1984. The correlation between the cytology of the vaginal smear and the time of ovulation in the bitch. Journal of Small Animal Practice, 25, 7782.
- Maneke, N., 2002. Untersuchung zur Beschreibung von Vaginalzellen der Hundin als ein Beitrag zur objektiven Zyklusdiagnostik. Veterinary Medicine Dissertation, Berlin.
- Olson, P., M. Thrall & P. Wykes, 1984a. Vaginal cytology: Part I: A useful tool for staging the canine estrous cycle. Compendium of Continuous Education of the Practicing Veterinarian, 6, 288–298.
- Olson, P., M. Thrall & P. Wykes, 1984b. Vaginal cytology. Part II. Diagnosing canine reproductive disorders. Compendium of Continuous Education of the Practicing Veterinarian, 6, 385–390.
- Olson, P., T. Thomas, P. Husted & T. Nett, 1988. Clinical Evaluation of Infertility in the Bitch. Clinical Signs and Diagnosis in Small Animal Practice, ed R. B. Ford, Churchill Livingstone, New York, pp. 631–654.
- Olson, P., 1989. Exfoliative cytology of the canine reproductive tract. In: Proceedings of the Annual Meeting of the Society for Theriogenology, Coeur d'Alene, ID, September 29–30. Nashville, Society for Theriogenology.
- Papanicolaou, G., 1942. A new procedure for staining vaginal smear. Science of New York, 95, 438.
- Rieck, G. & Kratzheller, K., 1955. Zytologie des desquamierenden Vaginalepithels der Hundin und ihre Anwendung fur die Zytodiagnostik. Zentralblatt der Veteri– narmedizin, 2, 82–101.
- Rottger, K., 2010. Untersuchungen zur durchfuhrung der exfoliativen vaginalzytologie bei der hundin. Dissertation.
- Schutte, A., 1967. Canine vaginal cytology — I. Technique and cytological morphology. Journal of Small Animal Practice, 8, 301306.
- Simmons, J., 1970. The vaginal smear and its practical application. Veterinary Medicine/ Small Animal Clinician, 65, 369–373.
- Simmons, J. & Olson, P., 1989. Nomenclature for small animal theriogenology. Society for theriogenology Newsletter, July/August.
- Soderberg, S., 1986a. Canine breeding management. Veterinary Clinics of North America: Small Animal Practice, 16, 419–433.
- Soderberg, S., 1986b. Vaginal disorders. Veterinary Clinics of North America: Small Animal Practice, 16, 543–559.
- Stone, E., C. Cantrell & N. Sharp, 2003. Ovary and uterus. In: Textbook of Small Animal Surgery, 2nd edn, ed D. Slatter, W. B. Saunders Company, Philadelphia, USA, pp. 1293–1308.
- Srinivas, M., N. Lakshmi Rani, K. Suresh & M. Sreenu, 2004. Vaginal exfoliative cytology as a tool in diagnosing reproductive disorders in bitches. Intas Polivet, 5, 354–356.
- Stone, E., 2003. Textbook of Small Animal Surgery, 3rd edn, W. B. Saunders, Philadelphia, p. 1498.
- Tammer, I., K. Blendinger, A. Sobiraj & H. Bostedt, 1994. Uber den Einsatz der exfoliativen Vaginalzytologie im Rahmen der gynakologischen Befunderhebung bei der Hundin. Tierarztliche Praxis, 22, 199207.
- Tavasoli, A. & A. Solati, 2011. Granulosa cell tumor of the ovary in dog: Case Report from Teheran. Journal of Cell and Animal Biology, 5, 66–68.
- Theise, B., 2002. Unterstutzung zur Entwicklung eines computergestutzten Lernprogramms zu den Grundlagen der Gynakologie bei der Hundin. Dissertation.
- Trasch, K, 2008. Gynakologie bei der Hundin. CVE Kleintier, 2, 9–14.
- Turmalay, L., S. Duro, E. Lika & V. Ceroni, 2011. The hormonal control of estrus in bitches. Journal of Animal and Veterinary Advances, 10, 2447–2449.
- Wallace, M., 1991. The ovarian remnant syndrome in the bitch and queen. Veterinary Clinics of North America: Small Animal Practice, 21, 501–507.
- Wehrend, A., 2007. Durchfuchrung und Interpretation der exfoliativen Vaginal– zytologie bei der Hundin. Spektrum Tiermedizin 9, Veterinarsspiegel Verlag, Berlin.
- Wehrend, A., K. Von Plato & S. Goericke-Pesch, 2013. Die exfoliative vaginal–zytologie bei der hundin–indikationen, durchfuhrung, interpretation. Tierarztliche Praxis, 4, 267–274.
- Wright, P. & B. Parry, 1989. Cytology of the canine reproductive system. Veterinary Clinics of North America: Small Animal Practice, 19, 851–874.
- Wrobel, K., M. El–Etreb & P. Gunzel, 1975. Histochemical and histological studies of the vagina of the beagle during various functional conditions. Acta Histochemica, 52, 257–270.
- Zoldag, L., Kecskemethy, S. & P. Nagy, 1993. Heat progesterone profiles of bitches with ovulation failure. Journal of Reproduction and Fertility. Supplement, 47, 561–562.
Источник: Bulgarian Journal of Veterinary Medicine, 2017, 20, No 3, 193–203. The BJVM operates under Creative Commons License BY-NC-ND 4.0.
СВМ № 6/2017