Elsa Murgia, Roberta Troia, Cecilia Bulgarelli, Marco Pelizzola, Armando Foglia, Francesco Dondi and Massimo Giunti
Department of Veterinary Medical Sciences, Alma Mater Studiorum, University of Bologna, Bologna, Italy
Политравма — это распространённое неотложное состояние у мелких домашних животных, которое часто связано с более высоким процентом инвалидизации и смертности по сравнению с мелкими травмами. Ведущим осложнением обширного травматического повреждения является синдром полиорганной недостаточности (СПОН), который несёт высокий риск смерти, несмотря на проводимую интенсивную терапию. На сегодняшний день существует мало данных о распространённости и прогностическом значении синдрома полиорганной недостаточности при политравме у кошек. Задачей настоящего исследования является проспективный анализ развития и прогностического значения недостаточности внутренних органов, диагностированной при поступлении в клинику у группы кошек с политравмой. Кошки с множественными повреждениями, которым требовалась госпитализация в отделение интенсивной терапии, были включены в исследование и разделены на категории в зависимости от исхода (выжили / не выжили). На момент госпитализации были собраны и проанализированы с учётом смертности клинические и клинико-патологические данные, включая оценку степени тяжести состояния по шкалам ATTS, APPLEfast и APPLEfull, наличие нарушения функций отдельных органов и развитие синдрома полиорганной недостаточности. Использовались непараметрические методы анализа данных, значимым было признано значение p < 0,05. 38 кошек соответствовали критериям и были включены в исследование: 8 из 38 (21%) поступили с проникающими ранениями, а 30 из 38 (79%) поступили с тупой травмой. Общая смертность в стационаре составила 37% (14/38). Кошки с синдромом полиорганной недостаточности до госпитализации показали значительно большую смертность по сравнению с кошками без СПОН (9/14 к 2/24, p = 0,0004). В соответствии с результатами однофакторного логистического регрессионного анализа нарушения гемостаза, дыхательная дисфункция и СПОН, диагностированные в момент госпитализации, были в высокой степени связаны со смертностью (p = 0,005, p = 0,001, p = 0,001 соответственно). Результаты оценки по шкалам APPLEfast, APPLEfull и ATTS были независимо связаны с высоким риском смерти и положительно коррелировали с числом органов с нарушенной функцией (p = 0,025, p = 0,004, p = 0,003, r = 0,57, р = 0,0002, r = 0,59, p = 0,0001, r = 0,55, p = 0,0003 соответственно). Синдром полиорганной недостаточности является распространённым осложнением политравмы у кошек, и его развитие связано с более тяжёлым течением болезни и ухудшением прогнозов. Нарушения гемостаза и дыхания, диагностированные в момент госпитализации, связаны с более высоким риском смерти. Шкалы ATTS и APPLE являются ценными прогностическими инструментами для оценки кошек при политравме.
Ключевые слова: политравма, синдром полиорганной недостаточности, шок, системы оценки тяжести состояния, кошки, прогноз.
Сокращения: ОПН — острая почечная недостаточность, ATTS — шкала классификации тяжести состояния при травме для животных, APPLE — шкала физикальной и лабораторной оценки тяжести состояния неотложных пациентов, СПОН — синдром полиорганной недостаточности, ССВР — синдром системной воспалительной реакции.
Введение
Политравма — это распространённое состояние в гуманной интенсивной терапии, связанное с различной степенью инвалидизации и смертности [1]. У пациентов, переживших первичное травматическое повреждение, могут развиваться опасные для жизни системные осложнения, такие как сепсис, кровотечения, синдром полиорганной недостаточности (СПОН). Среди этих осложнений СПОН является частой причиной ранней и поздней смерти примерно у 40% пациентов в гуманной реанимации после тяжёлой травмы, и частота его развития зависит от типа и тяжести травмы [2–4].
Травма — это один из наиболее распространённых случаев обращения в специализированные клиники и кабинеты общей практики в ветеринарии [5]. Общий уровень смертности у кошек при травме варьируется от 12 до 22% [5–11]. Множественные травматические повреждения составляют у кошек 25–64% всех случаев травматизма [5; 10] и связаны с высоким риском смерти по сравнению с лёгкими травмами (17,2% к 2,9%) [10]. Существует мало данных в ветеринарной литературе о синдроме полиорганной недостаточности (СПОН), сопровождающем травму. В двух ретроспективных исследованиях, включавших собак с проникающими и тупыми травмами соответственно, распространённость СПОН и недостаточности отдельных органов, включая нарушения дыхания, гемостаза и функции сердечно-сосудистой системы, была в значительной мере связана с ухудшением прогноза [12–14]. По нашим данным, влияние нарушений функций органов никогда не было исследовано у кошек с политравмой. Целью настоящего исследования является проспективный анализ распространения и прогностического значения нарушений функций органов, диагностированных в момент госпитализации среди группы кошек с политравмой. Мы выдвинули гипотезу о том, что СПОН является частым осложнением политравмы у кошек и его развитие связано с более тяжёлым течением болезни и ухудшением прогноза.
Материалы и методы
Это проспективное обсервационное исследование по оценке политравмы в выборке кошек, поступивших в отделение интенсивной терапии Университетского ветеринарного госпиталя между сентябрём 2015 и сентябрём 2017 года. Исследование было одобрено локальной Институциональной комиссией по охране и использованию животных.
Животные
Кошки были включены в исследование, если в анамнезе и по клиническим признакам у них была признана политравма, которая возникла в предшествующие 24 часа. Политравма была определена как одновременное наличие клинически значимых повреждений нескольких частей тела или полостей, нарушающих физиологические процессы в организме животного [5; 10] и требующих госпитализации в отделение реанимации и интенсивной терапии (ОРИТ). Животные не включались в исследование, если до поступления в клинику им была оказана помощь.
Сбор данных
Лечащие врачи ОРИТ были ответственны за лечение животных, включённых в исследование. На момент госпитализации в наш Университетский ветеринарный госпиталь были зафиксированы следующие данные: анамнез и симптомы, включая время, прошедшее с момента получения травмы до поступления в ОРИТ, тип и локализацию повреждений, тип травмы (проникающая или тупая) и результаты физикального осмотра, включая ректальную температуру, ЧСС, ЧДД и ментальный статус. Была проведена фокусированная ультразвуковая оценка грудной и брюшной полости (протоколы TFAST и AFAST соответственно) с использованием неспециализированного ультразвукового аппарата (Z5Vet с микроконвексным датчиком 6,5 МГц, Mindray, Шензен, Китай), как было описано в более ранних публикациях [15]. Неинвазивное измерение артериального давления было выполнено с использованием осциллометрического метода на грудной конечности (petMATтм graphic, Ramsey Medical, Сидней, Япония) и перепроверено с использованием допплерометрии (Minidop ES-100 VX, Hadeco, Кавасаки, Япония). Относительная сатурация была оценена с помощью пульсоксиметра (Masimo RAD-57, Калифорния, США). Взятие крови осуществлялось путём пункции вены с помощью вакуумной системы в соответствии со стандартами проведения процедур. Были выполнены следующие анализы: газы венозной крови, включая концентрации лактата и электролитов (ABL 800 FLEX, Radiometer Medical ApS, Копенгаген, Дания), общий клинический анализ крови (ADVIA 2120, Siemens Healthcare Diagnostics, Эрланген, Германия) и микроскопическое исследование мазков крови, биохимический профиль, включая определение в сыворотке крови креатинина и билирубина (AU 480, Beckman Coulter-Olympus, Брея, Калифорния, США), а также коагулограмма, включая протромбиновое время (ПТВ) и активированное частичное тромбопластиновое время (АЧТВ) (BFT II, Siemens, Мюнхен, Германия). Взятие крови производилось до начала волемической поддержки и введения препаратов в тех случаях, когда это было возможно. В случаях серьёзных гемодинамических или дыхательных нарушений взятие образцов крови было выполнено во время или сразу после первичных мер стабилизации, в течение 1 часа после поступления. Конечные точки реанимации включали восстановление таких параметров, как ЧСС, качество пульса на периферических артериях и ректальная температура, а также кровяное давление и диурез. В дополнение были исследованы показатели концентрации лактата в крови для оценки эффективности реанимационных мероприятий. Баллы по шкале классификации тяжести состояния при травме для животных (ATTS) и баллы по шкале физикальной и лабораторной оценки тяжести состояния неотложных пациентов (адаптирована для кошек) (APPLE — APPLEfast и APPLEfull) были рассчитаны, как было описано в более ранних публикациях [16;17]. Дополнительные собранные данные включали результаты рентгенографии, потребность пациентов в инфузионной терапии, применение препаратов крови и методы лечения, использованные в течение госпитализации. Кошки были классифицированы в соответствии с исходом как выжившие (живые на момент выписки) и не выжившие (погибли, несмотря на лечебные мероприятия, или были гуманно эвтаназированы в связи с очевидно неблагоприятным прогнозом). Кошки, эвтаназированные по финансовым и другим неэтичным причинам, были исключены из исследования.
Нарушения функций органов
Критерии определения и классификации нарушения функций различных органов были адаптированы из доступных аналогичных опубликованных исследований собак [18–20]. Пороговые значения для специфических показателей были основаны на верхней границе референсных интервалов нашей лаборатории клинической патологии: общий билирубин 0–5,98 мкмоль/л, ПТВ 9–15 сек., АЧТВ 9–20 сек. Были диагностированы следующие нарушения функций внутренних органов: а) нарушения функции сердечно-сосудистой системы: гипотония (систолическое АД менее 90 мм рт. ст.) у пациентов после возмещения потери жидкости, требующая поддержки с помощью кардиотоников или сосудосуживающих препаратов; b) нарушения гемостаза: ПТВ более 15 сек. и/или АЧТВ более 20 сек. и/или количество тромбоцитов менее 100,000/мм3 при отсутствии сгустков на микроскопическом исследовании мазка крови; с) нарушение функции печени: билирубин в сыворотке крови более 5,98 мкмоль/л при отсутствии гемолиза или обструкции / разрыва жёлчных путей (на основании полного ультразвукового исследования брюшной полости); d) нарушение функции почек: признаки острого повреждения почек (ОПП), диагностированного на основании повышения уровня креатинина в сыворотке крови более 141,44 мкмоль/л и/или повышения концентрации креатинина более 26,52 мкмоль/л от нормальных значений и/или олигурии (выделение мочи менее 1 мл/кг/ч на протяжении более 6 часов) [20]; e) нарушения дыхания: признаки респираторного дистресса, такие как сатурация ниже 95% при дыхании атмосферным воздухом, потребность в кислородной поддержке и/или механической вентиляции лёгких; f) СПОН: нарушение функции как минимум двух органов одновременно.
Клинические и лабораторные показатели, зафиксированные на момент поступления, включая нарушения функций отдельных органов, развитие СПОН, общее число органов с нарушенной функцией и баллы по шкалам ATTS, APPLEfast и APPLEfull, были использованы для формирования прогноза.
Статистический анализ
Распределение данных анализировали графически и с помощью теста Д’Агостино-Пирсона. Описательные статистические данные были оценены в соответствии с требованиями. Так как большинство показателей не попадали под нормальное распределение, данные были выражены как средние значения и пределы значений (минимальный и максимальный), а для сравнения были использованы непараметрические методы. Точный тест Фишера и U-критерий Манна—Уитни были использованы для сравнения дискретных и непрерывных переменных соответственно между группами. Анализ ROC-кривой был использован, чтобы найти оптимальные пороговые значения для показателей, имеющих прогностическую ценность, и определить область под ROC-кривой (AUC). Однофакторный линейный регрессионный анализ был использован для оценки переменных значимых для прогнозирования исхода (пошаговый подход). Корреляции между непрерывными переменными были определены с использованием коэффициента ранговой корреляции Спирмена; показатель p меньше 0,05 считался значимым. Статистический анализ был выполнен с использованием пакета программного обеспечения для статистического анализа (MedCala Statistical Software версия 15,8 (MedCalc Software bvba, Остенд, Бельгия, https://www.medcalc.org;2015).
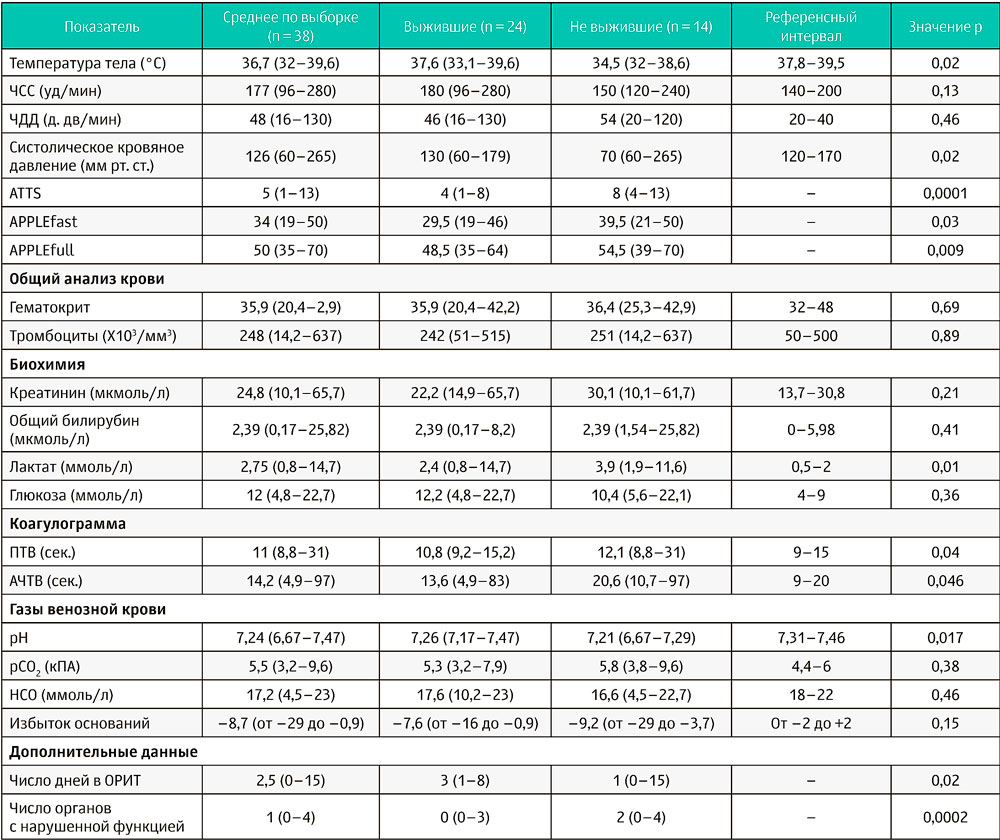
Таблица 1. Описательная статистика отдельных показателей, измеренных у кошек с политравмой при поступлении в госпиталь (n = 38); кошки были классифицированы как выжившие (n = 24) и не выжившие (n = 14)
Значение каждого показателя представлено как среднее и как интервал значений для группы. ATTS — шкала классификации тяжести состояния при травме для животных, APPLE — шкала физикальной и лабораторной оценки тяжести состояния неотложных пациентов (адаптирована для кошек), ОРИТ — отделение реанимации и интенсивной терапии, ПТВ — протромбиновое время, АЧТВ — активированное частичное тромбопластиновое время. Значение р < 0,05 говорит о значительной разнице между группами выживших и не выживших.
Результаты
Всего за период исследования в ОРИТ поступило 113 кошек с травмой. 75 из них были исключены по следующим причинам: медицинская помощь, оказанная до момента поступления в ОРИТ на первичном приёме у направившего ветеринарного врача (2 из 113, 2%), поступление в клини-ку более чем через 24 часа после получения травмы (2 из 113, 2%), неполный сбор данных (2 из 113, 2%), эвтаназия по финансовым причинам (2 из 113, 2%), наличие мелких травм, не требующих госпитализации в ОРИТ (67 из 113, 59%). В итоге 38 кошек удовлетворяли критериям включения в настоящее исследование. Средний возраст кошек был 3 года (0,58–18). 19 из 38 (50%) были самцы (8 кастрированных и 11 некастрированных) и 19 из 38 (50%) были самки (11 кастрированных и 8 некастрированных). Большинство кошек (97%) были метисами (37 из 38), и только одна чистопородная (3%) — мейн-кун. Средний вес тела составил 4 кг (2,5–8,5), среднее время от возникновения травмы до поступления в клинику составило 4 часа (0,5–24). Тупая травма была диагностирована у 30 из 38 кошек (79%), а проникающая — у 8 из 38 (21%) животных. Между типом травмы и временем, прошедшим от возникновения травмы до поступления в клинику, связи не обнаружено. Среди 30 описанных случаев тупой травмы были дорожно-транспортные происшествия (19 из 30, 63%), падения с высоты (7 из 30, 23%), повреждения с размозжением тканей (2 из 30, 7%) и травмы неизвестного происхождения (2 из 30, 7%). В то же время 8 случаев проникающих ранений включали кусаные раны (6 из 8, 75%), колотые раны (1 из 8, 12,5%) и пулевое ранение (1 из 8, 12,5%). Выбранные клинические и клинико-патологические показатели, зафиксированные до начала лечения, в исследуемой выборке кошек, классифицированных как «выжившие» и «не выжившие», указаны в таблице 1. Области, затронутые травмой, включали конечности и таз (23 из 38, 61%), грудную клетку (17 из 38, 45%), голову и морду (12 из 38, 32%, и 7 из 38, 18%, соответственно), кожу (9 из 38, 24%), живот (8 из 38, 21%) и позвоночник (4 из 38, 11%), некоторые кошки были отнесены к нескольким категориям. Свободная жидкость в грудной полости была выявлена у 9 из 38 кошек (24%) с помощью фокусированного ультразвукового исследования (протокол TFAST), у 7 из 38 кошек (18%) была выявлена свободная жидкость в брюшной полости с помощью фокусированного ультразвукового исследования по протоколу AFAST. На основании типа дыхания и/или показателей пульсоксиметрии ни одной из кошек со свободной жидкостью в грудной полости не потребовался торакоцентез. Сбор проб и анализ свободной жидкости из брюшной полости были возможны в 4 случаях, удалось выявить уроабдомен у 1 кошки и гемабдомен у остальных 3. Пневмоторакс, требующий торакоцентеза, был выявлен с помощью ультразвукового протокола TFAST у 2 из 38 кошек (5%). Инфузионная поддержка для коррекции гиповолемического шока потребовалась 24 из 38 кошек (63%) на момент поступления. Средний объём жидкости, введённый при инфузионной терапии, составил 63,5±33,9 мл на кошку. Наиболее часто применялся раствор Рингера лактата (22 из 24, 92%) со средним объёмом введения 65±32 мл, следующими были гипертонический раствор NaCl 7,5% (5 из 24, 21%) со средним объёмом введения 20 мл (от 10 до 22) и раствор гидроксиэтилированного крахмала (8,4 мл 6% гидроксиэтилкрахмала 130/0,42, Amidolite®) (1 из 24, 4%). 23 из 24 кошек (96%) отреагировали на полученную инфузионную терапию в течение часа. У одной кошки с кусаной раной развилась сердечно-сосудистая недостаточность, и потребовалось использование вазопрессора норадреналина в течение 14 часов. За время госпитализации использование эритроцитарной массы и свежезамороженной плазмы для коррекции анемии и восполнения дефицита факторов свёртывания крови при кровотечении потребовалось 2 из 38 и 1 из 38 кошек соответственно.
14 кошек не выжили, среди них 2 кошки были эвтаназированы из-за очевидно неблагоприятного прогноза, в то время как у 12 кошек развилась остановка дыхания, сердечной деятельности и спонтанная смерть. 9 из 14 кошек (64%) погибли в течение 24 часов после поступления. Между временем с момента травмы до поступления в ОРИТ, типом травмы (тупая или проникающая) и смертностью не было выявлено значимой связи.
По мнению лечащего врача, кошкам, которые не выжили, волемическая поддержка требовалась значительно чаще, чем выжившим (12 из 14, 86% по сравнению с 12 из 24, 50%, p = 0,04), при этом средний объём инфузионной терапии сильно не отличался между группами (69,5 мл, интервал 20–136, против 51 мл, интервал 20–133, соответственно, p = 0,2).
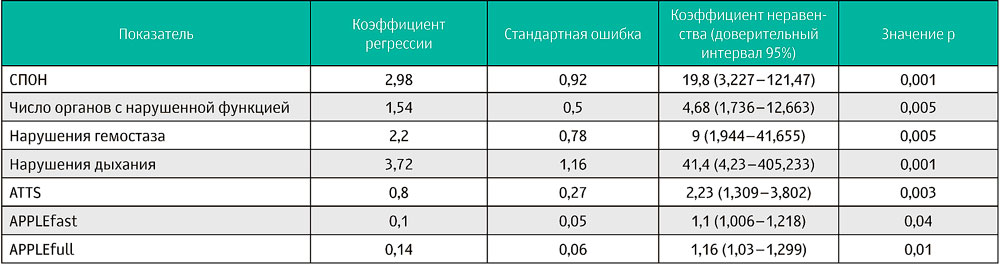
По результатам однофакторного логистического регрессионного анализа (таблица 2), баллы по шкалам ATTS, APPLEfast и APPLEfull на момент поступления в клинику независимо коррелировали с высоким риском смерти. Анализ ROC-кривой показал, что балл по шкале ATTS выше 5 (чувствительность 78,6%, специфичность 79,2%, AUC = 0,78), балл по шкале APPLEfast более 37 (чувствительность 71,4%, специфичность 79,2%, AUC = 0,71) и балл по шкале APPLEfull более 53 (чувствительность 64,3%, специфичность 83,3%, AUC = 0,75) могут быть предикторами смертности на момент госпитализации.
Таблица 2. Результаты однофакторного бинарного логистического регрессионного анализа показателей, влияющих на исход (выжившие / не выжившие) у 38 кошек с политравмой
ATTS — шкала классификации тяжести состояния при травме для животных, APPLE — шкала физикальной и лабораторной оценки тяжести состояния неотложных пациентов (адаптирована для кошек), СПОН — синдром полиорганной недостаточности.
Нарушение функций органов и исход
В исследуемой группе распространённость нарушений функций органов, диагностированных при поступлении в клинику, была следующей: нарушения гемостаза (13 из 38, 34%), нарушения функции почек (12 из 38, 32%), респираторные нарушения (10 из 38, 26%), нарушения функции печени (5 из 38, 13%) и сердечно-сосудистые нарушения (1 из 38,3%). 22 из 38 кошек (58%) имели дисфункцию хотя бы одной системы органов. В исследованной нами выборке травмы грудной клетки были выявлены с помощью рентгенологического исследования только у 6 из 10 (60%) кошек с нарушениями дыхания и были ассоциированы с контузией лёгких (n = 6), переломами рёбер (n = 3), пневмотораксом (n = 2) и острым повреждением лёгких (n = 1) на основании опубликованных ранее критериев [21]. 4 из 10 (40%) кошек с нарушениями дыхания поступили с травмой головы. Анализ газов артериальной крови был доступен только для кошки с острым повреждением лёгких, по результатам анализа была определена гипоксемия (рО2 = 8,39 кПА) и гиперкапния (рСО2 = 9,59 кПа) при дыхании атмосферным воздухом. Среднее рСО2 в венозной крови у остальных пациентов (n = 37) составило 5,47±1,1 кПа. Нарушения дыхания и гемостаза были самыми распространёнными нарушениями у кошек, которые не выжили (9 из 14, 64%). Однако эти нарушения не коррелировали с внутренними кровотечениями, изменениями при фокусированных ультразвуковых исследованиях грудной и брюшной полостей, а также необходимостью использования препаратов крови и антифибринолитических препаратов (данные не представлены). В соответствии с критериями определения острой травматической коагулопатии, предварительно адаптированной Головайчук и др. [22], данный синдром мог быть диагностирован у 7 кошек нашей группы (n = 38). Однако ни одна кошка не подошла под критерии острой травматической коагулопатии, предложенные Готтлиб и др. [9]. Все кошки с нарушениями функции почек (12 из 38, 32%) поступили с повышенным показателем концентрации креатинина в сыворотке крови. Также у кошек с нарушением функции почек по сравнению с кошками без таких нарушений было выявлено значительно более низкое систолическое давление (70 мм рт. ст., интервал 70–149, против 130 мм рт. ст., 60–265, p = 0,01) и избыток оснований (–12,5, интервал от –20 до –7,7, против –7,2, интервал от –29 до –0,9, p = 0,0007), а концентрация лактата в крови была значительно выше (6,1, 1,1–14,7, против 2,4, 0,8–11,6, p = 0,003). Более того, 10 из 12 (83%) кошек с нарушением функции почек требовали волемической поддержки на момент поступления.
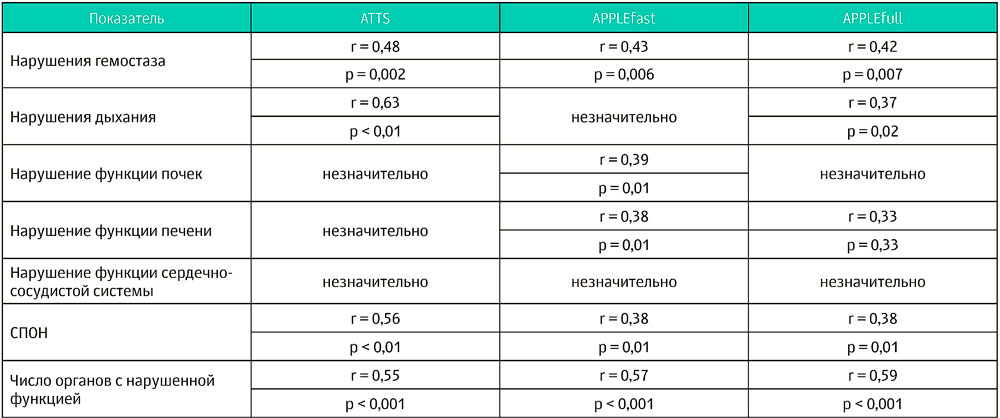
Развитие СПОН было зафиксировано у 11 из 38 кошек (29%) на момент госпитализации. Число органов с нарушением функции составляло 2 у 7 из 11 кошек, 3 у 3 из 11 и 4 у 1 из 11 кошек. У животных со СПОН были нарушены функции дыхания (10 из 11), гемостаза (8 из 11), почек (7 из 11), печени (1 из 11) и сердечно-сосудистой системы (1 из 11). Число органов с нарушением функции на момент госпитализации было значительно выше у кошек, которые не выжили, чем у выживших кошек (p = 0,0002) (таблица 1). Смертность у пациентов с признаками СПОН на момент поступления была выше, чем у пациентов без СПОН (9 из 14, 64%, против 2 из 24, 8%, p = 0,0004). В соответствии с результатами однофакторного логистического регрессионного тестирования были выявлены положительные связи между повышенным риском смерти и нарушениями гемостаза, дыхательной недостаточностью и СПОН (таблица 2). Положительные корреляции между нарушениями функции органов и степенью тяжести состояния представлены в таблице 3. Среди выживших нарушения гемостаза, количество органов и систем с нарушенной функцией, баллы по шкале APPLEfast и необходимость волемической поддержки на момент поступления положительно коррелировали с продолжительностью госпитализации в ОРИТ (r = 0,51; p = 0,01; r = 0,61, p = 0,001; r = 0,446, p = 0,03; r = 0,52, p = 0,009 соответственно).
Таблица 3. Значимые корреляции, выявленные между нарушениями функций отдельных органов и степенью тяжести состояния на момент поступления в клинику среди 38 кошек с политравмой
ATTS — шкала классификации тяжести состояния при травме для животных, APPLE — шкала физикальной и лабораторной оценки тяжести состояния неотложных пациентов (адаптирована для кошек), СПОН — синдром полиорганной недостаточности.
Обсуждение
В настоящем исследовании описана группа кошек с политравмой, госпитализированных в ОРИТ, с фокусом на дисфункцию органов на момент поступления, и её влияние на смертность.
Данное исследование выявило большее число тупых травм (79%) по сравнению с проникающими травмами (21%). Среди причин тупых травм дорожно-транспортные происшествия были наиболее распространены, что соответствует ранее опубликованным данным [7; 8; 10; 23]. Кошки, включённые в нашу выборку, часто демонстрировали симптомы, характерные для шока, и связанные с шоком метаболические нарушения, включая метаболический ацидоз, гиперлактатемию, гипергликемию и повышенные концентрации ферментов печени (данные не представлены), как сообщалось в работах, опубликованных ранее [10; 24; 25].
Смертность кошек с политравмой в настоящем исследовании была выше, чем в опубликованном ранее [10]; однако при сравнении результатов этих двух исследований следует учитывать различия в выборках, типах повреждений и случаях эвтаназии. Среднее время от возникновения травмы до госпитализации составило 4 часа, между продолжительностью госпитализации в ОРИТ и смертностью значительной корреляции установлено не было.
Наше исследование подтвердило, что среди кошек с политравмой более тяжёлая степень шока при поступлении (установлено на основании сниженного давления и температуры тела), более высокая концентрация лактата в крови, повышенная потребность в волемической поддержке и более тяжёлое состояние наблюдаются у кошек, которые не выживают, как и сообщалось ранее [10]. Интересно отметить, что объём инфузионной терапии не отличался между выжившими и не выжившими кошками. Более того, значительных осложнений, связанных с перегрузкой жидкостью (таких как плевральный выпот или отёк лёгких), в выборке зафиксировано не было, однако влияние водного баланса на исход не оценивалось.
Шкалы оценки состояния находят всё более широкое применение в интенсивной терапии [26]. По данным более раннего исследования среди собак и кошек с огнестрельными ранениями [27], шкала ATTS может определить краткосрочный прогноз и необходимость интенсивной терапии. Исследования по использованию шкалы APPLE у кошек с травмой не проводились. В настоящем исследовании шкалы ATTS, APPLEfast и APPLEfull использовали в момент поступления для оценки прогноза. В соответствии с нашими результатами более высокие значения баллов по этим шкалам были зафиксированы у не выживших пациентов. По данным анализа ROC-кривой, ATTS имеет хорошую точность для прогнозирования исхода, в то время как точность шкалы APPLE была только удовлетворительной. При этом все результаты оценки по шкалам коррелировали со СПОН или с нарушениями функций отдельных органов. Эти находки позволяют оценить роль этих инструментов в выявлении более тяжёлых пациентов и оправдывают использование шкал как компонента общей клинической оценки кошек с политравмой.
Полиорганная недостаточность встречалась достаточно часто в выборке этого исследования: так, у 11 кошек из 38 (29%) был диагностирован СПОН на момент включения в исследование. Вдобавок наличие СПОН было ассоциировано с повышенным риском смертности. Данные результаты являются новыми в исследовании кошек с политравмой и похожи на зафиксированные ранее среди людей и собак [12; 13; 28; 29].
Острая травматическая коагулопатия (ОТК) — это плохо изученный синдром, связанный с травмой и шоком, который является одной из причин посттравматического кровотечения и опасных для жизни осложнений в гуманной медицине [30; 31]. Существует небольшое количество исследований по оценке острой травматической коагулопатии у животных с политравмой. Данные о связи между возникновением нарушений гемостаза, развитием кровотечения, необходимостью использования препаратов крови и тяжестью травмы в этих исследованиях различаются [9; 22]. Предыдущее исследование показало, что острая травматическая коагулопатия редко встречается у кошек с минимальными повреждениями при тупой травме, и более высокие показатели тяжести состояния по шкале ATTS не могут прогнозировать развитие ОТК [9]. Критерии, использованные в этом исследовании для оценки гемостатической функции, могли придавать недостаточно внимания наличию острой травматической коагулопатии. Однако, в соответствии с нашими результатами, развитие нарушений гемостаза коррелирует с плохим прогнозом и не должно оставаться недооценённым, даже при отсутствии клинических признаков кровотечения. Критерии, адаптированные для определения нарушений функции гемостаза, использованные в нашем исследовании, имеют естественные ограничения и не способны прогнозировать кровотечение или риск возникновения кровотечения, так как эти показатели (ПТВ и АЧТВ) не предназначены для этих целей [32]. Несмотря на то что тромбоэластография и ротационная тромбоэластометрия могут с большей точностью прогнозировать кровотечения, чем стандартные тесты, рекомендации по их использованию для определения снижения свёртываемости крови до сих пор отсутствуют [32]. Таким образом, для более глубокой оценки и характеристики гемостатической дисфункции у кошек с политравмой требуются дальнейшие исследования.
Дисфункция почек была вторым по распространённости нарушением функции органов в нашей выборке, однако не показала никакого прогностического значения. У всех кошек с дисфункцией почек присутствовали азотемия и более выраженные признаки гиповолемии, зафиксированные как сниженные показатели систолического давления и избыток оснований, а также более высокие концентрации лактата в крови по сравнению с кошками без нарушений функции почек. Более того, волемическая поддержка на момент поступления требовалась большинству кошек с дисфункцией почек. Однако ранняя смерть в большинстве случаев не позволила более точно охарактеризовать повреждения почек (например, ответ на инфузионную терапию в зависимости от внутренних повреждений) в нашей выборке. Для кошек нет эпидемиологических данных относительно травматического ОПП, и критерии для определения нарушения функции почек различаются в разных исследованиях [13; 33]. Хотя дисфункция почек не несёт прогностической ценности в данном исследовании, требуются дополнительные исследования для изучения ОПП у кошек с политравмой.
В этом исследовании развитие дыхательной недостаточности значительно коррелировало с высоким риском смерти. По литературным данным для людей и собак, нарушение дыхания является частым осложнением у пациентов с политравмами, где травмы грудной клетки представляют собой частую причину смерти [13; 34; 35]. Однако оценка дыхательной недостаточности в настоящем исследовании была выполнена с определённой долей субъективности; гипоксемия оценивалась с помощью пульсоксиметрии и только в одном случае была подтверждена анализом газов артериальной крови, в то время как умеренная/выраженная гиперкапния наблюдалась у небольшого числа пациентов. Это ограничение должно быть учтено при оценке наших результатов.
Существуют некоторые ограничения, которые следует учесть при интерпретации результатов нашего исследования. Критерии, использованные для определения нарушений функций органов, хотя и были основаны на литературных данных о собаках, могут быть улучшены и должны быть проверены на более широкой популяции кошек.
Заключение
Настоящее исследование освещает прогностическую роль нарушения функции отдельных органов и СПОН в группе кошек с политравмой. Особенно часто у кошек с политравмой при поступлении в клинику встречались нарушения функции почек, гемостаза и дыхания. При этом нарушения гемостаза, дыхания, развитие СПОН и общее число органов с нарушенной функцией на момент поступления были ассоциированы с высоким риском смерти. Баллы по шкалам ATTS, APPLEfast и APPLEfull, рассчитанные при поступлении животных, положительно коррелировали с наличием СПОН и были независимо ассоциированы с высоким риском смерти, они должны быть использованы для коррекции интенсивной терапии таких пациентов. Требуются дальнейшие, более крупные исследования с фокусом на изучение СПОН у кошек с политравмой. Более того, для повышения прогностической ценности критериев дисфункции органов следует принимать во внимание степень нарушения функции, а не только наличие или отсутствие этих нарушений.
Этика исследования
Проект был утверждён Комиссией по охране животных Университета Болоньи (Болонья DL26/2014, проект 847).
Вклад авторов
Эльза Мурья, Марко Пелиццола и Роберта Троя разработали план исследования, выполнили анализ данных, в соавторстве написали и отредактировали рукопись. Чечилия Булгарелли, Марко Пелиццола и Армандо Фолья участвовали в разработке проекта, сборе и анализе данных. Франческо Донди выполнял анализ данных и редактировал рукопись. Все авторы участвовали в утверждении конечного варианта рукописи.
Благодарности
Авторы благодарят Ориану Фальконе за её помощь в подборе пациентов, сборе данных и формировании базы данных.
Конфликт интересов
Авторы заявляют, что исследование было проведено без каких-либо коммерческих или финансовых договорённостей, которые могут быть истолкованы как потенциальный конфликт интересов.
Литература
- Butcher N, Balongh ZJ. The definition of polytrauma: the need for international consensus. Injury. (2009) 40(Suppl. 4):12–22. doi: 10.1016/j.injury.2009.10.032.
- Manikis P, Jankowski S, Zhang H, Kahn RJ, Vincent JL. Correlation of serial blood lactate levels to organ failure and mortality after trauma. Am J Emerg Vet. (1995) 13:619–22. doi: 10.1016/0735–6757(95)90043–8.
- Dewar DC, MacKay P, Balogh Z. Epidemiology of post-injury multiple organ failure in an Australian trauma system. ANZ J Surg. (2009) 79:4316. doi: 10.1111/j.1445–2197.2009.04968.x.
- Baker CC, Oppenheimer L, Stephens B, Lewis FR, Trunkey DD. Epidemiology of trauma death. Am J Surg. (1980) 140:14450. doi: 10.1016/0002–9610(80)90431–6.
- Kolata RJ, Kraut NH, Johnston DE. Patterns of trauma in urban dogs and cats: a study of 1,000 cases. J Am Vet Med Assoc. (1974) 164:499–502.
- Kolata RJ. Trauma in dogs and cats: an overview. Vet Clin North Am Small Anim Pract. (1980) 10:515–22. doi: 10.1016/S0195–5616(80)50051–3.
- Rochlitz I. Study of factors that may predispose domestic cats to road traffic accidents: part 1. Vet Rec. (2003) 153:549–53. doi: 10.1136/vr.153.18.549.
- O’Neill DG, Church DB, McGreevy PD, Thomson PC, Brodbelt DC. Longevity and mortality of cats attending primary care veterinary practices in England. J Feline Med Surg. (2015) 7:125–33. doi: 10.1177/1098612X14536176.
- Gottlieb DL, Prittie J, Buriko Y, Lamb KE. Evaluation of acute traumatic coagulopathy in dogs and cats following blunt force trauma. J Vet Emerg Crit Care (San Antonio). (2017) 27:35–43. doi: 10.1111/vec.12525.
- Hernon T, Gurney M, Gibson S. A retrospective study of feline trauma patients admitted to a referral centre. J Small Anim Pract. (2018) 59:2437. doi: 10.1111/jsap. 12815.
- McDonald JL, Cleasby IR, Brodbelt DC, Church DB, O’Neill DG. Mortality due to trauma in cats attending veterinary practices in central and south-east England. J Small Anim Pract. (2017) 58:570–6. doi: 10.1111/jsap.12716.
- Simpson SA, Syring R, Otto CM. Severe blunt trauma in dogs: 235 cases. J Vet Emerg Crit Care (San Antonio). (2009) 19:588–602. doi: 10.1111/j.1476–4431.2009.00468.x.
- Ateca LB, Drobatz KJ, King LG. Organ dysfunction and mortality risk factors in severe canine bite wound trauma. J Vet Emerg Crit Care (San Antonio). (2014) 24:705–14. doi: 10.1111/vec.12256.
- Balakrishnan A, Drobatz KJ, Silverstein DC. Retrospective evaluation of the prevalence, risk factors, management, outcome, and necropsy findings of acute lung injury and acute respiratory distress syndrome in dogs and cats: 29 cases (2011–2013). J Vet Emerg Crit Care. (2017) 27:66273. doi: 10.1111/vec.12648.
- Boysen SR, Lisciandro GR. The use of ultrasound for dogs and cats in the emergency room: AFAST and TFAST. Vet Clin North Am Small Anim Pract. (2013) 43:773–97. doi: 10.1016/j.cvsm.2013.03.011.
- Rockar RA, Drobatz KS, Shofer FS. Development of a Scoring System for the veterinary trauma patient. J Vet Emerg Crit Care. (1994) 4:7783. doi: 10.1111/j.1476–4431. 1994.tb00118.x.
- Hayes G, Mathews K, Doig G, Kruth S, Boston S, Nykamp S, et al. The Feline Acute Patient Physiologic and Laboratory Evaluation (Feline APPLE) Score: a severity of illness stratification system for hospitalized cats. J Vet Intern Med. (2011) 25:26–38. doi: 10.1111/j.1939–1676.2010. 0648.x.
- Kenney EM, Rozanski EA, Rush JE, deLaforcade-Buress AM, Berg JR, Silverstein DC, et al. Association between outcome and organ system dysfunction in dogs with sepsis: 114 cases (2003–2007). J Am Vet Med Assoc. (2010) 236:83–7. doi: 10.2460/javma.236.1.83.
- Ripanti D, Dino G, Piovano G, Farca A. Application of the Sequential Organ Failure Assessment Score to predict outcome in critically ill dogs: preliminary results. Schweiz Arch Tierheilkd. (2012) 154:325–30. doi: 10.1024/0036–7281/a000356.
- Cowgill LD. Staging patients with acute kidney injury: a new paradigm. In: Proceedings of the 2010 ACVIM Forum. Anaheim, CA (2010). Available online at: http://www.iris-kidney.com/pdf/4_ldc-revised-grading-of-acute-kidney-injury.pdf.
- Wilkins PA, Otto CM, Baumgardner JE, Dunkel B, Bedenice D, Paradis MR, et al. Acute lung injury and acute respiratory distress syndromes in veterinary medicine: consensus definitions: the Dorothy Russell Havemeyer Working Group on ALI and ARDS in veterinary medicine. J Vet Emerg Crit Care. (2007) 17: 333–9. doi: 10.1111/j.1476–4431.2007.00238.x.
- Holowaychuk MK, Hanel RM, Darren Wood R, Rogers L, O’Keefe K, Monteith G. Prospective multicenter evaluation of coagulation abnormalities in dogs following severe acute trauma. J Vet Emerg Crit Care. (2014) 24:93–104. doi: 10.1111/vec.12141.
- Hall K, Sharp C, Reineke E, Cooper E, Koenigshof A, Drobatz K. A Multi- Center Prospective Cohort Study of Feline Patients Sustaining Trauma: Interim Analysis. Oral Presentation. San Diego, CA: IVECCS (2013).
- Michell AR. The metabolic consequence of trauma. J Small Anim Pract. (1974) 15:279–91. doi: 10.1111/j.1748–5827.1974.tb05696.x.
- Lawrence YA, Steiner JM. Laboratory evaluation of the liver. Vet Clin North Am Small Anim Pract. (2017) 47:539–53. doi: 10.1016/j.cvsm.2016.11.005.
- Le Gall JR. The use of severity scores in intensive care unit. Intens Care Med. (2005) 31:1618–23. doi: 10.1007/s00134–005–2825–8.
- Olsen LE, Streeter EM, DeCook RR. Review of gunshot injuries in cats and dogs and utility of triage scoring system to predict short-term outcome: 37 cases (2003–2008). J Am Vet Med Assoc. (2014) 245:9239. doi: 10.2460/javma.245.8.923.
- Sauaia A, Moore FA, Moore EE. Postinjury inflammation and organ dysfunction. Crit Care Clin. (2017) 33:167–91. doi: 10.1016/j.ccc.2016.08.006.
- Dewar D, Moore FA, Moore EE, Balogh Z. Postinjury multiple organ failure. Injury. (2009) 40:912–8. doi: 10.1016/j.injury.2009.05.024.
- Johansson PI, Henriksen HH, Stensballe J, Gybel-Brask M, Cardenas JC, Baer LA, et al. Traumatic endotheliopathy: a prospective observational study of 424 severely injured patients. Injury. (2017) 265:597–603. doi: 10.1097/SLA.0000000000001751.
- Brohi K, Cohen MJ, Davenport RA. Acute coagulopathy of trauma: mechanism, identification and effect. Curr Opin Crit Care. (2007) 13:6805. doi: 10.1097/MCC.0b013e3282f1e78f.
- Beer KS, Silverstein DC. Controversies in the use of fresh frozen plasma in critically ill small animal patients. J Vet Emerg Crit Care. (2015) 25:101–6. doi: 10.1111/vec.12280.
- Harison E, Langston C, Palma D, Lamb K. Acute azotemia as a predictor of mortality in dogs and cats. J Vet Intern Med. (2012) 26:10938. doi: 10.1111/j.1939–1676.2012.00985.x.
- Wanek S, Mayberry JC. Blunt thoracic trauma: flail chest, pulmonary contusion, and blast injury. Crit Care Clin. (2004) 20:71–81. doi: 10.1016/S0749–0704(03)00098–8.
- Durham RM, Moran JJ, Mazuski JE, Shapiro MJ, Baue AE, Flint LM. Multiple organ failure in trauma patients. J Trauma. (2003) 55:608–16. doi: 10.1097/01.TA.0000092378. 10660.D1.
Источник: Frontiers in Veterinary Science 6:189. This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY). The use, distribution or reproduction in other forums is permitted, provided the original author(s) and the copyright owner(s) are credited and that the original publication in this journal is cited, in accordance with accepted academic practice. No use, distribution or reproduction is permitted which does not comply with these terms.
СВМ № 3/2021
Возможно, вам будут также интересны:
Исходы у пациентов и практика СЛР после начала применения методических рекомендаций RECOVER