Дегенеративный люмбосакральный стеноз (ДЛСС) является относительно частым многофакторным заболеванием собак преимущественно крупных пород. Диагностика ДЛСС затруднена; очень часто его путают с ортопедическими нарушениями в области тазовых конечностей. В первой части статьи рассматривается патогенез, клинические признаки и диагностика ДЛСС; во второй — методы его лечения.
Введение
Синдром конского хвоста представляет собой совокупность клинических проявлений заболевания, которое развивается в результате патологических или дегенеративных процессов, приводящиx к сужению позвоночного канала на уровне позвонков L6-S1 с последующим сдавливанием конского хвоста и/или нервных корешков или нарушением кровоснабжения в поясничной области [1–7]. Наиболее частой причиной данного синдрома является дегенеративный люмбосакральный стеноз. Данная статья посвящена ДЛСС, поэтому в ней не рассматриваются другие причины синдрома конского хвоста, такие как дискоспондилит, новообразования или травмы [8].
ДЛСС — относительное частое многофакторное заболевание собак, преимущественно крупных пород, болеют также собаки средних и мелких пород и кошки [9]. Как правило, ДЛСС рассматривается как нейроортопедическое заболевание, но так как неврологические симптомы, в отличие от ортопедических, редки, часто ставится неверный диагноз, например дисплазия тазобедренных суставов. Для подтверждения ДЛСС необходимо сделать КТ, МРТ или контрастную рентгенографию, так как обычная рентгенография не позволяет рассмотреть ни конский хвост, ни позвоночный канал в поперечном сечении.
Клиническая анатомия
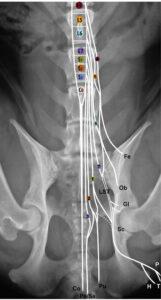
Спинной мозг и позвоночный столб развиваются одновременно на ранних стадиях эмбриогенеза, но затем развитие позвоночного столба ускоряется, и при рождении животного спинной мозг короче позвоночника, в связи с чем конский хвост располагается в позвоночном канале. Конский хвост представлен корешками спинномозговых нервов на уровне позвонков L6, L7, S1–S3 и Cd1–Cd5 и начинается от мозгового конуса — конечного отдела спинного мозга (таблица 1). У большинства собак мозговой конус расположен между каудальной частью позвонка L6 и краниальной частью позвонка L7 (у собак мелких пород, как правило, более каудально), а конский хвост продолжается в каудальном направлении до Cd5 (рис. 1) [10]. Хотя спинной мозг заканчивается на уровне позвонков L6-L7, более чем у 80% собак центральная часть дурального мешка достигает крестцового отдела [11].
Таблица 1. Периферические нервы, отходящие от конского хвоста и имеющие клиническое значение при ДЛСС у собак
| Нерв | Позво-ночный сегмент |
Рефлекс | Функция | Неврологические проявления при дегенеративном люмбосакральном стенозе |
| N. femoralis (бедренный нерв) |
L4-L6 | Коленный | Флексия бедра
Экстензия коленного сустава |
Норма или псевдо- гиперрефлексия |
| N. ischiadicus (седалищный нерв) |
L6-S1 | Краниаль- ный больше-берцовыйИкро- ножной мышцыСгиба- тельный |
Экстензия бедра
Флексия коленного сустава Флексия и экстензия плюсны Проприоцепция |
Мышечная атрофия
Нормальный, или Нормальная |
| N. pelvicus и sacrales (тазовый и крестцовый нервы) |
S1-S3 | Мочевой пузырь | Отсутствие мочеиспускания или недержание мочи |
|
| N. pudendus (срамной нерв) |
S1-S3 | Пери- неальныйАнальный |
Анальный сфинктер и сфинктер мочевого пузыря | Отсутствуют, или сниженный перинеальный рефлексОтсутствуют, или недержание мочи или кала |
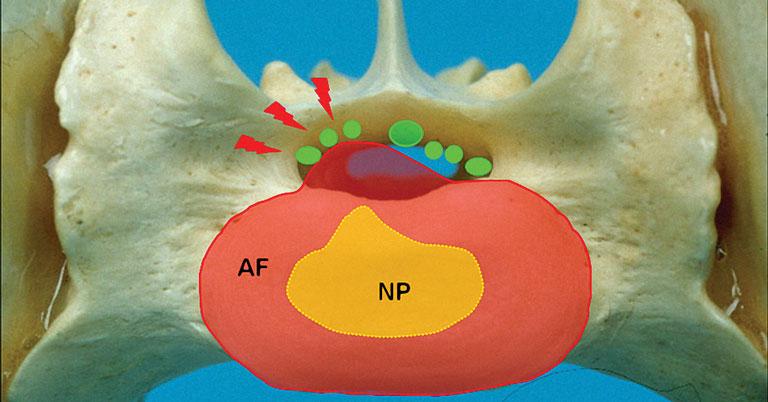
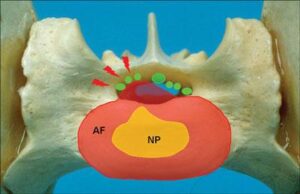
Наряду с грыжей Хансена 2 типа межпозвонкового диска (MПД) L7–S1, которая является наиболее выраженной патологией при дегенеративном люмбосакральном стенозе, причиной стеноза позвоночного канала могут быть гипертрофические изменения других анатомических структур, локализованных в непосредственной близости от конского хвоста. Как правило, ДЛСС формируется в результате суммарного воздействия аномалий развития, дегенеративных, гипертрофических и/или пролиферативных изменений в нескольких анатомических структурах в области конского хвоста, таких как МПД, дорсальная продольная связка, жёлтая связка, прилегающие позвонки или суставные поверхности (рис. 2) [10].
Патофизиология
Дегенеративный люмбосакральный стеноз представляет собой многофакторное дегенеративное заболевание, ведущее к стенозу позвоночного канала и компрессии конского хвоста или нарушению его кровоснабжения. Предложен ряд этиологических факторов данного заболевания [7] , в их числе врождённые аномалии позвонков (переходный или лишний позвонок) [12–17] (рис. 3), грыжа Хансена второго или, реже, первого типа [2,18], вентральный подвывих позвонка S1 (пояснично-крестцовая нестабильность) [19–23], смещение суставных поверхностей [24,25], гипертрофия жёлтой связки [27], остеохондроз крестца [28–30] и нарушение кровоснабжения спинальных нервов [6,27,31].
Каждый из этих факторов может быть причиной нарушения функции пояснично-крестцового сочленения, способствовать развитию дегенеративных изменений диска L7-S1 [19–23] и запускать медленно прогрессирующую дегенерацию пояснично-крестцового сочленения. С началом дегенеративных изменений в МПД его толщина меняется, а нагрузка смещается с центральной оси на периферию, то есть на суставные поверхности и вентральную область тела позвонка. Изменения биомеханической нагрузки и/или нестабильность сегмента позвоночника провоцируют пролиферативные изменения и гипертрофию окружающих анатомических структур. Возможна гипертрофия жёлтой связки, эпидуральный фиброз, образование остеофитов и вентральный спондилёз. Дальнейшее уменьшение толщины МПД и потеря реакции фиброзного кольца на компрессию ведут к его выпячиванию и грыже 2 типа [20,32]. В конечном итоге дегенерация окружающих структур и пролиферативные изменения приводят к компрессии конского хвоста, воспалительной реакции и, как следствие, боли в пояснично-крестцовом отделе позвоночного столба.
Эпидемиология
Согласно данным исследований, проведённых за последние 20 лет, дегенеративный люмбосакральный стеноз приблизительно в 2 раза чаще встречается у кобелей, у собак крупных пород, предрасположены немецкие овчарки, средний возраст около 7 лет [2,18,33–38]. С 1995 г. по 2006 г. в Швеции была изучена популяция собак численностью более 600 000 животных младше 12 лет[39] Это первое эпидемиологическое исследование зависимости ДЛСС от породы, возраста и пола, которое не было основано на учёте собак, направленных для лечения в клинику. Согласно результатам этого исследования, ДЛСС чаще встречается у кобелей (3:2) и у собак крупных пород (таблица 2). Основное отличие от предыдущих исследований заключатся в том, что заболеваемость ДЛСС увеличивается с возрастом, не достигая пика в возрасте 7 лет. Наиболее вероятной причиной данного разногласия является тот факт, что старых собак с диагнозом ДЛСС реже направляют в клинику.
Таблица 2. Заболеваемость на 10 000 собак в год в группе риска (СГГР) ± СО.
Из них 10 пород с высоким и 5 пород с низким риском заболевания [39].
Изучена популяция собак в Швеции (более 600 000 животных младше 12 лет)
в течение 12 лет (1995–2006).
| СГГР ± СО | Заболевшие собаки | |
| В среднем по популяции | 5,6 ± 0,1 | 1574 |
| Кобели | 6,7 ± 0,2 | 916 |
| Суки | 4,6 ± 0,2 | 658 |
| Группа высокого риска | ||
| Немецкая овчарка | 27,9 ± 1,2 | 526 |
| Доберман | 17,5 ± 3,7 | 22 |
| Ротвейлер | 15,9 ± 2,0 | 64 |
| Бернская овчарка | 15,5 ± 2,9 | 29 |
| Боксёр | 14,0 ± 2,7 | 27 |
| Далматин | 13,8 ± 2,8 | 24 |
| Ирландский сеттер | 11,3 ± 2,5 | 20 |
| Группа низкого риска | ||
| Йоркширский терьер | 0,0 ± 0,0 | 0 |
| Малый бассет-грифон | 0,0 ± 0,0 | 0 |
| Финский шпиц | 0,0 ± 0,0 | 0 |
| Тибетский спаниель | 0,0 ± 0,0 | 0 |
| Древер | 0,2 ± 0,2 | 1 |
Дегенеративный люмбосакральный стеноз: история болезни
При обращении в клинику, у собак с дегенеративным люмбосакральным стенозом владельцы чаще всего отмечают снижение двигательной активности и боль в пояснично-крестцовом отделе. Клинические признаки заболевания могут быть не выражены и проявляются только после значительной физической нагрузки. Со слов хозяина, собака неохотно прыгает, хромает на тазовые конечности, издаёт звуки при физической нагрузке и прыжках, с трудом встаёт, садится или ложится, низко опускает хвост, подвижность хвоста снижается, развивается кифоз, недержание мочи или кала, меняется походка, иногда собака волочит конечности [2,18,33,36]. Так как клинические проявления ДЛСС схожи с остеоартритом (ОА) и другими ортопедическими заболеваниями тазовых конечностей, владельца следует спросить о том, улучшается ли походка собаки после того, как она полежала некоторое время или после того, как она походила несколько минут. В отличие от ДЛСС, при ОА походка у собак улучшается после небольшой физической нагрузки. Это обусловлено усилением кровотока в пояснично-крестцовой области с последующей компрессией конского хвоста и усугублению клинических признаков (сосудистая хромота).
Насколько высоко собака держит хвост? Как правило, при заболеваниях тазовых конечностей положение хвоста у собак не меняется. Повышается ли чувствительность в пояснично-крестцовой области? У собак с компрессией конского хвоста может развиваться иррадиирущая боль в каудальной части поясничного отдела, хвоста и тазовых конечностей, особенно после физической нагрузки.
Разные подходы к интерпретации клинических признаков и обследованию животного могут привести к неправильному диагнозу. В большинстве случаев ДЛСС у собак представляет собой нейроортопедическое заболевание, т. е. по природе оно неврологическое, а проявляется как ортопедическое. Так как ДЛСС развивается преимущественно у собак среднего и старшего возраста, у них могут быть сопутствующие дегенеративные ортопедические заболевания, например, ОА. Следовательно, необходимо ортопедическое и неврологическое обследование.
Общее клиническое обследование
Перед неврологическим и/или ортопедическим обследованием следует провести общее клиническое обследование животного. Следует исключить все системные заболевания, которые вызывают слабость тазовых конечностей, чаще всего это дискоспондилит, новообразования в поясничной области и тромбоэмболия области бифуркации аорты. Важность общего обследования заключается в необходимости выявления других серьёзных заболеваний, дальнейшее лечение которых будет определяться наличием ДЛСС.
Ортопедическое обследование
В большинстве случаев результаты общего клинического обследования напрямую связаны с компрессией конского хвоста, при этом наиболее частым признаком является боль в пояснично-крестцовой области при пальпации [36]. Также часто отмечаются хромота на одну или обе тазовые конечности, атрофия мускулатуры и перенос веса тела на грудные конечности. Походка часто нарушена: от лёгкой до сильной хромоты, когда вес тела полностью переносится на грудные конечности, и от затруднённой походки до пареза обеих конечностей. При планировании лечения дегенеративного люмбосакрального стеноза необходимо учитывать сопутствующие ортопедические заболевания.
Специфические диагностические тесты на дегенеративный люмбосакральный стеноз
• Тест на лордоз — гиперэкстензия каудальной части поясничной области при одновременном воздействии на пояснично-крестцовую область. Тест проводится в положении стоя. Тазовым конечностям посредством соответствующей поддержки придают свободное висячее положение, не допуская экстензии конечностей в тазобедренных суставах.
• Гиперэкстензия хвоста (в кранио-дорсальном направлении) при нажатии на пояснично-крестцовую область. Часто возникает боль и состояние дискомфорта, собака может сопротивляться.
• Гиперэкстензия тазобедренных суставов (поочередно). Здоровая собака в положении лёжа на боку не должна ощущать боли в тазобедренных суставах при их разгибании. В большинстве случаев при ДЛСС или дисплазии при постепенном разгибании конечности в тазобедренном суставе боль не ощущается до тех пор, пока отсутствует гиперэкстензия в пояснично-крестцовой области. Опытный врач должен отличать умеренную реакцию на боль в суставе от выраженной реакции на боль, возникающей при компрессии конского хвоста.
• При односторонней хромоте возможна компрессия или ущемление спиномозговых нервов сегмента L7-S1. Если нерв ущемлён, при гиперэкстензии тазовой конечности в положении стоя с одновременным нажатием на пояснично-крестцовую область возникает иррадиирующая боль.
Неврологическое обследование
Хотя по определению дегенеративный люмбосакральный стеноз является неврологическим заболеванием, признаки неврологического дефицита у собак встречаются довольно редко. Это объясняется тем, что упругость спинномозговых нервов в составе конского хвоста намного выше, чем спинного мозга, что подтверждается результатами экспериментов, в которых значительная компрессия нерва не вызывала повреждения нервного волокна [40,41]. Следовательно, тщательное обследование собак со спинальной атаксией и проприоцептивными нарушениями необходимо для того, чтобы исключить новообразования, дегенеративную миелопатию и грыжи МПД в грудной и поясничной областях позвоночника. Неврологические нарушения при ДЛСС проявляются признаками поражения нижнего моторного нейрона, седалищного нерва (L6, L7, S1) и атрофией мышц-разгибателей, которые он иннервирует. Коленный (разгибательный) рефлекс — спинальный рефлекс, характеризующий функцию бедренного нерва (L4-L6) и соответствующего сегмента спинного мозга, — предположительно не нарушен, либо отмечается псевдогиперрефлексия из-за атрофии ингибирующих мышц-сгибателей, которые иннервируются седалищным нервом. При серьёзных нарушениях часто отмечается недержание мочи и/или кала[36], но в этих случаях, помимо ДЛСС, необходимо учитывать и другие причины.
Диагностика
Предварительный диагноз основан на информации, предоставленной владельцем, и на результатах ортопедических и неврологических обследований. Этот диагноз следует подтвердить результатами методов визуальной диагностики. Хотя признаки болезни можно распознать на рентгенограмме, этого недостаточно для постановки окончательного диагноза [42–44].
Методы визуализации
Для диагностики дегенеративного люмбосакрального стеноза используются стандартная рентгенография, стресс-рентгенография, миелография, эпидурография, дискография, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). По мере распространения и доступности, КТ и МРТ становятся стандартными методами диагностики ДЛСС, при этом отпадает необходимость применения инвазивных процедур с использованием контрастных веществ, но многие ветеринарные врачи до сих пор полагаются на данные обычной рентгенографии, основные аспекты которой рассматриваются ниже.
Рентгенография
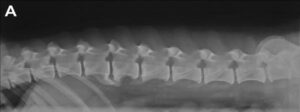
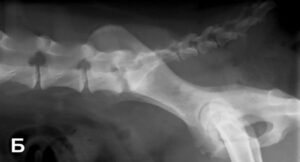
Наиболее информативной для диагностики дегенеративного люмбосакрального стеноза является рентгенография в боковой проекции [42,45–47]. Как правило, отмечаются склероз концевых пластин позвонков, уменьшение ширины МПД, удлинение крестцовой дужки в области каудальной апертуры L7, образование ступеньки с вентральным подвывихом позвонка S1, феномен вакуума, обусловленный накоплением азота в области МПД при его разрыве, и вентральный спондилёз (рис. 4-A) [2]. Отмечаются также аномалии позвонков L7 или S1, промежуточные позвонки или добавочный (восьмой) поясничный позвонок [12–16,28–30]. Обзорная рентгенография может быть полезна для исключения дискоспондилита (рис. 4-Б), травмы (рис. 4-Г) и новообразования с вовлечением костной ткани.
Рисунок 4.
Рентгенограмма пояснично-крестцовой области в боковой проекции.
Миелография
Информативность миелографии при ДЛСС остаётся под вопросом, так как её результат зависит от степени расширения дурального мешка (имеющего в своем составе субарахноидальное пространство) в пояснично-крестцовой области. Тем не менее, миелография используется в качестве метода диагностики ДЛСС, однако данный метод нельзя назвать надёжным, так как на основании результатов нормальной миелографии невозможно исключить ДЛСС [48].
Эпидурография
Данный метод технически проще, его надёжность выше и побочные эффекты менее выражены по сравнению с миелографией. Контрастное вещество вводится в эпидуральное пространство в пояснично-крестцовой или крестцово-хвостовой области. На снимке видно сужение, девиацию или обструкцию эпидуральной области (контрастной линии). Чувствительность метода можно повысить исследованием с функциональной нагрузкой (сгибание/разгибание) [49] (рис. 5-A, Б).
Дискография
В настоящее время считается устаревшим методом, так как прокол диска может запустить дегенеративные процессы. До сих пор прокол МПД чаще всего используется в экспериментальных исследованиях его дегенерации [50,51].
Компьютерная томография
Хотя КТ основана на рентгеновском излучении и лучше подходит для визуализации скелета, чем мягких тканей, она позволяет получить намного более высокое контрастное разрешение для мягких тканей, чем обычная рентгенография [52]. Основное преимущество КТ заключается в возможности рассматривать анатомические структуры в любой плоскости (сагиттальной, дорсальной или косой), благодаря реконструкции изображений, полученных с поперечных срезов; возможна также трёхмерная реконструкция. При дегенеративном люмбосакральном стенозе изображения, полученные при помощи КТ, аналогичны рентгенограммам, но они позволяют рассмотреть мягкие ткани, в том числе нервы, образующие конский хвост, утолщение корешков (позвонок L7 или S1), грыжу по типу Хансен-2, а также гипертрофию связок (жёлтой связки или продольной дорсальной связки) и капсулы суставных поверхностей позвонков (рис. 6). Изображения в поперечной плоскости позволяют оценить состояние межпозвонковых отверстий[55]. Преимущество КТ по сравнению с МРТ заключается в том, что КТ позволяет идентифицировать кальцификацию тканей, например остеофиты и спондилёзные мостики между позвонками, а также отложения кальция в пульпозных ядрах МПД, но чувствительность КТ ниже чем МРТ в плане визуализации мягких тканей, расположенных в спинномозговом канале [42].
Магнитно-резонансная томография
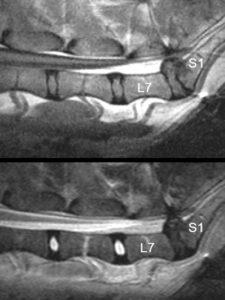
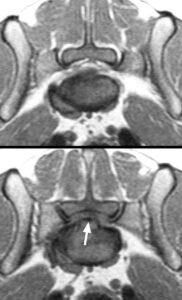
МРТ позволяет получить более детальное изображение мягких тканей, расположенных вокруг и внутри спинномозгового канала, а также подробную информацию о дегенеративных процессах, протекающих в МПД. МРТ выявляет с высокой степенью точности грыжи Хансена 1 и 2 типа, а также пролиферативные процессы в жёлтой связке, капсулах межпозвонковых суставов и дорсальной связке. По сравнению с КТ, МРТ обеспечивает более детальное изображение корешков нервов, их смещения или ущемления и потерю эпидуральной жировой ткани (рис. 7). На T1-взвешенных срезах жировая ткань даёт высокую интенсивность сигнала и на снимке окрашена в яркий белый цвет. МПД дают постоянную среднюю интенсивность сигнала, чуть выше сигнала от спинного мозга, корешков нервов и костного мозга (рис. 7). На сагиттальных T2-взвешеных срезах вода даёт сигнал высокой интенсивности и на изображении окрашена в яркий белый цвет. Из-за высокого содержания воды в пульпозном ядре на T2-взвешеных срезах МПД имеют яркий белый цвет. Дегенерация МПД характеризуется отсутствием воды в пульпозном ядре и, соответственно, снижением интенсивности сигнала [56-58] (рис. 7 и 8). Парасагиттальные и поперечные изображения позволяют оценить степень стеноза межпозвонковых отверстий в области L7-S1[59]. У собак с ДЛСС отмечена высокая степень соответствия результатов анализа изображений, полученных при помощи КТ и МРТ, при этом степень соответствия между результатами КТ и МРТ, с одной стороны, и хирургической картиной заболевания, с другой, несколько ниже [50,61].
Вспомогательные диагностические методы
В исследованиях, связанных с диагностикой дегенеративного люмбосакрального стеноза, используются электродиагностические методы, такие как электромиография (ЭМГ) [62,63], соматосенсорные вызванные потенциалы [41], а также анализ походки при помощи сенсорной платформы [2,64] и кинематический анализ походки. Эти методы позволяют получить дополнительную информацию, но они бесполезны в плане определения величины и области локализации компрессии нерва и имеют скорее академическую, а не практическую ценность.
Дифференциальный диагноз
Наиболее важными аспектами дифференциальной диагностики дегенеративного люмбосакрального стеноза является исключение других факторов, обусловливающих компрессию конского хвоста, таких как новообразования в области позвоночного столба, травма (перелом/вывих) и дискоспондилит [8]. Результатом спинальной травмы может быть перелом или смещение позвонков (рис. 4-В), а при дискоспондилите (рис. 4-Б) отмечается типичный остеолиз концевой пластины позвонка и остеосклероз, которые можно идентифицировать на обзорных рентгенограммах. МРТ необходима для диагностики новообразований, не затрагивающих костную ткань.
По клиническим признакам другие ортопедические заболевания могут иметь сходство с ДЛСС, наряду с возрастными изменениями и породной предрасположенностью, например разрыв краниальной крестовидной связки, дисплазия тазобедренных суставов, контрактура m. gracilis и m. semitendinosus. Для исключения этих факторов необходимо тщательное ортопедическое обследование. При очевидности неврологических нарушений необходимо исключить дегенеративную миелопатию, заболевание МПД грудного и поясничного отделов, новообразования (например, опухоль оболочки периферического нерва) и выраженный дискоспондилит [27,65].
Диагностика ДПКС затруднена не только по причинам, упомянутым выше, но и потому, что это заболевание развивается преимущественно у немолодых собак, в организме которых довольно часто протекают дегенеративные процессы. Сопутствующие заболевания могут затруднить диагностику и, соответственно, лечение собаки с ДЛСС. Например, если при диагностированном ДЛСС есть подозрение на дегенерирующую миелопатию, целесообразно сначала исключить миелопатию при помощи ДНК-теста, а затем рассмотреть возможность хирургического лечения ДЛСС.
Выводы
Дегенеративный люмбосакральный стеноз (ДЛСС) является наиболее частой причиной боли в пояснично-крестцовой области у собак. ДЛСС характеризуется типичными нейроортопедическими клиническими признаками. В патогенезе данного заболевания важную роль играют дегенеративные процессы в межпозвонковых дисках. Современные методы визуализации, такие как КТ и МРТ, в значительной степени способствуют выяснению некоторых аспектов течения заболевания и разработке индивидуальных подходов к его лечению.
Вторую часть статьи вы можете прочитать здесь.
Источник: интернет-журнал EJCAP
(№ 22(1), апрель 2012).
С разрешения совета FECAVA и
главного редактора журнала EJCAP
http://www.fecava.org/ejcap
Список литературы
I. Oliver J.E., Jr., Selcer R.R., Simpson S. Cauda equina compression from lumbosacral malarticulation and malformation in the dog. J Am Vet Med Assoc 1978; 173: 207–214.
2. Suwankong N., Meij B.P., Voorhout G., et al. Review and retrospective analysis of degenerative lumbosacral stenosis in 156 dogs treated by dorsal laminectomy. Vet Comp Orthop Traumatol 2008; 21: 285–293.
3. Wheeler S.J.. Lumbosacral disease. Vet Clin North Am Small Anim Pract 1992; 22: 937–950.
4. Koppel E., Rein D. [Lumbosacral instability. The cauda equina compression syndrome in dogs]. Tierarztl Prax. 1992; 20: 637–645.
5. Orendacova J., Cizkova D., Kafka J., et al. Cauda equina syndrome. Prog Neurobiol 2001; 64: 613-637. [6] Tarvin G, Prata RG. Lumbosacral stenosis in dogs. J Am Vet Med Assoc 1980; 177: 154–159.
7. Meij B.P., Bergknut N. Degenerative lumbosacral stenosis in dogs. Vet Clin North Am Small Anim Pract 2010; 40: 983–1009.
8. da Costa R.C., Moore S.A. Differential diagnosis of spinal diseases. Vet Clin North Am Small Anim Pract 2010; 40: 755–763.
9. Grevel V. [Lameness of the hindlimbs of the cat]. Berl Munch Tierarztl Wochenschr 1989; 102: 253–261.
10. Fletcher T.F., Kitchell R.L. Anatomical studies on the spinal cord segments of the dog. Am J Vet Res 1966; 27: 1759–1767.
11. Lang J. Flexion-extension myelography of the canine cauda equina. Vet Radiol 1988; 29: 242–257.
12. Aihara T., Takahashi K., Ogasawara A., et al. Intervertebral disc degeneration associated with lumbosacral transitional vertebrae: a clinical and anatomical study. J Bone Joint Surg Br 2005; 87: 687–691.
13. Damur-Djuric N., Steffen F., Hassig M., et al. Lumbosacral transitional vertebrae in dogs: classification, prevalence, and association with sacroiliac morphology. Vet Radiol Ultrasound 2006; 47: 32–38.
14. Fluckiger M.A., Damur-Djuric N., Hassig M., et al. A lumbosacral transitional vertebra in the dog predisposes to cauda equina syndrome. Vet Radiol Ultrasound 2006; 47: 39–44.
15. Morgan J.P. Transitional lumbosacral vertebral anomaly in the dog: a radiographic study. J Small Anim Pract 1999; 40: 167–172.
16. Meij B.P., Voorhout G., Wolvekamp W.T. Epidural lipomatosis in a six-year-old dachshund. Vet Rec 1996; 138: 492–495.
17. Steffen F., Berger M., Morgan J.P. Asymmetrical, transitional, lumbosacral vertebral segments in six dogs: a characteristic spinal syndrome. J Am Anim Hosp Assoc 2004; 40: 338–344.
18. De Risio L., Sharp N.J., Olby N.J., et al. Predictors of outcome after dorsal decompressive laminectomy for degenerative lumbosacral stenosis in dogs: 69 cases (1987–1997). J Am Vet Med Assoc 2001; 219: 624–628.
19. Tanaka N., An H.S., Lim T.H., et al. The relationship between disc degeneration and flexibility of the lumbar spine. Spine J 2001; 1: 47–56.
20. Adams M.A., Roughley P.J. What is intervertebral disc degeneration, and what causes it? Spine 2006; 31: 2151–2161.
21. Zhao F., Pollintine P., Hole B.D., et al. Discogenic origins of spinal instability. Spine (Phila Pa 1976). 2005; 30: 2621–2630.
22. Kaigle A.M., Holm S.H., Hansson T.H. Experimental instability in the lumbar spine. Spine (Phila Pa 1976) 1995; 20: 421–430.
23. Krismer M., Haid C., Ogon M., et al. [Biomechanics of lumbar instability. Orthopade 1997; 26: 516–520.
24. Seiler G.S., Hani H., Busato A.R., et al. Facet joint geometry and intervertebral disk degeneration in the L5-S1 region of the vertebral column in German Shepherd dogs. Am J Vet Res 2002; 63: 86–90.
25. Rossi F., Seiler G., Busato A., et al. Magnetic resonance imaging of articular process joint geometry and intervertebral disk degeneration in the caudal lumbar spine (L5-S1) of dogs with clinical signs of cauda equina compression. Vet Radiol Ultrasound 2004; 45: 381–387.
26. Benninger M.I., Seiler G.S., Robinson L.E., et al. Effects of anatomic conformation on three-dimensional motion of the caudal lumbar and lumbosacral portions of the vertebral column of dogs. Am J Vet Res 2006; 67: 43–50.
27. Sharp N., Wheeler S. Small Animal Spinal Disorders. Second ed: Elsevier, 2005. [28. Mathis K.R., Havlicek M., Beck J.B., et al. Sacral osteochondrosis in two German Shepherd Dogs. Aust Vet J 2009; 87: 249–252.
29. Lang J., Hani H., Schawalder P. A sacral lesion resembling osteochondrosis in the German Shepherd Dog. Veterinary Radiology and Ultrasound 1992; 33: 69–76.
30. Hanna F.Y. Lumbosacral osteochondrosis: radiological features and surgical management in 34 dogs. J Small Anim Pract 2001; 42: 272–278.
31. Sugawara O., Atsuta Y., Iwahara T., et al. The effects of mechanical compression and hypoxia on nerve root and dorsal root ganglia. An analysis of ectopic firing using an in vitro model. Spine 1996; 21: 2089–2094.
32. Brinckmann P., Grootenboer H. Change of disc height, radial disc bulge, and intradiscal pressure from discectomy. An in vitro investigation on human lumbar discs. Spine 991; 16: 641–646.
33. Danielsson F., Sjostrom L. Surgical treatment of degenerative lumbosacral stenosis in dogs. Vet Surg 1999; 28: 91–98.
34. Moore G.E., Burkman K.D., Carter M.N., et al. Causes of death or reasons for euthanasia in military working dogs: 927 cases (1993-1996). J Am Vet Med Assoc 2001; 219: 209–214.
35. Kinzel S., Koch J., Stopinski T., et al. [Cauda equina compression syndrome (CECS): retrospective study of surgical treatment with partial dorsal laminectomy in 86 dogs with lumbosacral stenosis]. Berl Munch Tierarztl Wochenschr 2004; 117: 334–340.
36. Indrieri R.J. Lumbosacral stenosis and injury of the cauda equina. Vet Clin North Am Small Anim Pract 1988; 18: 697–710.
37. Ness M. Degenerative lumbosacral stenosis in the dog: a review of 30 cases. J Small Anim Pract 1994; 35: 185–190.
38. Watt P.R. Degenerative lumbosacral stenosis in 18 dogs. Journal of small animal practice 1991; 32: 125–134.
39. Bergknut N., Egenvall A., Hagman R., et al. Incidence and mortality of diseases related to intervertebral disc degeneration in a population of over 600 000 dogs. J Am Vet Med Assoc, 2011. (In Press)
40. Sato K., Konno S., Yabuki S., et al. A model for acute, chronic, and delayed graded compression of the dog cauda equina. Neurophysiologic and histologic changes induced by acute, graded compression. Spine (Phila Pa 1976) 1995; 20: 2386–2391.
41. Delamarter R.B., Bohlman H.H., Dodge L.D., et al. Experimental lumbar spinal stenosis. Analysis of the cortical evoked potentials, microvasculature, and histopathology. J Bone Joint Surg Am 1990; 72: 110–120.
42. Sande RD. Radiography, myelography, computed tomography, and magnetic resonance imaging of the spine. Vet Clin North Am Small Anim Pract 1992; 22: 811–831.
43. Brawner W. Neuroradiology In: Slatter D., ed. Textbook of small animal surgery. Philadelphia: W. B. Saunders, 1993; 1008–1022.
44. Ramirez O., 3rd, Thrall D.E. A review of imaging techniques for canine cauda equina syndrome. Vet Radiol Ultrasound 1998; 39: 283–296.
45. Morgan J. Techniques of veterinary radiography. 5th ed. Ames: Iowa State University Press, 1993.
46. Middleton D.L. Radiographic positioning for the spine and skull. Vet Clin North Am Small Anim Pract 1993; 23: 253–268.
47. Dennis R. Radiographic examination of the canine spine. Vet Rec 1987; 121: 31–35.
48. Hachcock J.T., Pechmanm R.D., Dillon A.R., et al. Comparison of three radiographic contrast procedures in the evaluation of the canine lumbosacral spinal canal. Vet Radiol 1988; 29: 4–15.
49. Robert R.E., Selcer B.A. Diagnostic imaging: Myelography and epidurography. Vet Clin North Am Small Anim Pract 1993; 23: 307–329.
50. Masuda K., Aota Y., Muehleman C., et al. A novel rabbit model of mild, reproducible disc degeneration by an anulus needle puncture: correlation between the degree of disc injury and radiological and histological appearances of disc degeneration. Spine (Phila Pa 1976) 2005; 30: 5–14.
51. Sobajima S., Kompel J.F., Kim J.S., et al. A slowly progressive and reproducible animal model of intervertebral disc degeneration characterized by MRI, X-ray, and histology. Spine (Phila Pa 1976) 2005; 30: 15–24.
52. Jones J.C., Wilson M.E., Bartels J.E. A review of high resolution computed tomography and a proposed technique for regional examination of the canine lumbosacral spine. Vet Radiol Ultrasound 1994; 35: 339–346.
53. Jones J.C., Sorjonen D.C., Simpson S.T., et al. Comparison between computed tomographic and surgical findings in nine large-breed dogs with lumbosacral stenosis. Vet Radiol Ultrasound 1996; 37: 247–256.
54. Jones J.C., Inzana K.D. Subclinical CT abnormalities in the lumbosacral spine of older large-breed dogs. Vet Radiol Ultrasound 2000; 41: 19–26.
55. Wood B.C., Lanz O.I., Jones J.C., et al. Endoscopic-assisted lumbosacral foraminotomy in the dog. Vet Surg 2004; 33: 221–231.
56. Adams W.H., Daniel G.B., Pardo A.D., et al. Magnetic resonance imaging of the caudal lumbar and lumbosacral spine in 13 dogs (1990-1993). Vet Radiol Ultrasound 1995; 36: 3–13.
57. de Haan J.J., Shelton S.B., Ackerman N. Magnetic resonance imaging in the diagnosis of degenerative lumbosacral stenosis in four dogs. Vet Surg 1993; 22: 1–4.
58. Karkkainen M., Punto L.U., Tulamo R.M. Magnetic resonance imaging of canine degenerative lumbar spine diseases. Vet Radiol Ultrasound 1993; 34: 399–404.
59. Godde T., Steffen F. Surgical treatment of lumbosacral foraminal stenosis using a lateral approach in twenty dogs with degenerative lumbosacral stenosis. Vet Surg 2007; 36: 705–713.
60. Suwankong N., Voorhout G., Hazewinkel H.A., et al. Agreement between computed tomography, magnetic resonance imaging, and surgical findings in dogs with degenerative lumbosacral stenosis. J Am Vet Med Assoc 2006; 229: 1924–1929.
61. Jones J.C., Banfield C.M., Ward D.L. Association between postoperative outcome and results of magnetic resonance imaging and computed tomography in working dogs with degenerative lumbosacral stenosis. J AmVet Med Assoc 2000; 216: 1769–1774.
62. Sisson A.F., LeCouteur R.A., Ingram J.T., et al. Diagnosis of cauda equina abnormalities by using electromyography, discography, and epidurography in dogs. J Vet Intern Med 1992; 6: 253–263.
63. Kornberg M., Bichsel P., Lang J. [Electromyography and spinal evoked potentials in cauda equina syndrome of dogs. Schweiz Arch Tierheilkd 1989; 131: 287–298.
64. Suwankong N., Meij B.P., Van Klaveren N.J., et al. Assessment of decompressive surgery in dogs with degenerative lumbosacral stenosis using force plate analysis and questionnaires. Vet Surg 2007; 36: 423–431.
65. De Risio L., Thomas W.B., Sharp N.J. Degenerative lumbosacral stenosis. Vet Clin North Am Small Anim Pract 2000; 30: 111–132.
СВМ № 1/2013