Sun Young Kim1, Joon Young Kim2 , Soon Wuk Jeong1
1 College of Veterinary Medicine, Konkuk University, Seoul, Republic of Korea
2 Veterinary Medical Teaching Hospital, Konkuk University, Seoul, Republic of Korea
Ключевые слова: собаки; глаз; ультразвуковая биомикроскопия; зрение; помутнение; реконструкция роговицы; язвенный кератит.
Глубокие язвы роговицы являются патологией, потенциально угрожающей зрению и глазному яблоку в целом [20]. Когда глубина дефекта роговицы составляет более 50% её толщины, требуются специальные хирургические процедуры, чтобы предотвратить прогрессирование заболевания и сократить его продолжительность [9]. С начала 1950-х годов транспозиция конъюнктивальной ткани использовалась для лечения глубоких язв роговицы. Эта техника безопасна и обеспечивает быстрое заживление [15]. Хотя этот метод и успешен, он связан с уменьшением прозрачности роговицы после заживления из-за остатков перенесённых конъюнктивальных тканей [14, 11]. Поэтому для закрытия дефектов роговицы были разработаны несколько альтернативных методов с использованием амниотической мембраны [3, 23], бычьего перикарда [10], ацеллюлярной подслизистой ткани [13] и капсулы почки лошади [1, 9]. Несмотря на это, пересадка свежей или замороженной роговицы по-прежнему считается лучшим методом для сохранения зрения. Однако ветеринарные банки роговицы не распространены, что ограничивает использование свежей или замороженной ткани роговицы [9].
Аутологичная ламеллярная пересадка роговицы ранее использовалась для лечения децеметоцеле, стромальных абсцессов и перфорированных язв [6]. Эти трансплантаты используют смежные ткани роговицы, которые перемещаются, чтобы закрыть дефект [20]. Использование аутологичных ламеллярных трансплантатов роговицы предпочтительно, поскольку это приводит к меньшему количеству отторжений трансплантата, а донорскую ткань не нужно собирать или хранить до операции [20]. И хотя опубликовано много исследований по ламеллярным трансплантатам роговицы [16, 17], насколько нам известно, только в нескольких исследованиях использовались аутологичные ламеллярные трансплантаты роговицы у собак [6].
Цель этой публикации — описать клинические признаки, данные ультразвуковой биомикроскопии, выводы и стратегии хирургического лечения четырёх собак с тяжёлыми дефектами роговицы, которых лечили при помощи аутологичной ламеллярной пересадки роговицы.
Описание случаев
Случай 1. Девятилетний кастрированный самец породы йоркширский терьер был направлен в ветеринарный учебный госпиталь Университета Конкука с дефектом роговицы правого глаза. За неделю до направления собака получала терапевтическое лечение, и был использован фартук третьего века для лечения язвы роговицы, но никаких улучшений в плане клинических признаков или в самом дефекте не наблюдалось. Реакция на угрожающий жест, на ослепляющий свет, прямой и содружественный зрачковый рефлекс присутствовали. Значения теста Ширмера были нормальными (18 мм/мин). Внутриглазное давление не могло быть измерено из-за перфорации роговицы. Офтальмологическое обследование с помощью щелевой лампы (Hawk eye®, Dioptrix, Франция) выявило перфорацию роговицы, дефект диаметром 2 мм (рисунок 1А). Отёк роговицы и её неоваскуляризация также наблюдались вокруг дефекта (рисунок 1A). Для восстановления роговицы была проведена её аутологичная ламеллярная пластика.
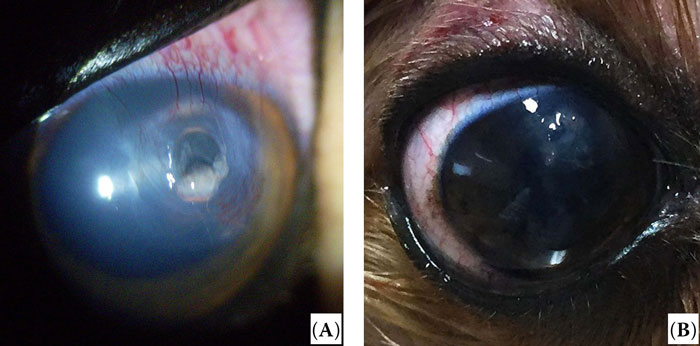 |
| Рисунок 1. Первичное офтальмологическое обследование (A) и результаты хирургического вмешательства через один год после операции (B) в случае 1. (A) Перфорация роговицы на правом глазу. (B) Помутнение трансплантата роговицы разрешилось |
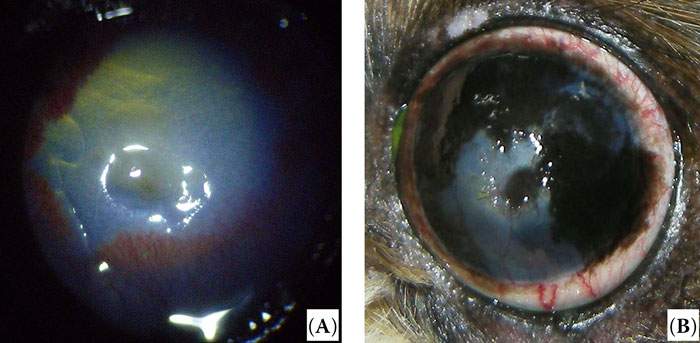
Случай 2. 11-летняя интактная самка ши-тцу была доставлена в нашу клинику с перфорацией роговицы правого глаза. Дефект роговицы был выявлен за два дня до госпитализации. Во время офтальмологического обследования наблюдался сгусток фибрина диаметром 3 мм (рисунок 2А). Хотя дефект был герметизирован пробкой из фибрина и крови, было обнаружено небольшое истечение внутриглазной жидкости. В поражённом глазу наблюдались умеренная гиперемия конъюнктивы и диффузный отёк роговицы. Зрачковый рефлекс невозможно было оценить из-за непрозрачности роговицы. Реакция на угрожающий жест и ослепляющий свет были отрицательными. Мы не смогли измерить тест Ширмера и внутриглазное давление из-за перфорации роговицы. Хоть и было рекомендовано выполнить конъюнктивальную пластику для лечения перфорации, но по настоянию владельца собаки, вместо этого была проведена аутологичная ламеллярная пластика роговицы.
 |
| Рисунок 2. Первичное офтальмологическое обследование (A) и результаты хирургического вмешательства через один год после операции (B) в случае 2. (A) Перфорация роговицы в правом глазу, дефект закрыт фибриновой пробкой с примесью крови. (B) Выраженный фиброз трансплантата роговицы из-за развития тяжёлого кератита и увеита, обнаруженных при первичном обследовании |
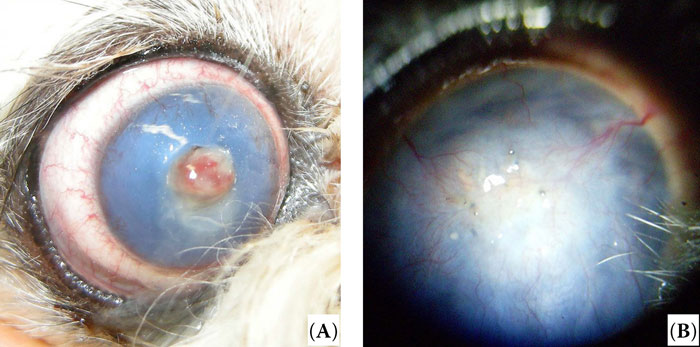
Случай 3. 15-летний кастрированный самец ши-тцу получал лечение от язвы роговицы левого глаза с использованием местных и системных препаратов в течение двух недель в ветеринарной клинике по месту жительства. Офтальмологическое обследование выявило наличие глубокой язвы роговицы диаметром 3 мм (рисунок 3А). Реакция на угрожающий жест и ослепляющий свет не оценивалась. Мы также не смогли оценить прямой и содружественный зрачковый рефлекс из-за отёка роговицы и выраженного помутнения внутриглазной жидкости. Тест Ширмера был низким (9 мм/мин), а внутриглазное давление было незначительно снижено (11 мм рт. ст.), согласно данным тонометрии (TonoPen, Reichert, США). Была выполнена аутологичная ламеллярная пересадка роговицы для предотвращения прогрессирования язвы роговицы.
 |
| Рисунок 3. Первичное офтальмологическое обследование (A) и результаты хирургического вмешательства через один год после операции (B) в случае 3. (A) Глубокая язва роговицы левого глаза. (B) Язва роговицы зажила, но развился пигментный кератит из-за сухого кератоконъюнктивита |
Случай 4. Двухлетний самец породы мальтийская болонка с катарактой на обоих глазах был доставлен в нашу клинику с язвой роговицы правого глаза. Четыре недели назад была травма правого глаза кошачьим когтём, в результате чего возникли рваные раны роговицы. Несмотря на четыре недели лечения в клинике по месту жительства, дефект роговицы прогрессировал. При офтальмологическом обследовании был обнаружен дефект роговицы овальной формы диаметром 3 мм (рисунок 4А). Хотя реакция на угрожающий жест и ослепляющий свет были положительными, прямой и содружественный зрачковый рефлекс были отрицательными. Значение теста Ширмера было нормальным — 17 мм/мин, и внутриглазное давление было немного снижено в правом глазу — 11 мм рт. ст. Мы считаем, что этот глаз имел признаки переднего увеита, вторичного к язве роговицы.
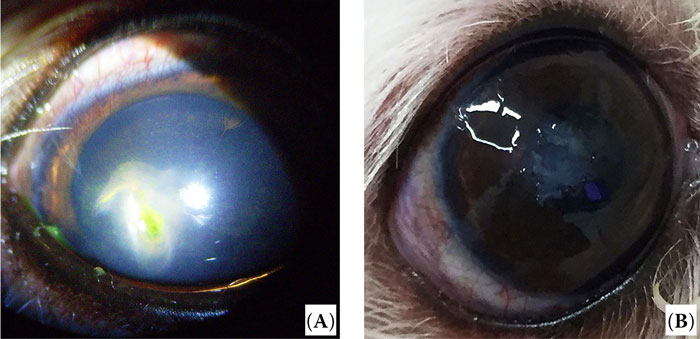 |
| Рисунок 4. Первичное офтальмологическое обследование (A) и результаты хирургического вмешательства через один год после операции (B) в случае 4. (А) Язва роговицы глубиной более 2/3 толщины роговицы на правом глазу. (B) Помутнение трансплантата роговицы разрешилось |
Техника операции
Местные препараты, в том числе офлоксацин (Tarivid®, Santen Pharm., Ltd., Республика Корея) и атропина сульфат (Isopto Atropine® 1%, Alcon®, США), были назначены до операции. Цефазолин (30 мг/кг внутривенно; Chongkundang Pharm. Co., Ltd., Республика Корея) вводили в качестве профилактического антибиотика до индукции анестезии пропофолом (6 мг/кг внутривенно; Provive 1% ®, Myungmoon Pharm. Co., Ltd., Республика Корея). Поддержание анестезии проводилось с использованием 1,5–2% изолюрана (Forane®, Choongwae, Республика Корея) и кислорода. Интраоперационная инфузионная терапия проводилась с использованием 0,9% натрия хлорида. Собак укладывали на спину, выбривали шерсть с век, глаз с дефектом роговицы подготавливали к операции. После обработки кожи периокулярной области раствором повидон-йода 1:10, конъюнктивальный мешок очищали стерильной ватной палочкой, пропитанной раствором повидон-йода 1:50. После этого роговицу и конъюнктиву тщательно промывали с помощью раствора Хартманна (Daihan Hartmann's Sol., Dai Han Pharm. Co., Ltd., Республика Корея), чтобы удалить слизь, мёртвые ткани и остатки антисептиков.
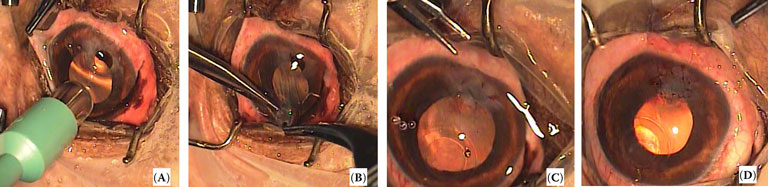 |
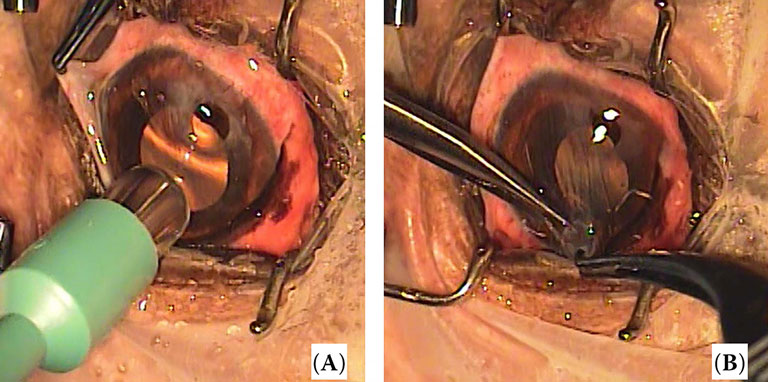
| Рисунок 5. Техника операции по аутологичной ламеллярной трансплантации роговицы у собаки. (A) Донорский участок был взят из здоровой области роговицы поражённого глаза с помощью панча для биопсии кожи диметром на 1 мм больше чем диаметр дефекта роговицы. (B) Кератэктомия на ½ толщины роговицы выполнена расслаивателем и роговичными ножницами. (С) Трансплантат роговицы покрыл место дефекта и был зафиксирован четырьмя узловыми швами. (D) Трансплантат роговицы полностью фиксирован непрерывным швом |
Нежизнеспособные ткани роговицы или фибриновые сгустки вокруг дефекта роговицы были удалены для подготовки реципиентной зоны. Если глаз был перфорирован, то переднюю камеру заполняли гиалуронатом натрия (Healon®, AMO Uppsala AB, Швеция). Донорский трансплантат роговицы отбирали с нормальной области роговицы того же глаза с помощью панча для биопсии кожи, который был на 1 мм больше, чем диаметр дефекта роговицы (рисунок 5A). Кератэктомия на ½ толщины роговицы была выполнена расслаивателем (Ophthalmic crescent knife ®, Alcon®) и роговичными ножницами (рисунок 5B). Ламеллярный трансплантат роговицы помещали на область дефекта. Трансплантат был закреплён простыми узловыми швами на 12, 6, 3 и 9 часов (рисунок 5C), а затем фиксирован простым непрерывным швом 10-0 полиамид монофиламент (Dafilon®, B. Brown, Испания) (рисунок 5D). Частичная временная тарзоррафия была выполнена при помощи 4-0 полиамид монофиламента (Dafilon®, B. Brown, Испания) для защиты роговицы в течение двух недель после операции.
После операции использовали офлоксацин (глазные капли, четыре раза в день в течение двух недель, а затем три раза в день в течение двух недель) и цефазолин (системно в течение двух недель). Кроме того, использовали глазные капли 0,05% циклоспорин (Cyporin N®, Taejoon Pharm. Co., Ltd., Республика Корея) три раза в день, начиная десятого дня после операции, а затем постепенно снижали до одного раза в день в течение двух месяцев, и глазные капли 1% преднизолон (Pred Forte®, Allergan, Ирландия) три раза в день, начиная с десятого дня после операции, а затем постепенно снижали до 1 раза в 2 дня в течение трёх месяцев, для уменьшения неоваскуляризации и фиброза в области дефекта.
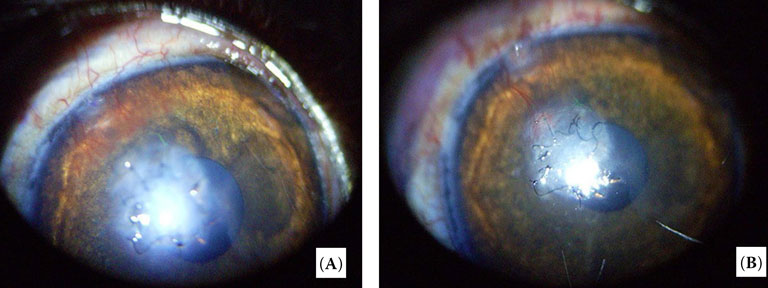 |
| Рисунок 6. Послеоперационные фотографии правого глаза собаки в случае 4. (A) Для оценки состояния глаза на 7-й день после операции шов с век был удалён. Наблюдался отёк трансплантата роговицы, неоваскуляризация подходила к краю трансплантата. Впоследствии мы повторно наложили тарзорафию под местной анестезией. (B) После снятия тарзорафии на 14-й день после операции: отёк трансплантата снизился, васкуляризация менее заметна |
Результаты операций и последующие наблюдения
На второй послеоперационный день не было обнаружено никаких признаков утечки внутриглазной жидкости. Реакция на угрожающий жест и ослепляющий свет присутствовала, а блефароспазм отсутствовал в течение пяти дней после операции во всех четырёх случаях. Через семь дней после операции все зоны с трансплантатами были флуоресцеин-отрицательными, и все швы были состоятельны. Поскольку частичная тарзоррафия была выполнена с захватом 1/3 или 1/4 длины век, прооперированную область можно было наблюдать и без снятия швов с век. Отёк трансплантата роговицы и неоваскуляризация, простирающаяся к краю трансплантата, наблюдались в раннем послеоперационном периоде (рисунок 6А). Однако отёк снизился, и васкуляризация стала менее заметной (рисунок 6В). Через месяц после операции сосуды были сужены, и трансплантаты стали полупрозрачными, что позволило нам тщательно изучить переднюю камеру. Шовный материал с роговицы был удалён через год, и циклоспориновые глазные капли постоянно использовались после снятия швов. Все пересаженные трансплантаты и места отбора донорской ткани роговицы оставались целостными, а хозяева всех собак остались довольны эстетикой. Зрение было удовлетворительно сохранено во всех случаях, хотя в случае 2 зрение было неоптимальным. Помутнение в области пересадки роговицы было малозаметно (минимальное помутнение) в случаях 1 и 4 (рисунки 1B и 4B, соответственно). Однако в случае 2 возник выраженный фиброз трансплантата роговицы (рисунок 2B) из-за тяжёлого кератита и увеита, наблюдавшихся в глазу уже при первичном обследовании. В случае 3 развился пигментный кератит из-за сухого кератоконъюнктивита (рисунок 3В). Через месяц после операции значение теста Ширмера этого глаза снизилось, и в течение трёх месяцев после операции значение составляло почти 0 мм/мин.
Через два года после операции была выполнена ультразвуковая биомикроскопия — UBM (MD-320W, MEDA Co., Ltd., China) для определения толщины, эхогенности и эндотелиальной непрерывности пересаженных трансплантатов и донорского участка роговицы. Измерения по UBM показали, что толщина пересаженных трансплантатов и участков роговицы, где отбирали донорский материал была аналогична тем, которые наблюдались в здоровых зонах роговицы, и что эндотелиальный слой роговицы был непрерывным в зонах трансплантатов в случаях 1 и 4 (рисунок 7).
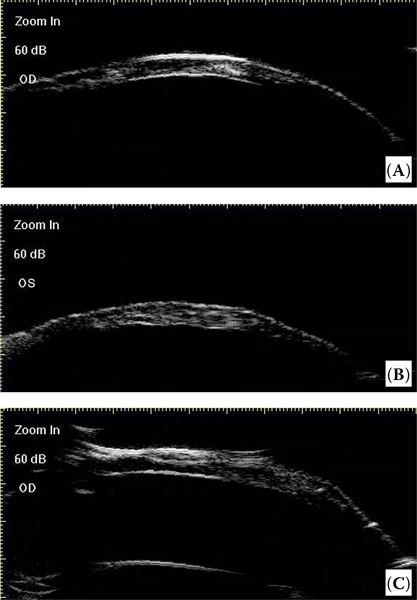 |
| Рисунок 7. Случай 1 (A), случай 2 (B), случай 4 (C). Эпителиальная и эндотелиальная целостность трансплантата отмечается в случаях (A) и (C), но не (B, случай 2), толщина трансплантатов почти такая же, как и в здоровых участках роговицы (ультразвуковая биомикроскопия) |
Обсуждение
В ветеринарной офтальмологии существует несколько хирургических методов для замещения и регенерации дефектов роговицы, в том числе тканевые клеи [22], конъюнктивальный лоскут на ножке [14], проникающая и ламеллярная кератопластика [15] и лоскуты из биоматериалов [13, 10]. Однако продолжают исследоваться и разрабатываться новые методы, направленные на сохранение прозрачности роговицы и обеспечение быстрого и лёгкого заживления.
В человеческой офтальмологии метод пересадки роговицы является предпочтительным для лечения дефектов, так как он обеспечивает прозрачность и тектоническую поддержку роговицы [21]. В ветеринарной офтальмологии, хоть конъюнктивальная пластика и является надёжным методом, который используется на протяжении более 60 лет для лечения глубоких или сквозных язв роговицы, использование конъюнктивальной ткани может уменьшить прозрачность роговицы из-за фиброза [9]. Таким образом, трансплантация роговицы, которая является эффективной, стабильной и может обеспечить прозрачность роговицы, предпочтительнее, чем конъюнктивальная пластика [18]. Корнеоконъюнктивальная транспозиция (CCT) является ещё одним альтернативным методом [2], который используется для лечения глубоких язв роговицы, десцеметоцеле и корнеальных секвестров с вовлечением глубоких слоёв стромы [11]. Хотя CCT является хорошим вариантом лечения язвы роговицы, она может приводить к фиброзу в периферической части роговицы.
Отторжение роговичного трансплантата является одним из основных осложнений при пересадке роговицы и наиболее распространённой причиной несостоятельности трансплантата после операции. Кроме того, отторжение трансплантата может привести к расхождению швов и помутнению роговицы. Эта реакция возникает, когда иммунная система реципиента распознаёт чужеродные антигены трансплантата. Основным фактором риска для отторжения трансплантата является васкуляризация роговицы реципиента [19], которая позволяет антигенам из донорской ткани выходить через кровеносные сосуды, а антиген-презентирующим клеткам реципиента транспортироваться к трансплантату [7]. В недавнем исследовании Lacerda et al. [18] показатели отторжения трансплантатов роговицы и ламеллярных трансплантатов у собак составляли 56% и 55%, соответственно. Однако, в недавнем исследовании Barut Selver et al. [4], частота отторжения трансплантата и повторной проникающей кератопластики у человека среди 1613 случаев составила 9,23%. В отличие от этого, в другом исследовании у человека, проведённом Coster [8], уровень успешности кератопластики составил всего 62%. Таким образом, лучшее понимание факторов риска, причин и осложнений при отторжении трансплантата может помочь увеличить успешность кератопластики в ветеринарной офтальмологии. Один из способов уменьшить вероятность отторжения трансплантата заключается в использовании аутологичных ламеллярных тканей роговицы. У пациентов из данного исследования после операции наблюдалась неоваскуляризация, однако образование кровеносных сосудов было ослаблено путём использования низких доз циклоспорина в форме глазных капель. И хотя помутнение роговицы полностью не разрешилось, кератит практически исчез. Тем не менее в случае 2 возник выраженный фиброз донорской роговицы. При первичном обследовании этот глаз уже имел перфорацию роговицы и тяжёлый кератит, и диффузный отёк роговицы. Хотя перфорация и была ликвидирована аутологичным ламеллярным трансплантатом роговицы, фиброз остался. Поскольку трансплантат был собран из поражённого глаза, мы считаем, что его ткань изначально не была достаточно здоровой для обеспечения прозрачности роговицы. В случае 3 развился пигментный кератит в связи с сухим кератоконъюнктивитом. Это привело к неравномерной толщине роговицы, пигментированная область роговицы была немного толще, чем в других областях, хотя язва роговицы зажила хорошо.
Донорский трансплантат роговицы был взят с нормальной зоны роговицы поражённого глаза с помощью панча для биопсии кожи, который был на 1 мм больше, чем диаметр дефекта роговицы.
Аутологичная ламеллярная пересадка роговицы также устраняет необходимость получения донорского материала из другого источника. Это важно, потому что, несмотря на достижения в области хирургии пересадки роговицы и послеоперационного ухода в ветеринарии, банки роговицы ещё не доступны во всём мире. Из-за нехватки таких банков были разработаны биоматериалы, которые могут служить в качестве заменителей роговицы в ветеринарной офтальмологии. Поскольку аутологичные ламеллярные донорские участки роговицы получают от самого пострадавшего животного, то сторонний донорский материал в таком случае не требуется. Несмотря на некоторые ограничения, в целом мы выяснили, что получить трансплантат с поражённого глаза довольно просто. По нашему опыту изъязвление не происходит сразу по всей площади роговицы, за исключением расплавляющей язвы роговицы, следовательно, даже при тяжёлых случаях есть вероятность выбрать подходящий участок для взятия донорской ткани роговицы. В данном исследовании даже в случае перфорации трансплантат был взят из тканей роговицы соседних к дефекту. Кроме того, если трансплантат нельзя взять из тканей больного глаза, то его можно получить и из роговицы соседнего здорового глаза.
Интересно, что исследование Brightman et al. [6] показало, что здоровые эндотелиальные клетки, прилегающие к области трансплантата, удлиняются и увеличивают площадь поверхности по мере миграции, в конечном итоге покрывая эндотелий-дефицитный ламеллярный трансплантат. Такие выводы подтверждают мнение о том, что аутологичная ламеллярная пластика может быть использована даже при перфорации роговицы.
После аутологичной ламеллярной пересадки роговицы, однако, место отбора донорского участка роговицы истончается, и происходит ли нормальное заживление его, остаётся неясным. Чтобы определить степень заживления, была использована ультразвуковая биомикроскопия (UBM). Это неинвазивный метод с применением высокочастотных (50 МГц) ультразвуковых датчиков, он позволяет визуализировать на микроскопическом уровне структуры в живых тканях in vivo (Bentley et al. 2003). UBM может быть применена для получения изображений передней камеры с более высоким разрешением, чем те, которые получаются при использовании ультразвука высокого разрешения — HRUS (частота 20 МГц). Глубина проникновения в ткани и разрешение изображения UBM является достаточным для оценки структур переднего сегмента in vivo. Кроме того, в большинстве случаев исследование UBM может проводиться без анестезии. UBM может предоставить дополнительную информацию о патогенезе и прогнозе и может быть выполнена в случае непрозрачной или отёчной роговицы [12]. В данном исследовании UBM показала, что толщина пересаженных трансплантатов и участков отбора донорской роговицы были почти одинаковыми по сравнению с интактной зоной роговицы, и что эндотелий имел непрерывное строение, как и в неповреждённой зоне. Хотя прозрачность пересаженного трансплантата не была полной, косметические эффект при этом был лучше, чем при конъюнктивальной пластике, что больше удовлетворяло владельцев собак.
В заключение следует отметить, что аутологичная ламеллярная пересадка является эффективным хирургическим методом лечения тяжёлых дефектов роговицы (в том числе язв роговицы), которые требуют немедленного вмешательства, в связи с его пригодностью и лёгким применением на практике. Трансплантат обеспечивает достаточную тектоническую поддержку и хорошие оптические и косметические результаты.
Литература
- Andrade AL, Laus JL, Figueiredo F, Batista CM (1999): The use of preserved equine renal capsule to repair lamellar corneal lesions in normal dogs. Veterinary Ophthalmology 2, 79–92.
- Andrew SE, Tou S, Brooks DE (2001): Corneoconjunctival transposition for the treatment of feline corneal sequestra: a retrospective study of 17 cases (1990–1998). Veterinary Ophthalmology 4, 107–111.
- Barros PS, Safatle AM, Godoy CA, Souza MS, Barros LF, Brooks DE (2005): Amniotic membrane transplantation for the reconstruction of the ocular surface in three cases. Veterinary Ophthalmology 8, 189–192.
- Barut Selver O, Karaca I, Palamar M, Egrilmez S, Yagci A (2018): Graft failure and repeat penetrating keratoplasty. Experimental and Clinical Transplantation, doi: 10.6002/ ect.2017.0165.
- Bentley E, Miller PE, Diehl KA (2003): Use of high-resolution ultrasound as a diagnostic tool in veterinary ophthalmology. Journal of the American Veterinary Medical Association 223, 1617–1622.
- Brightman AH, McLaughlin SA, Brogdon JD (1989): Autogenous lamellar corneal grafting in dogs. Journal of the American Veterinary Medical Association 195, 469–475.
- Brooks DE, Plummer C, Kallberg M, Barrie K, Ollivier FJ, Hendrix DV, Baker A, Scotty NC, Utter ME, Blackwood SE, Nunnery CM, Ben-Shlomo G, Gelatt KN (2008): Corneal transplantation for inflammatory keratopathies in the horse: visual outcome in 206 cases (1993–2007). Veterinary Ophthalmology 11, 123–133.
- Coster DJ (1997): Evaluation of corneal transplantation. British Journal of Ophthalmology 81, 618–619.
- Dorbandt DM, Moore PA, Myrna KE (2015): Outcome of conjunctival flap repair for corneal defects with and without an acellular submucosa implant in 73 canine eyes. Veterinary Ophthalmology 18, 116–122.
- Dulaurent T, Azoulay T, Goulle F, Dulaurent A, Mentek M, Peiffer RL, Isard PF (2014): Use of bovine pericardium (Tutopatch®) graft for surgical repair of deep melting corneal ulcers in dogs and corneal sequestra in cats. Veterinary Ophthalmology 17, 91–99.
- Gelatt KN, Brooks DE (2011): 8. Surgery of the cornea and sclera. In: Gelatt KN, Gelatt JP (eds): Veterinary Ophthalmic Surgery. Saunders. 191–236.
- Gibson T, Roberts SM, Severin GA, Steyn PH, Wrigley RH (1998): Comparison of gonioscopy and ultrasound biomi- croscopy for evaluating the iridocorneal angle in dogs. Journal of the American Veterinary Medical Association 213, 635–638.
- Goulle F (2012): Use of porcine small intestinal submucosa for corneal reconstruction in dogs and cats: 106 cases. Journal of Small Animal Practice 53, 34–43.
- Hakanson NE, Merideth RE (1987): Conjunctival pedicle grafting in the treatment of corneal ulcers in the dog and cat. Journal of the American Animal Hospital Association 23, 641.
- Hansen PA, Guandalini A (1999): A retrospective study of 30 cases of frozen lamellar corneal graft in dogs and cats. Veterinary Ophthalmology 2, 233–241.
- Jensen EC (1963): Experimental corneal transplantation in the dog. Journal of the American Veterinary Medical Association 142, 11–22.
- Kim S, Kwak JY, Jeong M, Seo K (2016): Deep anterior lamellar keratoplasty of dog eyes using the big-bubble technique. Journal of Veterinary Science 17, 347–352.
- Lacerda RP, Pena Gimenez MT, Laguna F, Costa D, Rios J, Leiva M (2017): Corneal grafting for the treatment of full-thickness corneal defects in dogs: a review of 50 cases. Veterinary Ophthalmology 20, 222–231.
- Laguna F, Leiva M, Costa D, Lacerda R, Pena Gimenez T (2015): Corneal grafting for the treatment of feline corneal sequestrum: a retrospective study of 18 eyes (13 cats). Veterinary Ophthalmology 18, 291–296.
- Ledbetter EC, Gilger BC (2013): 18. Diseases and surgery of the canine cornea and sclera. In: Gelatt KN, Gilger BC, Kern TJ (eds): Veterinary Ophthalmology. 5th edn. Wiley-Blackwell. 976–1049.
- Moffatt SL, Cartwright VA, Stumpf TH (2005): Centennial review of corneal transplantation. Clinical & Experimental Ophthalmology 33, 642–657.
- Refojo MF, Dohlman CH, Ahmad B, Carroll JM, Allen JC (1968): Evaluation of adhesives for corneal surgery. Archives of Ophthalmology 80, 645–656.
- Tsuzuki K, Yamashita K, Izumisawa Y, Kotani T (2008): Microstructure and glycosaminoglycan ratio of canine cornea after reconstructive transplantation with glycerin-reserved porcine amniotic membranes. Veterinary Ophthalmology 11, 222–227.
Источник: Veterinarni Medicina 64, 2019 (02): 84–91. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (http://creativecommons.org/ licenses/by/2.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
СВМ № 4/2019