Аннотация
Практическая значимость. Гиперпаратиреоз кошек бывает первичный и вторичный. Первичный гиперпаратиреоз обычно считается заболеванием, которое редко поражает кошек, но в действительности это состояние более распространено, чем предполагалось ранее. Вторичный гиперпаратиреоз может быть следствием тех или иных особенностей кормления (т. е. алиментарный вторичный гиперпаратиреоз) или хронического заболевания почек (т. е. вторичный почечный гиперпаратиреоз). Третичный гиперпаратиреоз до сих пор в ветеринарной медицине не зарегистрирован, но возможно, что такое состояние возникает у некоторых кошек после длительного почечного вторичного гиперпаратиреоза.
Клинические проблемы. Диагностика этой группы нарушений метаболизма кальция представляет ряд проблем для клинициста. Например, клинические признаки могут быть неспецифическими, и, особенно в случае первичного гиперпаратиреоза, часто бывает низкий индекс подозрения на заболевание; требуется осторожное обращение с образцами для определения уровней паратиреоидного гормона (ПТГ) и ионизированного кальция; в настоящее время не существует специфического для кошек теста для определения концентрации ПТГ, что влияет на чувствительность и интерпретацию результатов.
Цели. В этой статье кратко описывается физиология обмена ПТГ и кальция как введение к обзору измерения уровня ПТГ и интерпретации его результата. Затем описываются различные формы гиперпаратиреоза кошек с охватом вариантов диагностики и лечения.
Регуляция выработки паратиреоидного гормона и обмена кальция
Паратиреоидный гормон (ПТГ) является основным гормоном, участвующим в быстрой и точной регуляции концентрации кальция в крови через эффекты канальцевой реабсорбции кальция, всасывание кальция в кишечнике косвенно опосредовано через кальцитриол и его поступление в кровь при резорбции кости. ПТГ представляет собой кальциемический гормон, секретируемый главными клетками паращитовидных желез (ПЩЖ).
Анатомия ПЩЖ у кошек аналогична анатомии собак и людей. Обыкновенно на каждой доле щитовидной железы есть две ПЩЖ (одна внешняя и одна внутренняя), но у собак существует значительная вариабельность в количестве ПЩЖ [1]; о детальных диссекционных исследованиях подобных явлений у кошек сообщений не появлялось. ПЩЖ исключительно чувствительны к колебаниям уровня ионизированного кальция (iCa), особенно при его низком уровне. ПЩЖ реагируют на эти колебания соответствующим образом: секреция ПТГ резко возрастает при низком уровне iCa; при высоком уровне iCa секреция ПТГ снижается. Воздействие ПТГ можно наблюдать непосредственно в почках и костях и косвенно в желудочно-кишечном тракте (илл. 1):
- В почках ПТГ увеличивает реабсорбцию кальция и экскрецию фосфора. Он также повышает активность 1α-гидроксилазы, фермента, ответственного за превращение 25-гидроксивитамина D (25OHD) в 1,25-дигидроксивитамин D3 (1,25[OH]2D3) (кальцитриол).
- Затем кальцитриол воздействует на желудочно-кишечный тракт, увеличивая всасывание кальция и фосфора.
- В кости ПТГ индуцирует костную остеокластную резорбцию, что увеличивает поступление кальция и фосфора.
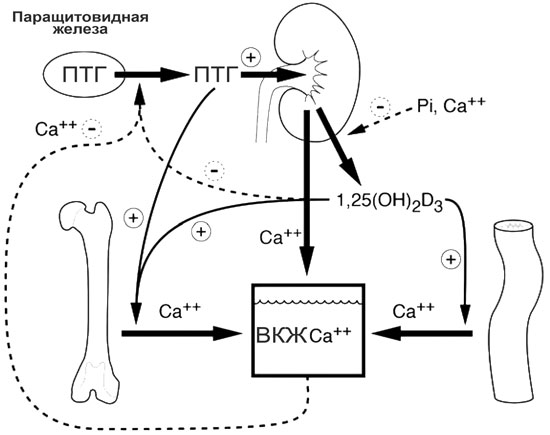
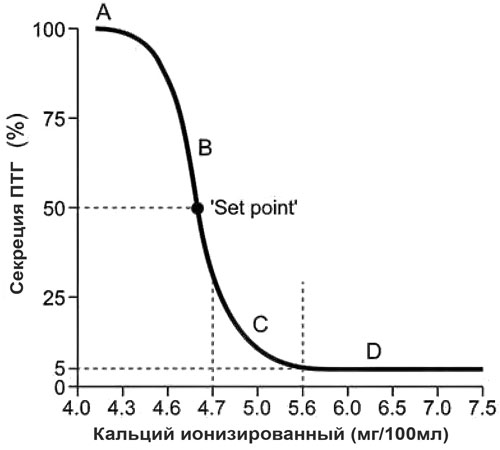
Все эти процессы приводят к увеличению концентрации циркулирующего iCa; что, в свою очередь, обеспечивает отрицательную обратную связь для снижения секреции ПТГ. При графическом отображении концентраций ПТГ и iCa получается обратная сигмоидальная кривая с крутым наклоном (илл. 2), как недавно было продемонстрировано у кошки [2]. Эта взаимосвязь обеспечивает относительно большое изменение концентрации циркулирующего ПТГ в ответ на небольшие изменения iCa за пределами физиологического диапазона. Заданное значение определяется как концентрация циркулирующего кальция, которая приводит к половинному уровню от максимальной секреции ПТГ, какая может быть достигнута. Определённые заболевания могут сдвигать эту кривую вправо или влево. Например, при первичном гиперпаратиреозе (ПГПТ) кривая ПТГ–iCa смещается вправо по мере увеличения заданного значения кальция [3].
Уровень общего кальция в сыворотке крови не может быть надёжно использован для прогнозирования метаболически активной фракции iCa у кошек [4; 5]. В одном исследовании оценивали 434 образца сыворотки крови кошек, общая диагностическая дискордантность при использовании iCa для прогнозирования изменения содержания составила 40%. Гиперкальциемия и нормокальциемия (с оценкой по уровню ионизированного кальция) были недооценены, а гипокальциемия (с оценкой по уровню ионизированного кальция) была переоценена [5]. Таким образом, скрининг кошек на нарушения метаболизма кальция лучше проводить путём измерения iCa (см. вставку).
Измерение концентрации iCa
Измерение в клинике
Уровень ионизированного кальция можно измерить в образцах сыворотки или плазмы с помощью портативных устройств, предназначенных для анализа в месте оказания медицинской помощи. Важно убедиться, что ЭДТА не используется в качестве антикоагулянта для образцов плазмы, поскольку ЭДТА хелатирует кальций — измерение в этих случаях даст искусственно заниженные значения iCa. iCa также можно измерить с помощью настольных анализаторов, в которых используются селективные по кальцию электроды. При сборе образцов как в пробирки для получения сыворотки, так и в пробирки с ЭДТА лучше сначала поместить кровь в пробирку для получения сыворотки, а затем в пробирку с ЭДТА, чтобы ЭДТА не могла загрязнить образец сыворотки.
Измерение сторонней лабораторией
Сыворотку следует предпочесть плазме при отправке образцов в стороннюю лабораторию для измерения iCa. Важно обращаться с образцами анаэробно, иначе воздействие воздуха во время сбора и транспортировки приведёт к значительному увеличению pH образца и искусственному уменьшению содержания ионизированного кальция. Некоторые сторонние лаборатории принимают аэробно обработанные образцы сыворотки — в этих случаях образец сначала подкисляют до примерного pH 7,4, а затем применяется алгоритм «коррекции», чтобы получить окончательный расчётный результат. Хотя этот метод коррекции не был полностью валидирован, представляется, что iCa в сыворотке, измеренный перед отправкой, и полученный из отправленных образцов сыворотки, прошедших «коррекцию», аналогичны (DJC, неопубликованные наблюдения). В случае несоответствия значение концентрации iCa, измеренной в свежей сыворотке, полученной в анаэробных условиях, следует считать золотым стандартом по сравнению со скорректированным значением iCa, полученным из образцов крови, взятых в аэробных условиях [6].
! ЭДТА не следует использовать в качестве антикоагулянта для получения образцов плазмы. Он хелатирует кальций и даёт искусственно заниженные значения iCa.
Измерение и интерпретация концентрации ПТГ
ПТГ высвобождается из ПЩЖ в виде одноцепочечного пептида, состоящего из 84 аминокислот. Эта интактная активная форма гормона (ПТГ1–84) инактивируется в процессе печёночного и почечного метаболизма (период полувыведения из плазмы приблизительно 2–4 минуты). N-концевая область 1–34 необходима для биологической активности ПТГ, и расщепление в этом месте эндопротеазами делает гормон неактивным. При этом образуются фрагменты различной длины, попадающие в кровь. Затем эти фрагменты выводятся из кровотока путём почечной экскреции.
Разработка методов иммуноанализа для исследования концентрации ПТГ
Разработка первого радиоиммунотеста для измерения концентрации ПТГ предшествовала идентификации укороченных форм ПТГ [9]. Отсутствие специфичности односайтового антитела, используемого в этих ранних тестах (как правило, направленного к средней области последовательности ПТГ1–84 — области наибольшей антигенности), означало значительную перекрёстную реактивность циркулирующих фрагментов ПТГ и, таким образом, завышенную оценку концентрации интактного активного PTH1–84. Открытие циркулирующих фрагментов ПТГ в конце 1960-х и в 1970-х годах стало основной движущей силой для разработки всё более точных методов иммунотеста второго и третьего поколения для измерения концентрации ПТГ.
Двухсторонние иммунотесты второго поколения (или «интактные») используют два антитела: одно направлено на С-концевую область (аминокислоты 39–84), а другое направлено на N-концевую область интактной молекулы 1–84 ПТГ. В большинстве тестов второго поколения используются N-концевые антитела, направленные на аминокислоты 12–24, хотя некоторые используют антитела, направленные на аминокислоты 26–32. Эти тесты считались гораздо более специ-фичными, поскольку они позволяли избежать перекрёстной реактивности с С-концевыми фрагментами ПТГ (ПТГ 34–84) [7]. Однако описывать эти тесты как исследования уровня «интактного» ПТГ неверно; эти тесты не смогли отличить целую молекулу (1–84) от фрагментов, расщеплённых между аминокислотами 1–12.
В середине 1990-х годов было признано, что такие фрагменты действительно существуют и состоят из биологически активной N-концевой области разной длины. Это привело к разработке диагностических тестов третьего поколения, в которых используются первичные антитела, направленные на С-концевую область, вместе со вторичными антителами, направленными на аминокислоты 1–4 в N-концевой области, для определения «цельного» ПТГ (т. е. с помощью этих тестов обнаруживалась только цепочка ПТГ полной длины [все 84 аминокислоты]).
Исследование уровня «истинного» ПТГ1–84 не является однозначным — существует удивительно гетерогенный диапазон фрагментов ПТГ [7]. Как точный состав, так и возможные биологические функции фрагментов ПТГ ещё предстоит полностью разобрать, равно как и вариабельное влияние этих фрагментов на доступные в настоящее время аналитические методы тестирования концентрации ПТГ, особенно у кошек. Накопление фрагментов ПТГ у людей с заболеванием почек, например, может быть настолько выраженным, что на интактный гормон 1–84 приходится лишь 5–20% измеренной концентрации ПТГ, в зависимости от статуса кальциемии и стадии заболевания почек [8].
Валидация и точность тестов
Хотя специфичность была улучшена за счёт разработки иммунотестов второго и третьего поколения, чувствительность этих тестов до сих пор остаётся нерешённой проблемой. Аминокислотная последовательность неодинакова у разных видов, а посттрансляционные модификации (например, фосфорилирование, расщепление и т. д.) различаются в разных физиологических и патофизиологических состояниях [7; 11]. Пределы каких-либо посттрансляционных модификаций у кошек неизвестны. Посттрансляционные модификации могут влиять на аффинность молекулы ПТГ к антителу, используемому в тесте, даже если аминокислотная последовательность остаётся прежней. Кроме того, другие молекулы, присутствующие в крови, могут мешать обнаружению ПТГ, они могут быть видоспецифичными или ассоциироваться с определёнными патологическими состояниями. Все эти факторы могут влиять на антигенность ПТГ и снижать чувствительность данного теста в определённых условиях и у разных видов.
Тест для измерения у человека концентрации ПТГ («интактного») второго поколения (иммунорадиометрический тест Allegro Intact PTH; Nichols Institute Diagnostics, Калифорния, США), который был валидирован для использования у кошек, больше не доступен в продаже [12]. Этот тест был стандартом в медицине кошек в течение многих лет, он использовался в большинстве исследований, изучающих измерение концентрации ПТГ у кошек [4; 13; 14]. Тест, однако, имел ряд ограничений. Процесс валидации этого теста не включал оценку точности, поскольку исследователям не был доступен очищенный кошачий ПТГ [12]. Специфичность (на основе исследования параллелизма разведений) и точность этого теста были ограничены. Кроме того, адекватность этого теста на нижнем пределе обнаружения была поставлена под сомнение первоначальными исследователями, поскольку нормальная концентрация паратгормона кошек была ниже очевидной чувствительности теста (3,9 пг/мл [37,1 пмоль/л]). Перекрытие между референтным диапазоном и чувствительностью теста снижало способность любого исследования обнаруживать концентрацию ПТГ, которая была ниже нормы. Это имеет решающее значение при состояниях, для которых низкая концентрация ПТГ является ключевым параметром для диагностики (например, при дифференциации ПГПТ от идиопатической гиперкальциемии).
Недавно тест третьего поколения (Duo PTH IRMA Kit; Scantibodies Laboratory, Калифорния, США) был валидирован для использования у кошек и сравнен с тестом второго поколения [2]. В целом результативность обоих тестов была приемлемой; однако нижний предел обнаружения по-прежнему перекрывался с нижним пределом рассчитанного референтного интервала. Интересно, что в этом исследовании здоровых кошек тест для определения уровня «интактного» ПТГ дал значения, аналогичные тем, о которых сообщалось ранее [12], но неожиданно более высокие значения концентрации ПТГ были обнаружены при использовании теста третьего поколения (определение концентрации цельного ПТГ). При меньшей перекрёстной реактивности с фрагментами ПТГ весь анализ ПТГ теоретически должен давать более низкие значения. Однако различия в аминокислотной последовательности, посттрансляционные модификации и внешние факторы могут повлиять на сродство молекулы к трассирующим антителам.
Судя по результатам этого исследования, аффинность меченого антитела против 1–4 ПТГ в тесте на целый ПТГ выше, чем аффинность антитела против 7–34 ПТГ человека, используемого в тесте для определения концентрации «интактного» ПТГ [2]. Это согласуется с данными о том, что аминокислотная последовательность в положениях 1–4 идентична в молекулах ПТГ кошек и человека, но есть различия между двумя молекулами в аминокислотах 7, 16, 18 и 26 [15]. Значения, полученные с помощью теста для определения концентрации цельного ПТГ, также больше соответствуют «истинной» концентрации цельного ПТГ у других видов и с большей вероятностью отражают концентрации биологически значимого соединения, поскольку область 1–4 является наиболее важной для активации ПТГ-рецептора.
Важным компонентом валидации теста в этом исследовании было изучение его биологической значимости (т. е. построение кривой ПТГ–iCa как при высоких, так и при низких концентрациях циркулирующего iCa). В целом тесты как второго, так и третьего поколения дали ожидаемую сигмовидную кривую ПТГ–iCa. Однако в диапазоне гиперкальциемии концентрации ПТГ лишь немного превышали нижний предел обнаружения тестов и всё ещё находились в пределах референтного интервала для «нормальных» кошек. Это снова означает, что определение «неадекватно подавленной» концентрации ПТГ у кошки с гиперкальциемией будет проблематичным для обоих тестов. Тот же тест второго поколения, который использовался в этом исследовании [2], также был валидирован другой группой, и их результаты были схожими [16]. В то же время значения концентрации ПТГ у здоровых кошек иногда были ниже нижнего предела обнаружения теста (5,2 пг/мл в этом исследовании).
Обработка проб для исследования концентрации ПТГ
Образцы следует хранить и транспортировать в замороженном виде, чтобы предотвратить разложение ПТГ. Стабильность ПТГ выше всего в плазме, собранной с ЭДТА, но сыворотка пригодна, если хранить её в замороженном виде после отделения от крови [6]. Референтная лаборатория может отказаться измерять ПТГ в образце, который поступает слишком тёплым, из-за опасений, что значение концентрации ПТГ будет искусственно занижено.
Оптимальный текущий вариант
Чтобы разработать тест, который точно измеряет концентрацию ПТГ кошек, гормон кошек должен быть очищен, а затем использован либо для получения специфических антител, либо, по крайней мере, для валидации специфичности и чувствительности доступных антител. Этот процесс является дорогостоящим и вряд ли будет коммерчески приемлемым. В настоящее время кажется, что у кошек лучше всего работает тест для определения концентрации «цельного» ПТГ третьего поколения [2], однако следует соблюдать осторожность при интерпретации результатов теста, особенно при измерении концентраций в нижней части референтного интервала.
Таблица 1. Ожидаемые биохимические изменения при различных причинах гиперкальциемии
| Заболевание | Общий кальций | Ионизированный кальций | Фосфор | ПТГ | ПТГрП | Визуализация ПЩЖ |
| Первичный гиперпаратиреоз |
↑ | N или ↑ | N или ↓ | ↑ или верхняя половина или контрольный диапазон | N или не обнаружен |
↑ обычно одна железа |
| Гиперкальциемия злокачественных новообразований | ↑ | ↑ | N или ↓ | ↓ или нижняя половина или контрольный диапазон |
N или ↑, в зависимости от типа опухоли |
N или ↓ |
| Хроническая болезнь почек | ↓, N, ↑ | ↓, N, ↑ | ↑ или N | ↑ | N или не обнаружен |
↑ нескольких желез |
| Идиопатическая гиперкальциемия | ↑ | ↑ | N | N или ↓ | N или не обнаружен |
N или ↓ |
| Острая интоксикация витамином D |
↑↑ | ↑↑ | ↑↑ | ↓ | N или не обнаружен |
N |
| Пищевой вторичный гиперпаратиреоз |
N или ↓ | N или ↓ | N или ↓ | ↑ | N или не обнаружен |
N или ↑ |
| Гипоадренокортицизм | ↑ | N или ↑ | ↑ | N или ↓ | N или не обнаружен |
N |
Стрелки указывают степень увеличения или уменьшения параметра.
Одна стрелка представляет слабое изменение, две стрелки представляют умеренное отклонение от нормы (N).
ПТГ — паратгормон; ПТГрП — паратгормонподобный пептид; ПЩЖ — паращитовидная железа.
Первичный гиперпаратиреоз
ПГПТ кошек был описан в нескольких небольших сериях о клинических случаях и отчётах о клинических случаях. Повышенная концентрация общего кальция в сыворотке крови при рутинном клиническом биохимическом исследовании обычно является ключевой находкой, которая инициирует диагностическую работу, чтобы определить, является ли гиперкальциемия ПЩЖ-зависимой или независимой от неё [5].
Эпизоотические данные
Кошки болеют, как правило, в возрасте от среднего до старшего (8–15 лет). О породной предрасположенности кошек не сообщается; чаще всего поражаются домашние короткошёрстные кошки. У собак особенно часто болезнь встречается у кеесхондов [17; 18].
Клинические признаки и дифференциальная диагностика
Клинические признаки, как правило, неспецифичны, анорексия и вялость наиболее часто встречаются у кошек с ПГПТ. Рвота, полиурия, полидипсия и потеря веса также могут наблюдаться в запущенных случаях. У некоторых кошек встречаются мочевые камни, содержащие кальций [19]. В одном отчёте у 4/7 кошек пальпировалось образование в области шеи [20]. Маловероятно, что само по себе увеличение ПЩЖ приведёт к появлению пальпируемого образования в области шеи, так как эти образования довольно малы; однако кистоподобные структуры, связанные с массой ПЩЖ, часто пальпируются. Объёмные образования в шейной области необходимо дифференцировать от увеличения щитовидной железы, которое легче пропальпировать.
Идиопатическая гиперкальциемия, хроническая болезнь почек (ХБП) и новообразования являются наиболее распространёнными и важными диагнозами, которые в процессе дифдиагностики необходимо исключить; гипервитаминоз D и гипоадренокортицизм являются другими, гораздо менее распространёнными причинами паратиреоидно-независимой общей гиперкальциемии [4; 14]. Измерение концентрации паратгормон-родственного пептида (ПТГрП) может использоваться для диагностики гиперкальциемии при злокачественных новообразованиях [21].
Как ни странно, идиопатическая гиперкальциемия, по-видимому, является наиболее часто диагностируемой причиной гиперкальциемии (оценённой по измерению уровня общего кальция) у кошек в Северной Америке, хотя с 2000 года не публиковалось эпизоотологических исследований причин гиперкальциемии у кошек. ПГПТ изредка диагностировался как причина гиперкальциемии (оценённой по измерению уровня общего кальция) в одном учебном госпитале (4/71 кошек) [4], но гораздо чаще этот диагноз ставится ветеринарными эндокринными референтными лабораториями [6; 21].
Диагноз
Исследование биохимического профиля сыворотки и анализ мочи могут косвенно говорить о диагнозе ПГПТ. Из-за эффекта ПТГ, заключающегося в увеличении экскреции фосфора почками, уровень фосфора в сыворотке крови должен быть низкий или на нижней границе нормы. Однако в одном исследовании с участием 210 собак гипофосфатемия была выявлена только в 65% случаев [17]. Если отмечается гиперфосфатемия, диагноз ПГПТ маловероятен, и следует рассмотреть другие дифференциальные диагнозы (например, ХБП, интоксикация витамином D; см. таблицу 1). Гиперкальциемия у собак обычно вызывает полиурию из-за влияния кальция на реакцию почечных канальцев на антидиуретический гормон, при этом у многих собак моча становится гипостенурической. У кошек без ХБП в двух сообщениях была отмечена неожиданная сохранность способности концентрировать мочу на фоне гиперкальциемии [4; 14]. В одном исследовании, включавшем кошек с ХБП, средний удельный вес мочи составлял 1,032 (диапазон 1,012–1,06) [14].
ПГПТ характеризуется избыточной секрецией ПТГ одной или несколькими ПЩЖ, что приводит к гиперкальциемии к моменту постановки диагноза. Окончательный диагноз ПГПТ требует парного измерения концентрации ПТГ и iCa, чтобы выяснить, соответствует ли концентрация ПТГ степени кальциемии (с оценкой по уровню ионизированного кальция). Большинство кошек с ПГПТ имеют единичные аденомы ПЩЖ. У меньшего числа кошек диагностируют гиперплазию паращитовидной железы, карциному или цистаденому [18; 20]. Высокочастотное ультразвуковое исследование области щитовидной железы и ПЩЖ в значительной степени подтверждает диагноз ПГПТ при обнаружении одиночной увеличенной ПЩЖ [17].
Диагностика ПГПТ иногда может быть сложной (см. вставку).
Диагностические проблемы
Диагностика ПГПТ проста, когда уровни ПТГ и iCa превышают референтный интервал; однако диагноз часто ставится, когда концентрация ПТГ находится в пределах верхней половины референтного интервала, так как это считается недостаточной подавленностью на фоне гиперкальциемии (с оценкой по уровню ионизированного кальция). Тем не менее, в одном большом исследовании собак с гистологически подтверждённым ПГПТ у 45% собак концентрация ПТГ находилась в нижней трети референтного интервала [17]. Аналогичной информации о кошках не поступало. Таким образом, в то время как повышенная концентрация ПТГ подтверждает диагноз ПГПТ, даже низкая нормальная концентрация ПТГ не может окончательно исключить ПГПТ. Это особенно актуально при использовании доступных в настоящее время тестов для измерения концентрации ПТГ, которые относительно нечувствительны. Вполне возможно, что низкое значение ПТГ вовсе не является истинно низким для конкретной кошки, поскольку здоровые кошки часто имеют концентрации ПТГ ниже уровня обнаружения при использовании имеющихся в настоящее время тестов.
У кошки с персистирующей гиперкальциемией, связанной с ПГПТ, концентрация ПТГ повышалась в двух случаях, но была в пределах референтного интервала в пяти других случаях [6]. Сообщалось о циркадном ритме секреции ПТГ у собак [22; 23]; исследований на кошках не проводилось. Часто предполагалось, что гиперкальциемия сопровождается постоянно повышенной концентрацией кальция, но иногда сообщалось о широких колебаниях концентрации общего кальция у людей с ПГПТ [24].
Лечение
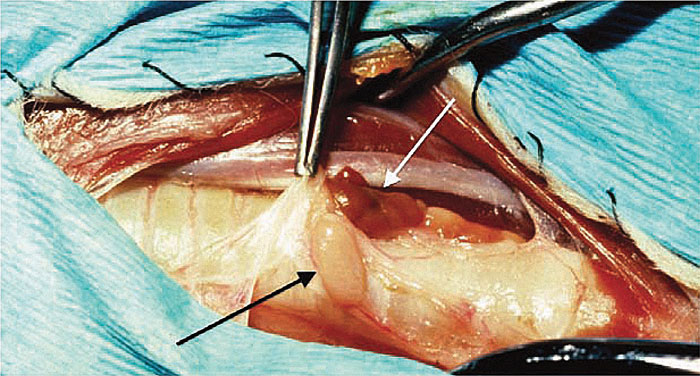
Чаще всего для окончательного лечения рекомендуется паратиреоидэктомия одной или нескольких ПЩЖ. Ультразвуковое исследование шеи позволяет определить расположение опухоли ПЩЖ и позволяет провести предоперационное планирование (илл. 3). При хирургическом исследовании шейного отдела у больных с аденомой или карциномой ПЩЖ обычно выявляют увеличение одной ПЩЖ; остальные три, как правило, малы или их невозможно идентифицировать, поскольку гиперкальциемия приводит к атрофии нормальной ткани паращитовидных желез (илл. 4). Первичная гиперплазия ПЩЖ может поражать более одной железы, и клинические признаки могут появляться вновь, если хирургическим путём удаляется только самая большая железа. Опухоли ПЩЖ трудно идентифицировать, если опухоль встроена в жировую ткань или возникает из внутренней ПЩЖ.
Паратиреоидэктомия аденомы или цистаденомы была связана с хорошим прогнозом долгосрочной выживаемости у подгруппы кошек в одном исследовании [20]. О чрескожной абляции этанолом под ультразвуковым контролем и чрескожной тепловой абляции под ультразвуковым контролем, проводимых для лечения ПГПТ у собак [25], в отношении кошек сообщений не было.
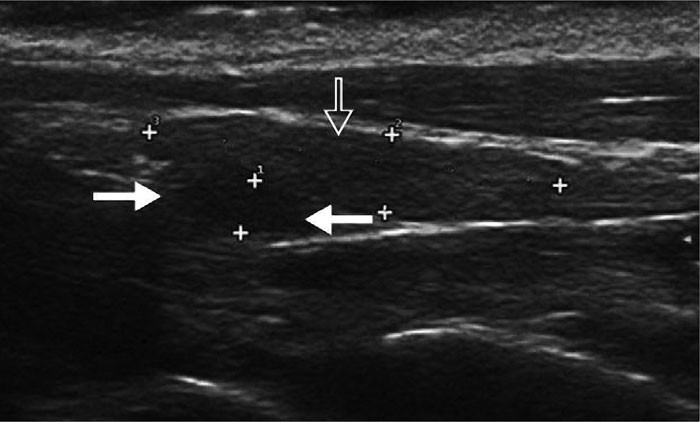
Илл. 3. Новообразование паращитовидной железы при ультразвуковом исследовании у 9-летней домашней среднешёрстной кастрированной кошки с гиперкальциемией и лёгким угнетением. Обратите внимание на гипоэхогенное образование (сплошные стрелки) под щитовидной железой (незакрашенная стрелка), которое представляет собой аномальную паращитовидную железу (ПЩЖ; высота 1,4 мм, длина 2,8 мм). Нормальная кошачья ПЩЖ слишком мала, чтобы её можно было увидеть даже с помощью высокочастотной ультразвуковой техники, доступной сегодня. После хирургического удаления и проведения гистопатологического исследования было подтверждено, что это образование является аденомой ПЩЖ. Предоставлено доктором John Mattoon, Washington State University College of Veterinary Medicine, USA
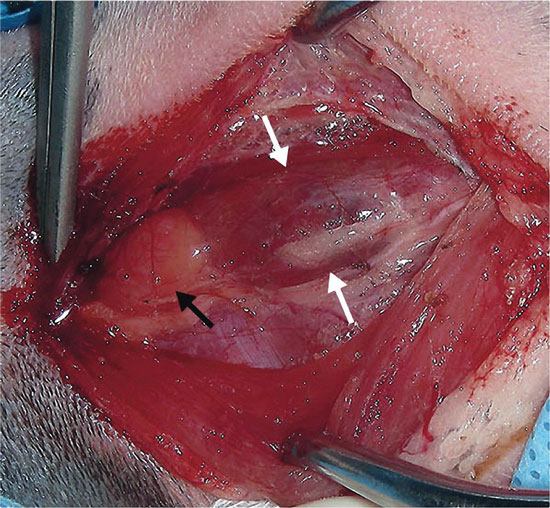
Вторичный гиперпаратиреоз
Алиментарный вторичный гиперпаратиреоз
Пищевой (алиментарный) вторичный гиперпаратиреоз (АВГПТ) может возникать как следствие нарушений соотношения в рационе кальция, фосфора и витамина D. В ветеринарии сообщается, что АВГПТ возникает, когда кошка потребляет диету с относительным или абсолютным дефицитом кальция (илл. 5). Относительная концентрация кальция зависит от концентрации фосфора в рационе, поскольку рационы с высоким содержанием фосфора будут иметь изменённое соотношение кальция и фосфора (Ca: P). Рекомендуется, чтобы подрастающие котята получали рацион с соотношением Ca: P примерно 1:1 [26].
Развитие АВГПТ чаще всего связывают с потреблением полностью мясных диет. Низкая концентрация кальция в мясе в сочетании с высокой концентрацией фосфора приводит к очень низкому соотношению Ca: P. Молодые животные подвергаются более высокому риску развития АВГПТ, учитывая повышенную потребность в кальции, необходимом для роста костей, в сочетании с их минимальными запасами кальция [13; 27].
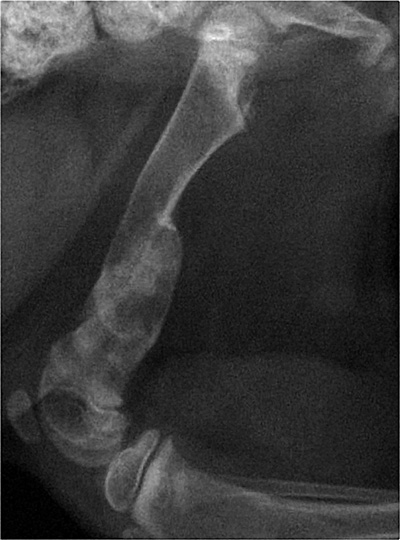
Клинические признаки
В сообщениях о котятах с АВГПТ клинические признаки чаще всего связаны с последствиями гипокальциемии и остеопении. Клинические признаки, связанные с гипокальциемией, включали тремор и судорожную активность. Часто поражаются длинные кости и позвонки, что приводит к болезненному передвижению, деформации конечностей или парезу. Переломы тел позвонков могут привести к серьёзным неврологическим нарушениям. Рентгенограммы могут выявить диффузную остеопению, костные деформации и переломы [13; 28].
Данные биохимического исследования крови
Отсутствует информация о минимальной базе данных, патогномоничных для АВГПТ. Уровни концентрации общего кальция и iCa могут быть как нормальными, так и сниженными. Они будут нормальными, если секреция ПТГ достаточно велика для коррекции гипокальциемии; при частичной коррекции может возникнуть гипокальциемия. Концентрация фосфора в сыворотке обычно нормальная или снижена. Поскольку молодые растущие животные часто имеют более высокие концентрации общего кальция и фосфора, чем взрослые животные, эти «нормальные» значения могут для них быть относительно ненормальными. Может отмечаться гипофосфатемия из-за снижения реабсорбции фосфора в почках и, следовательно, увеличения его экскреции. Повышенные концентрации щелочной фосфатазы часто наблюдаются из-за повышенного уровня костного изофермента, связанного с ростом [13; 28].
По определению, концентрация циркулирующего ПТГ повышается в ответ на гипокальциемию. Это вызывает хроническую резорбцию костей с выделением в кровь кальция и может привести к фиброзной остеодистрофии. В ряде случаев у кошек с АВГПТ было снижено содержание 25OHD и повышены концентрации кальцитриола. Это может быть связано с влиянием ПТГ на активацию 25OHD в кальцитриол или с изменениями активности 1α-гидроксилазы в почках, если уровень кальция в сыворотке имеет тенденцию к снижению [13].
Дифференциальный диагноз
В дифференциальную диагностику для АВГПТ включают почечный вторичный гиперпаратиреоз (ПВГПТ) (см. ниже), несовершенный остеогенез и рахит.
Несовершенный остеогенез — это генетическое заболевание, характеризующееся ломкостью костей, вызванное нарушением выработки коллагена. Хотя он редко описывается у животных, он был зарегистрирован у такс и котёнка [29–31]. У этих животных должны быть нормальные концентрации кальция, фосфора, витамина D и ПТГ в крови. Заболевание следует подозревать у молодых животных со спонтанными переломами, несмотря на получение полноценного и сбалансированного рациона. Также может наблюдаться аномальное развитие дентина, характеризующееся выраженным истончением слоя дентина, прозрачностью и изменением цвета на розовый [31].
Для рахита характерно нарушение минерализации костей у молодых животных из-за гиповитаминоза D. У людей алиментарный рахит определяется либо как дефицит витамина D, либо как диетический дефицит кальция. Основным признаком рахита, вызванного дефицитом витамина D, является снижение всасывания кальция в кишечнике из-за неадекватных концентраций кальцитриола на фоне нормального потребления кальция с пищей. Сравнение биохимических отклонений у людей: при рахите, вызванном дефицитом кальция, обычно наблюдаются более высокие концентрации 25OHD, чем у людей с дефицитом витамина D, также постоянно наблюдается повышение концентрации кальцитриола [32]. Рахит также был описан у животных с нормальным потреблением витамина D с пищей, но с избыточным потреблением кальция в раннем возрасте, что приводит к гиперкальциемии, вторичному гипопаратиреозу и снижению продукции кальцитриола [27].
Наследственный рахит, также известный как псевдо-D-дефицитный рахит, несколько отличается. Эта генетическая форма рахита подразделяется на два типа: витамин D-зависимый рахит I и II типов (VDDR-I и VDDR-II). VDDR-I возникает в результате дефицита 1α-гидроксилазы, фермента, ответственного за превращение 25OHD в кальцитриол. VDDR-II возникает в результате резистентности органов-мишеней к кальцитриолу, обычно из-за дефекта рецептора витамина D. VDDR-I был описан у котёнка [33]. VDDR-II был описан у померанского шпица [34]. Концентрация ПТГ была повышена в обоих случаях.
Лечение
Лечение ПВГПТ предполагает полноценное и сбалансированное питание. Животным с острыми признаками гипокальциемии можно кратковременно вводить добавки кальция парентерально или перорально. Может быть рекомендован покой с содержанием в клетке для снижения риска развития или разрушения переломов. Животным с переломами или другими болезненными деформациями костей может потребоваться обезболивание.
Прогноз на выздоровление в неосложнённых случаях (т. е. без серьёзных костных аномалий) благоприятный. Хотя точные сроки нормализации концентраций кальция, фосфора и паратгормона неизвестны, у одной кошки iCa вернулся к уровням референтного интервала при повторной проверке через 10 дней [28]. Как правило, авторы ожидают, что эти значения должны вернуться к норме в течение 2 недель. Пока кошка чувствует себя хорошо с клинической точки зрения, нет необходимости повторно проверять концентрацию PTH. Соответствующая минерализация костей может произойти в течение 4–8 недель после изменения диеты.
Для животных с переломами позвоночника или более серьёзными изменениями костей прогноз может быть неблагоприятным.
Почечный вторичный гиперпаратиреоз (ПВГПТ)
ПВГПТ представляет собой сложное заболевание, возникающее вторично по отношению к ХБП (илл. 6). Диагноз ставится на основании повышенной концентрации ПТГ у кошки с ХБП.
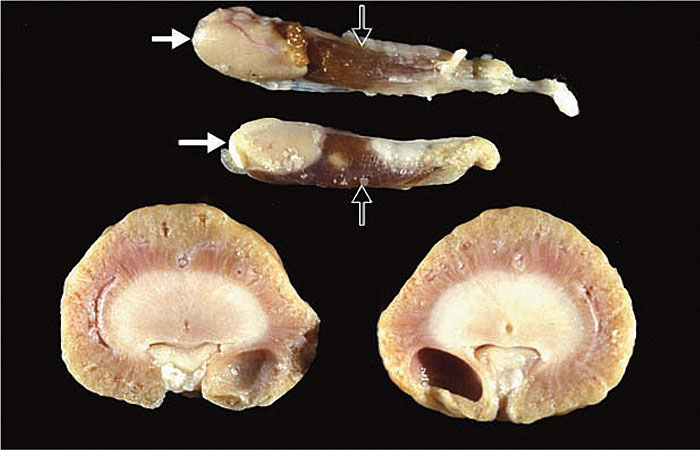
Открытые стрелки обозначают щитовидную железу. Увеличение концентрации ПТГ в основном связано с гиперплазией главных клеток, хотя вносит свой вклад и гипертрофия главных клеток.
Предоставлено доктором Larry Nagode, The Ohio State University College of Veterinary Medicine, USA
Развитие понимания патофизиологии
Первоначальная «гипотеза компромисса» для развития ПВГПТ считалась довольно простым процессом, начинающимся с начала развития ХБП. Прогрессирующая потеря функциональных нефронов приводит к увеличению содержания фосфора (за счёт снижения скорости клубочковой фильтрации) и снижению активации 25OHD в кальцитриол (за счёт снижения активности 1α-гидроксилазы), оба процесса вызывают снижение концентрации iCa. Гиперфосфатемия, гипокальциемия (с оценкой по уровню иони-зированного кальция) и снижение уровня кальцитриола приводят к секреции ПТГ. ПТГ признан уремическим токсином, который может способствовать развитию почечной остеодистрофии, угнетению функции костного мозга, анемии и прогрессированию ХБП у людей и собак [35; 36]; у кошек это специально не изучалось. Вполне вероятно, что повышенная секреция ПТГ у пациентов с ПВГПТ в первую очередь вызвана гиперплазией ПЩЖ, поскольку каждая клетка вносит свой вклад в секрецию ПТГ, которую невозможно подавить.
Диагноз ПВГПТ ставится на основании документирования повышенной концентрации ПТГ у животного с ХБП. Концентрации кальция и фосфора варьируют. Сообщается, что распространённость ПВГПТ у кошек достигает 84% [37]. Подобно тому, что было описано у собак [38], концентрации ПТГ могут повышаться на ранних стадиях ХБП у кошек [39; 40]. В одном исследовании концентрации ПТГ были выше у кошек без азотемии (креатинин <2 мг/дл; 176,8 ммоль/л), у которых впоследствии развилась азотемия в течение 12 месяцев, по сравнению с кошками, у которых не было азотемии. Было отмечено, что это увеличение концентрации ПТГ происходило до того, как были обнаружены изменения концентрации кальция или фосфора в плазме [39]. Однако в другом исследовании концентрации ПТГ существенно различались только между кошками из контрольной группы и кошками с ХБП 4-й стадии по классификации Международного общества изучения почек (IRIS) [41]. Подобно тому, что наблюдается в медицине человека, было показано, что концентрации ПТГ положительно коррелируют с возрастом у кошек без диагностированной ХБП [39].
Более свежие данные показали, что существуют и другие гормональные факторы, влияющие на отношения между метаболизмом кальция, фосфора и витамина D. Фактор роста фибробластов-23 (ФРФ-23) играет важную роль в регуляции обмена фосфора. Он был связан с прогрессированием ХБП, развитием ПВГПТ и более высокой смертностью у людей [42–44]. Стимулируемый гиперфосфатемией и повышенными концентрациями кальцитриола, ФРФ-23 представляет собой фосфатонин, синтезируемый и секретируемый остеобластами и остеоцитами, который способствует выведению фосфора почками. Влияние ФРФ-23 на развитие ПВГПТ сложно. В то время как на ранних стадиях ХБП ФРФ-23 непосредственно снижает синтез ПТГ, он также подавляет 1 -гидроксилазу, что приводит к снижению концентрации кальцитриола и дополнительно способствует отсутствию ингибирования транскрипции и секреции ПТГ. Неясно, способствуют ли повышенные концентрации ФРФ-23 развитию ПВГПТ, или повышенные концентрации ФРФ-23 не могут ингибировать секрецию ПТГ из-за отсутствия экспрессии ПЩЖ белка Клото.
Было показано, что белок Клото, который существует как в мембраносвязанной, так и в растворимой формах, влияет на прогрессирование ХБП и развитие ПВГПТ у людей [45]. Экспрессируемый в почках и ПЩЖ мембраносвязанный Клото является корецептором, необходимым для активности ФРФ-23. Растворимый Клото влияет на гомеостаз кальция путём подавления 1 -гидроксилазы в почках. Он также играет роль в синтезе ПТГ в ПЩЖ. Экспрессия Клото снижена в почках пациентов с ХБП. Таким образом, хотя секреция ФРФ-23 повышена при ХБП, существует резистентность органов-мишеней к ФРФ-23 из-за дефицита кофактора Клото. В результате последующего подавления рецепторного комплекса Клото/ФРФ-23 в ПЩЖ концентрации ПТГ увеличиваются. У людей Клото изучался как ранний биомаркер при ХБП и ПВГПТ, поскольку он был идентифицирован как независимый фактор риска прогрессирования ХБП [45]. В настоящее время нет ветеринарных исследований, в которых оценивался бы Клото.
Концентрации ФРФ-23 измеряли у здоровых кошек без азотемии и кошек с ХБП. В одном исследовании наблюдали за гериатрическими кошками без азотемии в течение 12 месяцев, исходные концентрации ФРФ-23 были значительно повышены у кошек, у которых развилась азотемия (креатинин > 2 мг/дл; 176,8 ммоль/л), по сравнению с кошками, у которых не развилась азотемия. У этих кошек наблюдалась слабая положительная линейная зависимость между концентрациями ФРФ-23 и ПТГ и умеренная отрицательная экспоненциальная зависимость между ФРФ-23 и скоростью клубочковой фильтрации [46]. У кошек с ХБП концентрации ФРФ-23 значительно различались между группой здоровых кошек из контрольной группы и кошек с ХБП 2–4-й стадии IRIS. По мере увеличения стадии ХБП по IRIS концентрации ФРФ-23 увеличивались. Кроме того, на стадиях 2 и 3 по IRIS у кошек с гиперфосфатемией (концентрация фосфатов > 5 мг/дл; 1,6 ммоль/л) концентрация ФРФ-23 была выше, чем у кошек с нормофосфатемией (концентрация фосфатов <4,5 мг/дл; 1,5 ммоль/л). Концентрации фосфора в сыворотке были независимыми предикторами концентрации ФРФ-23 [41]. Сообщалось, что целевые концентрации циркулирующего фосфора в сыворотке крови ниже 4,5 мг/дл (1,5 ммоль/л) у собак с ХБП являются суррогатным показателем ПТГ, уровень которого не повышен [38].
Результаты лечения
Лечение ПВГПТ включает в себя контроль концентрации фосфора в сыворотке путём соблюдения диеты с пониженным содержанием фосфора и возможным введением пищевой добавки, связывающей фосфор. В одном исследовании увеличение выживаемости кошек с ХБП было частично связано с контролем гиперфосфатемии и снижением концентрации ПТГ [47]. Концентрация ФРФ-23 в плазме снижалась у кошек с ХБП, получавших диету с пониженным содержанием фосфора [48].
Кальцитриол также использовался в попытке снизить концентрацию ПТГ путём предотвращения или обращения вспять гиперплазии ПЩЖ и ингибирования транскрипции матричной РНК ПТГ [49]. Эффекты терапии кальцитриолом были неоднозначными. В двух исследованиях сообщалось об улучшении клинических признаков и выживаемости у собак и кошек, получавших кальцитриол [36; 50]. Другое исследование не показало снижения концентрации ПТГ у кошек, получавших кальцитриол; однако у этих кошек изначально не было явного увеличения концентрации ПТГ. Вариабельность тестов для определения концентрации ПТГ, использовавшихся в то время, также могла способствовать получению таких результатов [35].
Одним из потенциальных недостатков применения кальцитриола является риск гиперкальциемии, но этот риск минимален, когда кальцитриол используется в низких дозах (т. е. 2,5–3,5 нг/кг/день или 9 нг/кг/нед. два раза в неделю). При сопутствующей гиперфосфатемии возрастает риск минерализации мягких тканей [49]. Применение 22-оксакальцитриола, аналога кальцитриола с меньшей кальциемической активностью, было исследовано у собак с индуцированным ПВГПТ. Был сделан вывод, что это может быть применимым альтернативным лечением ПВГПТ [51; 52]. Этот аналог витамина D не исследовался на кошках.
Исторически измерения концентрации кальцитриола считались более значимыми в диагностике и лечении ПВГПТ по сравнению с измерением концентрации 25OHD. Учитывая период полувыведения, 25OHD является лучшим маркером системного статуса витамина D, чем кальцитриол, период полувыведения которого составляет 4–6 часов. Циркулирующие концентрации 25OHD могут иметь большее значение, чем считалось ранее. Пониженные концентрации 25OHD часто обнаруживаются у людей с ХБП, и было показано, что 25OHD независимо связан с прогрессированием заболевания и смертностью от ХБП [53]. Собаки с ХБП также имеют низкие концентрации циркулирующего 25OHD [54]. Раньше это могло быть связано с низким потреблением витамина D с пищей или снижением абсорбции витамина D. В настоящее время известно, что низкий уровень циркулирующего 25OHD может быть результатом ХБП, поскольку отфильтрованный 25OHD и белок, связывающий витамин D, неадекватно реабсорбируются проксимальными канальцами, так что меньше 25OHD возвращается в кровоток. Понимание, что низкая концентрация 25OHD у кошки с ХБП может быть результатом комбинации пищевых или почечных факторов, основано на наблюдениях за людьми и собаками с ХБП [49].
Поскольку концентрации 25OHD часто снижаются у людей с ХБП, часто рекомендуют вводить исходную добавку витамина D (например, эргокальциферол, холекальциферол) перед терапией активированным витамином D (например, кальцитриолом) [55]. Существуют видовые различия в способности метаболизировать различные источники витамина D; кошки используют эргокальциферол (витамин D2) с эффективностью 70% по сравнению с холекальциферолом (витамин D3) [56]. Можно попытаться провести дополнительную медикаментозную терапию с использованием кальцимиметиков, которые ингибируют секрецию ПТГ путём модулирования рецептора, чувствительного к кальцию, в ПЩЖ. Имеются некоторые данные, позволяющие предположить, что это может быть эффективным для снижения уровня кальция у людей с третичным гиперпаратиреозом (ТГПТ) [57]. Опубликованных данных об опыте применения кальцимиметиков у кошек нет.
Необходимы дополнительные исследования для дальнейшего выяснения взаимосвязи между концентрациями iCa, фосфора, метаболита витамина D, ФРФ-23 и Клото, чтобы определить, существует ли лучший способ диагностики и лечения ПВГПТ на самых ранних стадиях ХБП у кошек.
Гипертиреоз и гиперпаратиреоз
Была установлена связь между гипертиреозом и гиперпаратиреозом: 57–77% кошек с гипертиреозом имеют сопутствующий гиперпаратиреоз (илл. 7) [16; 58]. Концентрации общего кальция и iCa у этих кошек изменялись по-разному, но, как правило, либо оставались нормальными, либо слегка снижались. Чаще наблюдается гиперфосфатемия. Эти результаты, скорее всего, связаны с влиянием гормонов щитовидной железы на метаболизм костной ткани и почечную экскрецию. Гипокальциемия и/или гиперфосфатемия вызывают компенсаторное увеличение секреции ПТГ.
В одном исследовании кошек с гипертиреозом концентрация ПТГ сильно варьировала: от нормы до 19-кратного превышения верхнего предела референтного интервала [58]. Хотя эти кошки имели концентрации креатинина в пределах референтного интервала, возможно, что ПВГПТ может способствовать гиперпаратиреозу, связанному с гипертиреозом, поскольку концентрация ПТГ может увеличиваться до появления азотемии [16; 39]. В одном исследовании лечение гипертиреоза привело к увеличению концентрации кальция, снижению концентрации фосфора и возвращению концентрации ПТГ к норме у кошек без азотемии [16].
Третичный гиперпаратиреоз
ТГПТ развивается как следствие длительного ПВГПТ и характеризуется повышенным уровнем ПТГ и гиперкальциемией. При этом синдроме ПЩЖ действуют почти автономно, подобно тому, что наблюдается при ПГПТ. Возникает вопрос, как отличить ПВГПТ от ТГПТ. Одно из различий между этими двумя синдромами заключается в том, что в то время как уровень кальция в сыворотке крови при ПВГПТ обычно нормальный или низкий, при ТГПТ будет наблюдаться гиперкальциемия. Предполагается, что ТГПТ возникает из-за моноклональной экспансии клеток паращитовидной железы, которые имеют изменённую установку их рецепторов, чувствительных к кальцию, вероятно, в результате подавления экспрессии рецептора витамина D и рецептора, чувствительного к кальцию, в ПЩЖ по мере прогрессирования ХБП (вторично по отношению к динамике снижения уровня кальцитриола).
Долгосрочный анамнез ХБП, который показывает, что уровень кальция в сыворотке в течение некоторого времени был нормальным, прежде чем он стал повышенным, помогает в диагностике ТГПТ. Существенно, что увеличение кальция связано с гиперкальциемией с оценкой по уровню ионизированного кальция; концентрация общего кальция может повышаться у кошек с ХБП в то время, когда концентрация iCa не увеличивается, вероятно, это вызвано увеличением количества циркулирующих комплексов, связывающих кальций [59].
ТГПТ был описан у людей, в основном с тяжёлой ХБП или после трансплантации почки. Это слабо описанное явление, и о нём никогда не сообщалось у кошек. Лечение у людей может быть различным. Цинакальцет — кальцимиметик, усиливающий регуляцию рецептора, чувствительного к кальцию, в некоторых случаях был эффективен для снижения концентрации ПТГ, кальция и фосфора в сыворотке [60]; при этом люди с сильно увеличенными ПЩЖ могут быть менее чувствительными [61]. При длительной персистирующей гиперкальциемии может быть рекомендовано хирургическое лечение для уменьшения количества функциональных клеток паращитовидной железы, хотя также может быть эффективной высокодозовая пульс-терапия активированными метаболитами витамина D (например, кальцитриолом) для усиления экспрессии рецепторов витамина D и рецепторов, чувствительных к кальцию. Сообщалось, что пульс-протоколы с высокими дозами кальцитриола были эффективны для снижения концентрации iCa при подавлении синтеза ПТГ, предположительно из-за активизации рецептора витамина D в ПЩЖ [57].
Примеры клинических случаев
Ниже описаны три случая с некоторыми лабораторными показателями. Пожалуйста, ознакомьтесь с ними, прежде чем переходить к следующей странице с интерпретацией случаев авторами.
Случай 1
12-летняя кастрированная домашняя короткошёрстная кошка поступила на приём по поводу вялости и лёгкой потери веса.
Лабораторные показатели: случай 1
| Тест | Результат | Референтный интервал |
| Кальций общий | 13,1 (3,3) | 8,5–10,5 мг/дл (2,1–2,6 ммоль/л) |
| Фосфор | 3,2 (1) | 2,5–6 мг/дл (0,8–1,9 ммоль/л) |
| Азот мочевины крови | 20 (7,1) | 14–36 мг/дл (5–12,9 ммоль/л) |
| Креатинин | 1,3 (114,9) | 0,8–1,8 мг/дл (70,7–159,1 мкмоль/л) |
| Кальций ионизированный |
6,8 (1,7) | 4,8–5,6 мг/дл (1,2–1,4 ммоль/л) |
| Паратгормон | 8 | 0–4 пмоль/л |
| 25OHD | 40 | 26–68 нг/мл |
Увеличение концентрации общего кальция в сыворотке у этой кошки также связано с гиперкальциемией с оценкой по уровню ионизированного кальция. Связь гиперкальциемии с оценкой по уровню ионизированного кальция и уровня фосфора в сыворотке крови в диапазоне очень низких — нормальных значений обусловлена действием ПТГ или паратгормонподобного пептида (ПТГрП). Поскольку кошка не больна тяжело, маловероятно, что гиперкальциемия и низкий уровень фосфора вызваны злокачественными новообразованиями. Концентрация ПТГ выше референтного интервала (в 2 раза выше верхнего предела) при высоком уровне ионизированного кальция определяет паратиреоидзависимую гиперкальциемию. Единичная аденома ПЩЖ была удалена во время операции.
Случай 2
8-летний кастрированный сиамский кот поступил на приём по поводу прогрессирующей потери аппетита и потери веса с периодической рвотой в течение предыдущих 3 месяцев.
Лабораторные показатели: случай 2
| Тест | Результат* |
| Кальций общий | 9,4 (2,4) |
| Фосфор | 6,3 (2) |
| Азот мочевины крови | 45 (16,1) |
| Креатинин | 2,7 (238,7) |
| Кальций ионизированный | 4 (1) |
| Паратгормон | 24 |
| 25OHD | 20 |
| Удельный вес мочи | 1,018, неактивный осадок |
* См. случай 1 для оценки референтных интервалов и единиц измерения.
Диагноз кота — ХБП был поставлен на основании анамнеза и повышенного содержания азота мочевины в крови (АМК), креатинина и фосфора в сочетании с удельным весом мочи 1,018 и неактивным мочевым осадком. Концентрация общего кальция сыворотки находится в пределах референтного интервала, но уровень ионизированного кальция у кота в то же время низкий, как это часто бывает у кошек с ХБП. Концентрация ПТГ в 6 раз превышает верхний предел референтного интервала, а концентрация 25OHD ниже нижнего референтного интервала. Высокий уровень ПТГ ожидается у кошек с ХБП, имеющих высокий уровень фосфора в сыворотке, как в данном случае. Возврат уровня циркулирующего фосфора в пределы референтного интервала, предпочтительно к значениям 3–4 мг/дл (1–1,3 ммоль/л), вероятно, снизит концентрацию ПТГ, но не гарантирует, что концентрация ПТГ будет в пределах референтного интервала; следовательно, необходимо снова измерить концентрацию ПТГ, когда концентрация сывороточного фосфора будет снижена, чтобы установить, имеет ли ещё место ПВГПТ или нет. Обнаружение низкого уровня 25OHD соответствует как диагнозу «алиментарный вторичный» (снижение поступления или всасывания), так и диагнозу «почечный вторичный» (снижение поступления 25OHD из канальцевой жидкости) гиперпаратиреоз.
Случай 3
4-месячная домашняя короткошёрстная кошка поступила на приём по поводу вокализации и нежелания двигаться. Физикальное обследование выявило генерализованную боль в длинных костях и подозрение на перелом по крайней мере одной большеберцовой кости. Рентгенограммы подтверждают выраженное снижение плотности кортикальной зоны кости и складчатые переломы левой большеберцовой кости. Диетический анамнез показывает, что кошка ест в основном мясо, которым хозяева кормят со стола.
Лабораторные показатели: случай 3
| Тест | Результат* |
| Кальций общий | 7,8 (2) |
| Фосфор | 2,2 (0,7) |
| Азот мочевины крови | 18 (6,4) |
| Креатинин | 1,1 (97,2) |
| Кальций ионизированный | 4,4 (1,1) |
| Паратгормон | 30 |
| 25OHD | 20 |
* См. случай 1 для оценки референтных интервалов и единиц измерения.
Сочетание низкого уровня кальция, фосфора и 25OHD в сыворотке подтверждает диагноз АВГПТ у этой кошки, потребляющей классическую диету, способную вызвать это состояние. Нормальный уровень мочевины и уровень креатинина в сыворотке исключают диагноз ПВГПТ.
Ключевые моменты
- Образцы сыворотки или плазмы для измерения концентрации ПТГ должны быть заморожены вскоре после сбора и отправлены в замороженном виде, чтобы предотвратить разложение ПТГ. Образцы, поступающие в лабораторию слишком тёплыми, не подходят для анализа. Температура образца по прибытии в лабораторию должна быть отмечена в форме отчёта.
- Тесты третьего поколения для измерения концентрации ПТГ, которые обнаруживают «цельный» ПТГ, рекомендуются для использования у кошек, поскольку они обладают большей аффинностью к кошачьему ПТГ.
- Концентрацию ПТГ всегда следует интерпретировать вместе с концентрацией ионизированного кальция в одном и том же образце крови, чтобы определить адекватность концентрации ПТГ.
- Высокие концентрации ПТГ часто встречаются у кошек с ХБП (даже на стадии 1 IRIS) и могут быть связаны с неблагоприятным исходом. Необходимо измерять концентрацию самого ПТГ, поскольку другие параметры, такие как сывороточный фосфор, не могут точно предсказать, повышен ли уровень ПТГ у кошек с ХБП.
- Высокие концентрации ПТГ обычно встречаются у кошек с алиментарным вторичным гиперпаратиреозом и первичным гиперпаратиреозом (ПГПТ). У некоторых кошек с ПГПТ будет документально подтверждено, что концентрации ПТГ находятся в пределах референтного интервала.
- Разработка теста на ПТГ с использованием антител, направленных против аминокислотной последовательности, специфичной для кошачьего ПТГ, вероятно, приведёт к повышению способности обнаруживать изменения концентрации циркулирующего ПТГ с большей чувствительностью на ранних стадиях болезненных процессов, влияющих на метаболизм кальция и фосфора.
Конфликт интересов
Авторы не имеют конфликта интересов, о котором требуется заявить.
Финансирование
Авторы не получали специального гранта от какого-либо финансирующего агентства в государственном, коммерческом или некоммерческом секторах для подготовки этой статьи.
Литература
- Krook L. Spontaneous hyperparathyroidism in the dog; a pathological-anatomical study. Acta Pathol Microbiol Scand Suppl 1957; 122: 1–88.
- Pineda C, Aguilera-Tejero E, Raya AI, et al. Feline parathyroid hormone: validation of hormonal assays and dynamics of secretion. Domest Anim Endocrinol 2012; 42: 256–264.
- Malberti F, Farina M, Imbasciati E. The PTH-calcium curve and the set point of calcium in primary and secondary hyperparathyroidism. Nephrol Dial Transplant 1999; 14: 2398–2406.
- Savary K, Price GS, Vaden SL. Hypercalcemia in cats: a retrospective study of 71 cases (1991–1997). J Vet Intern Med 2000; 14: 184–189.
- Schenck PA, Chew DJ. Prediction of serum ionized calcium concentration by serum total calcium measurement in cats. Can J Vet Res 2010; 74: 209–213.
- Schenck PA, Chew DJ, Nagode LA, et al. Disorders of calcium: hypercalcemia and hypocalcemia. In: DiBartola SP (ed). Fluid, electrolyte, and acid-base disorders in small animal practice. 4th ed. St Louis, MO: WB Saunders, 2012, pp. 120–194.
- Couchman L, Taylor DR, Krastins B, et al. LC–MS candidate reference methods for the harmonisation of parathyroid hormone (PTH) measurement: a review of recent developments and future considerations. Clin Chem Lab Med 2014; 52: 1251–1263.
- D’Amour P. Circulating PTH molecular forms: what we know and what we don’t. Kidney Int Suppl 2006: S29–33.
- Berson SA, Yalow RS, Aurbach GD, et al. Immunoassay of bovine and human parathyroid hormone. Proc Natl Acad Sci USA 1963; 49: 613–617.
- Gao P, Scheibel S, D’Amour P, et al. Development of a novel immunoradiometric assay exclusively for biologically active whole parathyroid hormone 1–84: implications for improvement of accurate assessment of parathyroid function. J Bone Miner Res 2001; 16: 605–614.
- Toribio RE, Kohn CW, Chew DJ, et al. Comparison of serum parathyroid hormone and ionized calcium and magnesium concentrations and fractional urinary clearance of calcium and phosphorus in healthy horses and horses with enterocolitis. Am J Vet Res 2001; 62: 938–947.
- Barber PJ, Elliott J, Torrance AG. Measurement of feline intact parathyroid hormone: assay validation and sample handling studies. J Small Anim Pract 1993; 34: 614–620.
- Tomsa K, Glaus T, Hauser B, et al. Nutritional secondary hyperparathyroidism in six cats. J Small Anim Pract 1999; 40: 533–539.
- Midkiff AM, Chew DJ, Randolph JF, et al. Idiopathic hypercalcemia in cats. J Vet Intern Med 2000; 14: 619–626.
- Toribio RE, Kohn CW, Chew DJ, et al. Cloning and sequence analysis of the complementary DNA for feline preproparathyroid hormone. Am J Vet Res 2002; 63: 194–197.
- Williams TL, Elliott J, Syme HM. Calcium and phosphate homeostasis in hyperthyroid cats: associations with development of azotaemia and survival time. J Small Anim Pract 2012; 53: 561–571.
- Feldman EC, Hoar B, Pollard R, et al. Pretreatment clinical and laboratory findings in dogs with primary hyperparathyroidism: 210 cases (1987–2004). J Am Vet Med Assoc 2005; 227: 756–761.
- Bonczynski J. Primary hyperparathyroidism in dogs and cats. Clin Tech Small Anim Pract 2007; 22: 70–74.
- Marquez GA, Klausner JS, Osborne CA. Calcium oxalate urolithiasis in a cat with a functional parathyroid adenocarcinoma. J Am Vet Med Assoc 1995; 206: 817–819.
- Kallet AJ, Richter KP, Feldman EC, et al. Primary hyperparathyroidism in cats: seven cases. J Am Vet Med Assoc 1991; 199: 1767–1771.
- Bolliger AP, Graham PA, Richard V, et al. Detection of parathyroid hormone-related protein in cats with humoral hypercalcemia of malignancy. Vet Clin Pathol 2002; 31: 3–8.
- Domingo V, Lopez I, Mendoza FJ, et al. Circadian variation of the Ca2+–PTH curve during hypercalcaemia in dogs. J Vet Med A Physiol Pathol Clin Med 2007; 54: 545–548.
- Lopez I, Aguilera-Tejero E, Estepa JC, et al. Diurnal variations in the plasma concentration of parathyroid hormone in dogs. Vet Rec 2005; 157: 344–347.
- Wood GM, Sidhu B, Saunders WA, et al. Disappearing hypercalcaemia. Postgrad Med J 1987; 63: 741–744.
- Rasor L, Pollard R, Feldman EC. Retrospective evaluation of three treatment methods for primary hyperparathyroidism in dogs. J Am Anim Hosp Assoc 2007; 43: 70–77.
- National Research Council Ad Hoc Committee on Dog and Cat Nutrition. Minerals. In: Nutrient requirements of dogs and cats. Washington DC: National Academies Press, 2006, pp. 145–192.
- Towell TL. Nutrition-related skeletal disorders. In: Ettinger S, Feldman EC (ed). Textbook of veterinary internal medicine. 7th ed. St Louis, MO: Elsevier, 2010; 668–672.
- Dimopoulou M, Kirpensteijn J, Nielsen DH, et al. Nutritional secondary hyperparathyroidism in two cats: evaluation of bone mineral density with dual-energy X-ray absorptiometry and computed tomography. Vet Comp Orthop Traumatol 2010; 23: 56–61.
- Seeliger F, Leeb T, Peters M, et al. Osteogenesis imperfecta in two litters of dachshunds. Vet Pathol 2003; 40: 530–539.
- Eckardt J, Kluth S, Dierks C, et al. Population screening for the mutation associated with osteogenesis imperfecta in dachshunds. Vet Rec 2013; 172: 364.
- Evason MD, Taylor SM, Bebchuk TN. Suspect osteogenesis imperfecta in a male kitten. Can Vet J 2007; 48: 296–298.
- Glorieux FH, Pettifor JM. Vitamin D/dietary calcium deficiency rickets and pseudo-vitamin D deficiency rickets. Bonekey Rep 2014; 3: 524.
- Geisen V, Weber K, Hartmann K. Vitamin D-dependent hereditary rickets type I in a cat. J Vet Intern Med 2009; 23: 196–199.
- LeVine DN, Zhou Y, Ghiloni RJ, et al. Hereditary 1,25-dihydroxyvitamin D-resistant rickets in a Pomeranian dog caused by a novel mutation in the vitamin D receptor gene. J Vet Intern Med 2009; 23: 1278–1283.
- Hostutler RA, DiBartola SP, Chew DJ, et al. Comparison of the effects of daily and intermittent-dose calcitriol on serum parathyroid hormone and ionized calcium concentrations in normal cats and cats with chronic renal failure. J Vet Intern Med 2006; 20: 1307–1313.
- Nagode LA, Chew DJ, Podell M. Benefits of calcitriol therapy and serum phosphorus control in dogs and cats with chronic renal failure. Both are essential to prevent or suppress toxic hyperparathyroidism. Vet Clin North Am Small Anim Pract 1996; 26: 1293–1330.
- Barber PJ, Elliott J. Feline chronic renal failure: calcium homeostasis in 80 cases diagnosed between 1992 and 1995. J Small Anim Pract 1998; 39: 108–116.
- Cortadellas O, Fernandez del Palacio MJ, Talavera J, et al. Calcium and phosphorus homeostasis in dogs with spontaneous chronic kidney disease at different stages of severity. J Vet Intern Med 2010; 24: 73–79.
- Finch NC, Syme HM, Elliott J. Parathyroid hormone concentration in geriatric cats with various degrees of renal function. J Am Vet Med Assoc 2012; 241: 1326–1335.
- Giovaninni LH. Serum intact parathyroid hormone evaluation in cats with chronic kidney disease. Pesq Vet Bras 2013; 33: 229–235.
- Geddes RF, Finch NC, Elliott J, et al. Fibroblast growth factor 23 in feline chronic kidney disease. J Vet Intern Med 2013; 27: 234–241.
- Juppner H. Phosphate and ФРФ-23. Kidney Int Suppl 2011; 79 Suppl 121: S24–S27.
- Kuro OM. Phosphate and Klotho. Kidney Int Suppl 2011; 79 Suppl 121: S20–S23.
- Shaikh A, Berndt T, Kumar R. Regulation of phosphate homeostasis by the phosphatonins and other novel mediators. Pediatr Nephrol 2008; 23: 1203–1210.
- Hu MC, Kuro-o M, Moe OW. Klotho and chronic kidney disease. Contrib Nephrol 2013; 180: 47–63.
- Finch NC, Geddes RF, Syme HM, et al. Fibroblast growth factor 23 (ФРФ-23) concentrations in cats with early nonazotemic chronic kidney disease (CKD) and in healthy geriatric cats. J Vet Intern Med 2013; 27: 227–233.
- Elliott J, Rawlings JM, Markwell PJ, et al. Survival of cats with naturally occurring chronic renal failure: effect of dietary management. J Small Anim Pract 2000; 41: 235–242.
- Geddes RF, Elliott J, Syme HM. The effect of feeding a renal diet on plasma fibroblast growth factor 23 concentrations in cats with stable azotemic chronic kidney disease. J Vet Intern Med 2013; 27: 1354–1361.
- de Brito Galvao JF, Nagode LA, Schenck PA, et al. Calcitriol, calcidiol, parathyroid hormone, and fibroblast growth factor-23 interactions in chronic kidney disease. J Vet Emerg Crit Care 2013; 23: 134–162.
- Polzin D, Ross SJ, Osborne CA, et al. Clinical benefits of calcitriol in canine chronic kidney disease [abstract]. J Vet Intern Med 2005; 19: 433.
- Monier-Faugere MC, Geng Z, Friedler RM, et al. 22-Oxacalcitriol suppresses secondary hyperparathyroidism without inducing low bone turnover in dogs with renal failure. Kidney Int 1999; 55: 821–832.
- Takahashi F, Furuichi T, Yorozu K, et al. Effects of i. v. and oral 1,25-dihydroxy-22-oxavitamin D(3) on secondary hyperparathyroidism in dogs with chronic renal failure. Nephrol Dial Transplant 2002; 17 Suppl 10: 46–52.
- Kim SM, Choi HJ, Lee JP, et al. Prevalence of vitamin D deficiency and effects of supplementation with cholecalciferol in patients with chronic kidney disease. J Ren Nutr 2014; 24: 20–25.
- Galler A, Tran JL, Krammer-Lukas S, et al. Blood vitamin levels in dogs with chronic kidney disease. Vet J 2012; 192: 226–231.
- Foundation NK. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification and stratification. Am J Kidney Dis 2002; 39: S1–S266.
- Morris JG. Cats discriminate between cholecalciferol and ergocalciferol. J Anim Phys Anim Nutr 2002; 86: 229–238.
- Jamal SA, Miller PD. Secondary and tertiary hyperparathyroidism. J Clin Densitom 2013; 16: 64–68.
- Barber PJ, Elliott J. Study of calcium homeostasis in feline hyperthyroidism. J Small Anim Pract 1996; 37: 575–582.
- Schenck PA, Chew DJ. Determination of calcium fractionation in dogs with chronic renal failure. Am J Vet Res 2003; 64: 1181–1184.
- Jean G, Vanel T, Terrat JC, et al. [Treatment of secondary hyperparathyroidism resistant to conventional therapy and tertiary hyperparathyroidism with Cinacalcet: an efficiency strategy] (article in French). Nephrol Ther 2010; 6: 105–110.
- Okada M, Tominaga Y, Izumi K, et al. Tertiary hyperparathyroidism resistant to cinacalcet treatment. Ther Apher Dial 2011; 15: 33–37.
Источник: Journal of Feline Medicine and Surgery (2015) 17, 427–439. Free access.
СВМ № 5/2023




