Jan-Niklas Mehl1*, Matthias Lupke1, Ann-Cathrin Brenner1, Peter Dziallas2, Patrick Wefstaedt2 and Hermann Seifert1
1 Institute for General Radiology and Medical Physics, University of Veterinary Medicine Hannover, Foundation, Bischofsholer Damm 15, 30173 Hannover, Germany.
2 Small Animal Clinic, University of Veterinary Medicine Hannover, Foundation, Bunteweg 9, 30559 Hannover, Germany.
* Correspondence: jan.mehl@gmx.de
Актуальность исследования
В медицине мелких домашних животных нельзя недооценивать важность нефропатий собак. По данным исследований, частота встречаемости хронической болезни почек у собак (ХБП) доходит до 3,74% [1–4]. Прогрессирующее течение этого заболевания требует гибких схем лечения. Более того, для адекватного лечения рекомендуются периодические контрольные осмотры [5]. Чаще всего в клинической практике для оценки функции почек используют измерение эндогенного креатинина и мочевины в сыворотке крови. Но эти показатели недостаточно чувствительны для выявления субклинической или пограничной почечной недостаточности [6, 7], также они не подходят для оценки функции одной почки [8, 9]. Измерение скорости клубочковой фильтрации (СКФ) считается «золотым стандартом» теста для оценки функции почки [10], несмотря на это, данный диагностический инструмент редко используется в ветеринарной медицине из-за высокой стоимости и трудозатратности [6]. Также это может являться ценным скрининговым методом для раннего мониторинга почечной функции у пород собак, предрасположенных к нефропатиям [6].
Клиренс инулина принято считать «золотым стандартом» измерения СКФ. Однако это исследование можно выполнить только в сложных клинических условиях [11]. Креатинин [6, 7, 12, 13] и гадолиний-1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (Gd-DOTA) [8, 14] считаются надёжными маркерами для измерения СКФ у людей и крыс.
По данным многочисленных исследований, в гуманной медицине функциональная магнитно-резонансная томография (фМРТ) используется для определения скорости клубочковой фильтрации. Главным преимуществом является отсутствие ионизирующего излучения. Этим фактом нельзя пренебрегать, учитывая повторяющиеся оценки почечного статуса пациента.
Тем не менее МР-томографы до сих пор не получили широкого распространения в ветеринарных клиниках, а также следует упомянуть о высокой стоимости подобных обследований [15]. Кроме того, ограничению исследования почек у собак и других животных с помощью фМРТ способствует отсутствие единого мнения относительно количественной оценки контрастного вещества в зависимости от интенсивности сигнала (ИС), а также стандартизированного протокола обследования и анализа полученных данных [16].
Также нет консенсуса по подходящей модели для подсчёта скорости клубочковой фильтрации [17, 18]. В предыдущих исследованиях были введены или доработаны различные модели для измерения СКФ, в том числе с различным количеством компартментов [18–23]. В данном исследовании СКФ рассчитывался с помощью модифицированного метода, основанного на дифференциации участка Ратленд-Патлака (Rutland-Patlak plot) (RPP). Эта модель была впервые использована Хакштейном и др. (Hackstein et al.) [19] для определения СКФ с помощью измерений на фМРТ и описывает графическое решение упрощённой двухкомпартментой модели [19]. Основное преимущество этой модели — её простота, поскольку это всего лишь двухкомпартментная модель и для вычисления СКФ не требуются другие физиологические параметры [21].
Данные фМРТ анализировались для того, чтобы ответить на следующие вопросы:
1) Возможно ли оценить функцию одной почки у собаки, используя отслеживание болюса на фМРТ?
2) Как влияют разные параметры оценки на подсчёт модифицированного RPP?
Методы
Собаки
В исследовании принимали участие 8 здоровых собак породы бигль (4 самца и 4 самки). Они содержались как экспериментальные животные в клинике для мелких животных при университете Фонда ветеринарной медицины Ганновера, Германия. Все процедуры были одобрены сотрудником отдела по охране животных университета Фонда ветеринарной медицины Ганновера и Государственного управления Нижней Саксонии по защите прав потребителей и безопасности пищевых продуктов, Ольденбург, Германия (TV-No. 33.9-42502-04-08/1600).
Возраст собак варьировал от 4 до 11 лет, со средним значением 8,5 года и стандартным отклонением 2,9 года. Масса тела (МТ) собак варьировала от 14 до 22 кг, средний вес — 17,5 кг, стандартное отклонение — 2,7 кг.
Измерение скорости клубочковой фильтрации по клиренсу экзогенно вводимого креатинина
Чтобы оценить состояние здоровья почек, у собак измеряли скорость клубочковой фильтрации с помощью определения модифицированного плазменного клиренса экзогенно введённого креатинина, в соответствии с тестом, который оценивался ранее [24, 25].
Этот метод считается достаточно простым и точным [6, 24, 25], чтобы надёжно выполняться в рутинной клинической практике без специальных сложных методов исследования [7, 12, 13].
Точно рассчитанное в зависимости от поверхности тела (ПТ) собаки количество 5%-го раствора креатинина (LABOKLIN GmbH & Co.KG, 97688 Бад-Киссинген, Германия) вводилось подкожно каждой собаке (2 г креатинина/м2 ПТ). ПТ вычислялась с помощью МТ.
ПТ [м2] = 0,1 × МТ[кг] 0,667
В соответствии с инструкцией к тесту, у каждой собаки были взяты четыре образца крови. Их отправили в стороннюю лабораторию (LABOKLIN GmbH & Co.KG), где они были проанализированы.
Последовательные разведения
Для того чтобы оценить измерения, полученные с помощью фМРТ in vivo, необходимо установить функциональную корреляцию между ИС и концентрацией контрастного вещества. Поэтому были сделаны последовательные разведения контрастного вещества. В 25 пробирок налили 0,9%-й раствор NaCl и контрастное вещество в концентрации от 0 до 80 ммоль/л. Все пробирки нагревались на водяной бане до 38°C, затем их помещали в МР-томограф и проводили исследование с теми же настройками, что и для фМРТ-обследования почек у собак (см. таблицу 1 — отслеживание болюса).
Все МР-исследования были выполнены на высокопольном томографе Philips Achieva 3 Tesla.
Из-за турбулентных потоков в воде все измерения считывались 4 раза с интервалами 14, 106 и 127 минут. Затем рассчитывалась средняя ИС различных концентраций контрастного вещества. Функциональная корреляция между ИС и концентрацией контрастного вещества вычислялась от 0 до 15 ммоль/л (ИС 0–1200) с использованием программного обеспечения Origin Pro® (OriginLab Corporation, Массачусетс, США). В качестве подходящей функции были выбраны полином третьей степени и возрастающая экспоненциальная функция.
МРТ-обследование собак
Для подготовки к анестезии и введения контрастного вещества для обследования почек у собак всем животным был установлен внутривенный катетер в подкожную вену (vena cephalica) или вену сафена (vena saphena). К внутривенному катетеру был присоединён Гейдельбергский удлинитель для инфузионных систем для ручной подачи контрастного вещества во время исследования. Анестезия всех собак начиналась с введения левометадона [0,2 мг/кг внутривенно (в/в)], диазепама (1 мл/10 кг в/в) и пропофола (4–6 мг/ в/в). После этого собак интубировали, и анестезия продолжалась с помощью газового наркоза (концентрация изофлурана в конце выдоха 1–1,2%).
Для проведения МР-исследования все собаки фиксировались в спинальном положении, использовалась катушка для тела. Предварительные настройки для последовательности импульсов фМРТ (отслеживание болюса) выбирались в соответствии с таблицей 1. Изображения последовательности импульсов создаются с помощью так называемой процедуры вычитания. Это означает, что ИС третьего изображения в последовательности берётся за референсное значение и вычитается из всех последующих изображений. Каждое фМРТ-исследование занимало около 15 минут.
Отслеживание болюса
Контрастное вещество (Дотарем (Dotarem) 0,5 ммоль/мл; Guerbet, 95943 Roissy CdG Cedex, Франция) вводилось болюсно в дозировке 0,1 ммоль/кг (0,2 мл/кг). Для введения всего объёма контрастного вещества сперва в Гейдельбергский удлинитель вводили 6 мл 0,9% NaCl. Затем вводили контрастное вещество, после удлинитель промывали 15 мл 0,9% NaCl.
Таблица 1. Параметры последовательности МР-импульсов
| Параметр | Отслеживание болюса | «Анатомическая» последовательность |
| Последовательность импульсов | Т1 – FFE = быстрое полевое эхо = последовательность градиентного эхо | T2W – TSE_HR = ускоренная спин-эхо |
| Время повторения (мс) | 4,2628 | 1510,694 |
| Время эхо (мс) | 1,281 | 100 |
| Угол наклона вектора | 40° | 90° |
| Размер вокселя (мм) | 1,74 × 1,74 × 45 | 0,73 × 0,73 × 5 |
| Время между
2 срезами (с) |
0,58 | |
| Толщина среза (мм) | 45 | 5 |
| Ориентация среза | Дорсальная | Поперечная/дорсальная |
Анализ изображений
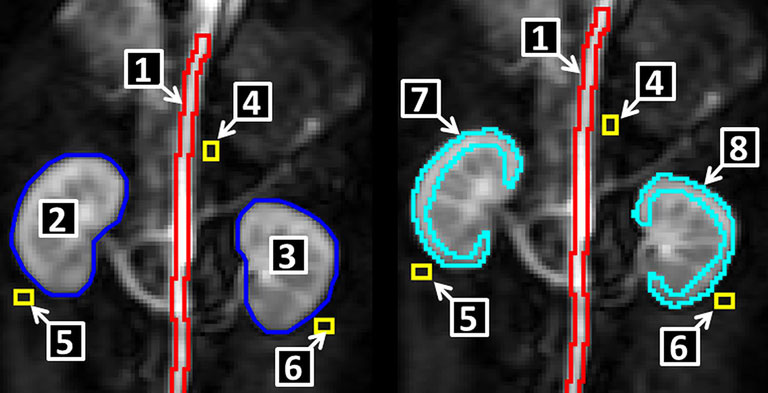
Для вычисления изменений ИС фМР-изображений последовательности импульсов загружались в программное обеспечение ImageJ®. После этого один раз для всех срезов вручную выделялись области интереса (region of interest) (ROI). Области интереса включали обе почки у собак и отдельно корковый слой почек. Затем ROI выделялась над аортой, представляющей собой сосудистое пространство. Все ROI определялись в границах тканей. Дополнительно были обрисованы небольшие прямоугольные ROI рядом с левой и правой почкой и аортой для установления поправочного коэффициента (рис. 1). Они были нужны для подсчёта концентрации контрастного вещества в органах.
Прежде всего мы сравнили прогрессию изменений ИС во всех областях интереса у всех собак. Средние значения изменения ИС измерялись вплоть до конца МР-исследования и заносились в Excel® (Microsoft Corporation).
Для перевода ИС от разных областей интереса в концентрацию контрастного вещества в ОИ использовалась функциональная корреляция последовательных разведений.
Толщина среза фМР-исследований была больше, чем объём соответствующих органов.
Поэтому для расчёта скорости клубочковой фильтрации может быть использована вся почка собаки, а не только небольшая часть почечной паренхимы. В дополнение к этому увеличенная толщина среза ведёт к улучшению соотношения сигнала к шуму.
Таким образом, в интенсивность вокселей в областях интереса вносят вклад как исследуемые органы, так и окружающие ткани.
Поэтому необходимо скорректировать дисторцию, вызванную окружающими тканями. Для вычисления объёма органов в ОИ были измерены диаметры аорты, почек и коркового слоя почек на Т2-взвешенных изображения (таблица 1). После этого объём окружающих тканей подсчитывался путём вычитания объёмов органов. Настоящую концентрацию Сткань в тканях можно вычислить с помощью следующей формулы:
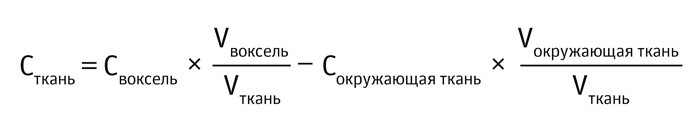
где Своксель — это концентрация контрастного вещества в целом вокселе, Vвоксель — это объём вокселя, Vткань — измеренный объём ткани в вокселе, Сокружающая ткань — концентрация контрастного вещества в окружающей ткани в вокселе и Vокружающая ткань — это объём окружающей ткани.
Для удаления артефактов, возникающих в основном из-за дыхательных движений пациента, использовался фильтр Савицкого-Голея [26]. Лучшие результаты были получены, когда фильтр накладывался на 15 изображений (8,7 с).
Для всех собак вычисляли и сравнивали изменение концентрации контрастного вещества во времени. Начальной точкой для интегрирования (t = 0°c) взято последнее изображение перед подъёмом ИС, вызванным появлением болюса контраста в ROIаорта, которое удалось измерить.
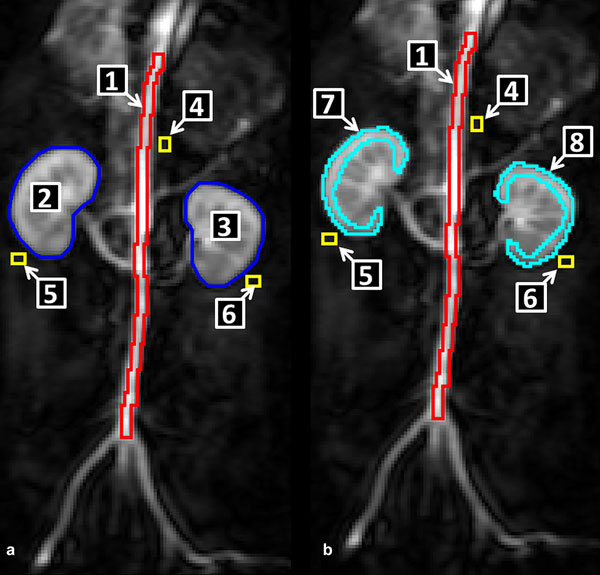 |
| Рис. 1. Локализация различных ROIs для анализа последовательности импульсов для отслеживания болюса. Цифры представляют: 1. ROIаорта (красный), 2. ROIправая почка (синий), 3. ROIлевая почка (синий), 4. ROIпоправочный коэфф. аорта (жёлтый), 5. ROIп. коэфф. правая почка (жёлтый), 6. ROIп. коэфф. левая почка (жёлтый), 7. ROIкорковый слой правой почки (голубой), 8. ROIкорковый слой левой почки (голубой). |
Метод, основанный на дифференциации участка Ратленд-Патлака
Для вычисления скорости клубочковой фильтрации в одной почке у собак применяли модифицированный метод, основанный на дифференциации участка Ратленд-Патлака (RPP), используя данные об изменении концентрации контрастного вещества в зависимости от времени в исследуемых органах, полученные ранее. Как сообщалось ранее [20], RPP необходимо модифицировать из-за отсроченного распространения контрастного вещества в сосудах почек по сравнению с аортой. Для удовлетворения всех требований RPP-модели [19], изменения концентраций в почках были смещены во времени (Δt). Таким образом, формула RPP была изменена на Δt. Окончательная формула RPP представляет собой уравнение для прямой линии. Значение y наносится на график напротив значения x, что позволяет графически вычислить изменения p×Vсосуды. Это позволяет подсчитать скорость клубочковой фильтрации в одной почке.
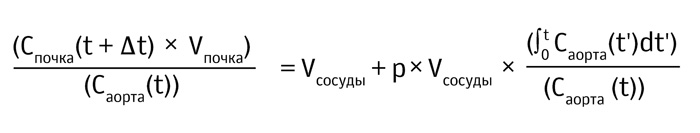
где Cпочка — концентрация контрастного вещества в почке, Vпочка — объём почки, а Саорта — концентрация в аорте. Vсосуды — объём сосудистого пространства, а p — константа пропорциональности.
Временной промежуток между первой максимальной концентрацией в ROIаорта и ROIпочка был принят за Δt.
Из-за гетерогенного распространения болюса контраста у разных собак начальной точкой для интегрирования выбирался момент времени, соответствующий второй максимальной концентрации, достигаемой в аорте. Временной интервал для всех RPP был 60 с. Начальная точка также обозначала первую пару x и y значений, которые отмечались на RPPs.
Для вычисления скорости клубочковой фильтрации в одной почке у собак градиент нужно умножить на 60 и поделить на площадь тела (ПТ) для того, чтобы получить результаты в мл/мин/м2 ПТ. Для подсчёта скорости клубочковой фильтрации плазмы результаты умножали на коэффициент [1 — гематокрит (Ht)]. Поскольку Ht не измерялся во время МР-исследования и все собаки рассматривались как клинически здоровые, в качестве среднего значения гематокрита было выбрано 0,47, в соответствии с исследованием Буржес-Абелла (Bourges-Abella), которая пыталась установить референсные значения для биглей, содержащихся в лабораторных условиях [27].
Дополнительно определялось влияние различных размеров ROIаорта на вычисление скорости клубочковой фильтрации. Как показано на рис. 2, в области аорты были выделены ещё два участка интереса для измерения влияния размера и локализации ROIs в сосудистом пространстве. Один прямоугольный участок интереса был обозначен над бифуркацией правой почечной артерии (ROIправая почечная а.) размером 3 × 5 вокселей; второй прямоугольный участок интереса (ROIнаибольшая ИС) такого же размера был выделен над точкой, в которой получалось измерить максимальное значение ИС. Для этих двух ROIs также высчитывался RPP.
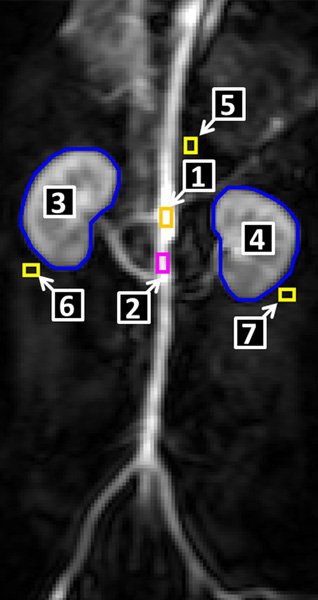 |
Рис. 2. Различные ROIs, выделенные над аортой для вычисления влияния расположения ROI. ROIнаибольшая ИС (1; оранжевый); ROIправая почечная а. (2; малиновый); ROIпочки (3, 4; синий); ROIп. коэфф. аорта (5; жёлтый); ROIп. коэфф. правая почка (6; жёлтый); ROIп. коэфф. левая почка (7; жёлтый) |
Статистический анализ
Для статистического анализа использовалось программное обеспечение Origin Pro® (OriginLab Corporation, Массачусетс, США). Различные RPPs сравнивались с помощью ящичковой диаграммы (box-plot). Дополнительно, для сравнения функции левой и правой почки у собак, проводили t-тест парных образцов.
Результаты
Контрольный метод
У собак все значения концентрации эндогенного креатинина сыворотки были в пределах референсных значений, так же, как и результаты вычисления «модифицированного клиренса креатинина плазмы». В итоге все 8 тестируемых животных можно признать здоровыми с точки зрения функции почек собак в соответствии с контрольным методом.
Последовательные разведения
Измеренные значения и средние значения всех четырёх измерений представлены на рис. 3. Результаты всех четырёх отдельных измерений представлены с помощью разных символов, а среднее значение — в виде сплошной линии. В начале ИС возрастает с повышением концентрации контрастного вещества, затем достигает максимального значения и вновь снижается. Как показано на рис. 3, корреляция ИС и концентрации контрастного вещества не линейная. Хотя интенсивность сигнала у трёх собак превышает 1200 на короткий промежуток времени, подходящая функция между ИС и концентрацией контрастного вещества вычислялась в этом диапазоне. Аппроксимация в этом промежутке показала лучшие значения для низких концентраций и достаточно хорошее приближение для высоких значений.
Лучшие результаты были найдены для возрастающей экспоненты и полинома третьей степени. Сравнение этих двух функций с помощью информационного критерия Акаике (ИКА) [28] показало, что возрастающая экспоненциальная функция была верна с большей вероятностью (в 4,8 раза). Соответствующая экспоненциальная кривая показана на рис. 4 и описывается следующим выражением:
СГадолиний [ммоль/л] = a + b × ex×S[a.u.],
где «СГадолиний» — концентрация Gd-DOTA, «a» = —1,933, «b» = 1,996, «x» = 0,001876, «S» — интенсивность сигнала (ИС).
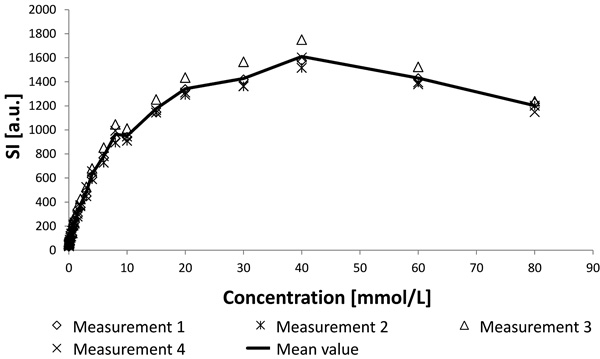 |
| Рис. 3. ИС, зависящая от концентрации (ммоль/л) контрастного вещества. После крутого подъёма при низких концентрациях кривая выходит на плато по достижению концентрации примерно 40 ммоль/л. При повышении концентрации может наблюдаться снижение ИС из-за Т2*-эффекта |
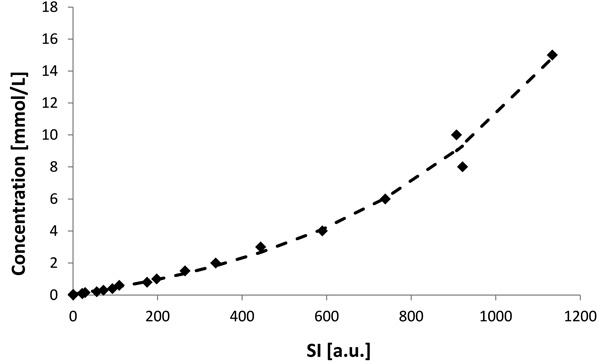 |
| Рис. 4. Соответствующая экспоненциальная кривая для концентрации контрастного вещества (ммоль/л) в зависимости от ИС от 0 до 15 (ммоль/л). Символы представляют средние значения, а пунктирная линия — подходящую кривую |
Анализ изображений
Распространение контраста во времени и пространстве можно чётко увидеть через всю последовательность изображений, полученную на настройках для отслеживания болюса, у каждой собаки. Для каждой области интересов можно однозначно измерить повышение и снижение ИС.
С помощью установленного уравнения все значения ИС можно перевести в определённую концентрацию для каждой области интереса. Как показано на рис. 5, сглаженная кривая на графике помогает определить и интерпретировать экстремальные значения концентрации контрастного вещества и кривую прогрессии. Каждый раз фильтр накладывался на 15 изображений.
После того, как были внесены корректировки, касающиеся окружающей ткани, кривая прогрессии осталась примерно той же формы у всех собак. Как показано на рис. 6, характерное распространение концентрации контрастного вещества в ROIаорта достигает первого максимального значения после первого возрастающего участка. После этого концентрация снижается до характерного минимального значения. Затем концентрация контрастного вещества снова поднимается до второго максимального значения, которое уже меньше предыдущего, и далее постепенно снижается. Второй максимум был в основном вызван влиянием болюса контраста, который второй раз прошёл через аорту.
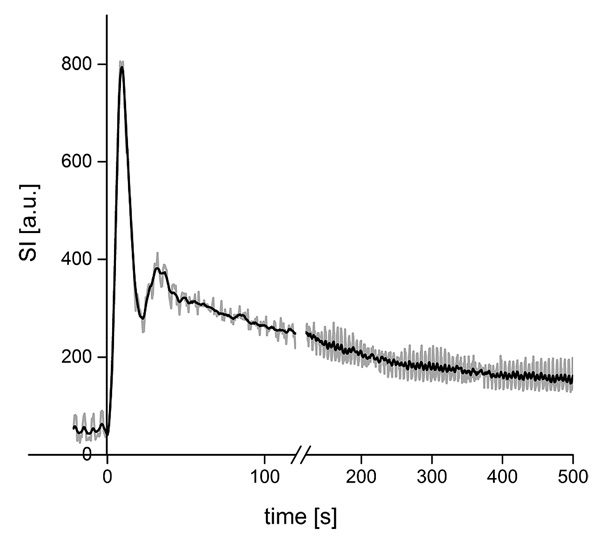 |
| Рис. 5. Изменения ИС во время распространения болюса контрастного вещества у одной собаки. Использование фильтра Савицкого-Голея помогло удалить артефакты, которые возникли преимущественно из-за дыхательных движений. Артефакты, вызванные дыхательными движениями, были убраны практически полностью. Максимальные значения в соответствии с моментами во времени и высотой ИМ отображаются удовлетворительно. Серая линия представляет первичные данные, а непрерывная линия показывает сглаженную кривую. После 120-й секунды графическое представление отрезка времени укорочено |
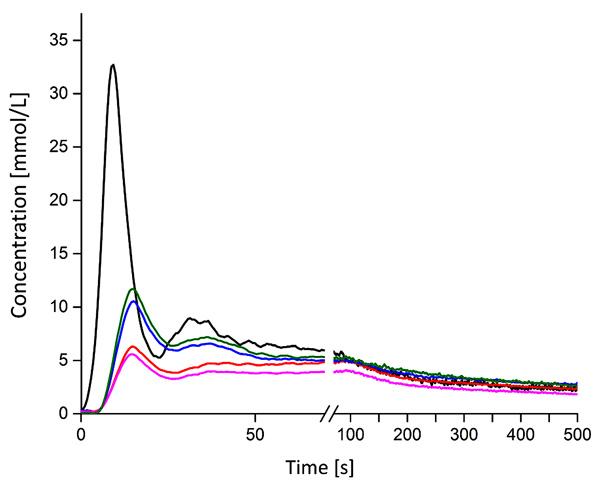 |
| Рис. 6. Репрезентативное распространение болюсной дорожки при обследовании одной собаки. Чёрной линией обозначено распространение концентраций контрастного вещества через аорту, красная линия показывает концентрацию контрастного вещества в левой почке собаки, малиновая линия — в правой почке, синяя линия — в корковом слое левой почки, зелёная линия — в корковом слое правой почки. Второй максимум можно заметить в основном в аорте и нельзя чётко определить в областях интереса вокруг почек и корковых слоёв |
При отслеживании областей интересов вокруг почек и коркового слоя получается примерно такая же кривая, описывающая продвижение контрастного вещества. По сравнению с ROIаорта, у всех восьми собак можно наблюдать индивидуальное небольшое повышение ИС, отсроченное во времени.
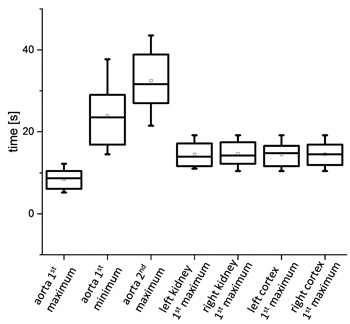
Несмотря на то, что кривые прогрессии у всех собак были схожи, максимальные значения достигались в разные моменты времени. В дополнение к этому, значения концентрации контрастного вещества значимо различались. Все временные точки, в которых достигались максимальные значения в разных областях интереса, представлены в ящичковой диаграмме на рис. 7, а соответствующие концентрации — на рис. 8.
Первый пик в ROIаорта появляется примерно после 8,5 с, первый минимум — после 23,9 с, а второй максимум — после 32,3 с. Максимум во всех областях интересов коркового слоя и почек у собак достигается после 14,5 с. Если у каждой собаки сравнивать время появления первого максимального значения в ROI слева и справа, то видна задержка в 0,2 с для ROIsпочка и 0,1 с для ROIкорковый слой почки.
Сравнение концентраций контрастного вещества (рис. 8) показало широкий диапазон для ROIаорта — от 17 мкмоль/мл до 125 мкмоль/мл. Концентрация в почках варьировала от 4 мкмоль/мл до 16 мкмоль/мл, а в корковом слое — от 6 мкмоль/мл до 20 мкмоль/мл. Различия слева и справа составили 3,8 мкмоль/мл для почек и 1,7 мкмоль/мл для коркового слоя.
 |
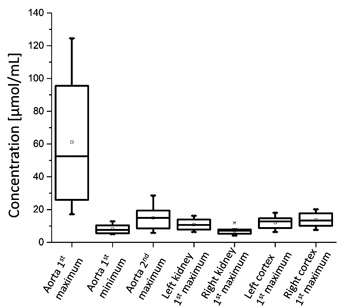 |
| Рис. 7. Сравнение точек во времени, в которых достигались максимальные значения во время отслеживания прохождения болюса, у разных собак. Сравнение левой и правой стороны демонстрирует, что первый максимум был достигнут примерно в одно и то же время как для почек, так и для корковых слоёв, а также для почек и для коркового слоя в целом | Рис. 8. Концентрация контрастного вещества, полученная при максимальных значениях во время отслеживания болюса. Измеренные концентрации в ROIаорта у разных собак значительно отличаются |
Метод, основанный на дифференциации участка Ратленд-Патлака
Для всех восьми собак почечный клиренс контрастного вещества был подсчитан с использованием метода, основанного на дифференциации участка Ратленд-Патлака (RPP). Среднее значение Δt (промежуток времени для сдвига функции, описывающей усиление сигнала от контраста перед тем, как контрастное вещество попадает в исследуемый орган — arterial input function (AIF)) равнялось 6,1 ± 0,8 с. Результаты для обеих почек одной собаки представлены на рис. 9. Градиент линии тренда представляет почечный клиренс контрастного вещества.
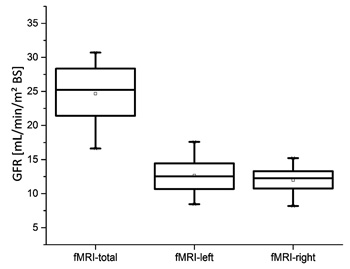
Обобщённое представление всех результатов можно видеть на рис. 10. Суммарная СКФ наших измерений составила в среднем 24,7 ± 4,8 мл/мин/м2 ПТ. Среднее значение для левой почки собаки составило 12,7 ± 2,9 мл/мин/м2 ПТ, а для правой — 12,0 ± 2,2 мл/мин/м2 ПТ. R2-значения регрессии были в среднем 0,91 ± 0,08.
Другим аспектом для анализа результатов RPPs был выбор размера и расположения областей интересов. Расположение разных ROIsаорта можно увидеть на рис. 1. Результаты представлены на ящичковой диаграмме на рис. 11. Расположение ROIаорта для определения площади под кривой имело большое влияние на результаты, вычисленные с помощью RPP.
Средние значения колебались от 24,7 ± 4,8 мл/мин/м2 ПТ (ROIаорта) до 26,2 ± 17,6 мл/мин/м2 ПТ (ROIправая почечная а.) и вплоть до 30,3 ± 18,3 мл/мин/м2 ПТ (ROIнаибольшая ИС). Также на результаты оказывал влияние и размер области интереса. С увеличением размера ROI разброс результатов уменьшался.
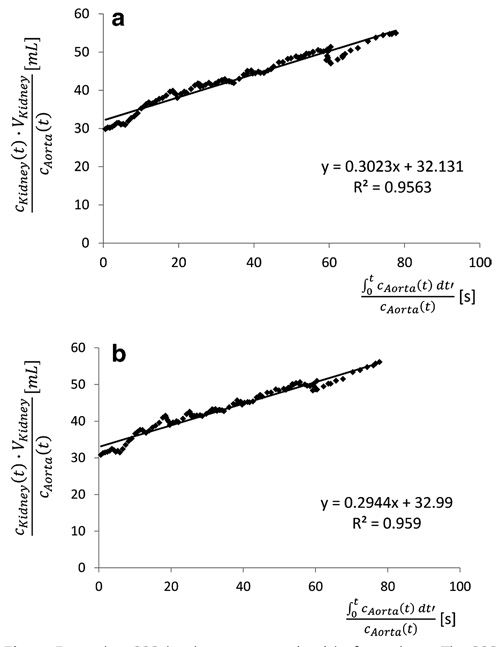 |
| Рис. 9. Типичный RPP (только оцениваемый интервал) одной собаки. a — RPP левой почки и b — RPP правой почки. Точки отображают измеренные значения RPP, а чёрная линия — линию тренда RPP. R2 = 0,96 указывает на хорошее соответствие линии регрессии |
 |
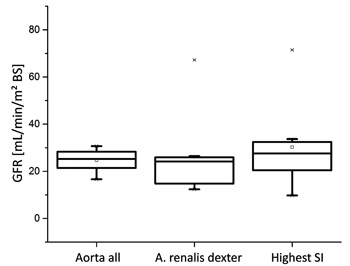 |
| Рис. 10. Результаты подсчёта скорости клубочковой фильтрации, основанные на RPPs. Полная СКФ была вычислена суммированием СКФ каждой почки собак. При сравнении левой и правой почки были получены близкие результаты | Рис. 11. Влияние различных локализаций ROIаорта на подсчёт СКФ с помощью RPP, разное месторасположение ROIs можно увидеть на рис. 3. Общая скорость клубочковой фильтрации отмечена для визуализации влияния размера и локализации ROIаорта |
Обсуждение
Распространение болюса
Для всех восьми собак в разных областях интереса можно наблюдать схожее по времени, но при этом индивидуально различающееся распространение контрастного вещества: в ROIаорта первое максимальное значение достигается за 7,0 с, а различия во времени появления следующих максимумов подчёркивают отличия в распространении болюса у разных собак. Очевидно, если первое максимальное значение достигается рано, то остальные максимумы возникнут раньше по сравнению с другими собаками.
Для вычисленных концентраций получены те же зависимости с ещё большим разбросом результатов.
С одной стороны, такие серьёзные колебания в распространении болюса у разных собак можно объяснить тем фактом, что болюс вводили вручную. Такой способ ввода никогда не бывает таким же точным, как автоматическое введение. С другой стороны, в качестве влияющих факторов следует рассматривать разницу в артериальном давлении и глубине анестезии, а также массу тела.
Как показано на рис. 7 и рис. 8, сложно отметить какие-то различия при сравнении левой и правой почки у каждой собаки, если рассматривать крайние значения времени или концентрации. При сравнении ROIsкорковый слой почек и ROIsпочка также были замечены только незначительные различия. Этот аспект подчёркивает, что данный метод, используемый для оценки функции одной почки у собак, может дать представление о сниженной функции одной почки по сравнению с другой.
Метод, основанный на дифференциации участка Ратленд-Патлака
Как показывают предыдущие исследования, на данный момент нет окончательного консенсуса относительно интервала оценки, который стоит использовать для расчёта наклона RPP [19, 29]. В этом исследовании предполагается вычислить идеальный интервал для оценки в RPPs. Для того чтобы удовлетворить все требования RPP-модели, необходимо учесть отсроченное накопление контрастного вещества в почках у собак по сравнению с аортой.
Из-за разницы в распространении болюса контрастного вещества у собак, определение идеального интервала оценки для RPPs вызвало затруднения. Перфузия почечных сосудов оказывала максимальное влияние на измерения ИС примерно в первые 30 с после поступления контрастного вещества в почки собак. Для исключения этого влияния в качестве оптимальной начальной точки для интегрирования была выбрана та точка во времени, в которой регистрировалась вторая максимальная концентрация Gd-DOTA в аорте. После этого момента времени для всех собак можно было построить график возрастающей регрессии с помощью RPP. Эта функция показывает клиренс контрастного вещества.
Конец интервала оценки был установлен после 60 с. У некоторых собак после примерно 70 с возникало снижение значений в RPPs. Это могло быть вызвано выведением контрастного вещества в мочевой пузырь. В этот момент времени не могли быть соблюдены все предварительные условия для RPP-моделей.
В итоге интервал оценки RPP был установлен после 60 с от второго максимального значения в аорте, так как для вычислений было взято более 100 точек данных, и значения R2 (R2 = 0,91 ± 0,08) для функции регрессии RPPs показали, что это значение даёт достаточно хорошую модель, описывающую такое большое количество точек данных. Этот временной промежуток хорошо подходит к результатам, описанным для 99mTc-DTPA в сцинтиграфии. Они выяснили, что лучшим временным интервалом для интегрирования является временной отрезок между 30 и 120 с [30].
Как показано на рис. 10, сравнение между собой функций левой и правой почки дало примерно одинаковые результаты. Для всех остальных собак разница никогда не превышала 5 мл/мин/м2 ПТ и было статистически незначимым (р = 0,65). Это соответствует нашим ожидаемым результатам для здоровых собак.
Как было описано ранее, AIF необходима для определения концентрации контрастного вещества в сосудистом пространстве. Кроме того, что кровеносные сосуды склонны к появлению артефактов при измерениях с помощью МРТ [17], выбор ROIаорта сильно влияет на вычисленные концентрации [31]. Даже в гуманной медицине нет стандартизированного способа вычисления AIF, позволяющего проводить сравнение между отдельными лицами [32].
Результаты, продемонстрированные на рис. 11, подчёркивают эти аспекты и в нашем исследовании. Это ведёт к необходимости стандартизации выбора ROIs для сравнения между отдельными пациентами и разными компартментными моделями.
В данном исследовании результаты с наименьшим стандартным отклонением были получены при выборе максимально большой области интереса.
Сложно провести сравнения между результатами скорости клубочковой фильтрации, полученными в нашей работе, и методом определения клиренса креатинина. В данном исследовании результаты измерения СКФ с помощью фМРТ были значительно ниже, чем при измерении клиренса креатинина.
Основным моментом является влияние анестезии на измерения СКФ во время фМРТ-обследования. Более низкие результаты СКФ были получены у пациентов под анестезией по сравнению с бодрствующими [33, 34]. Также результаты СКФ зависят от метода, используемого для измерений, и контрастного вещества.
Другая разница между методом определения клиренса креатинина и фМРТ измерениями состоит в периоде времени, во время которого подсчитывается скорость клубочковой фильтрации. Временной промежуток для оценки СКФ с помощью плазменного клиренса экзогенно введённого креатинина составляет как минимум 4 часа, в то время, как промежуток времени для измерения СКФ путём МР-отслеживания болюса составил 60 с. В дополнение к этому следует отметить, что функция одной почки у собак может быть оценена только с помощью фМРТ, а не по результатам анализов крови.
Анализ изображений
Одной из задач при оценке результатов отслеживания болюса на МРТ было устранение артефактов, преимущественно вызванных дыхательными движениями. В этом случае можно было выбрать один из двух разных подходов. Можно уменьшить дыхательные движения во время обследования с помощью глубокой анестезии и использовать искусственную вентиляцию лёгких. Другой подход состоит в том, чтобы удалить эти артефакты в процессе пост-обработки изображений. Вместо ручной корректировки [18] был использован фильтр Савицкого-Голая [26]. Как показано на рис. 5, использование этого фильтра даёт хорошую аппроксимацию, касающуюся кривой распространения болюса и максимальных значений. Этот фильтр представляет собой простой и быстрый метод для устранения подобных артефактов без потери информации о кривой распространения болюса или о максимальных значениях. Использование данного фильтра также упростило определение «точки после подъёма аорты», поскольку у некоторых собак дыхательные движения появлялись одномоментно с началом распространения болюса контрастного вещества.
Толщина среза в 45 мм имела ряд преимуществ и недостатков. Положительной стороной такого подхода является возможность измерения ИС для всей почки у собак. Более того, как почки, так и аорта были полностью захвачены одним срезом, поэтому вычисления не были ограничены небольшим участком паренхимы почек [18] и контрастное вещество оставалось в пределах области интереса на протяжении всего временного интервала для анализа [35]. В дальнейшем могут появиться другие источники возможных ошибок из-за использования дополнительных ROIs, которые необходимо выделить для вычисления поправочных коэффициентов. Поскольку толщина среза имеет более широкий диапазон, чем объём органа, необходимо вычесть окружающие ткани. Это может привести к некоторым искажениям из-за возможных расположений областей интереса, особенно, для ROIаорта.
Общие недостатки этого метода состоят в сильном влиянии размера и локализации областей интереса на вычисления и в возможной нефротоксичности контрастного вещества [36], особенно если назначать повторные исследования. Второе слабое место — это отсутствие подтверждённых референсных значений скорости клубочковой фильтрации для одной почки у собак и нехватка опубликованных данных о клинической значимости изменений СКФ, полученных с помощью фМРТ [37]. Это значительно осложняет интерпретацию расчётных результатов.
Выбор плоскости сечения также влияет на результаты. Если для МР-измерений выбирать корональную плоскость сканирования, то выбор областей интереса более ограничен из-за анатомических факторов. По нашему мнению, определение ROI является ключевым фактором для того, чтобы внедрить данный метод измерений в рутинную клиническую практику, поскольку в популяции собак существует большое количество различий в зависимости от породы. Это может вызывать некоторые затруднения для стандартизации выбора ROIs.
Другим преимуществом этого метода является быстрота проведения исследования по сравнению с различными методами исследования образцов крови.
Заключение
Можно хорошо отследить распространение болюса контрастного вещества. Также для каждой собаки болюс контраста распространяется схожим образом. В дополнение к этому, с помощью данного метода можно сравнить функцию одной почки у каждой собаки.
Для минимизирования влияющих факторов рекомендуется стандартизированная процедура исследования (протокол анестезии, автоматическое введение контрастного вещества, локализация и размер ROIs и определение временного интервала для интегрирования RPPs).
Поскольку идеальное представление о процедуре обследования почек заключается в том, чтобы за одно исследование оценить как морфологические, так и функциональные характеристики, то обследование почек с помощью МРТ, по-видимому, является перспективным инструментом для решения этой проблемы.
Литература
- Sosnar M, Kohout P, Ruzicka M, Vrbasova L. Retrospective study of renal failure in dogs and cats admitted to University of Veterinary and Pharmaceutical Sciences Brno during 1999-2001. Acta Vet Brno. 2003;72:593–8.
- OʼNeill DG, Elliott J, Church DB, McGreevy PD, Thomson PC, Brodbelt DC. Chronic kidney disease in dogs in UK veterinary practices: prevalence, risk factors, and survival. J Vet Intern Med. 2013;27:814–21.
- Macdougall DF, Cook T, Steward AP, Cattell V. Canine chronic renal disease: prevalence and types of glomerulonephritis in the dog. Kidney Int. 1986;29:1144–51.
- Ettinger SJ, Feldman EC. Textbook of veterinary internal medicine diseases of the dog and the cat. 7th ed. St. Louis: Elsevier Saunders; 2010.
- Polzin DJ. Chronic kidney disease in small animals. Vet Clin N Am-Small. 2011;41:15–30.
- Von Hendy-Willson VE, Pressler BM. An overview of glomerular filtration rate testing in dogs and cats. Vet J. 2011;188:156–65.
- Watson ADJ, Lefebvre HP, Concordet D, Laroute V, Ferre J-P, Braun J-P, et al. Plasma exogenous creatinine clearance test in dogs: comparison with other methods and proposed limited sampling strategy. J Vet Intern Med. 2002;16:22–33.
- Zeng MY, Cheng YS, Zhao BH. Measurement of single-kidney glomerular filtration function from magnetic resonance perfusion renography. Eur J Radiol. 2015;84:1419–23.
- Nikken JJ, Krestin GP. MRI of the kidney — state of the art. Eur Radiol. 2007;17:2780–93.
- Finco DR, Brown SA, Vaden SL, Ferguson DC. Relationship between plasma creatinine concentration and glomerular filtration rate in dogs. J Vet Pharmacol Ther. 1995;18:418–21.
- Gleadhill A, Peters AM, Michell AR. A simple method for measuring glomerular filtration rate in dogs. Res Vet Sci. 1995;59:118–23.
- Braun JP, Lefebvre HP, Watson ADJ. Creatinine in the dog: a review. Vet Clin Path. 2003;32:162–79.
- Cortadellas O, Fernandez del Palacio MJ, Talavera J, Bayon A. Glomerular filtration rate in dogs with leishmaniasis and chronic kidney disease. J Vet Intern Med. 2008;22:293–300.
- Baumann D, Rudin M. Quantitative assessment of rat kidney function by measuring the clearance of the contrast agent Gd (DOTA) using dynamic MRI. Magn Reson Imaging. 2000;18:587–95.
- Leyendecker JR, Clingan MJ. Magnetic resonance urography update—are we there yet? Semin Ultrasound CT MRI. 2009;30:246–57.
- Chandarana H, Lee VS. Renal functional MRI: are we ready for clinical application? Am J Roentgenol. 2009;192:1550–7.
- Zhang JL, Rusinek H, Chandarana H, Lee VS. Functional MRI of the kidneys. J Magn Reson Imaging. 2013;37:282–93.
- Buckley DL, Shurrab AE, Cheung CM, Jones AP, Mamtora H, Kalra PA. Measurement of single kidney function using dynamic contrast- enhanced MRI: comparison of two models in human subjects. J Magn Reson Imaging. 2006;24:1117–23.
- Hackstein N, Heckrodt J, Rau WS. Measurement of single-kidney glomerular filtration rate using a contrast-enhanced dynamic gradient-echo sequence and the Rutland-Patlak plot technique. J Magn Reson Imaging. 2003;18:714–25.
- Annet L, Hermoye L, Peeters F, Jamar F, Dehoux J-P, Van Beers BE. Glomerular filtration rate: assessment with dynamic contrast-enhanced MRI and a cortical-compartment model in the rabbit kidney. J Magn Reson Imaging. 2004;20:843–9.
- Sourbron SP, Michaely HJ, Reiser MF, Schoenberg SO. MRI-measurement of perfusion and glomerular filtration in the human kidney with a separable compartment model. Invest Radiol. 2008;43:40–8.
- Lee VS, Rusinek H, Bokacheva L, Huang AJ, Oesingmann N, Chen Q, et al. Renal function measurements from MR renography and a simplified multicompartments! model. Am J Physiol Renal Physiol. 2007;292:F1548–59.
- Zhang JL, Rusinek H, Bokacheva L, Lerman LO, Chen Q, Prince C, et al. Functional assessment of the kidney from magnetic resonance and computed tomography renography: impulse retention approach to a multicompartment model. Magn Reson Med. 2008;59:278–88.
- Hochel J, Finnah A, Velde K, Hartmann H. Epidemiologie — Bewertung einer modifizierten Plasma-Clearance mit exogenem Kreatinin als ein fur die Kleintierpraxis geeignetes Verfahren der renalen Funktionsdiagnostik. Berl Muench Tieraerztl Wochenschr. 2004. p. 420–7.
- Hartmann H, Mohr S, Thure S, Hochel J. Routine use of a renal function test for the quantitative determination of glomerular filtration rate (GFR) including the determination of the cut-off value for azotemia in the dog. Wien Tierarztl Monatsschr. 2006;93:226–34.
- Savitzky A, Golay MJE. Smoothing and differentiation of data by simplified least squares procedures. Anal Chem. 1964;36:1627–39.
- Bourges-Abella NH, Gury TD, Geffre A, Concordet D, Thibault-Duprey KC, Dauchy A, et al. Reference intervals, intraindividual and interindividual variability, and reference change values for hematologic variables in laboratory beagles. J Am Assoc Lab Anim Sci. 2015;54:17–24.
- Akaike H. Information theory and an extension of the maximum likelihood principle. In: Petrov BN, editors. Proceedings of the second international symposium on information theory; Budapest. Akademiai Kiado. 1973. p. 267–81.
- Bokacheva L, Rusinek H, Zhang JL, Chen Q, Lee VS. Estimates of glomerular filtration rate from MR renography and tracer kinetic models. J Magn Reson Imaging. 2009;29:371–82.
- Kampa N, Wennstrom U, Lord P, Twardock R, Maripuu E, Eksell P, et al. Effect of region of interest selection and uptake measurement on glomerular filtration rate measured by Tc-99m-DTPA scintigraphy in dogs. Vet Radiol Ultrasound. 2002;43:383–91.
- Cutajar M, Mendichovszky IA, Tofts PS, Gordon I. The importance of AIF ROI selection in DCE-MRI renography: reproducibility and variability of renal perfusion and filtration. Eur J Radiol. 2010;74:E155–61.
- Mendichovszky IA, Cutajar M, Gordon I. Reproducibility of the aortic input function (AIF) derived from dynamic contrast-enhanced magnetic resonance imaging (DCE-MRI) of the kidneys in a volunteer study. Eur J Radiol. 2009;71:576–81.
- Boscan P, Pypendop B, Siao K, Francey T, Dowers K, Cowgill L, et al. Fluid balance, glomerular filtration rate, and urine output in dogs anesthetized for an orthopedic surgical procedure. Am J Vet Res. 2010;71:501–7.
- Bovee KC, Joyce T. Clinical evaluation of glomerular function: 24-hour creatinine clearance in dogs. J Am Vet Med Assoc. 1979;174:488–91.
- Daghini E, Juillard L, Haas JA, Krier JD, Romero JC, Lerman LO. Comparison of mathematic models for assessment of glomerular filtration rate with electron-beam CT in pigs. Radiology. 2007;242:417–24.
- Pollard RE, Puchalski SM, Pascoe PJ. Hemodynamic and serum biochemical alterations associated with intravenous administration of three types of contrast media in anesthetized in dogs. Am J Vet Res. 2008;69:1268–73.
- Mendichovszky I, Pedersen M, Frokter J, Dissing T, Grenier N, Anderson P, et al. How accurate is dynamic contrast-enhanced MRI in the assessment of renal glomerular filtration rate? A critical appraisal. J Magn Reson Imaging. 2008;27:925–31.
Источник: Acta Veterinaria Scandinavica (2018) 60:72, https://doi.org/10.1186/s13028-018-0423-3 © The Author(s) 2018. This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licen ses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made.
СВМ № 3/2019