Н.В. Данилевская, В.В. Субботин
Иррациональная лекарственная терапия – одна из причин снижения колонизационной резистентности и, как следствие, развития дисбактериозов у животных. Игнорирование при этом возможности дисбиотических нарушений – одна из ошибок отрицательно сказывающейся на эффективности лечения других заболеваний.
Известно, что дисбактериозы в организме животного и человека – это микроэкологические нарушения, характеризующиеся количественными или качественными изменениями в составе нормальной флоры того или иного биотопа, появлением представителей индигенной флоры вне мест естественного обитания. Характер, степень выраженности и длительность нарушений зависят от интенсивности и продолжительности воздействия факторов, влияющих на фиксацию, выживание и функциональную активность как нормальной, так и случайной транзиторной микрофлоры. Наиболее чувствительным является микробиоценоз кишечника. Именно поэтому дисбактериоз кишечника – наиболее ранний сигнал начавшегося в организме микроэкологического дисбаланса. К развитию дисбактериозов у домашних животных часто приводит нерациональное использование различных лекарственных препаратов.
Дисбактериозы у животных вследствие применения антибиотиков и химиотерапевтических средств
Существенные нарушения в микроэкологии кишечника и организма, ведущие к дисбактериозам у животных, в целом часто возникают при использовании антибиотиков и других химиотерапевтических средств. Следует помнить, что максимальное воздействие они оказывают при энтеральном введении. Однако и при других способах поступления (внутривенно, внутримышечно) в результате распределения и выведения из организма через пищеварительный тракт многие препараты накапливаются в содержимом кишечника в значительных концентрациях. Спектр их действия во многом определяет изменения микробиоценоза (приложение 1). Нарушение естественной колонизации приводит к избыточной пролиферации устойчивых к препарату групп микроорганизмов. Поражения в этом случае часто не ограничиваются желудочно-кишечным трактом, а принимают генерализованные формы с вовлечением почек, сердца, легких, других органов.
Приложение 1. Влияние некоторых антибиотических и химиотерапевтических препаратов
на нормальную кишечную микрофлору
Спектр действия препаратов в значительной степени определяет их влияние на микробиоценоз кишечника.
Полусинтетические пенициллины (ампициллин, ампиокс и другие) ведут к значительному уменьшению в кишечнике энтерококков, клостридий, бактерий группы кишечной палочки, в меньшей степени – лакто- и бифидобактерий. Снижение колонизационной резистентности при этом способствует увеличению количества клебсиелл, цитробактеров, энтеробактеров, протеев, морганелл, других представителей рода Enterobactriaceae, стафилококков, кандид. Поэтому на фоне данных препаратов часто отмечается избыточная колонизация условно-патогенными бактериями тонкого отдела (прежде всего тощей кишки) кишечника.
Сходные изменения в кишечном биоценозе вызывает карбенициллин, хотя его ингибирующий эффект на лактобактерии, бактероиды и фузобактерии менее выражен [13].
Цефалоспорины (в зависимости от поколения) могут уменьшать число бифидобактерий, лактобактерий, эшерихий при увеличении пула стафилококков, энтерококков, кандид, представителей различных родов энтеробактерий.
Тетрациклины, имеющие широкий спектр действия, резко снижают (иногда наблюдается полная элиминация) число эшерихий, клебсиелл, уменьшают содержание в фекалиях стрептококков, клостридий, лакто- и бифидобактерий, бактероидов. На фоне их применения растет уровень протеев и ряда других энтеробактерий, псевдомонад, энтерококков, стафилококков, грибов рода Candida. Однако в последние годы многие штаммы, особенно патогенной и условно-патогенной микрофлоры, к тетрациклинам резистентны. Это может вести к их размножению из-за устранения конкурентных взаимоотношений с нормальной флорой за сайт прикрепления и источник питания. Кроме того, тетрациклины оказывают токсичное влияние на энтероциты и клетки ретикулоэндотелиальной системы слизистой кишечника, приводя не только к снижению колонизационной резистентности, но и ослабляя факторы иммунной защиты слизистой оболочки. Подобно тетрациклинам на кишечную микрофлору влияет хлорамфеникол (левомицетин).
Аминогликозиды заметно снижают в кишечнике число аэробных грамнегативных энтеробактерий (эшерихии, клебсиеллы и другие). Менее выражен их ингибирующий эффект в отношении лакто- и бифидофлоры, энтерококков и практически не оказывают действия на псевдомонасы, протеи и некоторые другие энтеробактерии. Характерная особенность аминогликозидов – существенное увеличение в фекалиях кандид [1].
Линкозамины (линкомицин, клиндамицин) резко снижают или даже элиминируют из кишечника лактобактерии, бифидобактерии, грамнегативные анаэробные бактерии, стафилококки, стрептококки. Освободившаяся на фоне этих препаратов экологическая ниша занимается такими энтеробактериями, как протей, цитробактеры, энтеробактеры, клебсиеллы, морганеллы, резко увеличивается число псевдомонад, кандид, клостридий [13].
Макролиды уменьшают количество бифидо- и лактофлоры, других анаэробных и аэробных бактерий в кишечном содержимом, увеличивая одновременно количество клебсиелл, энтеробактеров, протеев, псевдомонад, энтерококков [7].
Полимиксины, колистин практически не изменяют анаэробную флору толстой кишки, заметно уменьшают число бактерий группы кишечной палочки и несколько увеличивают количество протеев, псевдомонад, реже клебсиелл, энтеробактеров, стрептококков. Применение новобиоцина мало изменяет количество неспорообразующих анаэробных бактерий, кандид, но заметно снижает в кишечнике число клостридий, эшерихий, стафило- и стрептококков. Как и на фоне большинства других препаратов, на фоне новобиоцина увеличивается пул энтеробактерий (клебсиелл, протеев, энтеробактеров, морганелл и др.).
Нитрофураны (фуразолидон) в толстой кишке редко достигают бактерицидных концентраций, поэтому существенных изменений в составе кишечной микрофлоры обычно не наблюдают [15].
Хинолоны последних поколений (ципрофлоксацин, энрофлоксацин, пефлоксацин) практически не действуют на анаэробную микрофлору кишечника.
Фунгициды (нистатин, леворин) приводят к селективному размножению лактозонегативных со сниженной лактазной активностью эшерихий, протея.
Хочется обратить внимание специалистов на то, что дисбактериальные реакции у животных на фоне антибиотикотерапии могут появляться не только в момент лечения, но и в отдаленные сроки. В этом отношении показателен линкомицин, который в связи с хорошим распределением в костной ткани часто назначают при лечении острых и хронических остеомиелитов и инфекционных поражений суставов, а также для профилактики инфекций в хирургической практике. Так как препарат лишь частично метаболизируется в печени, он выделяется в значительных количествах в неизменном виде с желчью (концентрация в желчи в 10 раз выше, чем в крови). При этом подавление нормальной микрофлоры создает условия для чрезмерной пролиферации Clostridium difficile, который не чувствителен к линкомицину (как и некоторые виды стафилококков, нейсерий, гемофильных и других бактерий). В период лечения и в отдаленные сроки (спустя 2–3 недели) это может вызывать энтероколит (в терапевтической практике известен как псевдомембранозный) с персистирующей лихорадкой, лейкоцитозом, сильной болевой реакцией. Если процесс не остановить, то далее развивается перитонит, токсический мегаколон, бактериальный шок, возможен летальный исход. Подобные осложнения необходимо лечить с применением антибиотиков, имеющих другой спектр действия (например, ванкомицин) и последующим назначением пробиотиков.
Антибиотики и химиотерапевтические препараты могут влиять не только на микроорганизмы в кишечнике, но и изменять условия их персистенции. Известно, что энтероциты – это активно возобновляющиеся клетки, причем наибольшей абсорбтивной активностью обладают зрелые формы на вершинах ворсин в тонком отделе кишечника. Многие препараты, механизм действия которых связан с подавлением синтеза белков в бактериальной клетке (тетрациклины, левомицетин, бисептол, другие сульфаниламиды, потенцированные триметопримом), отрицательно влияют на быстро пролиферирующие клетки организма-хозяина. На фоне их длительного применения нарушаются процессы регенерации, миграции энтероцитов и их функциональные характеристики, в том числе уменьшается всасывание питательных веществ. Это усугубляет метаболические нарушения в организме животного, подавляя иммунитет, и увеличивает количество не всосавшихся в тонкой кишке субстратов, которые служат питательной средой для микроорганизмов, обладающих селективной устойчивостью к назначаемому химиотерапевтическому средству. Таким образом, многие антибиотики оказывают не только прямое, но и опосредованное воздействие на микробиоценоз желудочно-кишечного тракта.
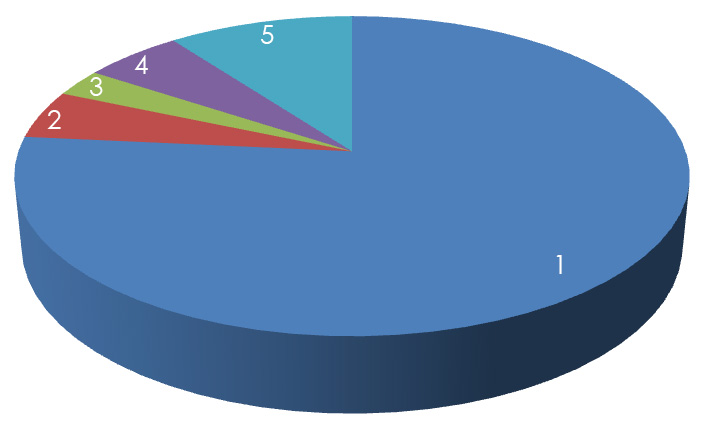
Мы наблюдали многочисленные случаи дисбактериозов у собак, кошек и других животных при использовании для лечения различных заболеваний левомицетина, олететрина, олеандомицина, эритромицина, ампиокса, гризеофульвина и других препаратов, особенно с широким спектром действия, либо преимущественным действием на грамположительную микрофлору. Диагноз ставили на основании изучения анамнеза, данных клинических, биохимических и бактериологических исследований. В большинстве случаев при дисбактериозах у собак с клинически выраженным диспепсическим синдромом отмечали резкое уменьшение числа бифидо-, лактобактерий, энтерококков, суммарная доля которых составляла от 1,5 до 6%. Доминирующей группой кишечного содержимого (94–98,5%) становились представители энтеробактерий, на долю которых в норме у собак 1–6 летнего возраста приходится от 7 до 15% [8, 9]. Было отмечено не только увеличение числа энтеробактерий, но и существенное изменение их качественного состава по сравнению со здоровыми животными. У клинически здоровых собак основная часть энтеробактерий (76,5%) представлена эшерихиями с типичной ферментативной активностью (в том числе лактазной). Доля эшерихий со слабой лактазной активностью, гемолитическими свойствами и лактозонегативных энтеробактерий не превышала 5% (рис. 1).
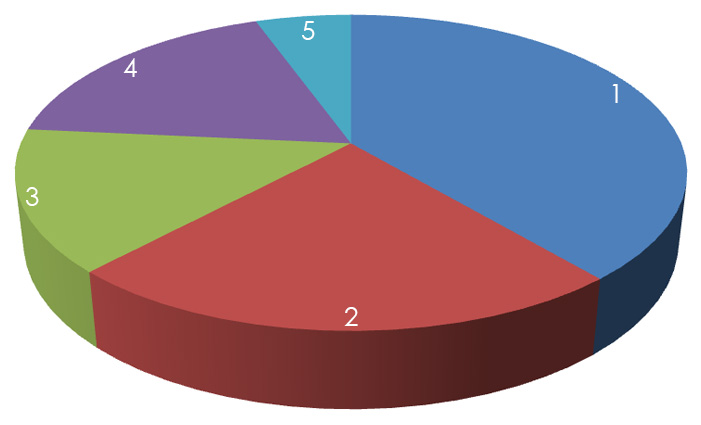
При дисбактериозе у собак снижался в среднем до 38,8% уровень эшерихий с нормальной лактазной активностью, одновременно увеличивался до 14,5% гемолитических и до 23,2% пул слабо ферментирующих лактозу штаммов. Более чем в три раза возрастала доля лактозонегативных энтеробактерий (рис. 2).
Частота обнаружения различных энтеробактерий в фекалиях клинически здоровых собак и собак с дисбактериозом представлена в таблице 1. Из других изменений в микроэкологии кишечника обращает внимание увеличение по сравнению со здоровыми животными абсолютного числа стафилококков (4,20±0,619 lg/г при 100%-ной частоте обнаружения), грибов рода Candida (4,05±0,474 lg/г при 60%-ной частоте обнаружения). Количество дрожжей и плесеней составляло 3,81±0,653 lg/г при 100%-ной частоте обнаружения. Значимых изменений в количестве спорообразующих аэробных бактерий установлено не было.
Таблица 1. Частота обнаружения различных энтеробактерий в фекалиях клинически здоровых собак
и собак с дисбактериозом.
| Наименование энтеробактерий | Частота обнаружения (%) | |
| Клинически здоровые собаки (n=17) | Собаки с дисбактериозом (n=15) | |
| Эшерихии лактозопозитивные | 100 | 100 |
| Эшерихии со слабой лактазной активностью | 23,5 | 100 |
| Эшерихии гемолитические | 11,8 | 60,0 |
| Enterobacter ssp. | 17,6 | 46,7 |
| Citrobacter ssp. | 23,5 | 20,0 |
| Proteus ssp. | 0 | 100 |
| Klebsiella ssp. | 5,9 | 26,7 |
| Hafnia ssp. | 29,4 | 20,0 |
| Morganella ssp. | 0 | 13,3 |
При всем разнообразии причин и различиях в характере микроэкологических нарушений в кишечнике, прослеживаются определенные закономерности.
Во всех случаях наблюдается значительное уменьшение количества основных антагонистов, обеспечивающих колонизационную резистентность желудочно-кишечного тракта (бифидо-, лактобактерий). Освобождающаяся экологическая ниша занимается другими, чаще всего условно-патогенными бактериями (включая и представителей обычного нормобиоза), а иногда патогенными энтеробактериями и представителями других семейств.
Хочется обратить внимание практикующих врачей на то, что дисбактериоз у животных, в частности после применения антибиотиков и других химиотерапевтических препаратов, может клинически проявляться различным образом. Это связано с многообразием функций нормальной кишечной микрофлоры и ее влиянием на макроорганизм (приложение 2). Поэтому на фоне дисбактериоза часто отмечают не только синдром диспепсии, анорексию, потерю аппетита, но и общую интоксикацию с поражением печени, почек, суставов, других органов, иммунодефицитом (приложение 3).
Приложение 2. Наиболее важные функции нормальной микрофлоры
• Необходимы для нормального развития в онтогенезе (морфокинетическое действие) желудочно-кишечного тракта, эндокринной и других систем.
• Иммуногенная роль.
• Обеспечение колонизационной резистентности, предотвращение транслокации из кишечника в кровяное и лимфатическое русло патогенов и их токсинов.
• Участие в водно-солевом обмене, поддержании рН и регуляции анаэробиоза кишечника.
• Участие в обмене белков, углеводов, липидов, нуклеиновых кислот и других соединений.
• Участие в кишечно-печеночной рециркуляции желчных кислот, стероидов и других макромолекул.
• Продукция биологически активных соединений: летучих жирных кислот, витаминов, бактериальных липополисахаридов, пептидогликанов, аминов и других производных аминокислот, антибиотиков, перекиси водорода, других веществ с антимикробной активностью и др.
• Участие в детоксикации экзогенных, эндогенных субстратов и метаболитов.
Приложение 3. Клинические синдромы и патологические состояния, патогенез которых может быть связан
с изменениями в составе и функциях нормальной микрофлоры [14]
• Эндогенные и секундарные (вторичные) инфекционные процессы.
• Диареи, запоры, рвота, синдром малабсорбции.
• Различного типа и локализации воспалительные процессы желудочно-кишечного тракта (гастриты, дуодениты, энтериты, колиты и т.д.).
• Язвенная болезнь желудка, двенадцатиперстной кишки.
• Гипо- или гиперхолестеринемия.
• Злокачественные новообразования толстой кишки, молочной железы и другие онкологические заболевания.
• Мочекаменная болезнь и другие поражения почек.
• Гипо- или гипертензия.
• Портальная системная энцефалопатия, другие поражения печени.
• Артриты, спондилоартриты, другие поражения соединительной ткани.
• Дерматиты и другие поражения кожи и ее производных.
• Коагулопатии.
• Острая мезентериальная ишемия.
• Заболевания, связанные с нарушениями обмена веществ (анемия, кахексия, другие патологические состояния).
В развитии дисбактериоза кишечника у животных некоторые авторы выделяют четыре стадии [2, 6]. По нашим наблюдениям, их в большей мере следует характеризовать как степень микроэкологических нарушений (приложение 4), что определяется совокупностью условий: патогенетическими особенностями основного и сопутствующих заболеваний, воздействием лекарственных препаратов, иммунологическим, гормональным статусом, возрастом и кормлением.
Приложение 4. Микроэкологические нарушения в желудочно-кишечном тракте
Минимальные изменения (1 степень) характеризуются уменьшением количества бифидо- и лактобактерий до нижней границы либо несколько ниже физиологической нормы при сохранении преобладания общего количества анаэробной микрофлоры кишечника над аэробами. Количество эшерихий может незначительно колебаться, а уровень других условно-патогенных микроорганизмов практически не изменяется. Как правило, при таких состояниях патологические процессы не развиваются, клинические проявления отсутствуют. У здоровых животных при нормальном кормлении и эксплуатации нормобиоз, как правило, восстанавливается. По нашим наблюдениям у собак это происходит за 7–10 дней. Однако у молодых, старых (см. журнал «Ветеринар», N4, 2002, стр. 14–19), а также ослабленных особей латентные минимальные дисбиозы, выявляемые только при микробиологическом исследовании, могут персистировать до нескольких месяцев. Затем либо может восстановиться нормобиоз, либо состояние усугубляется.
Выраженные изменения (2 степень) характеризуются уменьшением лакто-, бифидобактерий и других облигатно-анаэробных микроорганизмов. Они перестают быть доминирующей группой, и их суммарное количество примерно уравнивается с популяцией аэробов. Увеличивается пул условно-патогенных бактерий, в том числе эшерихий, среди которых возрастает доля лактозонегативных или со слабой лактазной активностью. Могут появиться и эшерихии с гемолитическими свойствами. Такие изменения микробиоценоза ведут к избыточному токсинообразованию с развитием в кишечнике воспалительных процессов, энтерита, колита и т.п. Отсутствие помощи животному или неграмотная терапия на этом этапе способствуют быстрому нарушению барьерной функции слизистой кишечника и ухудшению состояния.
Глубокие нарушения микробиоценоза (3 степень) характеризуются преобладанием в кишечнике разнообразных представителей условно-патогенной флоры, чаще энтеробактерий. Бифидо-, лактобактерии либо высеваются в незначительных количествах, либо их вовсе не удается обнаружить. На этой стадии общее число бактерий в тощей кишке часто превышает 5,0 lg/г, что само по себе является свидетельством дисбактериоза у животных. Там появляются бактерии, преимущественным местом обитания которых являются толстый отдел и подвздошная кишка. Эшерихии на половину или более представлены атипичными по ферментативной активности формами, практически всегда среди них выделяются и гемолитические варианты. Резко увеличивается токсинообразование. Нарушению структуры слизистой оболочки кишечника при таком состоянии способствует и избыточное количество спирохет некоторых других условно-патогенных извитых бактерий. Ассоциируясь с энтероцитом одним своим полюсом, другим они раздвигают микроворсинки, разрушая гликокаликс и щеточную кайму [10]. На фоне пониженной колонизационной резистентности, а также под влиянием бактериальных энтеротоксинов снижается барьерная функция слизистой оболочки кишечника. Становится возможной транслокация через нее как различных микроорганизмов, так и их токсинов. Это не только значительно осложняет течение первичного заболевания, на фоне которого возник дисбактериоз, но и становится важнейшим, иногда ведущим патогенетическим звеном.
Критические изменения микробиоценоза (4 степень) – такой уровень нарушений, когда практически полностью исчезают бифидобактерии, молочнокислые микроорганизмы палочковидной и кокковой формы, значительно снижается в кишечнике число эшерихий, которые представлены в основном атипичными формами. Кишечная микрофлора почти полностью представлена ассоциацией условно-патогенных микроорганизмов. Чаще всего выявляется доминирующий микроорганизм определенного рода или вида. Именно в таких случаях говорят о протейном, кандидозном, стафилококковом, энтерококковом, псевдомонозном, клостридиозном и т.д. дисбактериозах у животных. Нередко на фоне резкого снижения резистентности макроорганизма происходит генерализация дисбактериоза с развитием бактериемии, пиемии, сепсиса и других тяжелейших патологических состояний.
Обсуждая тему дисбактериозов у животных, их причин и последствий, необходимо помнить, что не существует четкого разграничения между непатогенными комменсалами и условно-патогенными микроорганизмами. Чрезмерная колонизация организма любым видом бактерий в ущерб другим представителям биоценоза нарушает нормальное течение физиологических процессов и ведет к развитию патологии. Например, избыток в кишечнике бактероидов способен вызывать формирование абсцессов после проникновения этих бактерий в стенку кишечника.
Стафилококки (чаще всего S.aureus и S.epidermidis) могут стать причиной эндотоксикоза или развития артритов, остеомиелитов, перитонита, эндокардита, поражений кожи и ее производных.
Избыточная колонизация кишечника энтерококками, помимо нарушений желудочно-кишечного тракта, чревата развитием поражений мочеполовых органов, бактериальных эндокардитов, внутрибрюшинных абсцессов, бактериемии.
Дисбактериоз у животных с увеличением пула клостридий, главным образом Cl.difficile, характеризуется энтероколитом. Отмечаются болезненность в области живота, профузная диарея с примесью в фекалиях пленок фибрина и слизи, повышение температуры тела на 1,5–2,00 °С. Практикующие ветеринарные врачи хорошо знают, что такие изменения возникают при применении препаратов пенициллинового ряда грызунам (морским свинкам, крысам, кроликам и особенно хомякам). У них очень быстро развивается дисбактериоз в форме псевдомембранозного энтероколита с летальным исходом. Это полностью исключает использование антибиотиков пенициллинового ряда указанной группе животных [5].
Сугубо эндогенный характер имеют инфекционные процессы, связанные с патогенными свойствами анаэробных кокков (пептококков, пептострептококков). Они не способны вызывать моноинфекции, но часто выделяются в ассоциации с другими патогенами при внутрибрюшинных абсцессах, эндометритах, плевропневмониях и другой патологии.
В послеоперационный период у хирургических больных Pseudomonas aeruginosa на фоне антибиотикотерапии, цитостатиков, глюкокортикоидов может стать причиной бактериемии, сепсиса, патологии урогенитального тракта, пневмонии, гнойных процессов.
Практически постоянно наблюдаемое при дисбактериозах у животных увеличение пула энтеробактерий, изменение их качественного состава является одной из основных причин развития синдрома диареи. Из-за изменяющегося характера сбраживания углеводородов происходит накопление в кишечнике газов (причина метеоризма) и осмотически активных субстанций, не абсорбирующихся кишечником, что ведет к выходу жидкости в просвет кишечника. Потерю жидкости и нарушение водно-солевого обмена усиливает и действие токсинов энтеробактерий, активирующих систему аденилатциклазы клеток кишечника.
Часто практикующие врачи не могут остановить диарею у животного, заменяя поочередно один антибиотик другим. Это может быть связано с нарушением метаболизма желчных кислот на фоне дисбактериоза у животных. Известно, что деконьюгация желчных кислот осуществляется микрофлорой кишечника. Это обеспечивает их реабсорбцию через стенку данного органа и последующее включение в кишечно-печеночную рециркуляцию. Поэтому при нарушении нормобиоза вследствие применения антибактериальных или других препаратов происходит нарушение кишечно-печеночной рециркуляции желчных кислот. Это увеличивает нагрузку на печень в связи с необходимостью восполнения создавшегося дефицита (дополнительного синтеза желчных кислот). Снижение реабсорбции через стенку кишечника желчных кислот приводит к избыточному содержанию их в фекалиях, что оказывает выраженное раздражающее действие с последующим развитием желчнокислотной диареи. Кроме того, не подвергшиеся деконьюгации желчные кислоты значительно повреждают микроворсины энтероцитов, снижая активность гликопротеинов их апикальной мембраны, уменьшая синтез ферментов и абсорбцию. В результате нарушаются процессы пристеночного пищеварения, всасывание углеводов, жиров и жирорастворимых витаминов, аминокислот. Развиваются стеаторея, амилорея, креаторея. Снижается реабсорбция и стероидных гормонов, т.е. развиваются эндокринные нарушения.
Увеличение в кишечнике пула эшерихий со слабой лактазной активностью, появление лактозонегативных кишечных палочек и других энтеробактерий со сниженной ферментативной активностью в отношении углеводов и многоатомных спиртов при резком уменьшении бифидо-, а особенно лактобактерий, лактококков, энтерококков ведет к изменению рН кишечного содержимого в щелочную сторону. При щелочной реакции среды нарушается функциональная активность пептидаз, дисахаридаз и ряда других пищеварительных ферментов, что усугубляет нарушение обмена веществ.
Уменьшение числа бифидо- и лактобактерий (они наиболее активно снижают уровень холестерина в кишечнике), увеличение числа эшерихий, которые продуцируют холестерин, ведет к нарушению холестеринового обмена, изменению химических свойств и снижению бактерицидности желчи. Это способствует пролиферации микрофлоры из толстого отдела кишечника в тонкий и двенадцатиперстную кишку, инфицированию желчного пузыря по восходящим путям с развитием холецистита.
Избыток в кишечнике энтеробактерий, особенно иерсиний, может способствовать аутоиммунным нарушениям: Y.enterocolitica вырабатывает субстанции, поддерживающие аутоиммунные процессы. Опасны в отношении аллергизации организма и мицелиальные грибы рода Aspergillus [2].
Дисбиотические нарушения ведут к утрате кишечной микрофлорой ее способности к детоксикации продуктов белкового обмена (индола, скатола, фенола и др.), ксенобиотиков, гистамина, бактериальных токсинов, других субстратов и метаболитов экзогенного и эндогенного происхождения. Преобладающие при дисбактериозе у животных факультативные анаэробы и аэробы не только менее эффективны, но и сами продуцируют широкий спектр токсических веществ. Это увеличивает нагрузку на печень, способствуя развитию или отягощению её морфофункциональных изменений.
Следует отметить, что среди метаболитов патогенных и условно-патогенных бактерий есть канцерогены и вещества, активизирующие рост опухолей (производные триптофана, желчных кислот, 7-дегидрогеназы и др.) [3].
При дисбактериозах в кишечнике может интенсифицироваться процесс декарбоксилирования аминокислот, из-за чего резко возрастает уровень биогенных аминов, ведущих к нарушениям ряда функций организма. Так при эшерихиозном, протейном, стафилококковом, а также смешанном дисбактериозе у животных часто продуцируется в избытке гистамин. Воспаленная, поврежденная слизистая кишечника снижает или прекращает синтез разрушающего его фермента гистаминазы. Это способствует развитию язвенных поражений желудка и двенадцатиперстной кишки, гипотонии, разного рода аллергических реакций, нарушению функций эндокринной системы организма [12]. Аллергические реакции и декарбоксилазная активность кишечных микроорганизмов ведут к повреждению тучных клеток дополнительному освобождению из них гистамина, серотонина, лейкотриенов и других веществ, усиливающих морфологические дефекты слизистой, воспалительный процесс, нарушающие моторную и секреторную ее функции.
Следует помнить о том, что для макроорганизма вредно не только увеличение, но и чрезмерное снижение численности в кишечнике условнопатогенных бактерий (дефицитные формы дисбактериоза). В первую очередь это относится к уменьшению количества нормальных эшерихий, что ведет к снижению числа плазматических клеток, продуцирующих секреторный IgA, активный в отношении эшерихий и других энтеробактерий, имеющих с ними антигенное родство. Недостаток IgA и его секреторного компонента ведёт к уменьшению вирус- и токсиннейтрализующей активности, способности подавлять адгезию патогенов на энтероцитах. Ослабление местного иммунитета слизистой оболочки в таких случаях может оказаться решающим фактором в развитии инфекционного процесса как бактериальной, так и вирусной этиологии.
Таким образом, дисбиотические нарушения при применении антибактериальной терапии могут приводить к существенным изменениям со стороны макроорганизма и требуют адекватной коррекции.
Способность лекарственных препаратов других групп вызывать или усугублять нарушение микроэкологии в желудочно-кишечном тракте
Нарушение микроэкологии в желудочно-кишечном тракте , ведущей к дисбактериозу животных, можно наблюдать при назначении многих групп лекарственных препаратов.
В доступной литературе мало изучен вопрос о влиянии на микрофлору кишечника антигельминтиков.
В опытах in vitro при испытании некоторых антигельминтных препаратов нами были получены следующие результаты. Ивомек в дозе 0,1 мл не задерживал рост эшерихий, бацилл, стафилококков и имел слабо выраженный бактериостатический эффект в отношении энтерококков, лактобактерий и бифидобактерий. В дозе 0,2 мл эффект задержки роста микроорганизмов был слабо выраженным в отношении всех исследованных тест-культур. В целом к действию ивомека in vitro наиболее чувствительными оказались бифидобактерии (зоны задержки роста 10,0±0,47 мм и 12,0±0,47 мм при назначении препарата в дозах 0,1 мл и 0,2 мл).
Пирантел в дозе 0,1 мл не влиял на рост эшерихий, бацилл и стафилококка, но также проявлял ингибирующий эффект в отношении энтерококков (14,6±0,98 мм), лактобактерий (12,3±0,72 мм) и бифидобактерий (13,0±0,81 мм). В дозе 0,2 мл он слабо задерживал рост эшерихий, бацилл и стафилококков, но имел резко выраженный ингибирующий эффект на лактобактерии (18,0±0,47 мм) и энтерококки (28,3±0,72 мм).
Наибольшим антибактериальным действием обладал вальбазен. В дозе 0,1 мл он слабо задерживал рост эшерихий, бацилл, энтерококков и лактобактерий. Наиболее чувствительными к препарату в этой дозе оказались бифидобактерии (14,3±0,27 мм) и стафилококки (18,0±0,94 мм). В дозе 0,2 мл он слабо задерживал рост бацилл и эшерихий и проявлял выраженный ингибирующий эффект ко всем остальным испытанным тест-культурам.
Антибактериальную активность антигельминтиков у здоровых собак in vivo изучали при обработках декарисом и пирантелом. До обработки, на 2-е и 14-е сутки после обработки проводили бактериологические исследования фекалий.
Обработка декарисом вела к незначительному уменьшению в фекалиях на вторые сутки бифидобактерий (с 8,3 до 7,3 lg/г), лактобактерий (7,5 до 6,9 lg/г), энтерококков (с 7,6 до 7,2 lg/г). Общее число эшерихий не изменялось, но снижалась их доля со слабой лактазной активностью. Уменьшалось число грибов рода Candida с 6,2 до 4,01 lg/г. Одновременно отмечено незначительное увеличение числа стафилококков, спорообразующих аэробных бактерий, дрожжей и плесеней. Сходные изменения в кишечном микробиоценозе были отмечены и при обработке собак пирантелом.
У здоровых животных к 14-дневному сроку состав кишечной микрофлоры был близким к исходным показателям.
Группу риска составляли молодые, старые и ослабленные животные, а также пациенты с сопутствующей патологией или латентным дисбиотическим состоянием. У них во многих случаях сдвиги в микробиоценозе после дегельминтизаций были более продолжительными и требовали дополнительной коррекции. Известно, что гельминтозы сами сопровождаются микроэкологическими нарушениями, степень которых зависит от интенсивности инвазии. Неизбежное при этом применение антигельминтных препаратов с одной стороны способствует уничтожению паразитов, а с другой – усугублению состояния дисбактериоза у животных. В экспериментах на овцах со спонтанной ассоциативной трихостронгилидной инвазией нами показано, что глубокие дисбиотические изменения после лечения животных вальбазеном и полного их освобождения от паразитов, сохранялись более 21 дня (срок наблюдения). Аналогичные результаты были отмечены на продуктивной птице.
Цитостатики и иммунодепрессанты, в том числе глюкокортикоиды оказывают выраженное действие на микробиоценоз кишечника. Они применяются при тяжелых заболеваниях, угнетают иммунитет, кроме того, часто сочетаются с другими, в том числе антибиотическими препаратами. По нашим данным, цитостатики у животных способствуют развитию длительных дисбиотических нарушений, ведут к повреждению и атрофии энтероцитов и снижению синтеза секреторного IgA. Кортикостероидные препараты усиливают рост грибов рода Candida.
Противоопухолевая химиотерапия, особенно в сочетании с лучевой терапией, также влияет на весь организм, в том числе на желудочно-кишечный тракт. Среди осложнений особое место занимают диарея, рвота, потеря аппетита. Это приводит к дегидратации, гиповолемии, способствует появлению анорексии и раковой кахексии. Противоопухолевые препараты, действуя на быстро пролиферирующие клетки, поражают и энтероциты, нарушая условия персистенции нормальной флоры в кишечнике, что может привести к дисбактериозу у животных [5].Тяжелые дисбиотические состояния регистрируются практически у всех животных.
В последнее время широкое применение в ветеринарии нашли препараты, изменяющие естественные барьерные функции энтерального тракта. В первую очередь это антацидные средства, снижающие кислотность желудочного сока (альмагель, ранитидин, циметидин, фамотидин, омепразол и другие). Но при уменьшении секреции соляной кислоты и пепсина, что, безусловно, необходимо при коррекции многих заболеваний, теряется барьерная функция в отношении транзиторной, в том числе патогенной, микрофлоры. Дисбиотические состояния той или иной степени у таких животных обычны, особенно с учетом необходимости длительного курса лечения указанными препаратами.
Нарушение микробиоценоза макроорганизма способны вызвать многие другие лекарственные препараты. Изменяя моторику кишечника и нарушая образование в нем муцина, к дисбактериозу у животных может привести наркоз, назначение рвотных, обволакивающих, желчегонных средств. Хорошо известен дисбиотический потенциал широкой группы антигистаминных препаратов (димедрол, супрастин, пипольфен, фенкарол, диазолин, димебон, перитол), которые наряду с блокадой Н1-рецепторов гистамина, сосудосуживающим и другими фармакологическими эффектами, способны ингибировать рост различных грамнегативных и грампозитивных бактерий. Это происходит за счет взаимодействия с рецепторами клеточных мембран бактерий, что изменяет их проницаемость для предшественников нуклеиновых кислот и белков [11]. Перитол, тавегил, димебон, фенкарол более активны в отношении грамположительных, а димедрол, пипольфен и супрастин – в отношении грамотрицательных бактерий. Антибактериальный эффект антигистаминных препаратов потенцируется различными антибиотиками, особенно аминогликозидами. В опытах in vitro [4] показан антибактериальный эффект большой группы лекарственных средств, относящихся к антидепрессантам (инказин, пиразидол, тетриндол), противоопухолевым препаратам (проспидин, спиробромин, тамоксифен), нестероидным противовоспалительным (ортофен, напроксен, производные салициловой кислоты).
На структуру и функцию энтероцитов кишечника, а, следовательно, и микробиоценоз влияют сердечные гликозиды, аллопуринол, колхицин и многие другие лекарственные средства.
Как видно из приведенных выше примеров, спектр лекарственных препаратов, применение которых может приводить к изменениям состава и функций микрофлоры организма хозяина, достаточно широк. Он увеличивается по мере проведения исследований в этом направлении. Это делает актуальным разработку способов фармакокоррекции указанных состояний.
Следует добавить, что на микробиоценоз влияют также тип кормления, кровопотери, хирургические вмешательства, гормональные нарушения, разнообразные стрессы, лейкопения, новообразования, ионизирующая радиация, ксенобиотики, поступающие в организм с кормом или водой. Холециститы, панкреатиты, гепатопатии, гастриты, язвы желудка или двенадцатиперстной кишки, другие заболевания могут быть как причинами развития дисбактериоза у животных, так и его следствием. Все это необходимо учитывать при назначении комплекса средств медикаментозной терапии.
Игнорирование возможных дисбиотических нарушений при той или иной патологии, при использовании лекарственных препаратов, отказ от применения средств и методов коррекции дисбактериоза – одна из серьезнейших ошибок в терапевтической практике, снижающая эффективность лечебных мероприятий при многих заболеваниях.
Литература:
1. Ануфриева Р.Г. Влияние рифампицина на генеративную функцию и микробную экологию кишечника (экспериментальное исследование). // Дисс. канд. биол. наук. М., 1990.
2. Барановский А.Ю., Кондрашина Э.А. Дисбактериоз и дисбиоз кишечника. – СПб, «Питер»,2002.
3. Гребенев А.Л., Мягкова Л.П. Кишечный дисбактериоз // Руководство по гастроэнтерологии в 3 томах. – М., 1996.
4. Гуськова Т.А., Пушкина Т.В. Дисбиотические состояния – как побочные эффекты лекарственных средств неантибиотической группы. // Тез. докл. конф. «Дисбактериозы и эубиотики». М., 1996.
5. Дональд К. Пламб. Фармакологические препараты в ветеринарной медицине. – М.: Аквариум, 2002.
6. Красноголовцев В.Н. Дисбактериозы кишечника. – М.: Медицина,1989.
7. Лапчинская А.В., Шендеров Б.А., Чахава О.В. и др. Изменение микрофлоры толстой кишки крыс при оральном введении цефалексина и эритромицина. // Антибиотики и медицинская биотехнология. 1987, № 3.
8. Субботин В.В., Данилевская Н.В. Микрофлора кишечника собак: физиологическое значение, возрастная динамика, дисбактериозы, коррекция. Часть 1. Нормальная микрофлора кишечника собак.// Ветеринар. 2002, № 1.
9. Субботин В.В., Данилевская Н.В. Микрофлора кишечника собак: физиологическое значение, возрастная динамика, дисбактериозы, коррекция. Часть 2. Возрастная динамика микрофлоры кишечника собак. // Ветеринар. 2002, № 4.
10. Чахава О.В., Горская Е.М., Рубан С.З. Микробиологические и иммунологические основы гнотобиологии. – М, 1982.
11. Шевелева Н.Е. Антимикробные свойства блокаторов Н1-рецепторов гистамина. // Автореф. дисс. канд. биол. наук., М., 1991.
12. Уголев А.М. Теория адекватного питания и трофология. – СПб, 1991.
13. Finegold S.P., Mathisen C.E., George W.L. // In: Human Intestinal Microflora in Heals and Disease (ed. D.S.Hentges), Acad. Press. NY, 1983.
14. Shenderov B.A., Mitrokhin S.D., Zaslavskaya P.L. The effect of antibiotics on excretion of different metabolites in the faeces of rats.// Microecol. Terapy, 1990, vol. 20.
15. Wells C.L., Madaus M.A., Jechrek R.P. et al. – In: Gnotobiology and its application. Versal, 1987.
СВМ № 1/2003