Е. Гогер, Г. Бурдвазу
У кошки европейской породы в возрасте 7 лет, на фоне иммуносупрессивного состояния под воздействием FIV, выявлена дерматофитная мицетома.
Дерматофитии — это поверхностные дерматомикозы, возникающие вследствие инокуляции, инфицирования и заражения патогенными эпидермотропными грибами с кератинофильными и кератинолитическими свойствами, относящимися к группе дерматофитов, в основном, к роду микроспории (Microsporum) и трихофитии (Trichophyton). У кошек клинические признаки дерматомикозов характеризуются выраженным полиморфизмом [монетовидная, центробежно развивающаяся алопеция, милиарный (просяной) дерматит, локальная или генерализованная корковая депиляция, региональная или генерализованная кератосеборея, перионихии (воспаления мягких тканей около когтей) и онихии (поражение когтя по причине воспаления когтевого ложа), а также керионы и т.д.] (D.N. Carloti, B. Couprie, 1988).
Иногда дерматофиты способны инокулироваться в дерму, гиподерму или в соединительнотканные фасции. Они могут стать причиной псевдоновообразований и повреждений, которые называют мицетомами (J. Euzeby, 1992, 1944). У кошки дерматофитные мицетомы встречаются редко и, вероятно, только у персидской породы (M. Bourdin et coll., 1975; P.A. Tuttle, 1983; J.A. Yager et coll., 1986; W.H. Miller, M.H. Goldchmidt, 1986; L. Midleau P.M. Rakich, 1994; M. Corazza, 1998).
Исследование мицетомы, вызванной Microsporum canis у кошки европейской породы, вызвало необходимость описать клиническую картину, а также на конкретном случае получить данные гистоморфологических и терапевтических исследований в ассоциации с хирургическим иссечением и системным назначением антифунгоидного итраконазола.
1. Описание клинического случая
Кошка европейской породы в возрасте 7 лет была обследована по причине обнаружения безболезненного узла, локализующегося на боковой поверхности туловища и развивающегося в течение четырех месяцев. Кошка живет в доме и имеет возможность выходить во внешнюю среду, где она встречается со своими сородичами. Год назад у нее выявляли дерматофитию, вызываемую Microsporum canis, клинически характеризующуюся сквамозной депиляцией на наружной поверхности преддверия ушных раковин и дистальной части передних (грудных) конечностей. Лечение путем системного назначения антифунгоидного препарата кетоконазола (Ketofongol 50 ND, 10 мг/кг/в сутки перорально вместе с кормом), проводимое каждые четыре дня на протяжении шести недель в сочетании с топическим применением антифунгоидного препарата эниоконазола (Imaveral ND), разведенного в 50 раз (0,2% р-р, раз в четыре дня в течение шести недель), обеспечило полное клиническое выздоровление животного. С этого момента никакого контроля в отношении элиминации грибов не проводили.
На день консультации было проведено общее клиническое обследование, при котором не удалось выявить каких-либо специфических изменений. При обследовании кожного покрова не удалось выявить хоть каких-нибудь алопецических нарушений, но при этом отмечали дискретную себорею. На левой стороне боковой поверхности туловища, было обнаружено присутствие только одного узелка в диаметре 4 см, с углублением в центре и недавно проявившимся изъязвлением (фото 1). Выделения из узелка сопровождались наличием желтоватых зерен.
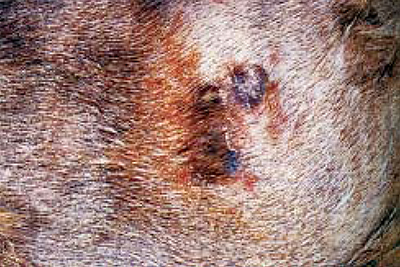 |
| Фото 1. Мицетома, вызванная Microsporum canis. |
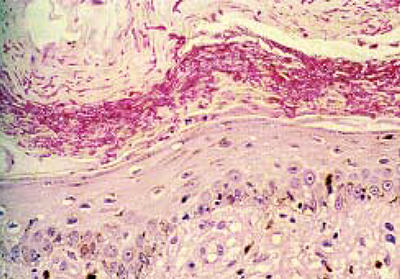
Предположительный диагноз был ориентирован на паникулит полиэтиотропной природы (бактерии, грибы, опухоли и т.д.). Учитывая локализацию образования на боковой поверхности туловища, было принято решение о проведении обширной хирургической операции. После ушивания иссеченного участка кожного покрова, одну часть биопсийного материала поместили в 10% р-р формальдегида для проведения дальнейшего рутинного гистоморфологического исследования (окраска гемотоксилин-эозином и применение кислой поэтапной реакции Шифа), тогда как другую после растирания в ступке посеяли на среду Сабуро с добавлением хлорамфеникола и актидиона. Помимо этого, животное было подвержено классическому микологическому обследованию. Проведенные исследования с помощью лампы Вуда, а также шерстного покрова и чешуек, взятых с периферийной части узла, не позволили выявить инвазии волосяного покрова, которая была бы возможна с помощью филаментов и спор. И, наконец, культуральный высев для обнаружения грибов осуществляли на среде Сабуро с добавлением хлорамфеникола и актидиона, используя при этом шерсть и десквамированную часть кожного покрова (чешуйки), полученного путем вычесывания с помощью стерильной зубной щетки. При проведении клинического и биохимического анализов крови (мочевина, креатинин, глюкоза, ALAT, PAL, GGT) каких-либо отклонений от нормы установлено не было. Исследование на инфицирование ретровирусами дало негативную реакцию в отношении FeLV и позитивную для FIV. Гистоморфологическое исследование элементов биопсийного материала свидетельствует о наличии в глубоком слое дермы и жировой части подкожной клетчатки, гранулем, центрированных на фунгоидных элементах, окруженных эпителиоидными макрофагами, а также гистиоцитами, небольшим количеством гигантских полинуклеарных клеток, плазмоцитов и нейтрофильных гранулоцитов (фото 2). Ни одного фунгоидного элемента не было выявлено в поверхностной части кератина эпидермального слоя и в волосяных фолликулах кожного покрова. По истечении десяти дней в обеих средах было обнаружено множество колоний мицелярной формы, имеющих картину пуха желто-оранжевого цвета как на поверхности, так и внутри культуральной среды. На третью неделю в расплавленной, утолщенной и омертвевшей стенке макроконид было обнаружено и идентифицировано шесть ячеек, относящихся к дерматофиту Microsporum canis.
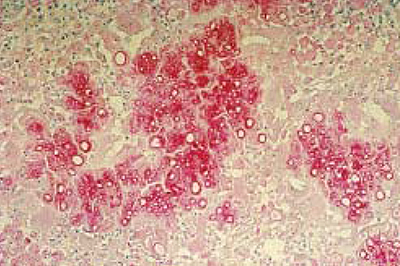 |
| Фото 2. Гистоморфологическое исследование: следует отметить наличие фунгоидных гранулем, локализующихся в центре на колониях Microsporum canis (окраска PAS, ×250). |
На основании проведенных исследований поставлен окончательный диагноз — дерматофитная мицетома, вызванная Microsporum canis, в ассоциации с инфекцией FIV.
Предшествующее этому хирургическое иссечение патологического очага было дополнено системным назначением антифунгоидного препарата итраконазола. Итраконазол относится к триазолам, который в отличие от эмидазола и кетаконазола, более эффективен и менее токсичен. На первом этапе лечения препарат назначали в дозе 10 мг/кг перорально в форме сиропа с интервалом 24 часа в течение шести недель. Повторный высев на грибы из шерстного покрова и чешуек, собранных с помощью стерильной зубной щетки, был осуществлен к концу шестой недели. За время ожидания результатов высева лечение итраконазолом продолжали в течение двух недель. Результаты культурального роста из волосяного покрова и чешуек оказались негативными. Лечение с помощью итраконазола продолжали в течение двух недель. В целом полный курс лечения итраконазолом составил десять недель. Какого-либо вторичного эффекта на уровне клинического состояния пациента, а также биохимического исследования (изменения ферментативного состава печени) на протяжении всего курса лечения выявлено не было. Очередной культуральный высев грибов, осуществляемый по той же схеме, проводили через 3 месяца с момента прерывания курса лечения итраконазолом. Результаты высева оказались негативными (отсутствие роста грибов).
 |
 |
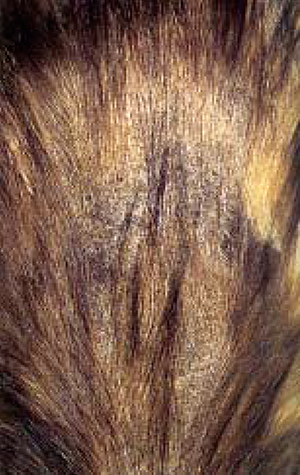
| Фото 3. Сквамозный дерматит в дорсолюмбальной области. | Фото 4. Хвост в состоянии кератосебореи. |
Через шесть месяцев у кошки с мицетомой, которая была представлена на консультацию, отмечали наличие распространяющейся сквамозной гиперпигментированной алопеции по поверхности грудного, поясничного отделов, позвоночного столба и хвосте (фото 3, 4). Прурит при этом не наблюдали. Исследование кожного соскоба, а также использование для этой цели лампы Вуда, подтвердили отсутствие возбудителя инфекции. Микроскопическое исследование шерстного покрова и чешуек указывает на присутствие распространения по волосяному покрову спор эндоэктотрихий. Высев шерстного покрова и чешуек, взятых с помощью гемостатического пинцета, с периферии пораженного участка кожного покрова на среду Сабуро с добавлением хлорамфеникола и актидиона, через три недели позволило идентифицировать микроконидии, типичные для Microsporum canis. Гистоморфологическое исследование пораженных участков биопсийного материала указывает на ярко выраженное уплотнение филаментов мицелий, локализующихся в гипер- и ортокератозном эпидермальном слое и фолликулах с лихеноидной формой дерматита, представленного с внутренней поверхности в основном лимфоцитами и плазмоцитами, (фото 5) и повреждениями в форме фурункулезных дерматофитных нарушений (фото 6).
Учитывая выраженное проявление дерматофитии и прогрессирующее ухудшение общего состояния пациента, вне всякого сомнения, ассоциирующееся с инфицированием FIV, владельцы попросили провести эвтаназию животного.
2. Обсуждение
Термин «мицетома» означает гранулематозное или пиогранулематозное псевдоонкологическое образование в дермальном или гиподермальном слое кожного покрова, а также в соединительной фасции. Это образование содержит нагноения в гранулах, которые формируются бактериями или грибами, что подтверждается их идентификацией при выделении в виде чистых культур, выращенных на специальной среде. По данным J. Euzeby, (1992, 1944), эти мицетомы встречаются в единственном количестве и возникают, в основном, при локальной инокуляции грибов или бактерий по причине проникающего ранения, укуса и т.д. Фунгоидные мицетомы носят исключительный характер и возникают при инокуляции дерматофитов, которые чаще относятся к роду Microsporum canis или грибам разных родов: Rhizomucor, Mortierella, Fusarium, Paecilomyces, Alternaria, Bipoloris, Cladosporium и т.д. (C.S. Foil, 1998). Что касается кошек, то все случаи дермофитных мицетом были выявлены у персидской породы (M. Bourdin et coll., 1975; P.A. Tuttle, 1983; J.A. Yager et coll., 1986; W.H. Miller, M.H. Goldchmidt, 1986; L. Midleau P.M. Rakich, 1994; M. Corazza, 1998). В собственных клинических исследованиях мы впервые описываем эти заболевания у другой породы. У персидской породы наиболее высокая частота асимптоматического течения заболевания, которое, вероятно, относится к мицетомам, вызываемым Microsporum canis в результате ранений. Наиболее часто мицетома ассоциируется с сопутствующей или более ранней дерматофитией (P.A. Tuttle, 1983; J.A. Yager et coll., 1986; W.H. Miller, M.H. Goldchmidt, 1986; L. Midleau P.M. Rakich, 1994; M. Corazza, 1998), как это имело место и в нашем случае. Развитие дерматофитий в кератиновом слое, в дерме и гиподерме, а также в соединительных фасциях происходит при определенных условиях (увеличение патогенности некоторых штаммов Microsporum canis, снижение резистентности хозяина, вследствие иммуносупрессии, вызванной ретровирусами) (Shaw S.E. et coll. 1990). В нашем случае сопутствующее инфицирование FIV, что очень важно, облегчило проявление мицетомы и инфестации дерматофитии на теле животного в форме мицелярных филаментов.
На данный момент нет исследований, которые доказывают наличие оппортунистических дерматозов, связанных с FIV (K. Hartman, W. Kraft,
1998). В одном из клинических случаев у человека сообщается об ассоциации между ретровирусами и оппортунистическими дерматозами. С другой стороны, в некоторых исследованиях выявлена ассоциация между некоторыми клиническими манифестациями и инфекцией, вызываемой этими ретровирусами (Shaw S.E. et coll. 1990). Появление оппортунистических дерматозов находится во взаимосвязи с более ранним проявлением иммунодепрессии, возникающей на клеточном уровне. В целом прогноз лечения кошки, инфицированной FIV, до появления у нее признаков, свидетельствующих о полном формировании иммунодефицита на уровне целлюлярного аппарата, не хуже чем у индемной (indemne) особи (K. Hartman, W. Kraft, 1998). В настоящее время имеется лишь незначительное число публикаций в отношении развития фунгоидной флоры кожного покрова у кошек, инфицированных ретровирусами (P. Sierra, 1997). Тем не менее, следует обратить внимание на то, что носительство грибов (роды и виды) наиболее характерно для кошек, инфицированных ретровирусами (F. Manciani et coll., 1992). У этих особей носительство Microsporum canis сильно варьируется и, согласно анкетированию, оно колеблется в пределах 10–75%. В основном эти вариации объясняются слишком разными формами проявления у тестированных популяций кошек (P. Sierra, 1997; F. Manciani et coll., 1992). Ни в одном из исследований также не говорится о том, что поверхностные и глубокие микозы чаще проявляются у кошек, инфицированных ретровирусами. Кроме того, мы можем сказать, что клинически они протекают намного тяжелее и содержат гораздо больше фунгоидных элементов, которые требуют более длительных курсов лечения и часто завершаются не полностью, даже при наличии поверхностных микозов, как это имело место и в нашем случае.
Лечение дерматофитных мицетом часто завершается неудачей (M. Bourdin et coll., 1975; P.A. Tuttle, 1983; W.H. Miller, M.H. Goldchmidt, 1986). Их хирургическое иссечение является недостаточным, поэтому необходимо проводить дополнительную системную антифунгоидную терапию. Что касается гризеофульвина, то результаты терапевтического вмешательства при его назначении неодинаковы (M. Corazza, 1998), и, с другой стороны, такой способ лечения противопоказан кошкам, инфицированным FIV, в связи с возможной индукцией аплазии костного мозга (G.H. Shelton et coll., 1990). Кетоконазол, который не имеет разрешения его реализации на рынке для кошек, при лечении дерматофитных мицетом также дает противоречивые результаты (W.H. Miller, M.H. Goldchmidt, 1986). С другой стороны, его назначение может давать осложнение на печень (рвоты, диарея, анорексия, иктеричность и повышение уровня ферментов печени) у представителей данного вида (L. Medleu, S.A. Chalmers, 1992; B.R. Mignon, B.J. Losson, 1997). Наконец, итраконазол является азолированным, фунгицидным веществом, к которому проявляется большой интерес в лечении дерматофитий (L. Medleau, P.M. Rakich, 1994; K.A. Moriello, D.J. De Boer, 1995). Он, как все дериваты азолов, действует на цитоплазму через P450 митохондрий. В отличие от других имидазолов, он обладает более специфическим действием на фунгоидные клетки и менее выраженным аффинитетом (сродством) к клеткам млекопитающих. Эти фармакокинетические свойства препарата характеризуются более длительным периодом полураспада в плазме (17–19 часов), наибольшим объемом распределения и концентрации в тканях, которая в 10–20 раз превышает таковую в сыворотке, что является основной причиной его применения для лечения глубоких микозов (H. Degreef, 1993; W. Meinhof, 1993; M.C. Heit, J.E. Riviere, 1995). В случае дерматофитий и дерматофитных мицетом, его назначение выверено наиболее точно и составляет 10 мг/кг в сутки в один прием перорально (W.H. Miller, M.H. Goldchmidt, 1986; L. Medleu, S.A. Chalmers, 1992; K.A. Moriello, D.J. De Boer, 1995), хотя его применение в более низких дозах (3 мг/кг перорально один раз в сутки), вероятно, также имеет благоприятный эффект терапевтического воздействия (F. Manciani, F. Pedonese, 1998). Вероятно толерантность к итраконазолу у кошек более выражена в отличие от кеназола. Если учесть его гепатотоксичность у собаки, то биохимическое исследование печени необходимо проводить регулярно. Эта редко возникающая гепатотоксичность, вероятно, объясняет его назначение в дозе 20 мг/кг в сутки в один прием (L. Medleau, P.M. Rakich, 1994). Наконец, следует иметь в виду, что использование итраконазола также противопоказано для беременных самок.
СВМ 2/2006