Обзор
Ксения Лисицкая, к. б. н., морфолог, гематолог, гистолог ветеринарной клиники «Биоконтроль», Москва
Lisitskaya Ksenia Valeryevna, Veterinary clinic Biocontrol, Moscow, e–mail: lisksenia@mail.ru
Резюме
Эритроциты мелких домашних животных постоянно подвергаются воздействию окислительного стресса, который создают окислители, как образующиеся в процессе нормальных метаболических реакций, так и поступающие из окружающей среды. В связи с ограниченными синтетическими способностями эритроцитов при воздействии оксидативного стресса, превышающего защитные механизмы клеток, эритроциты могут необратимо повреждаться. Окислительное повреждение эритроцитов может приводить к формированию метгемоглобина, телец Гейнца (Хайнца) и эссентроцитов. Среди наиболее широко известных причин оксидативного повреждения эритроцитов у собак является потребление лука и чеснока, лекарственных препаратов, таких как бензокаин и парацетамол, цинк и нафталин. У кошек наиболее часто встречается отравление пропиленгликолем, ацетаминофеном. В данной статье рассматриваются наиболее частые экзогенные причины, приводящие к окислительному повреждению эритроцитов у собак и кошек, рассмотрены клинические находки и диагностические тесты, а также кратко очерчиваются некоторые аспекты терапии.
Ключевые слова: анемия, антиоксиданты, гемолиз, лук, метгемоглобин, окислительный стресс, тельца Гейнца, эритроциты
Введение
В ходе протекания нормальных метаболических процессов в организме собак и кошек образуются активные формы кислорода и азота [1]. В небольших концентрациях они не вызывают значимого нарушения функций организма. Например, отмечено, что в ходе протекания метаболических реакций у собак образуется 3% метгемоглобина, который не обладает способностью связывать и переносить кислород [1]. Функцию защиты организма от окислительного стресса выполняет целый спектр ферментов, включая глутатион, супероксид дисмутазу, каталазу и другие [1]. Однако различные патологические состояния могут приводить к усилению эндогенного окислительного стресса, что отмечено, например, у кошек на фоне сахарного диабета [2]. Кроме того, описан целый спектр различных соединений, приводящих к оксидативному повреждению эритроцитов.
Окислительные реакции могут приводить к повреждению различных структур эритроцитов: мембран, гемоглобина, белков цитоплазмы. При окислении в молекулах гемоглобина двухвалентного железа до трёхвалентного происходит формирование метгемоглобина [1]. Необратимая денатурация белковой части молекулы гемоглобина приводит к появлению эритроцитов с тельцами Гейнца (Хайнца) [3]. Повреждение мембран приводит к появлению клеток эссентроцитов, что в дальнейшем может проявляться как внутрисосудистым гемолизом, так и сокращением времени жизни эритроцитов в результате эритрофагоцитоза патологически изменённых клеток, прежде всего, в макрофагах селезёнки [3].
Характер и степень клинических проявлений в каждом отдельном случае зависят от вида животного и типа соединения, а также интенсивности его воздействия (количества и кратности). Отмечено, что различные виды животных в разной степени подвержены оксидативному повреждению эритроцитов. Так, кошки более подвержены окислительному повреждению эритроцитов по сравнению с собаками, что обусловлено, во-первых, особенностью химического строения молекулы гемоглобина. Так, у кошек в молекуле гемоглобина представлено до 8 сульфгидрильных групп (вместо 2 у других видов), что приводит к более активной диссоциации гемоглобина с образованием димеров из тетрамеров [3]. Во-вторых, особенности строения селезёнки кошек приводят к неактивному удалению из кровотока образующихся в эритроцитах телец Гейнца [3]. В связи с этим кошки не только более подвержены формированию телец Гейнца при различных патологических состояниях, но данные тельца также могут быть в эритроцитах в отсутствие анемии [3].
Метгемоглобин
Метгемоглобин образуется, когда железо в молекуле гемоглобина окисляется из двухвалентного в трёхвалентное, в результате этого теряется способность переносить кислород. Отмечено, что у здоровых животных до 3% всех молекул гемоглобина окисляется до метгемоглобина в течение суток, однако в норме детектируется количество, как правило, не превышающее 1–1,5% [1]. Причиной поддержания низкого уровня метгемоглобина является функционирование ферментативной системы, включающей цитохром b5 и цитохром b5-редуктазу, которая восстанавливает 99% образующегося метгемоглобина, в меньшей степени восстановление до гемоглобина происходит при участии фермента NADH-метгемоглобин-редуктазы [4].
При накоплении в крови метгемоглобина говорят о метгемоглобинемии. Клинические проявления метгемоглобинемии зависят от его содержания в крови и у человека начинают развиваться при наличии > 20% метгемоглобина, при повышении до 50% развиваются непереносимость физических нагрузок, усталость и обмороки, тогда как содержание метгемоглобина > 50% ассоциировано с судорогами, комой и гибелью [5]. У собак и кошек с метгемоглобинемией отмечают наличие бледных и цианотичных слизистых оболочек, носового зеркала и подушечек лап, непереносимости физических нагрузок, летаргии, которые развиваются в результате гипоперфузии тканей, а также гибель [4, 5].
Причины развития метгемоглобинемии
У животных метгемоглобинемия может иметь как врождённый, так и приобретённый характер. Врождённые метгемоглобинемии описаны у собак пород чихуахуа, борзая, пудель, кокер-пудель, американская эскимосская собака, вельш-корги, английский сеттер, померанский шпиц, у метисов терьеров, а также у домашних короткошёрстных кошек [6]. Как правило, такие находки являются случайными при плановом приёме у ветеринара, а симптоматика часто выражена слабо. Так, McKenna J.A. et al. (2014) описывает клинический случай врождённой метгемоглобинемии у 4-летнего кастрированного метиса питбуля, с цианозом слизистых оболочек, плохой сатурацией гемоглобина, выявленной во время индукционного наркоза для проведения плановой операции по коррекции передней крестообразной связки. В результате секвенирования генов было выявлено два потенциальных варианта в гене цитохрома b5 (CYB5A), которые могли быть ассоциированы с развитием метгемоглобинемии [4].
Приобретённая метгемоглобинемия у собак и кошек развивается в результате воздействия на организм различных соединений, среди наиболее часто описанных в литературе таковыми являются: парацетамол (ацетаминофен), бензокаин, гидроксимочевина (собаки), феназопиридин (кошки), нитриты и нитраты (собаки и кошки) [7–9]. Среди описанных препаратов наибольшее внимание в литературе уделяется парацетамолу в связи с широтой использования в человеческой медицине. Парацетамол — анальгетик и антипиретик, который является ингибитором ЦОГ-3. При пероральном приёме собакой или кошкой препарат быстро всасывается. Описанные токсические дозировки парацетамола для собак 75-100 мг/кг, при этом образование метгемоглобина отмечается при дозировке свыше 200 мг/кг в связи с активной глюкуронизацией печенью [10]. У кошек токсическая дозировка значительно ниже и составляет 10 мг/кг, что делает кошек значительно более восприимчивыми к токсическому воздействию препарата [11]. У кошек при употреблении токсической дозировки парацетамола отмечается стремительное развитие симптомов метгемоглобинемии: отёк морды, анорексия, слюнотечение, летаргия, цианоз, отмечается тёмно-коричневый цвет крови, прогрессирует тахипноэ [11]. В дальнейшем развивается анемия с тельцами Гейнца, печёночная недостаточность, наступает гибель. У собак токсическое воздействие парацетамола ассоциировано с развитием печёночной недостаточности [10].
Среди других причин развития метгемоглобинемии у собак можно выделить интересный клинический случай, описанный Zaks K. et al. (2005) и произошедший с 5-летней стерилизованной самкой питбуля, которая после прогулки вернулась домой с запахом секрета скунса от шерсти. У собаки отмечалось коричневое окрашивание слизистых, тахикардия, коричневая моча. Спустя 3 суток отмечалось падение гематокрита до 15%, при этом в мазке крови выявлялись в большом количестве эритроциты с тельцами Гейнца. Таким образом, секрет скунса, в котором содержатся тиолы и другие гипотетические оксидативные соединения, согласно мнению авторов, мог вызвать метгемоглобинемию [12].
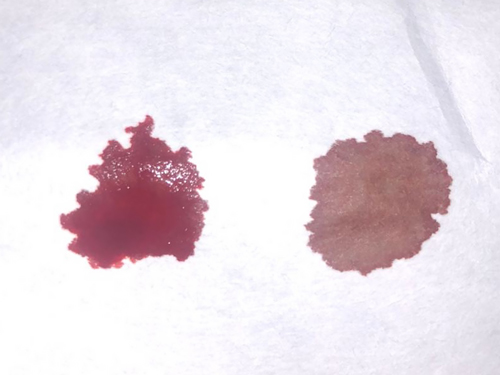 |
| Рис. 1. Тест с фильтровальной бумагой. Капли крови от контрольного пациента (норма — слева) и пациента с метгемоглобинемией (справа — шоколадно-коричневое окрашивание капли крови) |
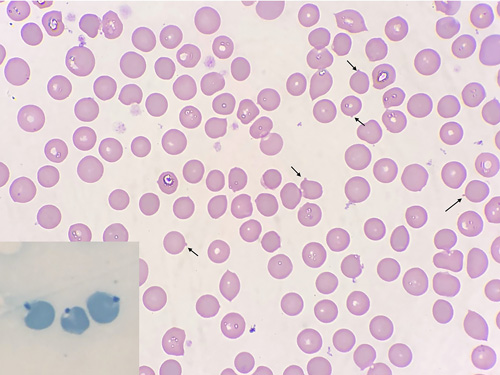 |
| Рис. 2. Мазок крови от собаки с анемией, в анамнезе поедание лука, окраска по Романовскому. В эритроцитах представлены тельца Гейнца — небольшие округлые выпячивания мембраны (отмечены чёрными стрелками). Внизу слева — тельца Гейнца синего цвета, окраска метиленовым синим |
Анализы для подтверждения метгемоглобинемии
Диагностика метгемоглобинемии может проводиться посредством различных тестов. Тест с фильтровальной бумагой является наиболее простым: на фильтровальную бумагу наносится капля крови пациента, в качестве контроля наносят кровь от здорового животного. При содержании более чем 10% метгемоглобина кровь приобретает коричневый цвет, что отмечается при сравнении с контрольным образцом (рис. 1) [4, 13]. Определение уровня метгемоглобина проводится спектрофотометрически (длина волны 630 нм) после добавления цианида, однако данная методика проводится в специализированных лабораториях и малодоступна для большинства клиницистов [13]. Другим методом определения содержания метгемоглобина в крови является оптическая спектроскопия [12].
Терапия метгемоглобинемии
Метиленовый синий считается методом выбора для пациентов с клиническими признаками приобретённой метгемоглобинемии, также описано его применение собакам и кошкам при наследственных случаях в дозировке 1 мг/кг внутривенно в течение 20 минут [4, 5]. Метиленовый синий следует с осторожностью применять кошкам с метгемоглобинемией и анемией с тельцами Гейнца в связи с возможностью более активного формирования последних. Наряду с инфузионной терапией проводят терапию развивающейся гипоксемии (кислородная терапия, переливание кровепродуктов).
Для терапии парацетамол-ассоциированной метгемоглобинемии можно использовать специфический антидот — N-ацетилцистеин, который дозируют перорально однократно 140 мг/кг, далее 70 мг/кг каждые 6–8 ч. в течение 36–72 ч. Для внутривенного введения используют начальную дозу 280 мг/кг в течение 6 ч., далее 70 мг/кг перорально каждые 6–8 ч. в течение 36–72 ч. Терапию прекращают, если через 48 ч. состояние приходит в норму [13]. Также описано применение аскорбиновой кислоты в дозе 30–40 мг/кг перорально или парентерально каждые 4–8 ч. и метионина в дозе 70 мг/кг перорально каждые 6–8 ч. в течение 24 ч. [10].
Анемия с тельцами Гейнца (Хайнца)
Тельца Гейнца (Гейнца-Эрлиха, Хайнца) образуются в эритроцитах в случае, когда повреждающее воздействие окислителя в крови превышает защитные механизмы эритроцитов. При этом оксидативный стресс приводит к повреждению глобина в молекуле гемоглобина, белковая часть необратимо денатурирует и прикрепляется к мембране эритроцита [3]. Впервые данные тельца были обнаружены немецким врачом Robert Heinz в 1860 году в эритроцитах у пациентов с гемолитической анемией, получавших препараты каменноугольной смолы [14]. По причине особенностей химического строения молекулы гемоглобина (большое количество сульфгидрильных групп) эритроциты кошек более склонны к формированию телец Гейнца. У кошек эритроциты с тельцами Гейнца могут быть представлены в норме в небольшом количестве (до 5%), в отсутствие анемии (например, при гипертиреозе) и при различных патологических состояниях, например, на фоне кетоацидоза [3]. При наличии телец Гейнца эритроциты становятся менее пластичными, что приводит к укорочению срока их жизни в результате внутрисосудистого гемолиза или фагоцитоза макрофагами селезёнки [3].
Описан широкий спектр различных пищевых продуктов, лекарственных препаратов и различных непищевых источников, которые у собак и кошек могут приводить к развитию анемии с тельцами Гейнца [15]: лук и чеснок (собаки и кошки), пропиленгликоль и метиленовый синий (кошки), избыточное применение витаминов К1 и К3 (собаки), бензокаин (собаки и кошки), феназопиридин (кошки), пропофол, парацетамол и фенацетин, DL-метионин (кошки), фенилгидразин (собаки), нафталин (собаки), цинк (собаки) и др.
Среди наиболее распространённых пищевых агентов, которые вызывают Гейнц-гемолитическую анемию у собак и кошек, является лук при употреблении в сыром, варёном, сушёном виде, в виде резаного дегидратированного лука, в составе суфле из лука и детского питания с порошковым луком [16]. Токсичная дозировка для собак и кошек зависит от вида животного, способа приготовления, однократности/многократности поедания. Так, экспериментальное однократное скармливание измельчённого обезвоженного лука собакам в дозе 5,5 г/кг в сутки показало развитие гемолиза на 2–3 сутки, тогда как максимальное количество телец Гейнца отмечалось на третьи сутки [17].
У кошек хорошо описан этиопатогенез формирования телец Гейнца при пероральном приёме пропиленгликоля в составе антифриза, консерванта пищевых продуктов, растворителя при приготовлении мазей, паст, кремов, шампуней и лекарственных препаратов (например, препарата для анестезии этомидата). Экспериментальное скармливание пропиленгликоля кошкам в дозе 8 г/кг массы тела приводило к появлению максимального количества телец Гейнца на шестые сутки после начала эксперимента, при этом анемия отсутствовала или имела слабую выраженность, однако отмечалось снижение времени жизни эритроцитов [3].
Диагностика анемии с тельцами Гейнца
Для диагностики анемии, связанной с оксидативным повреждением эритроцитов, необходимо выполнить мазок крови. При окрашивании по Романовскому тельца Гейнца визуализируются как небольшие (диаметр телец Гейнца 0,5–1 мкм) выпячивания мембраны эритроцита (рис. 2) [3]. Для лучшей визуализации мазок крови окрашивают метиленовым синим или бриллиантовым крезиловым синим, тельца при этом визуализируются и в виде базофильной точки, расположенной у мембраны (рис. 2).
Достаточно часто при оксидативном повреждении эритроцитов в мазке крови также выявляют эссентроциты — эритроциты, характеризующиеся концентрацией гемоглобина на одной стороне клетки с бледной или прозрачной частью на другой стороне (рис. 3). Эссентроциты, вероятно, образуются в результате прямого повреждения мембраны эритроцита при адгезии противоположных сторон мембраны. В дальнейшем эссентроциты могут гемолизироваться в сосудистом русле, либо будет происходить фагоцитоз повреждённых эритроцитов, прежде всего, в макрофагах селезёнки [3].
Специфических тестов для определения отравления луком, чесноком, пропиленгликолем и другими соединениями и препаратами нет. Необходимо тщательно оценить анамнез и обсудить с владельцем возможность их употребления. В некоторых случаях при обследовании животного можно уловить запах лука или чеснока из ротовой полости.
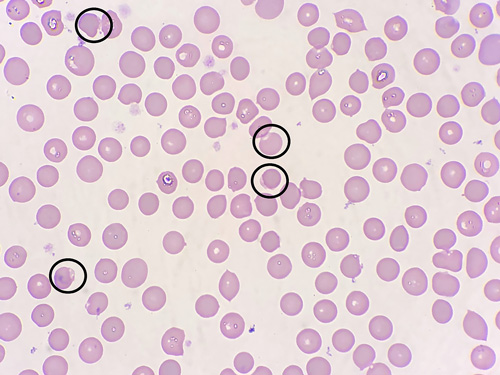 |
| Рис. 3. Мазок крови от собаки, тот же случай, окраска по Романовскому. Представлены эссентроциты — эритроциты с неокрашенными участками (отмечены чёрными кругами) |
Терапия анемии с тельцами Гейнца
Специфические антидоты для оксидативного повреждения эритроцитов луком, чесноком, пропиленгликолем и другими соединениями отсутствуют. Основные мероприятия, которые проводятся: убрать токсичное вещество, вызвать рвоту при пероральном приёме (если от момента употребления до поступления в клинику прошло менее 30 мин., далее неэффективно), дача активированного угля, слабительных препаратов или механическое извлечение (например, деталей, содержащих цинк). Проводится инфузионная терапия, мониторинг состояния пациента, при необходимости — переливание кровепродуктов. Для профилактики формирования телец Гейнца и окислительного повреждения у кошек HiLL et aL (2001) рекомендуют применение антиоксидантов (N-ацетилцистеина, витамина Е, аскорбиновой кислоты) [18]. Также есть рекомендации по применению аскорбиновой кислоты у собаки в дозе 30 мг/кг массы тела внутривенно каждые 6–8 ч. [16].
При токсическом гемолизе, сопровождающемся оксидативным повреждением эритроцитов, целесообразно применять синтетические антиоксиданты. Из отечественных антиоксидантов одними из наиболее перспективных являются препараты на основе этилметилгидроксипиридина [19]. Такие препараты обладают выраженными антиоксидантными, антигипоксическими и мембранопротекторными свойствами, что в свою очередь повышает устойчивость организма к воздействию свободных радикалов, возникающих при оксидативном повреждении и приводящих к различным патологическим состояниям.
Литература
- Harvey J.W. (2010) Erythrocyte biochemistry. In: (eds. Weiss D.J., Wardrop K.J.) SchaLm’s Veterinary HematoLogy, 6th edn. BLackweLL PubLishing, Ames. P. 131-135.
- Christopher M.M., Broussard J.D., Peterson M.E. Heinz body formation associated with ketoacidosis in diabetic cats. J Vet Intern Med. Jan-Feb 1995; 9(1):24-31. doi: 10.1111/j.1939-1676.1995. tb03268.x.
- Christopher M.M., White J.G., Eaton J.W. Erythrocyte pathoLogy and mechanisms of Heinz body-mediated hemoLysis in cats. Vet PathoL 1990 Sep; 27(5):299-310. doi: 1177/030098589002700501.
- McKenna J.A., Sacco J., Son T.T., Trepanier L.A., CaLLan M.B., Harvey J.W., Arndt J.W. CongenitaL methemogLobinemia in a dog with a promoter deLetion and a nonsynonymous coding variant in the gene encoding cytochrome b5. J Vet Intern Med. Sep-Oct 2014; 28(5):1626-31. doi: 10.1111/jvim.12423.
- Jaffey J.A., Scott N., Giger U., AbduLmaLik O., BuckLey R.M., Johnstone S., Lyons L.A., 99 Lives Cat Genome Consortium. CLinicaL, metaboLic, and genetic characterization of hereditary methemogLobinemia caused by cytochrome b5 reductase deficiency in cats. J Vet Intern Med. 2019 Nov; 33(6):2725-2731. doi: 1111/ jvim.15637.
- Harvey J.W. CongenitaL erythrocyte enzyme deficiencies. Vet CLin North Am SmaLL Anim Pract. 1996; 26(5):1003-11.
- WiLkie D.A., Kirby R. MethemogLobinemia associated with dermaL appLication of benzocaine cream in a cat. J Am Vet Med Assoc. 1988 Jan 1; 192(1):85-6.
- Wray J.D. MethaemogLobinaemia caused by hydroxycarbamide (hydroxyurea) ingestion in a dog. J SmaLL Anim Pract. 2008 Apr; 49(4):211-5. doi: 10.1111/j.1748-5827.2007.00449.x.
- Worth A.J., Ainsworth S.J., BrockLehurst P.J., CoLLett M.G. Nitrite poisoning in cats and dogs fed a commerciaL pet food. N Z Vet J. 1997 Oct; 45(5):193-5. doi: 1080/00480169.1997.36025.
- ViLLar D., Buck W.B., GonzaLez J.M. Ibuprofen, aspirin and acetaminophen toxicosis and treatment in dogs and cats. Vet Hum ToxicoL 1998 Jun; 40(3):156-62. PMID:
- Aronson L.R., Drobatz K. Acetaminophen toxicosis in 17 cats. J Vet Emerg Crit Care. 1997 JuLy; 6(2):65-69. https://doi. org/10.1111/j.1476-4431.1996.tb00034.
- Zaks K.L., Tan E.O., ThraLL M.A. Heinz body anemia in a dog that had been sprayed with skunk musk. J Am Vet Med Assoc. 2005 May 1; 226(9):1516-8, doi: 10.2460/javma.2005.226.1516.
- Patton T.G., BLamer S.L., Horak K.E. Detecting MethemogLobinemia in AnimaLs with a Drop of BLood. PLoS One. 2016 Dec 8; 11(12):e0167942. doi: 10.1371/journaLpone.0167942.
- Heinz R. MorphoLogische Veranderungen des roten BLutkorperchens durch Gifte. [Virchows] Archiv fur pathoLogische Anatomie und PhysioLogie und fur kLinische Medizin, BerLin, 1890, 122: 112-116.
- Houston D.M., Myers S.L. A review of Heinz-body anemia in the dog induced by toxins. Vet Hum ToxicoL. 1993 Apr; 35(2):158-61.
- KovaLkovicova N., Sutiakova I., PistL J., Sutiak V. Some food toxic for pets. Interdiscip ToxicoL. 2009 Sep; 2(3): 169-176.
- Harvey J.W., Rackear D. ExperimentaL onion-induced hemoLytic anemia in dogs. Vet PathoL 1985 JuL; 22(4):387-92. doi: 1177/030098588502200414.
- HiLL A.S., O’NeiLLS., Rogers Q.R., Christopher M.M. Antioxidant prevention of Heinz body formation and oxidative injury in cats. Am J Vet Res. 2001 Mar; 62(3):370-4.
- Лисицкая К.В. Цитопротективный и антиоксидантный эффекты препарата «Мексидол-вет» на культивируемых клетках человека и собаки (доклинические исследования). Российский ветеринарный журнал. 2016; 6(34):18-22.
СВМ № 6/2020




