Известно, что в клинической картине гиперкортицизм у кошек и собак имеет сходства, но данный случай позволяет акцентировать внимание на некоторых нюансах биохимических особенностей заболевания у кошек.
Ветеринарная эндокринология успешна в познании патофизиологии дизэндокриний. Прогресс её развития позволяет в основном выявить разницу между проявлением таких патологий у собаки и кошки.
Репутацию спонтанного гиперкортицизма у кошки как редко встречающегося заболевания на сегодняшний день, вероятно, можно объяснить отсутствием полноты данных в отношении этой патологии.
Гиперкортицизм у кошки: клинический случай
Анамнез
Стерилизованная кошка в возрасте 16 лет европейской породы представлена на консультацию по причине алопеции и нарушения кожного покрова при отсутствии зуда. Владельцы сообщают о том, что, несмотря на хороший аппетит, общее состояние животного угнетённое. С другой стороны, они описывают общее снижение состояния организма, которое наиболее чётко проявляется на протяжении последних месяцев, акцентируя при этом внимание на длительной сонливости, жажде (выпивает воду в объёме 500 мл/сут.), чувстве голода и прогрессирующей потере шерсти в области живота. Установлено, что на протяжении нескольких лет каких-либо лекарственных препаратов кошке не назначали.
Клиническое обследование
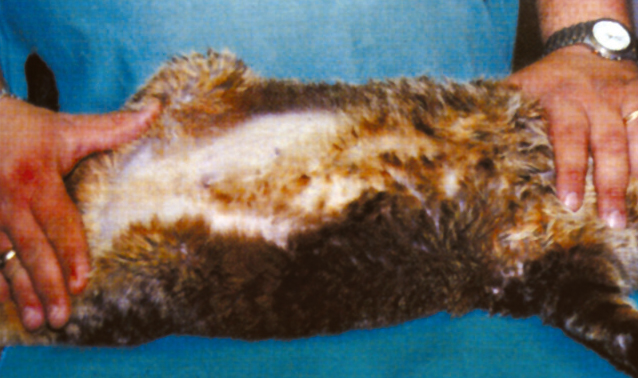
У животного выявлены избыточный вес (6 кг), птоз (опущение) живота и выраженная амиотрофия. Кроме того, на вентральной поверхности брюшной стенки (фото 1) и между лопатками отмечено потускнение шёрстного покрова с элементами сухой себореи, которая наиболее выражена в дорсолюмбальной области. Дискретный сквамозный (чешуйчатый) гиперкератоз отмечается по краям плантарной поверхности подушечек лап (фото 2).
 |
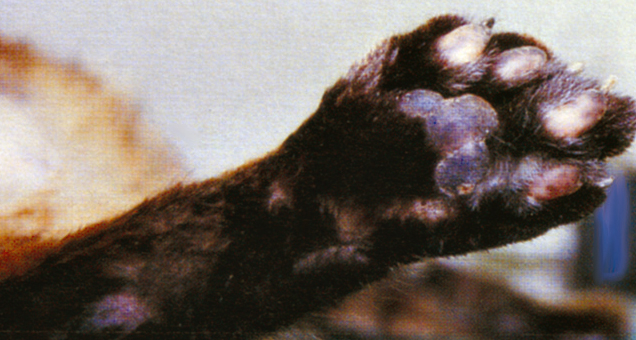 |
| Фото 1. Алопеция, выявленная на вентральной поверхности стенки живота. | Фото 2. Мы наблюдаем дискретный гиперкератоз на краевой части подушечек плантарной поверхности. |
Участки кожного покрова, подверженного алопеции, настолько тонки, что под ними удаётся разглядеть сплетения кровеносных сосудов. Кроме того, отмечается сухость, атрофичность, сморщенность (фото 3) и складки кожи. Шерсть краевой части зон алопеции легко выдёргивается.
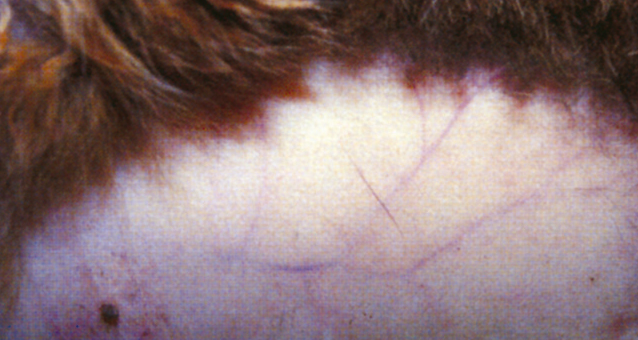 |
| Фото 3. Сеть кровяных сосудов, визуализируемых через прозрачный кожный покров. Кожа атрофированная и сморщенная. |
Общее исследование не позволяет выявить каких-либо аномалий.
Диагностические предположения
Для проведения дифференциальной диагностики, несмотря на то что клинические признаки говорят о вероятной дизэндокринии, было выполнено несколько дополнительных исследований:
– себорея паразитарной природы: отсутствие блох, вшей, хейлетиелл и демодекоза на адгезивных плёнках, в мазках и обычных соскобах;
– дерматофития: попытка обнаружения роста грибов на культуральной среде в течение 15 дней не увенчалась успехом;
– дизэндокриния: алопеция в результате кастрации, гиперкортицизм (спонтанный или ятрогенный) или гипотиреоз;
– паранеопластический дерматоз.
Дополнительные исследования и постановка диагноза
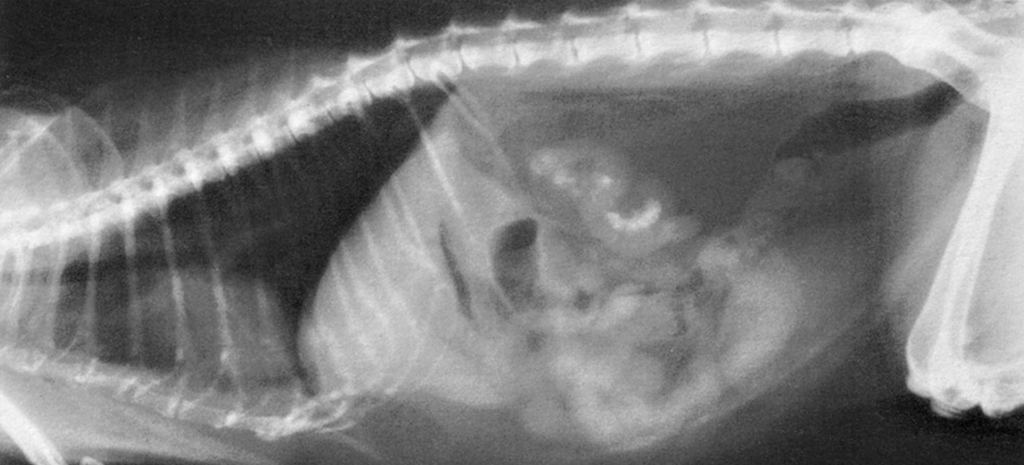
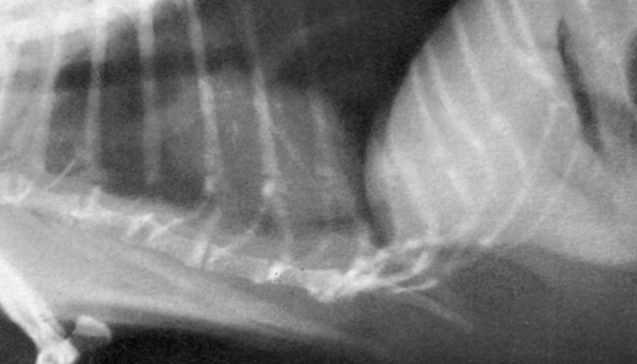
Два последних варианта в отношении дифференциальной диагностики вызывают необходимость проведения четырёх дополнительных исследований: общий и биохимический анализы крови (табл. 1), рентгенография брюшной и грудной полостей (фото 4, 5), биопсия кожного покрова и общегормональное исследование (табл. 1).
- Общий анализ крови свидетельствует об умеренном лейкоцитозе с проявлением нейтрофилии (зрелые формы — сегментоядерные нейтрофилы) и незначительном увеличении гликемии.
- Рентгенограмма брюшной полости в боковой проекции даёт положительную контрастность, указывая на присутствие жира и кальцификацию почек в некоторых чашечках.
Рентгенограмма грудной клетки в боковой проекции указывает на округлость задней стенки левого желудочка, но в прямой проекции рентгенографию не проводили в связи с невозможностью удержания кошки и отказа владельцев от проведения животному анестезии. - Несколько образцов биопсийного материала кожного покрова были взяты в зонах алопеции. Гистоморфологическое исследование указывает на атрофию эпидермиса (два или три ряда рогового слоя), фолликулярный кератоз и разрежение волосяных фолликулов. Картина воспаления на уровне дермы отсутствует.
- Отсутствие новообразования в брюшной полости подтверждено методом пальпаторного, рентгенографического исследований, а также гистоморфологического анализа кожного покрова. Это позволило исключить наличие паранеопластического дерматоза.
| Полученные данные | Норма | Единица измерения | |
| Эритроциты | 6,8 | 6,5–9,5 | 1012/л |
| Гемоглобин | 10,7 | 8,0–14,0 | г/дцл |
| Гематокрит | 30,6 | 24–45 | % |
| Лейкоциты | 14,5 | 6,0–17,0 | 109/л |
| Нейтрофилы сегментоядерные | 13,3 | 3,0–12,5 | 109/л |
| Эозинофилы | 0 | 0–15 | 109/л |
| Лимфоциты | 1,0 | 1,5–6,0 | 109/л |
| Моноциты | 0,1 | 0–1,0 | 109/л |
| Тромбоциты | 250 | 250–600 | 109/л |
| Мочевина | 0,88 | 0,25–0,75 | г/л |
| Креатинин | 11,8 | 5,0–14,5 | г/л |
| Глюкоза | 1,82 | 7,0–1,25 | г/л |
| Холестерол | 2,9 | 2,0–4,0 | г/л |
| ALAT | 88 | менее 100 | МЕ/л |
| PAL | 90 | менее 120 | МЕ/л |
| Общий белок | 79 | 55–85 | г/л |
| Калий | 3,8 | 3,5–5,5 | мЭк/л |
| Основной кортизол | 186 | менее 150 | нмоль/л |
| Кортизол после стимуляции | 600 | менее 450 | нмоль/л |
| Общий тироксин | 8 | 12–50 | нмоль/л |
На основании проведённых исследований мы с уверенностью можем ориентироваться на дизэндокринию — гиперкортицизм (спонтанный или ятрогенный) — на основании следующих признаков: дерматоз с алопециями, атрофия кожного покрова, птоз абдоминальной полости, полиуро-полидипсия, лейкоцитоз и гипергликемия.
Тест на стимуляцию надпочечников был выполнен путём введения половины ампулы (0,125 мг) синастена (Synasten R immediat) внутримышечно. Определение концентрации плазматического кортизола, которую осуществляли до (Т0) и через 30 минут (Т0 + 30 мин.), после введения препарата дополняли анализом общего содержания Т4:
– кортизолемия в Т0 равнялась 186 нмоль/л (норма: менее 150 нмол/л);
– кортизолемия Т0 + 30 мин. составила 600 нмоль/л (норма: менее 450 нмоль/л);
– Т4 общий: 8 нмоль/л (норма: более 15 нмоль/л).
В связи с этим можно прийти к заключению о спонтанной гиперкортизолемии.
Ятрогенная форма сопровождается гипокортизолемией и/или отсутствием стимуляции через АКТГ, и, с другой стороны, эта патология ассоциируется с приёмом лекарственных препаратов.
По просьбе владельцев тестирование на гиперкортицизм гипофизарной или надпочечниковой природы не проводили.
Гиперкортицизм: лечение и развитие заболевания
Гиперкортицизм лечился посредством кетоконазола (Nizoral® в форме суспензии для перорального применения) из расчёта 20 мг/кг/сутки, в два приёма, во время кормления.
Через месяц после курса лечения общее состояние кошки стало удовлетворительным, с повышенным тонусом мышечной ткани, «нормальным» аппетитом, снижением жажды (объём потребляемой воды не определяли) и уменьшением времени сна. После двухмесячного курса лечения шёрстный покров стал менее тусклым и алопеция между лопатками также исчезла, в то время как на вентральной части брюшной стенки она присутствовала, но становилась менее заметной, так как отмечалось диффузное прорастание шёрстного покрова. Через три месяца после курса лечения владельцы сообщили о смерти животного, при этом, как было сказано, общее состояние кошки было удовлетворительным и она хорошо переносила лечение. Аутопсии (патологоанатомического вскрытия) не проводили.
Обсуждение
Спонтанный гиперкортицизм кошки — это дизэндокриния, которая редко встречается, в основном её наблюдают у пожилых особей. Наиболее часто у больных кошек отмечают изменение морфологических признаков, имеющее близкое сходство с таковыми у собаки: алопеция и птоз стенки живота (R.W. Nelson, E.C. Feldman, M.C. Smit, 1987; M.E. Peterson, P. Steele, 1986; C.A . Zerbe, R.F. Nachreinier, R.W. Dunstan, J.B. Dalley, 1987).
При постановке окончательного диагноза в этом случае имеется ряд сложностей: разные причины возникновения симптомов (необходимо проведение дополнительных исследований), интерпретация общего клинического и биохимического анализов крови (отличия гиперкортицизма у собаки и кошки), выбор метода оценки функциональной деятельности надпочечников (существует несколько схем).
Симптомы данной патологии у кошки, описанные в разных публикациях, имеют большое сходство с клиническими признаками у собаки: полиуро-, полидипсия, алопеция (например, в вентральной части живота), себорея, атония брюшной стенки, нормальный или повышенный аппетит, слабость, потеря веса, неприятный запах, хронические или рецидивирующие инфекции (R.W. Nelson, E.C. Feldman, M.C. Smit, 1987; M.E. Peterson, P. Steele, 1986; C.A. Zerbe, R.F. Nachreinier, R.W. Dunstan, J.B. Dalley, 1987). Наиболее патогномоничными признаками данного заболевания, вероятно, являются полиуро-полидипсия и атония (птоз) брюшной стенки.
В представленном нами случае в основном отмечаются эти проявления. Несмотря на признаки гиперкортицизма, общие клинические проявления, тем не менее, носили слабоспецифический характер, и это требовало проведения дополнительных исследований.
Клинический анализ крови иногда даёт картину соответствующих нарушений: лейкоцитоз, нейтрофилия, лимфо- и эозинопения — всё это возможные изменения клинического анализа крови, но менее стабильные, в отличие от собак (R.W. Nelson, E.C. Feldman, M.C. Smit, 1987).
Также наблюдаются биохимические нарушения: гипергликемия, гиперхолистеролемия, повышение концентрации ALAT (R.W. Nelson, E.C. Feldman, M.C. Smit, 1987).
Гипергликемия, вероятно, наиболее стабильный маркер таких заболеваний, как гиперкортицизм и сахарный диабет у кошек (S.A. Jons, K.R. Refsal, B.J. Stevens, R.W. Lerner, 1992; R.W. Nelson, E.C. Feldman, M.C. Smit, 1987). Хроническая гиперкортизолемия стимулирует развитие сахарного диабета: гликогенолиз, снижение утилизации периферической глюкозы, уменьшение аффинности специфических рецепторов клеток для инсулина и подавление действия пострецепторного инсулина. Хроническое течение этого заболевания ведёт к становлению неинсулинзависимой формы сахарного диабета II типа вследствие отсутствия чувствительности к этому гормону – инсулину, который находится в высокой концентрации на первом этапе заболевания. Затем содержание инсулина в крови снижается в связи с «истощением» секреции его β-клетками, а также дегенерацией вакуолей и гиалинизацией островков поджелудочной железы.
Наиболее часто происходит изменение параметров биохимических маркеров у собак, где отмечается увеличение активности щелочной фосфатазы (PAL). У кошек, наоборот, повышение активности этого фермента встречается редко (S.A. Jons, K.R. Refsal, B.J. Stevens, R.W. Lerner, 1992; R.W. Nelson, E.C. Feldman, M.C. Smit, 1987; C.S. Schwedes, 1997). Объяснение этих различий найдено не до конца: было показано наличие дефицита кортикоиндуцированного изоэнзима желчных путей PAL у кошки и короткий период его полураспада в плазме крови (R.W. Nelson, E.C. Feldman, M.C. Smit, 1987). Проявления кортикоиндуцированной гепатопатии и гепатомегалии у кошки встречаются, вероятно, значительно реже, чем у собаки. Морфологическое исследование биопсийного материала печени позволило выявить три типа возможных повреждений: липидоз, дегенерация на целлюлярном уровне или некроз и значительно реже наиболее характерные признаки гепатопатии, проявляющиеся в форме вакуолей интрацитоплазматического гликогена, индуцированные кортикостероидами (R.W. Nelson, E.C. Feldman, M.C. Smit, 1987). Хроническая гиперкортизолемия, с другой стороны, приводит к другим эффектам: артериальной гипертензии, возрастающему риску тромбоэмболии лёгких, застойной сердечной недостаточности и чувствительности к бактериальной инфекции.
Что касается нашего случая, то активность PAL не повысилась, и на рентгенограмме по виду в профиль отсутствуют какие-либо признаки гепатомегалии.
Для пациентов с подозрением на гиперкортицизм существуют разные схемы исследования функциональной деятельности надпочечников (тесты на стимуляцию и торможение). Результаты разных схем согласно материалам существенно варьируются.
Неполная согласованность результатов тестирования на стимуляцию с помощью синтетического АКТГ указывает на то, что его химическая природа, способ назначения и галеновая стимуляция — это основные факторы вариации, проявляющиеся в пике действия препарата (от 30 до 240 мин.), оцениваемого по количеству кортизола в крови (от 115 до 490 нмоль/л, как это было показано в исследованиях S.P. Dibartola, J.M. Tarr, 1989; M.E. Peterson, R.J. Kemppainen, 1992; M.E. Peterson, R.J. Kemppainen, D.N. Orth, 1994; M. Robson, J. Taboada, K. Wolfsheimer, 1995; C.A. Zerbe, R.F. Nachreiner, R.W. Dunstan, J.B. Dalley, 1987).
Внутримышечное введение Synacthene R immediat обеспечивает наиболее быстрое увеличение кортизолемии (15 мин.) и пика действия (30–45 мин.) по сравнению с внутривенным способом введения (30 мин. и 60–180 мин. соответственно). Объяснения этому феномену нет (M.E. Peterson, R.J. Kemppainen, 1992; M. Robson, J. Taboada, K. Wolfsheimer, 1995; C.A. Zerbe, R.F. Nachreiner, R.W. Dunstan, J.B. Dalley, 1987). Вполне возможно, что методы манипуляции с животными, а также способ забора материала играют основную роль в генезе стресса, влияющего на кортизолемию. Более раннее проявление пика кортизолемии после внутримышечного введения препарата в сравнении с внутривенным способом остаётся непонятным. Некоторые авторы усматривают в этом роль болевой реакции, вызываемой путём внутримышечного введения, которая отсутствует при внутривенной инъекции через ранее поставленный катетер (M. Robson, J. Taboada, K. Wolfsheimer, 1995).
Однако следует заметить, что авторам всех публикаций, анализируемых в отношении разработки и стандартизации схемы тестирования на стимуляцию, не удалось добиться оценки кортизолемии, сходной с таковой в наших исследованиях, проведённых в режиме Т0 + 30 мин. (600 нмоль/л), где экстремальный показатель нормы не превышал 490 нмоль/л (M.E. Peterson, R.J. Kemppainen, 1992; M. Robson, J. Taboada, K. Wolfsheimer, 1995; C.A. Zerbe, R.F. Nachreiner, R.W. Dunstan, J.B. Dalley, 1987). Это даёт возможность обратить внимание на то, что количественный показатель стимуляции в описанном нами случае имеет высокую предиктивную оценку гиперкортицизма.
Тесты на торможение были также исследованы. Вероятно, торможение, проводимое в низкой дозе (0,01 мг/кг дексаметазона в/в), даёт интересные результаты. Тем не менее некоторые исследования показывают, что у 20% здоровых кошек, подверженных тестированию, показатели ускользания проявлялись на восьмой час, после того как торможение происходило на шестой час (M. Robson, J. Taboada, K. Wolfsheimer, 1995). Другие авторы отмечают, что назначение препарата в дозе 0,015 или 0,01 мг/кг даёт очень хорошую диагностическую специфичность (M. Robson, J. Taboada, K. Wolfsheimer, 1995). В исследованиях, уже проведённых на данном этапе, не удалось установить профиль типа вариации кортизолемии на протяжении всего теста торможения. Исследования показывают, что оценка кортизолемии, превышающая 40 нмоль/л на шестой и восьмой час торможения дексаметазоном, назначаемым в дозе 0,1 мг/кг, достаточна для постановки диагноза на данную патологию (M.E. Peterson, R.J. Kemppainen, 1992).
Тесты на дифференциацию, выполненные при использовании плазмы крови (использование высоких доз дексаметазона: 0,5–1 мг/кг), обладают, вероятно, низкой специфичностью.
По нашему мнению, анализ функции надпочечников через стимуляцию или торможение не следует рассматривать как вспомогательный метод для постановки диагноза.
Количественное определение плазматического АКТГ оказалось средним и, следовательно, более точным методом для идентификации (R.W. Nelson, E.C. Feldman, M.C. Smit, 1987; M.E. Peterson, R.J. Kemppainen, D.N. Orth, 1994).
Эхографическое исследование надпочечников возможно, но требует очень большого опыта. Недостаточность данных и контрольного иллюстрационного материала, фотографий, а также малый размер надпочечников вызывают сложности в интерпретации для постановки диагноза у кошек. Тем не менее, этот метод исследования, как оказалось, может очень широко использоваться при развитии неопластических феноменов.
Среди разных способов существующего лечения (OpDDD, ketoconazol, удаление надпочечника) мы, с согласия владельцев, а также ввиду простоты применения и стоимости выбрали второй препарат (легко потребляемая суспензия). Результаты клинического исследования свидетельствовали о корректности назначаемого лечения (улучшение общего состояния пациента), учитывая при этом слабый рецидив. Кетоконазол ингибирует энзимы, участвующие в генезе стероидов, происходящем в коре надпочечников. Эта субстанция, как показывают исследования R.W. Nelson, E.C. Feldman, M.C. Smit (1987) и C.S. Schwedes (1997), по всей видимости, в большинстве случаев имеет слабый эффект воздействия на представителей данного вида. Оценка её активности в лечении описанного нами случая является субъективной (не проводилось ни одного теста): всего лишь констатировали благоприятный процесс выздоровления, оцениваемый по общему состоянию пациента и началу роста шёрстного покрова.
Заключение
Несмотря на то что гиперкортицизм у кошек не поддавался тщательному исследованию, тем не менее возможно выявить у представителей данного вида нюансы течения заболевания. Клинические проявления схожи с таковыми у собаки, но существуют некоторые особенности биохимических процессов. Знание регуляции гипоталамо-гипофизарно-надпочечникового комплекса у кошки недостаточно, чтобы говорить о достоверности результатов исследования по совокупности данных клинического и дополнительных методов исследования (анализ крови, гистоморфология и эндокринология).
Основные положения:
> Спонтанный гиперкортицизм кошки — это редко встречаемая в литературе дизэндокриния, которая проявляется в основном у пожилых особей.
> Клинические признаки, описанные в разных публикациях, имеют сходство с таковыми, которые наблюдают у собаки: наиболее стабильными, вероятно, являются полиуро-полидипсия и птоз (опущение, провисание, атония) стенки живота.
> Гипергликемия, по всей вероятности, также является более частым маркером на гиперкортицизм и сахарный диабет, который выявляют у большинства кошек.
> Исследование функций надпочечников через стимуляцию или торможение не следует рассматривать как вспомогательный метод в постановке диагноза. Количественный показатель плазматического АКТГ оказался наиболее точным методом в дифференциальной диагностике.
СВМ 2/2007