Chad F. Berman1,2 ©, Remo G. Lobetti1 ©, Eric Lindquist3 ©
1 Bryanston Veterinary Hospital, Johannesburg, South Africa
2 Department of Companion Animal and Clinical Studies, Onderstepoort, South Africa
3 Sonopath, New Jersey, United States
Corresponding author: Chad Berman, c_berman@hotmail.com
Вступление
Панкреатит — наиболее распространённая патология поджелудочной железы у собак и рассматривается как воспаление её экзокринной части. Это понятие включает в себя заболевания поджелудочной железы, характеризующиеся некрозом, а также необратимыми структурными изменениями, такими как фиброз [57]. Панкреатит у собак в основном подразделяют на острую и хроническую формы на основе отсутствия или наличия явных гистопатологических признаков, таких как фиброз и/или атрофия [58]. Наличие перманентных гистопатологических изменений (а именно фиброза и ацинарной атрофии) рассматривается как хронический панкреатит, тогда как отсутствие подобной картины наряду с воспалительной реакцией более характерно для острого панкреатита [6; 37; 54]. Клеточные инфильтраты также могут быть использованы для дифференциации панкреатита на острую и хроническую формы, поскольку гнойное воспаление и лимфоцитарная инфильтрация являются признаками острого и хронического воспаления соответственно [11; 17]. Тем не менее, гистопатологическая дифференциация не всегда даёт ясную картину, поскольку многие животные могут иметь гистопатологические признаки и острого, и хронического панкреатита [57].
В большинстве случаев панкреатит возникает у собак в возрасте от среднего до пожилого (обычно > 5 лет), но в целом может диагностироваться у животных от молодых (нескольких месяцев) до особей старше 15 лет [3; 8; 16]. Цвергшнауцеры и терьеры имеют повышенный риск возникновения заболевания [10; 11]. Большинство случаев панкреатита у собак являются идиопатическими, хотя такие патологические состояния, как гипертриглицеридемия, эндокринные заболевания, побочные реакции на препараты, приём антиконвульсантов, хирургические операции, инфекционные и диетологические факторы, также имеют значение в его возникновении [57]. Хотя у собак отсутствуют патогномоничные клинические признаки панкреатита, типичным симптомом при обследовании животных с тяжёлым острым заболеванием является острый приступ абдоминальной боли [16; 55]. В зависимости от тяжести заболевания симптоматика может заметно варьировать и включать в себя неспецифические признаки, такие как сниженный аппетит, рвота, угнетение, диарея, абдоминальная боль и потеря веса. Все эти неспецифические клинические симптомы могут проявляться и при других заболеваниях [16; 47]. Список дифференциальных диагнозов включает в себя множество первичных заболеваний желудочно-кишечного тракта, гепатобилиарной и мочеполовой систем, интраабдоминальные опухоли, заворот селезёнки и гипоадренокортицизм. Также у собак может проявляться комбинация различных симптомов, включая обезвоживание, желтуху, лихорадку, гипотермию, геморрагическую диарею и асцит [16], а также наличие тяжёлых системных нарушений [55]. Эти системные нарушения могут включать как уже перечисленные выше, так и тахикардию, аритмии, гиповолемический шок, острый респираторный дистресс-синдром и смерть.
Диагностика острого панкреатита у собак может быть затруднена вследствие плохой анатомической доступности поджелудочной железы, а также неспецифичности клинических симптомов и результатов диагностики при клиническом обследовании. Несмотря на некоторый прогресс в развитии ряда диагностических техник, постановка диагноза при панкреатите остаётся проблематичной. Окончательный диагноз ставится только гистопатологически, что является крайне инвазивным методом, при этом биопсия ошибочно выбранного участка при локализованном процессе может дать отрицательный результат [37]. Хотя рутинные клинические признаки заболевания не являются специфичными, они могут помочь в оценке его тяжести [57]. При заболевании у животных могут наблюдаться различные гематологические нарушения [3; 11; 16; 17]. Было показано, что специфическая панкреатическая липаза (cPL) является как чувствительным, так и специфическим сывороточным маркером у собак с панкреатитом [31; 48; 51; 53], диапазон чувствительности — от 72 до 78% [31], специфичность — от 81 до 100% [30; 31; 36; 49; 51]. Тест SNAP на панкреатическую липазу собак (cPL) при панкреатите имеет чувствительность от 91 до 94%, специфичность от 71 до 78% [31]. Другие доступные диагностические исследования включают тест на трипсиноподобную иммунореактивность (TLI), активность сывороточной липазы и амилазы, триолеин и 1,2-О-дилаурил-рак-глицеро-3-глютаровую кислоту-(6-метилрезоруфин), который является тестом на основе липазы (анализ липазы DGGR, прецизионная специфическая липаза поджелудочной железы [PSL]). Сделанное ранее исследование показало высокую корреляцию между тестом на cPL и анализом липазы DGGR. Тем не менее, та же статья продемонстрировала справедливое соответствие между результатами ультразвукового исследования поджелудочной железы и анализа на сывороточную липазу [23]. Таким образом, результаты анализа липазы являются более точными, поэтому данные УЗИ следует интерпретировать осторожно. Рентгенография при панкреатите собак не является чувствительным методом диагностики, поскольку результаты не являются специфичными, а зачастую отсутствуют вовсе. Однако она помогает исключить другие возможные диагнозы [3; 16; 17]. Сообщалось о перспективности компьютерной томографии (КТ) с контрастным усилением в двух случаях панкреатита собак [18]; однако в другом исследовании чувствительность этого метода при небольшом числе случаев (n = 7) была расценена как слабая [44]. В пилотном исследовании КТ-ангиография на 10 собаках позволила более полно оценить всю поджелудочную железу, чем УЗИ. Также неоднородное накопление контраста в поджелудочной железе может быть негативным прогностическим индикатором у собак с острым некротизирующим панкреатитом [2]. Кроме того, контрастная КТ часто используется для диагностики панкреатита у людей [5; 7; 20; 42; 45]. Насколько известно авторам, использование магнитно-резонансной томографии (МРТ) для исследования поджелудочной железы собак не описано в литературе.
Ультрасонография (УЗИ) является альтернативной техникой для визуализации поджелудочной железы и принята в качестве метода выбора при диагностике панкреатита у собак [57], с описанной чувствительностью приблизительно 68% для животных с тяжёлым острым панкреатитом; однако результаты исследования зависят от того, кто его проводит [16; 11; 41; 50]. Специфичность этого метода до настоящего времени не была оценена, поскольку для её определения не проводилось гистопатологического подтверждения [29]. Также для собак с панкреатитом используется ультрасонография с контрастным усилением, она может выявлять изменения перфузии поджелудочной железы. Она была рекомендована для диагностики панкреатита, панкреонекроза, а также для мониторинга болезни при последующем лечении [27; 39]. Таким образом, клинический диагноз при панкреатите обычно основан на сочетании клинико-патологических данных и результатов визуальной диагностики.
Целью этого исследования было сравнение клинических признаков с результатами УЗИ у собак с острым панкреатитом и определение возможных различий в клинических проявлениях в зависимости от области поражения поджелудочной железы, определяемой ультразвуковым исследованием.
Материалы и методы
Было проведено мультиинституциональное кросс-секционное ретроспективное исследование в клиниках первого мнения и референсных клиниках Канады, США и Южной Африки. Проведён поиск историй болезни, в которых окончательный диагноз — панкреатит у собак — был поставлен на основе типичного анамнеза и клинических признаков, лабораторных исследований и абдоминальной ультрасонографии в течение 24-месячного периода (2013–2014). Критериям поиска соответствовали в общей сложности 293 случая.
Критериями включения в исследование были релевантные клинические признаки и/или результаты клинического обследования, соответствующие результаты УЗИ, а также результаты теста SNAP cPL, отличные от нормы. Для включения в работу животные должны были иметь как соответствующие результаты УЗИ, так и абнормальные результаты SNAP cPL, а также более одного клинического признака или результата клинического обследования. Маркерными клиническими симптомами были недавнее (< 2 недель) острое снижение аппетита и/или рвота или диарея. К соответствующим результатам клинического осмотра были отнесены абдоминальный дискомфорт и/или боль при пальпации.
Проводилось полное УЗИ брюшной полости с использованием ультразвукового аппарата (General Electric Logic E Ultrasound machine, GE Healthcare Biosciences, Shenzhen-China) в режиме 8 МГц, а также аппаратов подобного типа в таком же режиме в различных организациях. Результаты, соответствующие картине панкреатита у собак, подразумевают абнормальную эхогенность поджелудочной железы, включая смешанную гипоэхогенность паренхимы органа, а также наличие нечёткого гиперэхогенного изображения окружающей перипанкреатической жировой ткани и брыжейки (илл. 1–4). Кроме того, проводилась оценка дилатации панкреатических или жёлчных протоков, а также наличия асцита [15]. Также ультрасонографические изменения (подобные описанным выше) должны были быть ограничены только левой или правой долей поджелудочной железы, чтобы пациенты были классифицированы как имеющие лево- или правосторонний панкреатит соответственно. Любое поражение тела поджелудочной железы сверх этого расценивалось как диффузный панкреатит, а любое расширение органа или жёлчных протоков должно было относиться к группе правостороннего панкреатита. Во всех случаях левая, правая доли и тело поджелудочной железы были доступны для оценки. В исследование требовалось включать незатруднённые изображения левой, правой долей и тела поджелудочной железы, а также полное видеоизображение всех участков поджелудочной железы. Первоначальное ультразвуковое исследование проводили различные специалисты по УЗ-диагностике, имеющие опыт работы с мелкими животными. Все специалисты, выполнявшие УЗИ, являлись сертифицированными специалистами по внутренним болезням или клинической визуальной диагностике и следовали стандартизированной процедуре УЗИ, проводя обзор всех сопутствующих органов, что снижало вариабельность между различными исследователями. Все ультразвуковые изображения и видео были впоследствии рассмотрены слепым методом одним автором (E. L.), имеющим большой опыт в клинической сонографии (дипломант Американской коллегии ветеринарных практикующих врачей [DABVP], сертифицированный специалист Международного ветеринарного ультразвукового общества [Cert.IVUSS]). Критерием исключения являлось наличие других первичных заболеваний (таких как болезни желудочно-кишечного тракта, гепатобилиарной системы, мочевыделительного тракта) и неполная визуализация поджелудочной железы при УЗИ. Животные без ультрасонографических изменений поджелудочной железы также были исключены из исследования. На основе УЗ-результатов собаки были разделены на три группы. Группа 1: 41 собака с изменениями только в левой доле поджелудочной железы. Группа 2: 105 собак с изменениями только в правой доле поджелудочной железы. Группа 3: 147 собак с диффузным поражением поджелудочной железы.
Поскольку исследование было ретроспективным, абдоминальная боль могла присутствовать или отсутствовать, по шкале боли оценка не проводилась. У каждого животного проводилась пальпация всей брюшной полости от краниальной к каудальной и от дорсальной к вентральной части. Если появлялись какой-либо дискомфорт или вокализация, это расценивалось как наличие боли. Если ни дискомфорт, ни вокализация не отмечались, это интерпретировалось как отсутствие боли. В отношении плохого аппетита, рвоты и диареи отмечалось их наличие или отсутствие. Для любой собаки с панкреатитом, у которой аппетит полностью отсутствовал или был снижен, со слов владельца, в течение двух недель перед поступлением на приём, в числе симптомов записывался сниженный аппетит.
Все данные были занесены в таблицу программы Excel (Excel®, Microsoft Corporation, Вашингтон, США) и проанализированы статистически с использованием набора статистических программ (NCSS®, Kaysville, UT, United States). Для характеристики данных использовалась описательная статистика. Для отдельных параметров (абдоминальная боль, плохой аппетит, рвота и диарея) были проверены различия между группами с использованием одностороннего анализа вариантов со сравнением по Бонферрони и Таки-Крамеру. Для определения связи между результатами ультразвукового исследования и клиническими признаками использовался точный тест Фишера. Данные были нормально распределены, уровень значимости был определён как p < 0,05.
 |
 |
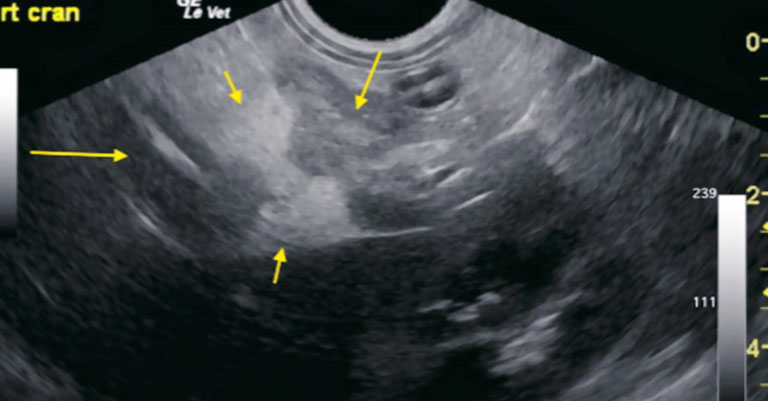
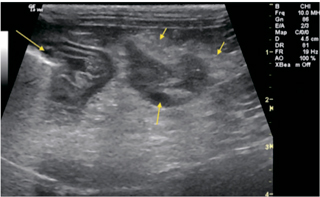
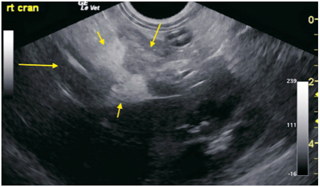
| Илл. 1. Пример панкреатита у собакт с поражением левой доли поджелудочной железы (группа 1): фокальные смешанные гипоэхогенные поражения (средняя стрелка) рядом с основанием левой доли поджелудочной железы. Отмечается в слабой степени нечётко выраженное воспаление жировой ткани (маленькая стрелка), граничащее с гипоэхогенной паренхимой поджелудочной железы, типичной для панкреатита. Расположение — каудальнее дна желудка (длинная стрелка), не подвержено влиянию на двенадцатиперстную кишку или отток привратника. Фото принадлежит Doug Casey, DMV, DABVP English Bay Ultrasound, Ванкувер, Британская Колумбия, Канада | Илл. 2. Пример панкреатита у собаки с поражением левой доли поджелудочной железы (группа 1): визуализируется крупнозернистая смешанная гипоэхогенная паренхима левой доли поджелудочной железы с нечётко выраженной гипоэхогенной окружающей жировой тканью (маленькая стрелка), типичной при остром панкреатите. Фото принадлежит Andi Parkinson, Intrapet Imaging, Балтимор, Мэриленд, США |
 |
 |
|
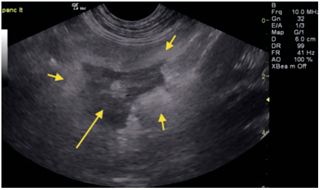
Илл. 3. Пример панкреатита у собаки с поражением правой доли поджелудочной железы (группа 2): гипоэхогенная отёчная паренхима поджелудочной железы (средняя стрелка) и гиперэхогенная нечётко очерченная окружающая жировая ткань (маленькая толстая стрелка), что соответствует омылению и воспалению брыжейки. Верхняя нисходящая двенадцатиперстная кишка в ближнем поле слегка отёчна и прилегает к воспалённому участку поджелудочной железы (длинная тонкая стрелка) |
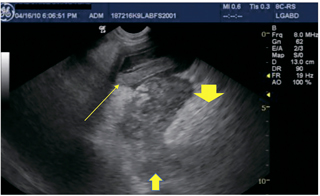
Илл. 4. Пример панкреатита у собаки, поражающего правую долю поджелудочной железы (группа 2): панкреатит правой доли со смешанной гипоэхогенной отёчной паренхимой (средняя стрелка), нечётко очерченная воспалённая окружающая жировая ткань (короткие стрелки), полностью окружённая участком верхней нисходящей двенадцатиперстной кишки с сопутствующим воспалением (длинная стрелка). В дальнем поле видна правая почка. Фото принадлежит Andi Parkinson, Intrapet Imaging, Балтимор, Мэриленд, США |
Результаты
Всего были исследованы 293 собаки с панкреатитом или подозрением на него, принадлежащие частным владельцам, средний возраст в группах 1–3 был 8,8, 9,8 и 10,1 года соответственно, статистическая разница между группами отсутствовала. Животные относились к различным породам, не наблюдалось преобладания в отношении любой из пород, а также пола. Были представлены следующие породы, в порядке убывания количества животных: беспородные (128), йоркширские терьеры / метисы йоркширских терьеров (31), ши-тцу (18), мальтезе / метисы мальтезе (18), лабрадор / метис лабрадора (17), бишон-фризе (16), цвергшнауцер (11), таксы (7), терьер / метис терьера (4), боксёр (3), голден-ретривер / метис голден-ретривера (3), карликовый пудель (3), по две собаки пород метис американской эскимосской собаки, бассет-хаунд, бигль, бордер-колли / метис бордер-колли, чихуахуа / метис чихуахуа, хаски, джек-рассел-терьер / метис джек-рассел-терьера, померанский шпиц, шелти и веймаранер; а также по одному животному пород акита-ину, бостон-терьер, кокер-спаниель, метис колли, английский сеттер, фокстерьер, метис лхасского апсо, карликовый пинчер, пекинес, метис питбуля, пиренейская горная собака, рэт-терьер, выжла и вест-хайленд-уайт-терьер. Соотношение полов: в 1-й группе было 18 самцов и 23 самки; во 2-й группе — 52 самца и 53 самки; в 3-й группе — 68 самцов и 79 самок, статистическая разница между группами отсутствовала.
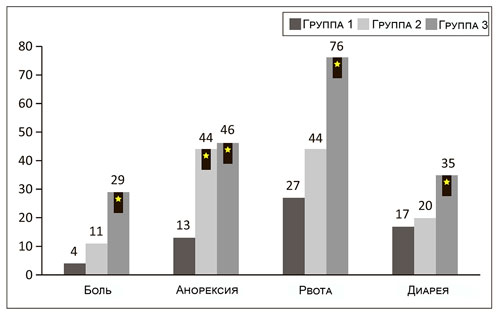
В группе 1 боль отмечалась у 4/41 собак (10%), плохой аппетит у 13/41 собак (32%), рвота у 27/41 собак (66%), диарея у 17/41 собак (41%). В группе 2 боль присутствовала у 11/105 собак (10%), плохой аппетит у 44/105 собак (42%), рвота у 44/105 собак (42%), диарея у 20/105 собак (19%). В группе 3 боль отмечалась у 29/147 собак (20%), плохой аппетит у 46/147 собак (31%), рвота у 76/147 собак (52%), диарея у 35/147 собак (24%) (таблица 1). Статистическая значимость имелась в отношении боли в группе 3; плохого аппетита в группах 2 и 3; рвоты и диареи в группе 3 (илл. 5).
Таблица 1. Процентное соотношение собак с различными клиническими признаками соответственно поражённому участку поджелудочной железы
|
Группа |
Клинические признаки (% поражённых собак) |
|||
| Боль | Анорексия | Рвота | Диарея | |
| 1 (левая доля) | 11 | 32 | 66 | 41 |
| 2 (правая доля) | 10 | 42 | 42 | 19 |
| 3 (диффузно) | 20 | 31 | 52 | 24 |
 |
|
Илл. 5. Клинические признаки в трёх группах и количество животных с проявлением симптомов. Группа 1 — собаки с панкреатитом левой доли, группа 2 — панкреатит правой доли, группа 3 — диффузный панкреатит. Звёздочка — статистическая значимость между группами (p < 0,05). |
Обсуждение
Это исследование фокусировалось на том, чтобы связать клинические признаки панкреатита у собак с поражённой областью поджелудочной железы; при этом было задокументировано различие в проявлении клинических признаков в зависимости от того, какая доля поджелудочной железы была поражена. В исследовании не было выявлено явной породной предрасположенности; это согласуется с предыдущими исследованиями, в которых сообщалось, что у собак любого возраста, породы и пола может развиться панкреатит. Большинство собак с панкреатитом, как правило, старше 5 лет [8; 11; 16; 53]. Различные исследования показывали неодинаковую породную предрасположенность из-за разных географических регионов. В США повышенному риску подвержены цвергшнауцеры и терьеры (особенно йоркширские терьеры) [8; 16; 26]. В Великобритании, по сообщениям исследователей, повышенному риску возникновения хронического панкреатита подвержены кокер-спаниели, кавалер-кинг-чарльз-спаниели, бордер-колли и боксёры [54].
Различия между настоящим исследованием и более ранними можно отнести на счёт разницы в размере популяции, поскольку размер выборки в текущем исследовании был значительно выше, чем в предыдущих.
Поджелудочная железа собак разделена на правую и левую доли, соединяющиеся в области тела органа; правую долю легче всего идентифицировать на УЗИ, она расположена дорсомедиальнее нисходящей части двенадцатиперстной кишки, вентральнее правой почки и латеральнее восходящей части ободочной кишки [25]. Двенадцатиперстная кишка и правая доля поджелудочной железы могут быть расположены в дорсальной части 10–12-го межреберья (варьируется в зависимости от экстерьера животного) и следовать каудально, в поперечной или продольной плоскости [25]. Тело поджелудочной железы лежит непосредственно каудально и дорсально от пилородуоденального сфинктера, вентрально от портальной вены и медиально от проксимального участка двенадцатиперстной кишки. Левая доля у собак расположена дорсально и каудально от тела желудка, краниально от поперечной ободочной кишки. Она следует по ходу селезёночной вены, которая проходит от ворот селезёнки медиально к воротной вене на уровне тела поджелудочной железы. Левая доля у собак чаще всего намного меньше, чем правая, и, таким образом, менее доступна для визуализации вследствие затенения и артефактов реверберации из-за газов в желудке и поперечной ободочной кишке [25]. Анатомическое расположение каждой доли является важным, поскольку может объяснить результаты, полученные в настоящем исследовании.
Ультразвуковое исследование брюшной полости считается методом выбора для диагностики панкреатита у собак, оно также позволяет исключить дифференциальные диагнозы, которые дают схожую клиническую картину [57]. Однако эффективность абдоминальной ультрасонографии зависит от опыта выполняющего её специалиста. УЗ-признаки у собак с острым панкреатитом включают наличие гипоэхогенных участков поджелудочной железы, повышенную эхогенность брыжейки и увеличение или неровные края поджелудочной железы, расширение протока поджелудочной железы или жёлчных протоков, а также асцит [11; 15; 16; 41; 50]. Расширение протока поджелудочной железы считается патогномоничным при панкреатите у человека, и, возможно, является таковым и у собак [46; 52]. Окружающая орган брыжейка при панкреатите может быть гиперэхогенной, что говорит о перипанкреатическом стеатите и жировом некрозе [15]. Считается, что правая доля поджелудочной железы у собак наиболее часто поражается в острых случаях; это может быть следствием того, что правая часть чаще видна при ультразвуковом исследовании [25]. Подобные результаты УЗИ были представлены в настоящем исследовании и использовались для диагностики острого панкреатита у собак. Проведённое ранее исследование описало нормальную ультрасонографическую картину у здоровых собак. Оно показало, что правая доля поджелудочной железы была наиболее доступна для визуализации и была оценена у 98% собак по сравнению с левой долей (88% собак), телом (64%) и протоком поджелудочной железы, который визуализировался только у 8% животных [34]. В экспериментальном исследовании индуцированного панкреатита у 6 здоровых собак нечёткое образование с неоднородной эхогенностью, сопровождающееся общим снижением эхогенности, было зарегистрировано как в левой, так и в правой долях поджелудочной железы. Процесс затронул правую долю поджелудочной железы у 5 из 6 собак, левую — у 4 из 6 [34]. В исследовании, которое оценивало ультрасонографические результаты у 3 собак с экспериментально вызванным панкреатитом, патология правой доли поджелудочной железы выявлялась чаще, чем патология левой доли [38]. Эти результаты также схожи с результатами другого исследования [24]. Хотя эти работы являются экспериментальными и проводились на небольшом числе собак, их результаты, тем не менее, схожи с результатами нашего исследования, где очаги, обнаруженные в правой доле поджелудочной железы, были выявлены в 36% случаев по сравнению с очагами, выявленными в левой доле поджелудочной железы (14% случаев). Диффузный панкреатит был выявлен у 50% собак. Таким образом, из настоящего исследования следует, что диффузная патология поджелудочной железы, судя по всему, является наиболее частым результатом УЗИ у пациентов с острым панкреатитом.
Результаты УЗИ, характерные для острого панкреатита у собак, были отмечены в ранее проведённом исследовании в 68% случаев [16]. Преимущества УЗИ перед другими методами визуализации — сравнительно низкая стоимость и неинвазивность. Однако низкая отрицательная прогностическая ценность нормальных результатов ультразвукового исследования не позволяет использовать его в качестве диагностики выбора для исключения острого панкреатита, поскольку возможны ложноотрицательные результаты [40]. Не всегда поражения будут коррелировать с клиническим состоянием пациента [32]. Поскольку при ультразвуковом исследовании могут быть обнаружены несущественные поражения поджелудочной железы, значимость патологий, выявленных с помощью этого метода, должна интерпретироваться в свете клинических признаков пациента [32]. Более раннее исследование показало, что с панкреатитом была связана ультразвуковая картина спазмированной и утолщённой стенки кишечника. В этом исследовании 18 собак имели спазмированный кишечник; тем не менее, окончательный диагноз острого панкреатита был поставлен только в 50% случаев [33]. Таким образом, постановка диагноза при панкреатите должна основываться не только на результатах УЗИ; сопоставление анамнеза, результатов клинического осмотра и биохимический анализ крови также очень важны.
Ни один из клинических симптомов при панкреатите собак не является патогномоничным. Тем не менее, животные с тяжёлым острым панкреатитом, как правило, попадают на приём с приступом острой абдоминальной боли [16; 55]. В одном из исследований сообщалось об абдоминальной боли у 58% собак с острым панкреатитом [16], что намного больше, чем в результатах настоящего исследования, где этот симптом присутствовал только в 15% случаев. Сниженный аппетит, по сообщениям, проявляется в 91% случаев, что отличается от результатов нашего исследования, где плохой аппетит отмечался только у 35% исследуемых животных. Острая рвота отмечалась исследователями в 90% случаев [16], тогда как в нашем исследовании она проявлялась только у 50% пациентов. О диарее сообщалось в 33% случаев, в нашем исследовании она возникала у 25% животных. Разница между нашим исследованием и работой Hess et al. (1998) может объясняться различной направленностью двух исследований, а также более совершенными технологиями абдоминальной ультрасонографии и большей опытностью операторов. Также размер выборки в нашем исследовании был значительно более высоким, чем у Hess et al. Кроме того, различия в результатах могут также возникать за счёт неоднородности популяции пациентов. В исследование Hess et al. (1998) были включены только погибшие пациенты; поэтому можно предположить, что они имели более тяжёлую клиническую картину. В другом исследовании на 20 собаках с панкреатитом только у одной собаки (5%) отсутствовали желудочно-кишечные симптомы [21]. При этом следует отметить, что такой размер выборки очень мал.
В добавление к вышесказанному следует отметить, что рвота и диарея чаще наблюдались при диффузном панкреатите. Плохой аппетит отмечался, как правило, при правосторонней и диффузной формах заболевания. Эти различия между группами могут быть связаны с вовлечением в процесс желудка и/или кишечника, проявляющимся по-разному при воспалении различных долей поджелудочной железы. В различных исследованиях у людей была продемонстрирована связь тошноты с возникновением нарушения моторики желудка у людей, склонных к укачиванию, беременных женщин и при гастропарезе [14; 22; 59]. Предыдущие исследования предположили существование связи между нарушением моторики желудка и тошнотой [59]. Кроме того, препараты, улучшающие моторику, уменьшают тошноту; напротив, стимулы, ухудшающие её, могут вызывать чувство тошноты [59]. Таким образом, можно предположить, что диффузный панкреатит собак из-за его тесной связи с работой желудка может привести к нарушениям моторики желудка, которые могут вызывать тошноту и рвоту. Возможными причинами увеличения частоты диареи при диффузном панкреатите могут быть утолщение стенки желудка и толстой кишки и/или синдром желудочного сброса. Проведённое ранее исследование у людей с острым панкреатитом, при котором для записи нарушений в желудочно-кишечном тракте использовалась МРТ, выявило утолщение стенки желудка и поперечной ободочной кишки у 20 и 15% пациентов соответственно [19]. Синдром желудочного сброса может развиваться у людей, перенёсших гастрэктомию. Это приводит к быстрому опорожнению гиперосмолярного содержимого желудка в проксимальный отдел кишечника [9; 28]. Близость левой доли поджелудочной железы к желудку может провоцировать нарушение перистальтики желудка из-за локализованного воспаления, в результате чего содержимое желудка выбрасывается в проксимальный отдел кишечника, вызывая диарею. У людей острый некротизирующий панкреатит может приводить к осложнениям в работе толстого кишечника. Проведённое ранее исследование показало, что из людей, перенёсших хирургическое лечение острого некротизирующего панкреатита, 6,1% имели инфаркты толстого кишечника как вторичный процесс вследствие осложнений [1]. Эти результаты сходны с полученными в более раннем исследовании, где из 22 пациентов с острым панкреатитом у 9 наблюдалось вовлечение в процесс толстого кишечника. Поперечная ободочная кишка была поражена у 3 из 9 пациентов [4]. У собак левая доля поджелудочной железы лежит краниально от поперечной ободочной кишки. Мы предполагаем, что локализованный воспалительный процесс, поражающий левую долю поджелудочной железы, даже не столь серьёзный, как осложнения, возникающие у людей, может привести к колиту поперечной ободочной кишки и не обязательно всегда вызывать рвоту; однако со временем, по мере прогрессирования состояния, ситуация может меняться. Хотя лёгкие клинические признаки, связанные с панкреатитом левой доли, не описаны в ветеринарной литературе, новая публикация по оценке КТ-ангиографии и УЗИ у собак с острым панкреатитом продемонстрировала некоторые интересные результаты. Это исследование показало, что у собаки с гетерогенным контрастным увеличением поджелудочной железы госпитализация длилась значительно дольше, включая вероятность госпитализации на срок более 5 дней, чаще случались рецидивы и тромбозы воротной вены [13]. Проведённое ранее исследование выявило слабую, но значимую линейную корреляцию между утолщением правой доли поджелудочной железы и утолщением стенки двенадцатиперстной кишки с увеличением её диаметра [56]. Это показывает, что размеры правой части поджелудочной железы и прилегающей двенадцатиперстной кишки взаимосвязаны, что может быть использовано для оценки размера поджелудочной железы у собак [56]. Кроме того, проведённые ранее исследования продемонстрировали, что кишечник, вероятно, способствует или усиливает воспаление поджелудочной железы из-за кишечной ишемии [12]. Правая доля поджелудочной железы лежит дорсомедиально от нисходящей двенадцатиперстной кишки. Статистически значимым результатом в настоящем исследовании было снижение аппетита у животных, проявлявшееся преимущественно у собак с правосторонним и диффузным панкреатитом. Возможным объяснением этого может быть тот факт, что двенадцатиперстная кишка имеет большое количество рецепторов, и её принято считать «органом тошноты» [43]. Стимуляция этих рецепторов может приводить к снижению аппетита из-за тошноты, не обязательно сопровождающейся рвотой. Кроме того, боль, регистрировавшаяся у больных собак с острым панкреатитом, отмечалась значительно чаще при диффузном панкреатите по сравнению с воспалением левой или правой долей железы. Возможно, причиной этого является то, что диффузный панкреатит у собак представляет собой более тяжёлую форму заболевания. Несмотря на частичное сходство между различными группами, настоящее исследование показало, что болевая реакция ожидаемо проявляется с большей частотой при диффузном панкреатите, но в конечном счёте не является обязательным клиническим признаком. Это важно, поскольку отсутствие абдоминальной боли не исключает наличия панкреатита, в особенности при поражении одной из двух долей.
Результаты нашей работы контрастируют с предыдущим исследованием, которое не показало существенных различий между клиническими признаками и ультразвуковыми изменениями поджелудочной железы [35]. Однако выборка в упомянутом исследовании была небольшой — 40 собак, принадлежащих частным владельцам [35]. Кроме того, цели исследования были сосредоточены на сравнении патологических результатов сывороточной специфической липазы поджелудочной железы собак и ультразвуковых изменений поджелудочной железы у собак с панкреатитом, что отличается от целей нашего исследования.
Важными ограничениями настоящего исследования были следующие: это было ретроспективное исследование, в котором собаки оценивались только в один момент времени; проводилось только одно ультразвуковое исследование без последующих сканирований; гистопатологическое исследование поджелудочной железы не проводилось. Кроме того, УЗИ выполняли разные люди, таким образом, могла иметь место вариабельность результатов, поскольку опытность проводящего исследование специалиста, а также чувствительность ультразвукового сканера чрезвычайно важны для ультрасонографии. Тем не менее, все лица, выполнявшие УЗИ, прошли обучение в области сонографии и должны были следовать стандартной ультразвуковой процедуре с использованием сходных ультразвуковых сканеров. Кроме того, все изображения и видео были оценены одним рецензентом с большим опытом работы с УЗИ мелких животных, что снизило влияние упомянутых ограничений. Хотя классификация поражений (в соответствии с клиническими и УЗ-данными), наблюдаемых у собак с панкреатитом, не обсуждалась, мы не считаем, что это повлияло на наши результаты, поскольку предметом исследования было наличие, а не тяжесть клинических признаков. Тем не менее, будущие исследования, оценивающие прогностическую значимость результатов, должны включать градационную шкалу для абдоминальной боли и сниженного аппетита. Дополнительным ограничением было то, что истинная распространённость панкреатита, ограниченного одной из долей поджелудочной железы, могла быть недостаточно представлена в этом исследовании, поскольку влияние желудочного содержимого на визуализацию могло приводить к необоснованному исключению животных с панкреатитом левой доли; также не была выполнена оценка вероятности для определения породной предрасположенности. Для включения в исследование у собак должны были быть обнаружены результаты, характерные для панкреатита, при выполнении УЗИ. Таким образом, пациенты без требуемых ультрасонографических результатов могли быть исключены из исследования, что могло исказить результат. Однако маловероятно, что у этих пациентов были другие критерии включения. Кроме того, концентрация сывороточной специфической липазы поджелудочной железы собак не оценивалась. Результаты решающего теста концентрации сывороточной липазы считаются сомнительными (при повышенных значениях по сравнению с нормой), если они лежат в пределах от 200 мг/л до 400 мг/л, а значение > 400 мг/л говорит о наличии панкреатита. Результаты SNAP cPL могут оцениваться только как нормальные и ненормальные. Таким образом, у некоторых пациентов могли присутствовать ложнопозитивные результаты SNAP cPL.
Несмотря на ограничения исследования, результаты, тем не менее, вызывают уместные вопросы, в том числе о том, как у собак с панкреатитом может проявляться множество различных клинических признаков в зависимости от поражённой области поджелудочной железы. Хотя подобные результаты ранее не были описаны, они важны для потенциального понимания того, как эти неопределённые клинические признаки возникают у собак; также это может помочь практикующим врачам в выборе схем лечения. Кроме того, для подтверждения наших результатов необходимы дальнейшие исследования и оценка, имеет ли прогностическое значение то, какая область поджелудочной железы собаки поражена.
На основе результатов, полученных в настоящем исследовании, можно заключить, что животные с поражением левой, правой долей и при диффузном панкреатите имеют различные клинические проявления. Кроме того, боль появляется чаще при диффузном панкреатите, хотя при этом варианте заболевания более распространены рвота и диарея. Помимо этого, снижение аппетита проявляется чаще всего у собак с диффузной формой панкреатита и при поражении правой доли поджелудочной железы.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Все авторы внесли значимый вклад в дизайн исследования, интерпретацию данных, написание и проверку статьи.
Информация о финансировании
Это исследование не получало специальных грантов от каких-либо фондовых агентств ощественного, коммерческого или некоммерческого секторов.
Дисклеймер
Взгляды, изложенные в этой статье, представляют собой точку зрения авторов, а не официальную позицию какой-либо организации или спонсора.
Литература
1. Adams, D.B., Davis, B.R. & Anderson, M.C., 1994, «Colonic complications of pancreatitis», The American Surgeon 60(1), 44–49.
2. Adrian, A.M., Twedt, D.C., Kraft, S.L. & Marolf, A.J., 2015, «Computed tomographic angiography under sedation in the diagnosis of suspected canine pancreatitis: A pilot study», Journal of Veterinary Internal Medicine 29(1), 97–103. https://doi.org/10.1111/jvim.12467.
3. Akol, K.G., Washabau, R.J., Saunders, H.M. & Hendrick, M.J., 1993, «Acute pancreatitis in cats with hepatic lipidosis», Journal of Veterinary Internal Medicine 7(4), 205–209. https://doi.org/10.1111/j.1939–1676.1993.tb01008.x.
4. Aldridge, M.C., Francis, N.D., Glazer, G. & Dudley, H.A., 1989, «Colonic complications of severe acute pancreatitis», British Journal of Surgery 76(4), 362–367. https://doi.org/10.1002/bjs.1800760416.
5. Arvanitakis, M., Koustiani, G., Gantzarou, A., Grollios, G., Tsitouridis, I., Haritandi- Kouridou, A. et al., 2007, «Staging of severity and prognosis of acute pancreatitis by computed tomography and magnetic resonance imaging — a comparative study», Digestive and Liver Disease 39(5), 473–482. https://doi.org/10.1016/j.dld.2007.01.015.
6. Bostrom, B.M., Xenoulis, P.G., Newman, S.J., Pool, R.R., Fosgate, G.T. & Steiner, J.M., 2013, «Chronic pancreatitis in dogs: A retrospective study of clinical, clinicopathological, and histopathological findings in 61 cases», The Veterinary Journal 195(1), 73–79. https://doi.org/10.1016/j.tvjl.2012.06.034.
7. Cappell, M.S., 2008, «Acute pancreatitis: Etiology, clinical presentation, diagnosis, and therapy», Medical Clinics of North America 92(4), 889–923, ix-x. https://doi.org/10.1016/j.mcna.2008.04.013.
8. Cook, A.K., Breitschwerdt, E.B., Levine, J.F., Bunch, S.E. & Linn, L.O., 1993, «Risk factors associated with acute pancreatitis in dogs: 101 cases (1985–1990)», Journal of the American Veterinary Medical Association 203(5), 673–679.
9. Davis, J.L. & Ripley, R.T., 2017, «Postgastrectomy syndromes and nutritional considerations following gastric surgery», Surgical Clinics of North America 97(2), 277–293. https://doi.org/10.1016Zj.suc.2016.11.005.
10. De Cock, H.E., Forman, M.A., Farver, T.B. & Marks, S.L., 2007, «Prevalence and histopathologic characteristics of pancreatitis in cats», Veterinary Pathology 44(1), 39–49. https://doi.org/10.1354/vp.44–1–39.
11. Ferreri, J.A., Hardam, E., Kimmel, S.E., Saunders, H.M., Van Winkle, T.J., Drobatz, K.J. et al., 2003, «Clinical differentiation of acute necrotizing from chronic nonsuppurative pancreatitis in cats: 63 cases (1996–2001)», Journal of the American Veterinary Medical Association 223(4), 469–474. https://doi.org/10.2460/javma.2003. 223.469.
12. Flint, R.S. & Windsor, J.A., 2003, «The role of the intestine in the pathophysiology and management of severe acute pancreatitis», HPB: The Official Journal of the International Hepato Pancreato Biliary Association 5(2), 69–85. https://doi.org/10.1080/13651820310001108.
13. French, J.M., Twedt, D.C., Rao, S. & Marolf, A.J., 2019, «Computed tomographic angiography and ultrasonography in the diagnosis and evaluation of acute pancreatitis in dogs», Journal of Veterinary Internal Medicine 33(1), 79–88. https://doi.org/10.1111/jvim.15364.
14. Hasler, W.L., Soudah, H.C., Dulai, G. & Owyang, C., 1995, «Mediation of hyperglycemia — evoked gastric slow-wave dysrhythmias by endogenous prostaglandins», Gastroenterology 108(3), 727–736. https://doi.org/10.1016/0016–5085(95)90445-X.
15. Hecht, S. & Henry, G., 2007, «Sonographic evaluation of the normal and abnormal pancreas», Clinical Techniques in Small Animal Practice 22(3), 115–121. https://doi.org/10.1053/j.ctsap.2007.05.005.
16. Hess, R.S., Saunders, H.M., Van Winkle, T.J., Shofer, F.S. & Washabau, R.J., 1998, «Clinical, clinicopathologic, radiographic, and ultrasonographic abnormalities in dogs with fatal acute pancreatitis: 70 cases (1986–1995)», Journal of the American Veterinary Medical Association 213(5), 665–670.
17. Hill, R.C. & Van Winkle, T.J., 1993, «Acute necrotizing pancreatitis and acute suppurative pancreatitis in the cat. A retrospective study of 40 cases (1976–1989)», Journal of Veterinary Internal Medicine7(1), 25–33. https://doi.org/10.1111/j.1939–1676.1993.tb03165.x.
18. Jaeger, J.Q., Mattoon, J.S., Bateman, S.W. & Morandi, F., 2003, «Combined use of ultrasonography and contrast enhanced computed tomography to evaluate acute necrotizing pancreatitis in two dogs», Veterinary Radiology & Ultrasound 44(1), 72–79. https://doi.org/10.1111/j.1740–8261.2003.tb01453.x.
19. Ji, Y.-F., Zhang, X.-M., Mitchell, D.G., Li, X.-H., Chen, T.-W., Li, Y. et al., 2017, «Gastrointestinal tract involvement in acute pancreatitis: Initial findings and follow-up by magnetic resonance imaging», Quantitative Imaging in Medicine and Surgery 7(6), 641–653. https://doi.org/10.21037/qims.2017.12.03.
20. Kim, D.H. & Pickhardt, P.J., 2007, «Radiologic assessment of acute and chronic pancreatitis», Surgical Clinics of North America 87(6), 1341–1358, viii. https://doi.org/10.1016/j.suc.2007.08.005.
21. Kis, I., Brkljacic, M., Mayer, I., Selanec, J., Jovic, I., Kucer, N. et al., 2013, «Diagnostics of acute canine pancreatitis and comparison of clinical, laboratory and ultrasound findings», in 5th International Congress Veterinary Science and Profession, Zagreb, Croatia, October 3–4, 2013. Book of abstracts, 38.
22. Koch, K.L., 2014, «Gastric dysrhythmias: A potential objective measure of nausea», Experimental Brain Research 232(8), 2553–2561. https://doi.org/10.1007/s00221–014–4007–9.
23. Kook, P.H., Kohler, N., Hartnack, S., Riond, B. & Reusch, C.E., 2014, «Agreement of serum Spec cPL with the 1,2-o-dilauryl-rac-glycero glutaric acid-(6’-methylresorufin) ester (DGGR) lipase assay and with pancreatic ultrasonography in dogs with suspected pancreatitis», Journal of Veterinary Internal Medicine 28(3), 863–870. https://doi.org/10.1111/jvim.12334.
24. Lamb, C.R. & Simpson, K.W., 1995, «Ultrasonographic findings in cholecystokinin-induced pancreatitis in dogs», Veterinary Radiology & Ultrasound 36, 139–145. https://doi.org/10.1111/j.1740–8261.1995.tb00234.x.
25. Larson, M.M., 2016, «Ultrasound imaging of the hepatobiliary system and pancreas», Veterinary Clinics of North America: Small Animal Practice 46(3), 453–480. https://doi.org/10.1016/j.cvsm.2015.12.004.
26. Lem, K.Y., Fosgate, G.T., Norby, B. & Steiner, J.M., 2008, «Associations between dietary factors and pancreatitis in dogs», Journal of the American Veterinary Medical Association 233(9), 1425–1431. https://doi.org/10.2460/javma.233.9.1425.
27. Lim, S.Y., Nakamura, K., Morishita, K., Sasaki, N., Murakami, M., Osuga, T. et al., 2015, «Quantitative contrast-enhanced ultrasonographic assessment of naturally occurring pancreatitis in dogs», Journal of Veterinary Internal Medicine 29(1), 71–78. https://doi.org/10.1111/jvim.12470.
28. Machella, T.E., 1950, «Mechanism of the post-gastrectomy dumping syndrome», Gastroenterology 14(2), 237–255. https://doi.org/10.1016/S0016–5085(50)80037–9.
29. Mansfield, C., 2012, «Acute pancreatitis in dogs: Advances in understanding, diagnostics, and treatment», Topics in Companion Animal Medicine 27(3), 123–132. https://doi.org/10.1053/j.tcam.2012.04.003.
30. Mansfield, C.S. & Jones, B.R., 2000, «Plasma and urinary trypsinogen activation peptide in healthy dogs, dogs with pancreatitis and dogs with other systemic diseases», Australian Veterinary Journal 78(6), 416–422. https://doi.org/10.1111/j.1751–0813.2000.tb 11833.x.
31. Mccord, K., Morley, P.S., Armstrong, J., Simpson, K., Rishniw, M., Forman, M.A. et al., 2012, «A multi-institutional study evaluating the diagnostic utility of the spec cPL and SNAP(R) cPL in clinical acute pancreatitis in 84 dogs», Journal of Veterinary Internal Medicine 26(4), 888–896. https://doi.org/10.1111/j.1939–1676.2012.00951.x.
32. Mix, K. & Jones, C., 2006, «Diagnosing acute pancreatitis in dogs» Compendium on Continuing Education for the Practicing Veterinarian 28:226–234.
33. Moon, M.L., Biller, D.S. & Armbrust, L.J., 2003, «Ultrasonographic appearance and etiology of corrugated small intestine», Veterinary Radiology & Ultrasound 44(2), 199–203. https://doi.org/10.1111/j.1740–8261.2003.tb01271.x.
34. Murtaugh, R.J., Herring, D.S., Jacobs, R.M. & Dehoff, W.D., 1985, «Pancreatic ultrasonography in dogs with experimentally induced acute pancreatitis», Veterinary Radiology 26(1), 27–32. https://doi.org/10.1111/j.1740–8261.1985.tb01111.x.
35. Myung-Jin, K., Joong-Hyun, S., Tae-Sung, H., Hee-Chun, L. & Dong-In, J., 2017, «Comparison between SNAP canine pancreas-specific Lipase (cPL) test results and pancreatic ultrasonographic findings in dogs with pancreatitis», Journal of Veterinary Clinics 34(4), 229–233. https://doi.org/10.17555/jvc.2017.08.34.4.229.
36. Neilson-Carley, S.C., Robertson, J.E., Newman, S.J., Kutchmarick, D., Relford, R., Woosley, K. et al., 2011, «Specificity of a canine pancreas-specific lipase assay for diagnosing pancreatitis in dogs without clinical or histologic evidence of the disease», American Journal of Veterinary Research 72(3), 302–307. https://doi.org/10.2460/ajvr.72.3.302.
37. Newman, S., Steiner, J., Woosley, K., Barton, L., Ruaux, C. & Williams, D., 2004, «Localization of pancreatic inflammation and necrosis in dogs», Journal of Veterinary Internal Medicine 18(4), 488–493. https://doi.org/10.1111/j.1939–1676.2004.tb02572.x.
38. Nyland, T.G., Mulvany, M.H. & Strombeck, D.R., 1983, «Ultrasonic features of experimentally induced, acute pancreatitis in the dog», Veterinary Radiology 24(6), 260–266. https://doi.org/10.1111/j.1740–8261.1983.tb00729.x.
39. Rademacher, N., Schur, D., Gaschen, F., Kearney, M. & Gaschen, L., 2016, «Contrast- enhanced ultrasonography of the pancreas in healthy dogs and in dogs with acute pancreatitis», Veterinary Radiology & Ultrasound 57(1), 58–64. https://doi.org/10.1111/vru.12285.
40. Ruaux, C.G., 2003, «Diagnostic approaches to acute pancreatitis», Clinical Techniques in Small Animal Practice 18(4), 245–249. https://doi.org/10.1016/S1096–2867(03) 00072–0.
41. Saunders, H.M., Vanwinkle, T.J., Drobatz, K., Kimmel, S.E. & Washabau, R.J., 2002, «Ultrasonographic findings in cats with clinical, gross pathologic, and histologic evidence of acute pancreatic necrosis: 20 cases (1994–2001)», Journal of the American Veterinary Medical Association 221(12), 1724–1730. https://doi.org/10.2460/javma.2002.221.1724.
42. Scaglione, M., Casciani, E., Pinto, A., Andreoli, C., De Vargas, M. & Gualdi, G.F., 2008, «Imaging assessment of acute pancreatitis: A review», Seminars in Ultrasound, CT and MR 29(5), 322–340. https://doi.org/10.1053/j.sult.2008.06.009.
43. Schoor, M.V., 2011, «Approach to the vomitting dog», in Proceedings of the World Veterinary Association Congress, Cape Town, South Africa, October 10–14, 2011, pp. 1–5.
44. Shanaman, M.M., Schwarz, T., Gal, A. & O’brien, R.T., 2013, «Comparison between survey radiography, B-mode ultrasonography, contrast-enhanced ultrasonography and contrast-enhanced multi-detector computed tomography findings in dogs with acute abdominal signs», Veterinary Radiology & Ultrasound 54(6), 591–604. https://doi.org/10.1111/vru.12079.
45. Sheu, Y., Furlan, A., Almusa, O., Papachristou, G. & Bae, K.T., 2012, «The revised Atlanta classification for acute pancreatitis: A CT imaging guide for radiologists», Emergency Radiology 19(3), 237–243. https://doi.org/10.1007/s10140–011–1001–4.
46. Simpson, K. & Lamb, C., 1995, «Acute pancreatitis in the dog», In Practice 17, 328–337. https://doi.org/10.1136/inpract.177.328.
47. Steiner, J.M., 2003, «Diagnosis of pancreatitis», Veterinary Clinics of North America: Small Animal Practice 33, 1181–1195. https://doi.org/10.1016/S0195–5616(03)00061–5.
48. Steiner, J.M., Newman, S., Xenoulis, P., Woosley, K., Suchodolski, J., Williams, D. et al., 2008, «Sensitivity of serum markers for pancreatitis in dogs with macroscopic evidence of pancreatitis», Veterinary Therapeutics 9(4), 263–273.
49. Strombeck, D.R., Farver, T. & Kaneko, J.J., 1981, «Serum amylase and lipase activities in the diagnosis of pancreatitis in dogs», American Journal of Veterinary Research 42(11), 1966–1970.
50. Swift, N.C., Marks, S.L., Maclachlan, N.J. & Norris, C.R., 2000, «Evaluation of serum feline trypsin-like immunoreactivity for the diagnosis of pancreatitis in cats», Journal of the American Veterinary Medical Association 217(1), 37–42. https://doi.org/10.2460/javma.2000.217.37.
51. Trivedi, S., Marks, S.L., Kass, P.H., Luff, J.A., Keller, S.M., Johnson, E.G. et al., 2011, «Sensitivity and specificity of canine pancreas-specific lipase (cPL) and other markers for pancreatitis in 70 dogs with and without histopathologic evidence of pancreatitis», Journal of Veterinary Internal Medicine 25(6), 1241–1247. https://doi.org/10.1111/j.1939–1676.2011.00793.x.
52. Watson, P., 2004, «Pancreatitis in the dog: Dealing with a spectrum of disease», In Practice 26.
53. Watson, P.J., Archer, J., Roulois, A.J., Scase, T.J. & Herrtage, M.E., 2010, «Observational study of 14 cases of chronic pancreatitis in dogs», Veterinary Record 167(25), 968–976. https://doi.org/10.1136/vr.c4912.
54. Watson, P.J., Roulois, A.J., Scase, T., Johnston, P.E., Thompson, H. & Herrtage, M.E., 2007, «Prevalence and breed distribution of chronic pancreatitis at post-mortem examination in first-opinion dogs», Journal of Small Animal Practice 48(11), 609–618. https://doi.org/10.1111/j.1748–5827.2007.00448.x.
55. Weatherton, L.K. & Streeter, E.M., 2009, «Evaluation of fresh frozen plasma administration in dogs with pancreatitis: 77 cases (1995–2005)», Journal of Veterinary Emergency and Critical Care (San Antonio) 19(6), 617–622. https://doi.org/10.1111/j.1476–4431.2009.00483.x.
56. Wickramasekara Rajapakshage, B.K., Ellearaewe Garuhamilage, J.P., De Silva, D.D. & Dangolla, A., 2016, «Dimensional ultrasonographic relationship of the right lobe of pancreas with associated anatomic landmarks in clinically normal dogs», Journal of Veterinary Medical Science 78(1), 1–5. https://doi.org/10.1292/ jvms.15–0209.
57. Xenoulis, P.G., 2015, «Diagnosis of pancreatitis in dogs and cats», Journal of Small Animal Practice 56(1), 13–26. https://doi.org/10.1111/jsap.12274.
58. Xenoulis, P.G., Suchodolski, J.S. & Steiner, J.M., 2008, «Chronic pancreatitis in dogs and cats», Compendium: Continuing Education for Veterinarians 30(3), 166–180; quiz 180–181.
59. Xu, L.H., Koch, K.L., Summy-Long, J., Stern, R.M., Seaton, J.F., Harrison, T.S. et al., 1993, «Hypothalamic and gastric myoelectrical responses during vection-induced nausea in healthy Chinese subjects», American Journal of Physiology 265(4 Pt 1), E578–E584. https://doi.org/10.1152/ajpendo.1993.265.4.E578.
Источник: Journal of the South African Veterinary Association 91(0), a2022. This work is licensed under the Creative Commons Attribution License.
СВМ № 2/2021