Brian C. Gilger, DVM, MS, Dipl. ACVO, Dipl. ABT, Professor, Ophthalmology, North Carolina State University College of Veterinary Medicine. Email: Brian_Gilger@ncsu.edu
Введение
Традиционно выделяют три основных пути введения лекарственных средств в глаз: с помощью местных средств, системных препаратов или инъекций, внутриглазных или периокулярных. Каждый из этих методов имеет существенные недостатки. Глазные растворы и мази для наружного применения обеспечивают менее 1% проникновения в ткани, подвержены быстрому разбавлению и вымыванию слезами, а также их применение предполагает чёткое выполнение владельцем животного назначений по введению препарата. Системно введённые препараты, как правило, имеют ограниченную способность к проникновению в ткани глаза и поэтому могут потребовать более высоких и потенциально токсичных концентраций препарата на периферии. Глазные и периокулярные инъекции препарата являются травматичными и инвазивными, подвержены быстрому разбавлению и могут потребовать повторного введения для достижения необходимых концентраций препарата. Эти недостатки, особенно в случаях хронических внутриглазных болезней у крупных животных, побудили автора изучить методы введения лекарства в глаз с помощью устройств постоянного высвобождения препарата.
Офтальмология на практике может быть сведена к простой задаче: доставить правильный фармакологический агент в подходящей терапевтической дозе к глазной ткани-мишени с помощью метода, не травмирующего здоровые ткани [1]. Тем не менее в случае глазных болезней эта простая задача усложняется из-за высокой чувствительности тканей глаза (таких, например, как увеальный тракт и сетчатка) и присутствия на пути проникновения препаратов тканевых барьеров, а именно липофильного эпителия роговицы, гидрофильной стромы роговицы и склеры, лимфатической системы конъюнктивы, сосудов хориоидеи и гемато-окулярных барьеров.
Выбирая метод введения лекарственных средств при терапии глаза необходимо учитывать три важных аспекта:
- длительность введения;
- ткань-мишень, для которой предназначен препарат;
- согласие владельца выполнять назначения.
Длительность введения препарата варьируется от минут — в случае применения наружных глазных капель, до нескольких лет, для некоторых глазных имплантатов. Путь введения препарата может влиять на способность препарата достигать тканей-мишеней. К примеру, наружные глазные препараты в терапевтических концентрациях скорее всего достигнут роговицы и конъюнктивы, однако вряд ли распространятся до сетчатки и хориоидеи.
 |
| Рис. 1. Кинетические профили стандартных доз (непрерывная линия), систем постоянного высвобождения препарата (пунктирная линия) и систем контролируемого высвобождения (штриховая линия). По Weiner A.L. Drug Delivery Systems I Ophthalmic Applications. Yorio T, Clark A, Wax M, eds. Ocular Therapeutics, Eye on New Discoveries, Elsevier Press/Academic Press, New York, Pgs 7–43 |
Наконец, должна быть принята во внимание проблема выполнения назначений. Например, при лечении хронического заболевания для достижения терапевтических концентраций препарата в тканях необходимо вводить его каждый час в течение года. Вряд ли владелец животного будет систематически выполнять назначение, если вообще будет его выполнять. Таким образом, метод введения лекарственного средства в глаз должен соответствовать заболеванию с точки зрения расположения мишени для препарата и длительности эффекта для обеспечения соблюдения назначений владельцем животного (рис. 1) [1].
Проблема соблюдения назначений особенно важна в ветеринарной медицине из-за трудностей последовательного лечения больного животного, которое зачастую возлагается на необученного владельца. В связи с этим началась разработка технологии постоянного введения глазного препарата, способной устранить или облегчить проблему выполнения назначений владельцами [2; 3].
 |
| Рис. 2. Реакция первого порядка |
 |
| Рис. 3. Реакция нулевого порядка |
Основные особенности введения лекарственных средств в глаз
В зависимости от расположения ткани-мишени главными проблемами, требующими решения при введении лекарственнх средств в глаз, являются локализация действия препарата в определённом месте и поддержание терапевтической концентрации при одновременной минимизации системных эффектов. Проникновение препарата через роговицу является главным путём поступления местного препарата в переднюю камеру глаза. Большинству препаратов требуется 20—60 минут для того, чтобы достичь пиковой концентрации во внутриглазной жидкости. Интервал между местным введением препарата и его появлением во внутриглазной жидкости называется временем запаздывания (временной лаг — Прим. перев.) данного препарата. Время запаздывания зависит от скорости диффузии препарата через роговицу. Количество препарата, проникающее через роговицу, линейно зависит от концентрации препарата в слезе; за исключением препаратов, имеющих другие физико-химические свойства, влияющие на их проникающую способность (такие как взаимодействие с другими молекулами, связывание с белками, ограниченная растворимость препарата, метаболизм ферментами слёз). Снижение концентрации препарата в слезе (а, следовательно, и его количества, которое проникает через роговицу) следует правилам кинетики реакции первого порядка, и скорость снижения концентрации зависит от скорости разведения препарата свежими слезами. У кроликов и человека период полувыведения одной-единственной капли глазного препарата объёмом 20 мкл варьируется от 2 до 20 минут. В результате, только 1—10% от дозы наружного препарата может достичь передней камеры глаза. Остаток выводится со слезами через носослёзную систему, откладывается на веках или подвергается расщеплению ферментами слёз или покровных тканей. Системное всасывание некоторых препаратов может быть значительным. Инфузия препарата с постоянной скоростью или его поступление из твёрдых имплантатов, содержащих препарат, обычно следуют правилам кинетики реакции нулевого порядка.
 |
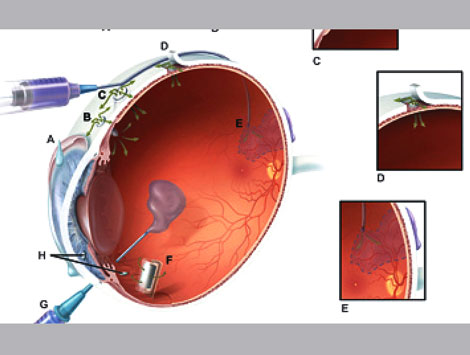
| Рис. 4. Места и методы доставки препаратов в глаз: глазные капли (A), склеральная пробка (B), субконъюнктивальный имплантат (C), супрахориоидальный имплантат (D), супрасклеральная инъекция (E), имплантат в стекловидное тело (F), инъекция в стекловидное тело (G), продукты Oculex (H) |
Анатомические и физиологические барьеры для проникновения препаратов в глаз
Местное введение лекарственных средств в глаз осложнено тем, что глаз имеет уникальные функциональные и структурные механизмы защиты, такие как моргание, постоянная продукция и дренаж слёз, которые необходимы для сохранения остроты зрения, но в то же время благоприятствуют быстрому выведению локально введённых глазных препаратов. Для препаратов, введённых периокулярно или системно, главными препятствиями для проникновения к внутренним тканям глаза являются склера и гемато-окулярные барьеры. Роговица, по существу, представляет собой многослойный сандвич: жир (эпителий) — вода (строма) — жир (эндотелий). Эпителий является главным барьером для всасывания, в особенности гидрофильных препаратов, в то время как строма роговицы служит основным барьером для липофильных препаратов. Таким образом, препарат с оптимальным соотношением гидрофильности и липофильности обеспечивает лучший трансфер через роговицу.
Глазное введение препаратов
Сложное разделение глаза на отделы создаёт уникальные места для размещения систем введения препаратов. В данном обзоре рассматриваются как неинвазивные местные стратегии введения препарата, так и более инвазивные технологии имплантатов.
Введение лекарственных средств в глаз: неинвазивные стратегии
В то время как стандартных офтальмических растворов для местного применения обычно достаточно для получения эффективного ответа при большинстве нарушений поверхностных структур и передней камеры глаза, существуют факторы, ограничивающие способность глазных капель достигать концентраций выше минимально эффективных при терапии заднего сегмента глаза. К этим факторам относятся в том числе коэффициенты распределения и диффузии препарата в тканях, гидравлическая проводимость тканей глаза, пределы растворимости препарата, конъюнктивальный клиренс, а также внутриглазные и эписклеральные давления венозной крови. Существует два подхода к увеличению концентрации препарата в задних отделах глаза при введении лекарственных средств в глаз: увеличение времени нахождения препарата в глазу и усиление способности препарата проникать в ткани. Время локального пребывания препарата можно увеличить с помощью гелей и вживления твёрдых имплантатов. Проникающую способность препаратов можно улучшить, используя пролекарства, солюбилизаторы и методы ионофореза [1].
Введение лекарственных средств в глаз: использование имплантатов
Разрушающиеся имплантаты
Глазные имплантаты имеют много преимуществ, в том числе, способность доставлять постоянные терапевтические концентрации препарата напрямую к месту локализации глазного заболевания при , одновременно снижая системные побочные эффекты. Данные устройства для контролируемого непрерывного высвобождения препарата разделяют на биоразлагаемые (разрушающиеся) и небиоразлагаемые. Преимуществом биоразлагаемых имплантатов является то, что при введении лекарственных средств в глаз им можно придавать любую форму, и они не требуют удаления. Достоинством биологически неразлагаемых имплантатов является то, что они постепенно и контролируемо высвобождают препарат в течение долгого периода времени (несколько лет), а недостатком — необходимость удаления и/или замены при истощении препарата.
Неразрушающиеся имплантаты, основанные на диффузии
Неразрушающиеся имплантаты высвобождают препарат из небиоразлагаемого устройства, которое содержит либо центральный резервуар, либо плотное центральное устройство, покрытое препаратом. При истощении препарата любой тип устройства может быть удалён из глаза и заменён. Типичные резервуарные имплантаты состоят из ядра в виде гранулированного препарата, окружённого нереактивной субстанцией, такой как силикон, этиленвинилацетат (ЭВА) или поливинилалкоголь (ПВА). Главным преимуществом данных имплантатов является их способность доставлять постоянные дозы препарата в течение нескольких лет.
Неразрушающиеся имплантаты-насосы
Исторически исследования по изучению эффектов постоянной инфузии препаратов, проводимые на небольших насосах, ограничивались оценкой использования осмотических насосов Alza. Эти имеющиеся в продаже насосы доставляют заранее установленные концентрации препарата, обычно помещаются под кожу и обеспечивают доставку препарата в течение месяца. Их использование для глазных инфузий было изучено на лошадях (Herring).
Внутриглазные линзы (ВГЛ)
Для введения лекарственных средств в глаз после операций на катаракте также исследовались внутриглазные линзы [5]. Препарат может быть помещён внутрь самой линзы или на её поверхность, либо к ВГЛ присоединяется отдельный резервуар с препаратом. Наиболее часто используются ВГЛ с повышенным содержанием воды, такие как гидрогели или мягкий акриловый пластик, которые позволяют заполнять ВГЛ препаратом с помощью простого метода «пропитывания» [5]. Использование ВГЛ снижает риск развития послеоперационного эндофтальмита с помощью введения антибиотиков, подавляет воспаление с помощью введения дексаметазона или НПВП (нестероидные противовоспалительные препараты — Прим. перев.), и/или предотвращает развитие фиброза задней капсулы хрусталика [5]. В нашем исследовании акриловые ВГЛ, инкубированные в растворе целекоксиба, продемонстрировали способность выделять целекоксиб в концентрациях, достаточных для уменьшения воспаления и предотвращения помутнения задней капсулы хрусталика, в течение 7 дней in vitro [5]. Несмотря на то, что на данный момент отсутствуют данные об исследованиях на ветеринарных пациентах, данный метод представляется имеющим практическое значение, и дальнейшее развитие ему гарантировано.
Супрахориоидальное введение лекарственных средств в глаз
Супрахориоидальное (перихориоидальное) пространство — в норме почти не выражено, почему его часто называют «потенциальным» — узкая щель, расположенная между склерой и сосудистой оболочкой глаза. Инъекция в него приводит к быстрой инфильтрации препарата в цилиарное тело и хориоидею. Однократное введение лекарственного средства в супрахориоидальное пространство глаз трупов собаки и свиньи обеспечила распределение препарата более чем в 50% тканей заднего сегмента глаза [6]. Постоянно выделяющие циклоспорин имплантаты, помещённые в супрахориоидальное пространство, обеспечивали долгосрочный контроль увеита у лошадей [7]. Использование особых микроигл для получения доступа к супрахориоидальному пространству позволит применять эту технику с широким диапазоном препаратов и обеспечит доступ к жёлтому пятну, глазному нерву и заднему полюсу глаза [8].
Итоги и выводы
В последние десять лет разработка офтальмических устройств и продуктов, предназначенных улучшить соблюдение назначений, избирательность и продолжительность доставки глазного препарата, значительно ускорилась. Это является следствием лучшего понимания динамики жидкостей в глазу и распределения препаратов, экспериментов с использованием новых мест введения лекарственных средств в глаз и улучшения технологий, приведших к появлению лучших биоматериалов и механизмов для высвобождения препарата. Более того, разработка новых классов препаратов для таких заболеваний, как глаукома, увеит и ретинопатии, положило начало развитию уникальных систем, направленных на преодоление недостатков, наблюдаемых в классической терапии этих новых сложных заболеваний. Надвигающаяся волна новых устройств, подвергающихся клинической оценке, предложит пациентам и практикующим врачам множество крайне необходимых и более эффективных методов лечения.
Литература
1. Wiener AL, Gilger BC. Advancements in Ocular Drug Delivery. Vet Ophthalmol 2010;13(6):395–406.
2. Davis JL, Gilger BC, Robinson MR. Novel approaches to ocular drug delivery. Curr Opin Mol Ther 2004;6:195–205.
3. Gilger BC, Salmon JH, Wilkie DA, et al. A novel bioerodible deep scleral lamellar cyclosporine implant for uveitis. Invest Ophthalmol Vis Sci 2006;47:2596–2605.
4. Blair MJ, Gionfriddo JR, Polazzi LM, et al. Subconjunctivally implanted micro-osmotic pumps for continuous ocular treatment in horses. Am J Vet Res 1999;60:1102–1105.
5. Davis DL, Yi NY, Salmon JH, Charlton AN, Colitz CMH, Gilger BC. Sustained-release celecoxib from incubated acrylic intraocular lenses suppress lens epithelial cell growth in an ex vivo model of posterior capsule opacity (PCO). J Ophthalmol Pharm Therapeutics.
6. Seiler GS, Salmon JH, Mantua R, Feingold S, Dayton PA, Gilger BC. Distribution of contrast after injection into the anterior suprachoroidal space using 2D and 3D ultrasound in pig eyes. Invest Ophthalmol Vis Sci 2011 52(8):5730–5736
7. Gilger BC, Wilkie DA, Clode AB, McMullen RJ, Utter M, Komaromy A, Brooks DE, Salmon JH. Long-term outcome after implantation of a suprachoroidal cyclosporine drug delivery device in horses with recurrent uveitis. Vet Ophthalmol 2010;13(5):294–300.
8. Jiang J, Moore JS, Edelhauser HF, et al. Intrascleral drug delivery to the eye using hollow microneedles. Pharm Res 2009;26:395–403.
Лекция предоставлена организаторами III Московского ветеринарного конгресса по офтальмологии, перевод и публикация осуществляются с любезного разрешения доктора Брайна Гилгера.
СВМ № 2/2016