Канадские исследователи опубликовали в журнале Molecular Systems Biology результаты своего эксперимента по созданию плазмиды со встроенным комплексом CRISPR/Cas9, которая за два часа передаётся к 96% целевых бактерий и вызывает их уничтожение в кишечнике мыши. Новая плазмида передаётся в два раза быстрее дикого типа, который использовали ранее.
Поскольку многие энтеробактерии, например Escherichia coli, Klebsiella pneumoniae, Shigella sp. и Salmonella sp., опасные сами по себе, могут быстро накапливать гены устойчивости к антибиотикам, учёные ищут альтернативные способы лечения, не включающие противомикробные препараты. Один из таких способов — транспортировка системы CRISPR/Cas9 в целевую клетку для разрезания двухцепочечной ДНК, что приводит к гибели бактерии. Для доставки этой системы используют бактериофаги или клетки других бактерий. Бактериофаги действительно быстро и точно доставляют CRISPR/Cas9, но их селективность снижает быстрая мутация рецепторов фагов на поверхности клеток, а условия окружающей среды в кишечнике (в частности, кислотность и активность ферментов) ухудшают их эффективность. Адаптированные к кишечнику бактерии являются более устойчивыми и используют бактериальную конъюгацию для доставки CRISPR/Cas9 к клеткам-мишеням, но предыдущие эксперименты показывали низкую эффективность передачи плазмиды в кишечнике мышей.
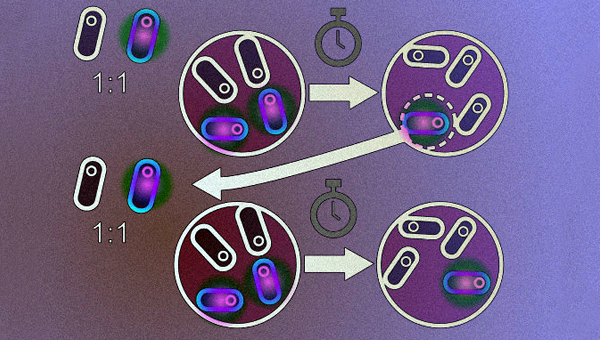
Чтобы решить эту проблему, канадские учёные из Университета Шербрука под руководством Кевина Нила разработали штамм кишечной палочки с более высокой эффективностью бактериальной конъюгации. Он содержит плазмиду TP114 с системой CRISPR/Cas9, нацеленной на ген cat, благодаря которой эффективен при лечении мышей от устойчивых к антибиотикам штаммов E. coli и Citrobacter rodentium. В предыдущем исследовании скрининг большинства использующихся плазмид показал, что TP114 наиболее эффективно передаётся соседним бактериям в микробиоте кишечника.
Для начала исследователи создали три штамма кишечной палочки: KN01, KN02, KN03. Все они устойчивы к стрептомицину, но у каждого есть индивидуальная резистентность к спектиномицину, хлорамфениколу и тетрациклину соответственно. Различия в устойчивости позволяли в процессе экспериментов фенотипировать эти бактерии. KN01 стали транспортёрами плазмиды, KN02 — целевым штаммом, несущим этот ген, а KN03 — нецелевым штаммом (контролем).
Чтобы оценить эффективность конъюгации, все три штамма вводили в кишечник самок мышей (линия C57BL, в каждой группе по шесть особей). Через 36 часов после введения бактерий — доноров плазмиды количество целевого штамма в среднем снижалось на 98,6%, подобные результаты были получены и при введении штамма-донора за 12 часов до целевого. А риботипирование всех микроорганизмов указало, что после обработки штаммом KN01 численность десяти высококонсервативных бактериальных групп не изменилась.
Для создания более эффективных вариантов плазмиды TP114 исследователи использовали ускоренную лабораторную эволюцию, а полученный мутант оказался в два раза эффективнее дикого типа. Эту же плазмиду авторы работы попробовали передать не кишечной палочке, а Citrobacter rodentium. Через два дня количество патогенных бактерий снизилось на 96%.
Таким образом исследователи показали, что конъюгация бактерий — это очень точный способ передачи плазмиды: например, у сконструированной плазмиды скорость конъюгации увеличилась на три порядка по сравнению с диким типом. А высокая эффективность уничтожения целевого штамма в кишечнике мыши (до 96%) указывает, что среда кишечника мало влияет на конъюгацию. Более того, введённые бактерии никак не повлияли на микробиоту кишечника, уничтожая только целевой патоген. Авторы считают, что нацеливание системы на гены резистентности к антибиотикам может быть не лучшим вариантом выбора целевого гена, так как они не всегда находятся в хромосомной ДНК. В будущем учёные предлагают использовать консервативные гены, например, рибосомных белков, для увеличения вероятности гибели целевых клеток.
Источник: nplus1.ru