Bilic Petra1, Kules Josipa2, Baric Rafaj Renata3, Mrljak Vladimir1, 2*
1 Clinic for Internal Diseases, Faculty of Veterinary Medicine, University of Zagreb, Heinzelova 55, Zagreb, Croatia;
2 ERA Chair project FP7, VetMedZg, Clinic for Internal Diseases, Faculty of Veterinary Medicine, University of Zagreb, Heinzelova 55, Zagreb, Croatia;
3 Department of Chemistry and Biochemistry, Faculty of Veterinary Medicine, University of Zagreb, Heinzelova 55, Zagreb, Croatia
*Corresponding author: e-mail: vmrljak@vef.hr
Ключевые слова: бабезиоз, собака, пироплазмоз, передаваемые клещами заболевания.
Клинические и лабораторные признаки бабезиоза собак
Клиническая картина при бабезиозе собак варьируется в широком диапазоне, однако включает в себя признаки, которые будут общими для всех видов бабезий её вызвавших. Такое разнообразие клинической симптоматики связано с несколькими факторами, такими как порода собаки, её иммунный статус, возраст, наличие в анамнезе спленэктомии, а также наличие сопутствующих инфекций или хронических заболеваний [20]. В среднем, инкубационный период при бабезиозе собак составляет от 4 до 21 дня [15].
Главным образом зависящая от вида и подвида бабезии, клиническая картина бабезиоза собак может быть подострой, острой или хронической, и различаться по степени тяжести от субклинической инвазии до полиорганной недостаточности с высоким риском смерти [124]. Подострый характер течения этого заболевания встречается довольно редко и характеризуется тяжёлым повреждением тканей и высокой смертностью. Для острого бабезиоза характерны лихорадка, тахикардия с усилением пульсовой волны, сонливость, гемолитическая анемия разной степени тяжести, бледность слизистых, анорексия, рвота, обезвоживание, спленомегалия, лимфаденомегалия, тромбоцитопения, желтуха, пигментурия, гипотензия и пульс по типу «водяного молота» [21, 125–129]. Хроническая инвазия в большинстве случаев протекает бессимптомно, поскольку у многих инвазированных собак иммунная система активна в отношении сопутствующих заболеваний, за исключением состояний иммуносупрессии [130]. В то же время некоторые собаки могут в течение целого года оставаться бессимптомными носителями паразитов, при этом имея высокие титры антител в крови [131]. Есть исследования, свидетельствующие о том, что собаки, живущие в эндемических районах, могут вырабатывать антитела к B. canis, порой даже в высоких концентрациях, при этом не проявляя никаких симптомов заболевания [132]. Присутствие B. canis в организме собак, не проявляющих симптомов заболевания, является важным фактом, поскольку попадая в неэндемичные регионы такие собаки могут выступать в роли резервуаров для переноса инвазии [23].
Бабезиоз собак клинически можно разделить на осложнённые и неосложнённые формы. Неосложнённой формой считаются последствия анемии, вызванной гемолизом [10]. Осложнённые формы могут быть следствием воспалительных реакций, ведущих к синдрому системного воспалительного ответа (ССВО) и синдрому полиорганной недостаточности, которые являются цитокин-опосредованными состояниями [87]. И, хотя по поводу патогенеза обеих форм бабезиоза выдвигались различные гипотезы, последние исследования показывают, что большая его часть объясняется воспалительной реакцией организма на присутствие возбудителя, а не действиями самого паразита [89].
К клиническим признакам неосложнённого бабезиоза можно отнести бледность слизистых оболочек, жар, анорексию, подавленность, спленомегалию и пульс по типу «водяного молота» [133]. Клинически манифестация осложнённых форм довольно вариабельна и зависит от развивающихся осложнений. При осложнённой форме бабезиоза собак может наблюдаться острая почечная недостаточность, церебральный бабезиоз, коагулопатия, желтуха и острая почечная недостаточность, иммунноопосредованная гемолитическая анемия, подострый бабезиоз, ОРДС, относительная гемоконцентрация, острый панкреатит, рабдомиолиз, сердечная недостаточность и шок [87, 112, 122, 134, 135].
Широкий спектр клинической симптоматики в течении этого заболевания связан с разными видами бабезий, которые его вызывают [136]. Существуют клинические и клинико-патологические симптомы, общие для всех видов бабезий. Чаще всего манифестация заболевания выражается в апатии, слабости, анорексии, лихорадке, анемии, бледности слизистых оболочек, тромбоцитопении, желтухе, пигментурии, увеличении селезёнки, гипоальбуминемии и гипербилирубинемии [34]. Анемия, которая может быть регенеративной и нерегенеративной, и тромбоцитопения могут быть как лёгкой, так и тяжёлой [34], хотя в нашей практике у собак с бабезиозом очень часто выявлялась выраженная тромбоцитопения, за которой следует увеличение среднего объёма тромбоцитов (MPV), что говорит о стимуляции мегакариоцитопоэза и сохранении полезной массы тромбоцитов [137].
Тромбоцитопения очень часто является одним из первых выявляемых проявлений заболевания. Однако анемия, связанная с количеством разрушенных эритроцитов, обычно значительно выше уровня паразитемии, что говорит о том, что разрушаться могут не только заражённые, но и интактные эритроциты [138]. Этот эффект был доказан в нескольких исследованиях, в которых предполагается, что его патогенез является многофакторным, и частично обусловлен иммуноопосредованными процессами [139], оксидативными повреждениями эритроцитов [140, 141] и ССВО [89]. Кроме того, известно, что в патогенезе паразитарной инвазии участвуют высокореактивные свободные радикалы кислорода [142]. В наших исследованиях мы подтвердили наличие окcидативного стресса у собак с бабезиозом, оценивая уровень малондиальдегида сыворотки крови (MDA) — конечного продукта перекисного расщепления липидов — и корреляцию между активностью параоксоназы 1 и концентрацией липопротеинов высокой плотности [143, 144]. В дополнение к этому, наши последние исследования подтвердили изменения уровней биомаркеров антиоксидантного статуса собак, естественным путём инвазированных B. canis [145].
Среди клинических и клиникопаталогических проявлений, характерных для инвазии всеми видами бабезий, есть некоторые изменения, характерные для конкретных видов.
Инвазия B. canis
B. canis в основном вызывает бабезиоз собак от лёгкой до тяжёлой степени в зависимости от развивающихся осложнений. Паразитемия часто бывает низкой, и анемия не обязательно коррелирует со степенью паразитемии. Экспериментальное заражение B. canis привело к кратковременной паразитемии (1–2%). Наиболее выраженными клиническими симптомами являются лихорадка, анорексия или снижение аппетита, вялость, слабость, обезвоживание, желтуха, бледность слизистых оболочек, наличие клещей и пигментурия [82, 148]. Клинико-патологические находки при инвазии B. canis включают в себя: нормоцитарную нормохромную регенеративную/нерегенеративную гемолитическую анемию от лёгкой до умеренной степени, тромбоцитопению, лейкопению и нейтропению, лимфопению, пигментурию, билирубинемию, билирубинурию, гиперфибриногенемию, спленомегалию [39, 82, 137,148–150].
При инвазировании собак американскими «штаммами» B. canis заболевание у них протекает обычно в лёгкой форме, тогда как африканские, австралийские и европейские штаммы являются более патогенными [117, 151]. В Европе более высокая смертность была зарегистрирована в странах, где осложнения аналогичны осложнениям при южноафриканской форме бабезиоза, вызванного B. rossi. Самый высокий уровень смертности отмечен в Венгрии, где СПОН был зарегистрирован в 16% случаев [148], в то время как в Хорватии СПОН развивался в 10% случаев [152]. Наши результаты подтверждают, что болезнь при заражении B. canis характеризуется не только гемолитической анемией (внутрисосудистым и внесосудистым гемолизом), которая является её отличительным признаком, но также рядом осложнений, различными клиническими синдромами и соответствующими клинико-патологическими нарушениями, связанными с инвазией B. canis. В ходе интенсивного гемолиза развивается гемоглобинемия, гемоглобинурия, билирубинемия и билирубинурия, которые приводят к гипоксии тканей с последующим гипотензивным шоком. В исследовании инвазии B. canis в Хорватии было отмечено значительное количество собак с гипотензивным шоком [153, 154]. В то же время возникает острая фазовая реакция, которая приводит к значительному увеличению концентрации основных белков острой фазы, С-реактивного белка и сывороточного амилоида А [89]. Наши данные также подтверждают, что при заражении B. canis происходит активация первичного и вторичного гемостаза. А именно: уровни ТАТ комплексов были значительно повышены, в то время как активность антитромбина III, белка С и фактора Хагемана была значительно снижена, а АЧТВ значительно укорочено [96,155–157]. Кроме того, исследования подтвердили, что провоспалительное состояние при бабезиозе, по-видимому, влияет на эндотелиальную дисфункцию и гемостатическую активность. Это выражается в том, что концентрации С-реактивного белка, растворимой формы молекулы межклеточной адгезии-1 и фибриногена перед началом терапии были значительно повышены и оставались высокими в течение 3 дней после начала терапии у собак с бабезиозом, в то время как активность фактора фон Виллебранда перед началом лечения была значительно снижена [91]. Кроме того, исследования, проведённые с аминоконцевой частью натрийуретического пептида С-типа (NT-pCNP), который экспрессируется главным образом эндотелием сосудов и макрофагами в ответ на несколько стимулов, подтвердили, что NT-pCNP можно считать хорошим прогностическим провоспалительным маркером исхода при бабезиозе собак [158]. Наши последние результаты подтвердили, что гемостатические изменения при неосложнённом бабезиозе представляют прокоагулянтное состояние, что во время лечения поддаётся контролю, хотя уровни биомаркеров эндотелиальной активации и фибринолиза у собак с бабезиозом также были изменены [98, 159]. А именно: концентрация растворимого тромбомодулина, белка группы высокой подвижности box-1, молекулы-1 адгезии сосудистого эндотелия и растворимого урокиназного рецептора активатора плазминогена была увеличена у собак с бабезиозом при поступлении, в то время как уровни плазминогена и ингибитора активатора плазминогена-1 были понижены при поступлении в сравнении с осмотром на 6-й день после лечения [159].
Инвазия B. rossi
Считается, что заражение B. rossi вызывает наиболее тяжёлые формы заболевания среди крупных форм бабезий, заражающими собак [112]. У большого количества собак развиваются различные осложнения, поэтому лечение собак с инвазией B. rossi представляет серьёзные сложности. Опубликованные данные сообщают об уровне смертности выше 45% [87]. У собак с инвазией B. rossi могут наблюдаться клинические проявления, связанные с патологическими процессами, развивающимися при осложнениях, таких как гепатопатия, острая почечная недостаточность, церебральный бабезиоз, острый респираторный дистресс-синдром, относительная гемоконцентрация, панкреатит, рабдомиолиз и сердечная недостаточность [10, 87, 112, 134]. Было показано, что с высокой смертностью от инвазии B. rossi связаны многие факторы, такие как высокий уровень паразитемии и состояние коллапса, гипогликемия, метаболический ацидоз и респираторный алкалоз, высокий уровень лактата в сыворотке крови, высокие концентрации кортизола и АКТГ, низкие концентрации тироксина и свободного тироксина, коагулопатия и диссеминированное внутрисосудистое свёртывание и иммуноопосредованная гемолитическая анемия [134, 160-162]. Патогенез церебрального бабезиоза характеризуется «осаждением» паразитированных эритроцитов в мелких сосудах головного мозга, тогда как почечные изменения связывают с гемоглобинурией, а также с метгемоглобином [10]. В экспериментальных исследованиях была продемонстрирована вероятная токсичность метгемоглобина [21]. В одном исследовании авторы обнаружили белок, названный мембранным антигеном-1 эритроцитов c B. rossi, который предположительно является фактором вирулентности при бабезиозе собак B. rossi [163].
Инвазия B. gibsoni
Инвазия B. gibsoni, относящейся к малым бабезиям, в основном вызывает умеренно выраженную симптоматику, проявляющуюся в виде субклинической инвазии или потери веса и слабости [136]. В США эта инфекция чаще всего встречается у питбультерьеров и обычно протекает в субклинической форме [164]. В последних исследованиях у собак, инвазированных B. gibsoni описывают азотемию и протеинурию [165]. В некоторых ситуациях инфекция B. gibsoni может вызвать тяжёлую анемию, из-за чего часто ставится ошибочный диагноз иммуноопосредованной гемолитичекой анемии. В основном это происходит потому, что у таких собак обычно довольно низкий уровень паразитемии и бабезии не выявляются в мазке крови и в то же время в неэндемичных регионах этого возбудителя редко подозревают [151]. У большинства собак с инвазией B. gibsoni отмечается анорексия, сонливость, диагностированная регенеративная анемия в анамнезе, хотя бывают случаи, когда у собак-носителей наблюдаются хронические инвазии без каких-либо клинических признаков в результате премуниции или иммуносупрессивного лечения [164, 166]. Хроническая инвазия встречается довольно часто и сопровождается низкой температурой, бледностью слизистых, спленомегалией и лимфаденомегалией [21].
Диагностика бабезиоза собак
Для точной диагностики бабезиоза собак рекомендуется прибегать к комплексному подходу и опираться на клиническую картину, микроскопию мазков крови и/или серодиагностику, а также подтверждать диагноз с помощью молекулярных методов.
Микроскопический анализ мазков крови
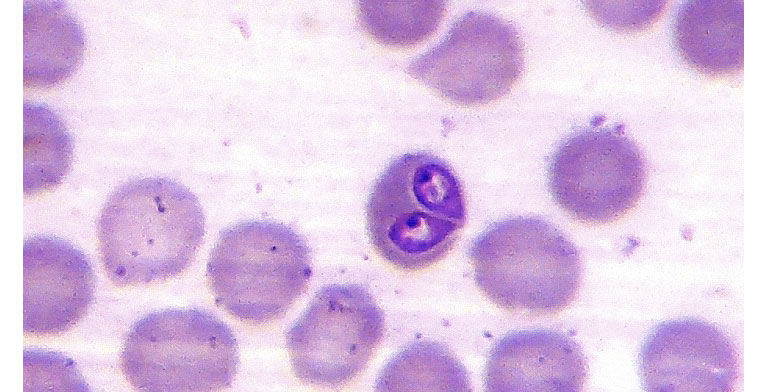
Микроскопия по-прежнему является одним из устоявшихся и недорогих прямых методов идентификации трансмиссивных патогенных микроорганизмов и методом выбора при выявлении паразитов крови, таких как Babesia или Plasmodium [167]. Микроскопическое исследование является наиболее простым и наиболее доступным диагностическим тестом для выявления бабезиоза у собак, требующим хорошо подготовленного и соответствующим образом окрашенного мазка крови и опытного эксперта. Для точного диагноза рекомендуется исследовать свежий мазок крови, а выявление паразитов может быть улучшено путём исследования мазков лейкоцитарного слоя (PRP фракции) или мазков, сделанных из капиллярной крови [15, 160]. На рисунке 1 показаны B. canis в эритроцитах из мазка крови, обнаруженные с помощью световой микроскопии.
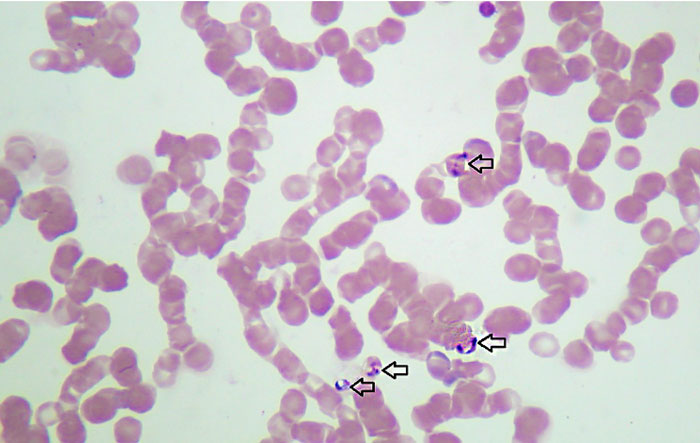 |
| Рисунок 1. Обнаружение Babesia spp. в мазке крови с помощью световой микроскопии. Стрелки указывают на паразита в красных кровяных клетках |
Размер и морфология внутриэритроцитарных паразитов являются основными параметрами в дифференциальной диагностике вида бабезии. Большую и малую форму бабезий можно различить с помощью микроскопического исследования мазка крови, хотя с помощью световой микроскопии, которая имеет относительно низкую чувствительность, мелкие пироплазмы (B. gibsoni, B. microti-like sp.) обнаружить довольно трудно [26]. Микроскопия даёт надёжный результат при уровне паразитемии от умеренной до высокой, но она менее чувствительна для выявления хронического и субклинического бабезиоза у собак-носителей из-за низкой и часто преходящей паразитемии [26].
Из-за этих ограничений, которые в основном сводятся к низкой чувствительности и невозможности идентифицировать вид паразита, микроскопическое исследование мазка крови должно сопровождаться более чувствительными молекулярными методами.
Серологические методы диагностики бабезиоза собак
Серологические тесты используются для диагностики бабезиоза собак на уровне скрининга, как для наблюдения, так и для исследований. Они имеют широкий диагностический временной интервал, поскольку антитела к паразиту могут сохраняться в течение нескольких месяцев или даже лет. Благодаря этому факту, серодиагностика предоставляет важную информацию о предшествующих контактах животного с возбудителем. Иммунофлуоресцентный анализ антител (МФА) является надёжным и широко применяемым серологическим тестом в клинической диагностике бабезиоза собак, в то время иммуноферментный анализ (ИФА) используется главным образом для научных и эпидемиологических исследований [168]. МФА считается высокочувствительным и умеренно специфичным методом для выявления хронической и субклинической инвазии у носителей.
Серология не позволяет дифференцировать между собой виды B. canis, T. annae и B. gibsoni, а исследование мазков крови не позволяет различить T. annae и B. gibsoni [26]. Для улучшения диагностической специфичности широко используются различные рекомбинантные или очищенные антигены. Использование рекомбинантных белков, таких как связанный с тромбоспондином адгезивный белок (TRAP) B. gibsoni, использовалось в качестве альтернативы для полного антигенного анализа паразита с хорошей чувствительностью и специфичностью [169].
Однако низкая специфичность, обусловленная перекрёстными реакциями между Babesia spp. с другими простейшими, неспособность отличить острые инфекции от хронических, а также сложности интерпретации положительных титров становятся ограничениями серодиагностики для врачей, работающих в эндемичных для бабезиоза регионах. При острых и подострых инфекциях могут встречаться ложноотрицательные результаты, так как на выработку антител обычно требуется от 8 до 10 дней. В этих случаях настоятельно рекомендуется использовать титры антител реконвалесцентов для подтверждения острой инвазии [136].
Молекулярная диагностика бабезиоза
Молекулярные методы чрезвычайно полезны для определения вида паразита и обладают более высокой чувствительностью и специфичностью по сравнению с анализом мазка крови для выявления бабезиоза собак. Благодаря использованию этих методов наши знания о распространённости и заболеваемости различными видами бабезий, патогенных для собак, значительно расширились [69].
Полимеразная цепная реакция (ПЦР) является чувствительным и специфическим диагностическим методом, который часто используется для диагностики бабезиоза. Он особенно полезен для выявления инвазии у собак с низким уровнем паразитемии и для дифференциальной диагностики видов паразита. Для обычной ПЦР используются гены рибосомной РНК 18S, 5.8S, 28S и последовательности внутреннего транскрибированного спейсера (ITS) [20]. Описано большое количество анализов и протоколов ПЦР с использованием различных генов-мишеней. К ним относятся полувложенная (semi-nested) ПЦР [61], обратный блоттинг (reverse line blotting) [56, 170, 171] и анализ полиморфизма длин рестрикционных фрагментов (ПДРФ) [172]. Кроме того, ряд этих методов ПЦР был применён в комбинации с технологиями переноса на фильтровальной бумаге, к примеру, на картах FTA (Whatman Bioscience) и IsoCode Stix (Schleicher and Scheull) для облегчения транспортировки образцов в удалённые лаборатории и для эпидемиологических и других диагностических исследований [172].
ПЦР-анализы, основанные на обнаружении малой субъединицы рДНК и анализе последовательности ампликонов, оказались эффективными для более точной идентификации видов. Поскольку между многими видами бабезий существует высокая степень идентичности последовательности 18S рДНК, следует всегда проводить полный анализ гена 18S рРНК (около 1700 н. п.), особенно в недавно выделенных организмах. Дальнейшее улучшение дизайна праймеров позволило чётко разделить ампликоны целевых фрагментов 342 н. п., 546 н. п. для B. rossi, B. vogeli, B. canis соответственно [173]. Метод ПЦР–ПДРФ позволил дифференцировать различные виды бабезий, как было описано ранее [18], а полувложенная ПЦР способна обнаруживать и отличать ДНК паразитов B. canis, B. rossi, B. vogeli и B. gibsoni [61]. Для различения видов B. gibsoni, B. canis, B. vogeli и B. rossi на основе анализа кривых плавления была разработана количественная флуоресцентная резонансная ПЦР высокого разрешения [174]. Обнаружено также, что петлевая изотермическая амплификация (LAMP) имеет преимущества в скорости и специфичности для выявления инвазий B. gibsoni у собак [175].
При хроническом бабезиозе ПЦР может давать ложноотрицательный результат, и очень важно учитывать это ограничение при скрининге потенциальных носителей и других собак без признаков инвазии, таких как доноры крови. Это может означать, что в долгосрочной перспективе инфекция может быть выявлена (ретроспективно) только серологически.
Анализы методами масс-спектрометрии
В последнее время появилось больше исследований, посвящённых использованию методов масс-спектрометрии для диагностики бабезиоза у собак. ПЦР-масс-спектрометрия с электрораспылительной ионизацией (PCR-ESI/MS) предлагает новый подход, использующий традиционную ПЦР с последующей масс-спектрометрией с электрораспылительной ионизацией (ESI-MS) для идентификации широкого спектра микробной инфекций по клиническим образцам [176]. Имеется векторная панель с небольшой библиотекой паразитов, включающей Babesia microti, Babesia divergens, нечеловеческие патогены Babesia bovis, Babesia gibsoni и Babesia canis, а также нитевидную нематоду Dirofilaria immitis, но пока ещё только для исследовательских целей.
Техника матрично-активированной лазерной десорбции/ионизации (MALDI-TOF) выявила наличие белковой фракции 51-52 kDa в сыворотке крови всех животных, заражённых B. canis, которая не была обнаружена в сыворотке крови здоровых собак [177]. Эти результаты согласуются с результатами ПЦР, демонстрируют хорошую чувствительность и специфичность, стоимость теста ниже, а скорость анализа выше, чем в случае стандартного молекулярного тестирования.
Другие исследования, использующие двухмерный электрофорез и жидкостную хроматографию в сочетании с тандемной масс-спектрометрией (ЖХ-МС/МС), показали возможность использования протеомного подхода не только в диагностике, но и для мониторинга и прогнозирования исхода при бабезиозе собак [84, 107].
Лечение бабезиоза собак
Основу противобабезиозной терапии составляют антипротозойные препараты, противомикробные препараты и поддерживающая терапия. Однако лечение бабезиоза собак не может быть шаблонным, схемы лечения варьируются по препаратам, дозам и продолжительности лечения, и требуют мониторинга реакции пациента на проводимую терапию. Важно отметить, что некоторые лекарства обладают большей эффективностью против больших или малых бабезий, за исключением, возможно, диминазена [20]. По этой причине во время лечения важно определить вид бабезии или, по крайней мере, определить, является ли она большой или малой формой.
Дипропионат имидокарба, карбанилид семейства диаминидинов, является препаратом выбора в лечении бабезиоза собак, вызванного большими видами бабезий. Он продемонстрировал высокую эффективность против B. canis. Однократная доза 6,6 мг/кг внутримышечно (В/М) или подкожно (П/К) является рекомендуемой схемой лечения. Существуют разные дозы и режимы лечения. Некоторые авторы предлагают однократную дозу 7,5 мг/кг В/М, другие — 5–6,6 мг/кг или 7 мг/кг В/М на 1-й и 14-й день, что устраняет клинические признаки и снижает патогенность клещей-переносчиков, которые кусают получившую препарат собаку в течение 4 недель после терапии [134, 178–180]. Во Франции специфическое лечение бабезиоза собак основано на однократном лечении дипропионатом имидокарба в дозе 2 мг/кг В/М или П/К [39]. По нашему опыту, лечение неосложнённых случаев инфекции B. canis в дозе 6,6 мг/кг приводит к значительному улучшению и разрешению клинических симптомов в течение первых 24–48 часов, с профилактическим защитным эффектом после терапии до 4 недель, а в некоторых исследованиях — до 6 недель [181]. Несмотря на защитный эффект, полного устранения возбудителя не всегда удаётся достичь, и часто наблюдаются рецидивы [117].
Приём дипропионата имидокарба вызывает, хотя и редко, побочные эффекты в виде боли на стороне инъекции и холинергические признаки (слюноотделение, слезотечение, рвота, диарея, тремор мышц, тахикардия и одышка) [182]. Побочные эффекты, как правило, исчезают довольно быстро, хотя некоторые эффекты могут быть ослаблены предварительным введением атропина или гликопирролата [180, 183]. Токсическое действие имидокарба может возникать спонтанно при его приёме в дозе 10 мг/кг [39]. В литературе описан случай передозировки, когда из-за нефротоксического эффекта от препарата развился массивный некроз печени [184]. Малые формы бабезий, такие как B. gibsoni и Babesia microti-like sp., являются более сложными в лечении, и имидокарб не является предпочтительным препаратом в случае инвазии малыми формами бабезий [34].
Диминазена диацетурат — производное ароматического диаминидина — традиционно использовался в качестве наиболее эффективного средства для лечения крупных видов бабезий, но в настоящее время он не одобрен для использования во многих странах. В дополнение к имидокарбу, большие формы бабезий (B. canis, B. rossi, B. vogeli) наиболее успешно лечат диминазеном в разовой дозе 3,5 мг/кг П/К, В/М или 3–5 мг/кг В/М в разовой дозе [134,178,185]. Диминазен используется для лечения B. gibsoni, хотя некоторые клинические отчёты вызывают сомнения в его эффективности [186]. Тем не менее, важно отметить, что диминазен является относительно токсичным, и после его использования регистрируются серьёзные побочные эффекты [187]. В виду особенностей методов очистки этого препарата, он характеризуется очень узким терапевтическим диапазоном и высокой токсичностью [178, 179]. К побочным эффектам относят токсичность для центральной нервной системы, которая, вероятно, находится в прямой зависимости от дозы или является следствием повторного приёма, поскольку этот препарат имеет довольно большой период полувыведения [188]. В настоящее время его использование ограничено клиническими случаями, которые не поддаются лечению [185, 188].
Изетионат фенамидина также является эффективным препаратом для лечения бабезиоза у собак, и особенно высокую восприимчивость к терапии фенамидином проявляют крупные виды бабезий (особенно B. canis). Препарат можно применять в дозе 15–20 мг/кг, вводимой П/К один раз в день в течение 2 дней подряд [117].
Изетионат пентамидина — другой антипротозойный препарат — одобрен для использования в Соединённых Штатах и имеет документально подтверждённую эффективность против B. canis и B. gibsoni. Рекомендуемая доза составляет 15–20 мг/кг, П/К каждые 12 часов в течение 2 дней подряд. Он имеет побочные эффекты, включающие боль в месте инъекции, гипотонию, тахикардию и рвоту [117, 179].
Хотя для малых форм бабезий существует несколько протоколов лечения, оно всё же не столь эффективно, и рецидивы возникают довольно часто. Например, инвазия B. gibsoni часто оказывается устойчива к лечению дипропионатом имидокарба и адиминазеном [136]. Антибиотики не подходят для лечения бабезиоза у собак и других носителей, но были попытки элиминации инвазии B. gibsoni с помощью комбинации трёх антибиотиков. Существует несколько комбинаций антибиотиков, таких как: доксициклин в дозе 10 мг/кг/день, вводимый per os (П/О) или внутривенно (В/В); клиндамицин (25 мг/кг перорально два раза в день); метронидазол (15 мг/кг (П/О), два раза в день) или доксициклин (7–10 мг П/О, два раза в день), энрофлоксацин (2–2,5 мг/кг П/О, два раза в день), метронидазол (5–15 мг/кг П/О два раза в день в сочетании с пероральными антибиотиками в течение 6 или 12 недель) [186, 189]. Однако одни только антибиотики не устранят инвазию. Некоторые авторы предлагают использовать альтернативную терапию с комбинацией противомалярийного препарата атоваквон (atovaquone) (13,3 мг/кг, три раза в день, П/О в течение 10 дней) и макролидного препарата азитромицин (10 мг/кг, один раз в день, П/О, на 10 дней) [190]. Другие лекарственные средства (например, сульфат квинурония (quinuronium sulfate), раствор трипанового синего, парваквон (parvaquone)) используются редко или находятся в экспериментальной фазе (артесунат (artesunate) и эпоксомицин (epoxomicin) [191, 192].
Поддерживающее лечение заключается в восстановлении адекватной оксигенации тканей путём коррекции анемии и коррекции дегидратационных и электролитных нарушений [182]. Поддерживающее лечение предоставляется только в условиях стационара госпитализированным собакам. Это особенно важно для пациентов со сложной формой бабезиоза, которые нуждаются в агрессивной терапии, такой как: инфузионная терапия для поддержания объёма крови и адекватной перфузии в органах, коррекция кислотно-щелочных и электролитных нарушений, переливание крови, иммунодепрессанты у собак с иммуноопосредованной гемолитической анемией или тромбоцитопенией и гепарин при ДВС-синдроме [182, 193]. Многие другие поддерживающие методы лечения могут быть полезны в зависимости от клинических проявлений и/или лабораторных отклонений.
Профилактика бабезиоза собак
Есть несколько стратегий, которые могут быть использованы для профилактики бабезиоза собак. Этими подходами являются: использование акарицидных препаратов против специфичных клещей-переносчиков, химиопрофилактика против паразитов, вакцинация собак и поведенческая профилактика, заключающаяся в ограничении нахождения собаки в зонах активности клещей. Повышенная осторожность требуется в летний период, когда средняя температура воздуха поднимается выше 12°C, что приводит к повышению активности клещей [194]. Важно удалять прикрепившихся клещей как можно скорее, чтобы предотвратить заражение до созревания и передачи инвазионных спорозоитов через слюну. Кроме того, так как паразиты могут передаваться при переливании крови, все собаки-доноры крови должны быть проверены на Babesia spp. с использованием серологических и молекулярных анализов [34].
Важным и широко применяемым подходом к борьбе с клещами является использование акарицидных препаратов. Акарицидные препараты имеют разные механизмы действия: они могут оказывать раздражающее/отпугивающее действие на клещей при контакте, препятствовать прикреплению и кормлению или быстро убивать прикрепившихся клещей, что важно для предотвращения выброса паразитов в кровоток хозяина. В Европе в настоящее время существуют лицензированные препараты, содержащие изоксазолины, которые перорально дают собакам и которые воздействуют на клеща, как только он прикрепляется и начинает кормиться, вызывая быструю смерть, или подавляют питание [194]. Например, Beugnet et al. показали, что после перорального приёма афоксоланера у собак не возникало заражения B. canis при экспериментальном контакте с клещами-переносчиками D. reticulatus, и этот защитный эффект сохранялся на протяжении четырёх недель. Также используются другие акарицидные средства, такие как ошейники, растворы для точечной аппликации и спреи. Ошейники содержат флуметрин/имидаклоприд или дельтаметрин с длительностью действия 5–8 месяцев, в то время как точечно наносимые препараты содержат перметрин или фипронил и имеют эффективность до четырёх недель [194]. Доказано, что акарициды полезны для профилактики бабезиоза у собак, причём в исследованиях сообщается об эффективности на уровне от 88 до 100% в течение 1–3 месяцев, хотя эффективность в основном проверялась в отношении B. canis, переносимых D. reticulatus [34]. Тем не менее возникает проблема устойчивости к акарицидам, поэтому новые методологии исследований помогают разрабатывать новые стратегии борьбы с клещами [196].
Химиопрофилактический подход с использованием таких препаратов, как дипропионат имидокарба или доксициклин, для предотвращения инвазии B. canis применяется редко, поскольку могут возникнуть побочные эффекты, такие как анафилактический шок и повреждение почек/печени. Применение этих препаратов для профилактики ограничено собаками с компрометированным иммунитетом — например, перенёсших спленэктомию — которые подвергаются воздействию клещей в эндемичных областях [34].
Чтобы защитить собак от бабезиоза (от инвазии B. canis), существует также возможность вакцинации коммерчески доступной в Европе вакциной Pirodog® (Merial, Франция), которая содержит растворимые антигены паразита (SPA), полученные из супернатантов культуры B. canis in vitro [197]. Иммунитет против B. canis у собак в значительной степени основан на гуморальных иммунных реакциях, включающих выработку специфических антител и активацию системы комплемента. Доступная вакцина на основе SPA стимулирует повышение титров антител, что не защищает от инвазии B. canis при заражении, но снижает тяжесть клинической симптоматики, что проявляется в сокращении периода анемии, паразитемии и гипертермии [197]. Было показано, что индуцированная защита развивается только против гомологичной (того же штамма) инвазии B. canis, а не против гетерологичных штаммов, что приводит к вариабельности степени эффективности вакцины [198]. Поэтому была разработана двухвалентная вакцина более широкого спектра, содержащая комбинацию супернатантов SPA из культур in vitro европейского изолята B. canis и южноафриканского изолята B. rossi, которые могут обеспечить защиту как от гетерологичной инвазии B. canis, так и от B. rossi [199, 200]. Было показано, что реактивность защитного иммунитета, индуцируемого двухвалентной вакциной, отличается при заражении B. canis или B. rossi, что связано с разной динамикой паразитемии [200]. Эта двухвалентная вакцина, названная Nobivac Piro®, была одобрена для использования на европейском рынке в течение нескольких лет, но в настоящее время недоступна. Недавно был открыт новый защитный антиген, из которого можно создать вакцину, и произведён в виде рекомбинантного белка, называемого антигеном бабезии собак (CBA). Вакцина CBA обеспечивала защиту у вакцинированных собак при заражении путём ограничения размножения паразитов и уменьшения клинических симптомов, и в будущем она может заменить вакцины на основе SPA [201]. Также предпринимаются попытки создать вакцины против B. gibsoni путём поиска подходящих антигенов, в основном на основе рекомбинантных белков паразитов, таких как поверхностный белок 50-kDa, но коммерческая вакцина пока недоступна [202].
Заключение
Бабезиоз у собак долгое время признавался одним из наиболее распространённых в мире трансмиссивных заболеваний, и, как представлено в настоящей статье, мы располагаем большим объёмом данных по этому заболеванию. Тем не менее остаются тёмные пятна, которые ещё предстоит исследовать, особенно в отношении патогенеза этого заболевания, что в будущем позволит разрабатывать новые, улучшенные стратегии профилактики и лечения. Это имеет особое значение, поскольку в ближайшем будущем стоит ожидать более высокую заболеваемость бабезиозом из-за изменения климата, связанного с глобальным потеплением.
Литература (ч. 2)
- Maegraith B, Gilles HM, Devakul K: Pathological processes in Babesia canis infections. Z Tropenmed Parasitol 1957: 8(4):485–514.
- Welzl C, Leisewitz AL, Jacobson LS, Vaughan-Scott T, Myburgh E: Systemic inflammatory response syndrome and multiple-organ damage/dysfunction in complicated canine babesiosis. J S Afr Vet Assoc 2001, 72:158–162.
- Goddard A, Leisewitz AL, Kjelgaard-Hansen M, Kristensen AT, Schoeman JP: Excessive pro-inflammatory serum cytokine concentrations in virulent canine babesiosis. PloS ONE 2016, 11(3): e0150113.
- Matijatko V, Mrljak V, Kis I, Kucer N, Forsek J, Zivicnjak T, Romic Z, Simec Z, Ceron JJ: Evidence of an acute phase response in dogs naturally infected with Babesia canis. Vet Parasitol 2007, 144:242–250.
- Mine S, Fujisaki T, Suematsu M, Tanaka Y: Activated platelets and endothelial cell interaction with neutrophils under flow conditions. Intern Med 2001, 40:1085–1092.
- Baric Rafaj R, Kules J, Selanec J, Vrkic N, Zovko V, Zupancic M, Trampus Bakija A, Matijatko V, Crnogaj M, Mrljak V: Markers of coagulation activation, endothelial stimulation, and inflammation in dogs with babesiosis. J Vet Intern Med 2013, 27:1172–1178.
- Kirtz G, Leschnik M, Hooijberg E, Tichy A, Leidinger E: In-clinic laboratory diagnosis of canine babesiosis (Babesia canis canis) for veterinary practitioners in Central Europe. Tierarztl Prax Ausg K Klientiere Heimtiere 2012, 40:87–94.
- Caudrillier A, Kessenbrock K, Gilliss BM, Nguyen JX, Marques MB, Monestier M, Toy P, Werb Z, Looney MR: Platelets induce neutrophil extracellular traps in transfusion-related acute lung injury. J Clin Invest 2012, 122:2661–2671.
- Kapur R, Zufferey A, Boilard E, Semple JW: Nouvelle cuisine: platelets served with inflammation. J Immunol 2015, 194:5579–5587.
- Goodger BV, Redebramanis K, Wright IG: Procoagulant activity of Babesia bovis-infected erythrocytes. J Parasitol 1987, 73:1052–1060.
- Baric Rafaj R, Matijatko V, Kis I, Kucer N, Zivicnjak T, Lemo N, Zvorc Z, Brkljacic M, Mrljak V: Alterations in some blood coagulation parameters in naturally occurring cases of canine babesiosis. Acta Vet Hung 2009, 57:295–304.
- Liebenberg C, Goddard A, Wiinberg B, Kjelgaard-Hansen M, van der Merwe LL, Thompson PN, Matjila PT, Schoeman JP: Hemostatic abnormalities in uncomplicated babesiosis (Babesia rossi) in dogs. J Vet Intern Med 2013, 27:150–156.
- Kules J, Gotic J, Mrljak V, Baric Rafaj R: Blood markers of fibrinolysis and endothelial activation in canine babesiosis. BMC Vet Res 2017, 13:82.
- Schetters TP, Kleuskens JA, Van De Crommert J, De Leeuw PW, Finizio AL, Gorenflot A: Systemic inflammatory responses in dogs experimentally infected with Babesia canis; a haematological study. Vet Parasitol 2009, 162:7–15.
- Dennis EA, Norris PC: Eicosanoid Storm in Infection and Inflammation. Nat Rev Immunol 2015, 15:511–523.
- Mrljak V, Kucer N, Kules J, Tvarijonaviciute A, Brkljacic M, Crnogaj M, Zivicnjak T, Smit I, Ceron JJ, Baric Rafaj R: Serum concentrations of eicosanoids and lipids in dogs naturally infected with Babesia canis. Vet Parasitol 2014, 201:24–30.
- Borghetti P, Saleri R, Mocchegiani E, Corradi A, Martelli P: Infection, immunity and the neuroendocrine response. Vet Immunol Immunopathol 2009, 130:141–162.
- Lewis DH, Chan DL, Pinheiro D, Armitage-Chan E, Garden OA: The immunopathology of sepsis: pathogen recognition, systemic inflammation, the compensatory antiinflammatory response, and regulatory T cells. J Vet Intern Med 2012, 26:457–82.
- Clark IA, Alleva LM, Budd AC, Cowden WB: Understanding the role of inflammatory cytokines in malaria and related diseases. Travel Med Infect Dis 2008, 6:67–81.
- Galan A, Mayer I, Rafaj RB, Bendelja K, Susic V, Ceron JJ, Mrljak V: MCP-1, KC-like and IL-8 as critical mediators of pathogenesis caused by Babesia canis. PloS One 2018, 13(1):e0190474.
- Zygner W Gojska-Zygner O, Bąska P, Dlugosz E: Increased concentration of serum TNF alpha and its correlations with arterial blood pressure and indices of renal damage in dogs infected with Babesia canis. Parasitol Res 2014, 113:1499–1503.
- Kules J, de Torre-Minguela C, Baric Rafaj R, Gotic J, Nizic P, Ceron JJ, Mrljak V: Plasma biomarkers of SIRS and MODS associated with canine babesiosis. Res Vet Sci 2016, 105:222–228.
- Brown AL, Shiel RE, Irwin PJ: Clinical, haematological, cytokine and acute phase protein changes during experimental Babesia gibsoni infection of beagle puppies. Exp Parasitol 2015, 157:185–96.
- Goris RJ, Bockhorst TP, Nuytinek JK, Gimbrere JS: Multiple-organ failure. Generalized autodestructive inflammation? Arch Surg 1985, 120:1109–1115.
- Purvis D, Kirby R: Systemic inflammatory response syndrome: septic shock. Vet Clin North Am Small Anim Pract 1994, 24:1225–1247.
- Szade A, Grochot-Przeczek A, Florczyk U, Jozkowicz A, Dulak J: Cellular and molecular mechanisms of inflammation induced angiogenesis. IUBMB Life 2015, 67:145–159.
- Jacobson LS: The South African form of severe and complicated canine babesiosis: clinical advances 1994-2004. Vet Parasitol 2006, 138:126–139.
- Zygner W, Wedrychowicz H: Influence of anaemia on azotaemia in dogs infected with Babesia canis in Poland. Bull Vet Inst Pulawy 2009, 53:663–668.
- Lobetti RG, Jacobson LS: Renal involvement in dogs with babesiosis. J S Afr Vet Assoc 2001, 72: 23–28.
- Lobetti RG, Reyers F, Nesbit JW: The comparative role of haemoglobinuria and hypoxia in the development of canine babesial nephropathy. J S Afr Vet Assoc 1996, 67:188–198.
- Mathe A, Dobos-Kovacs M, Voros K: Histological and ultrastructural studies of renal lesions in Babesia canis infected dogs treated with imidocarb. Acta Vet Hung 2007, 55:511523.
- Taboada J, Lobetti R: Babesiosis. In: Greene C ed. Infectious Diseases of the Dog and Cat. 3rd edn. St. Louis: WB Saunders Co; 2006, 722–735.
- Schetters TP, Eling WM: Can Babesia infections be used as a model for cerebral malaria? Parasitol Today 1999, 15:492–497.
- Jacobson LS, Lobetti RG: Rhabdomyolysis as a complication of canine babesiosis. J Small Anim Pract 1996, 37:286–291.
- Lobetti R, Kirberger R, Keller N, Kettner F, Dvir E: NT-ProBNP and cardiac troponin I in virulent canine babesiosis. Vet Parasitol 2012, 190:333–339.
- Lobetti R, Dvir E, Pearson J: Cardiac troponins in canine babesiosis. J Vet Intern Med 2002, 16:63–68.
- Mohr AJ, Lobetti RG, van der Lugt JJ: Acute pancreatitis: a newly recognised potential complication of canine babesiosis. J S Afr Vet Assoc 2000, 71:232–239.
- Schoeman JP, Rees P, Herrtage ME: Endocrine predictors of mortality in canine babesiosis caused by Babesia canis rossi. Vet Parasitol 2007, 148:75–82.
- Kraje AC: Canine haemobartonellosis and babesiosis. Compend Contin Educ 2001, 23:310–318.
- Rene-Martellet M, Chene J, Chabanne L, Chalvet-Monfray K, Bourdoiseau G: Clinical signs, seasonal occurrence and causative agents of canine babesiosis in France: results of a multiregional study. Vet Parasitol 2013, 197:50–58.
- Adaszek L, Winiarczyk S, Skrzypczak M: The clinical course of babesiosis in 76 dogs infected with protozoan parasites Babesia canis canis. Pol J Vet Sci 2009, 12:81–87.
- Freeman MJ, Kirby BM, Panciera DL, Henik RA, Rosin E, Sullivan LJ: Hypotensive shock syndrome associated with acute Babesia canis infection in a dog. J Am Vet Med Assoc 1994, 204:94–96.
- Abdullahi SU, Mohammed AA, Trimnell AR, Sannusi A, Alafiatayo R: Clinical and haematological findings in 70 naturally occurring cases of canine babesiosis. J Small Anim Pract 1990, 31:145–147.
- Irwin PJ, Hutchinson GW: Clinical and pathological findings of Babesia infection in dogs. Aust Vet J 1991, 68:204–209.
- Irwin PJ: Canine babesiosis. Vet Clin Smal Anim 2010, 40:1141–1156.
- Brandao LP, Hagiwara MK, Myiashiro SI: Humoral immunity and reinfection resistance in dogs experimentally inoculated with Babesia canis and either treated or untreted with imidocarb dipropionate. Vet Parasitol 2003, 114:253–265.
- Martinod S, Laurent N, Moreau Y: Resistance and immunity of dogs against Babesia canis in an endemic area. Vet Parasitol 1986, 19:245–254.
- Taboada J, Merchant SR: Babesiosis of companion animals and man. Vet Clin North Am Small Anim Pract 1991, 21:103–123.
- Schoeman JP: Canine babesiosis. Onderstepoort J Vet Res 2009, 76:59–66.
- Malherbe WD: Clinico-pathological studies of Babesia canis infection in dogs. V The influence of the infection on kidney function. J S Afr Vet Assoc 1966, 37:261–264.
- Solano-Gallego L, Baneth G: Babesiosis in dogs and cats-Expanding parasitological and clinical spectra. Vet Parasitol 2011, 181:48–60.
- Baric Rafaj R, Mrljak V, Guelfi JF, Marinculic A, Potocnjak D, Zvorc Z, Kucer N: Nombre de plaquettes et volume moyen plaquettaire dans la babesiose du chien. Revue Med Vet 2005, 156:95–98.
- Murase T, Maede Y: Increased erythrophagocytic activity of macrophages in dogs with Babesia gibsoni infection. Jpn J Vet Science 1990, 52:321–327.
- Morita T, Saeki H, Imai S, Ishii T: Erythrocyte oxidation in artificial Babesia gibsoni infection. Vet Parasitol 1996, 63:1–7.
- Chaudhuri S, Varshney JP, Patra RC: Erythrocytic antioxidant defense, lipid peroxides level and blood iron, zinc and copper concentrations in dogs naturally infected with Babesia gibsoni. Res Vet Sci 2008, 85:120–124.
- Murase T, Ueda T, Yamato O, Tajima M, Maede Y: Oxidative damage and enhanced erythrophagocytosis in canine erythrocytes infected with Babesia gibsoni. J Vet Med Sci 1996, 58:259–261.
- Biswas T, Ghosh DK, Mukherjee N, Ghosal J: Lipid peroxidation of erythrocytes in visceral leishmaniosis. J Parasitol 1997, 83:151–152.
- Crnogaj M, Petlevski R, Mrljak V, Kis I, Torti M, Kucer N, Matijatko V, Sacer I, Stokovic I: Malondialdehyde levels in serum of dogs infected with Babesia canis. Vet Med (Praha) 2010, 55:16–171.
- Rossi G, Kules J, Rafaj RB, Mrljak V, Lauzi S, Giordano A, Paltrinieri S: Relationship between paraoxonase 1 activity and high density lipoprotein concentration during naturally occurring babesiosis in dogs. Res Vet Sci 2014, 97:318–324.
- Crnogaj M, Ceron JJ, Smit I, Kis I, Gotic J, Brkljacic M, Matijatko V, Rubio CP, Kucer N, Mrljak V: Relation of antioxidant status at admission and disease severity and outcome in dogs naturally infected with Babesia canis canis. BMC Vet Res 2017, 13:114.
- Penzhorn BL: Why is Southern African canine babesiosis so virulent? An evolutionary perspective. Parasit Vectors 2011, 4:51.
- Carli E, Tasca S, Trotta M, Furlanello T, Caldin M, Solano-Gallego L: Detection of erythrocyte binding IgM and IgG by flow cytometry in sick dogs with Babesia canis canis or Babesia canis vogeli infection. Vet Parasitol 2009, 162:51–57.
- Mathe A, Voros K, Papp L, Reiczigel J: Clinical manifestations of canine babesiosis in Hungary (63 cases). Acta Vet Hung 2006, 54:367–385.
- Mathe A, Voros K, Nemeth T, Biksi I, Hetyey C, Manczur F, Tekes L: Clinicopathological changes and effect of imidocarb therapy in dogs experimentally infected with Babesia canis. Acta Vet Hung 2006, 54:19–33.
- Zvorc Z, Baric Rafaj R, Kules J, Mrljak V: Erythrocyte and platelet indices in babesiosis of dogs. Vet arhiv 2010, 80:259–267.
- Conrad P, Thomford J, Yamane I, Whiting J, Bosma L, Uno T, Holshuh HJ, Shelly S: Hemolytic anaemia caused by Babesia gibsoni infection in dogs. J Am Vet Med Assoc 1991, 199:601–605.
- Matijatko V, Kis I, Torti M, Brkljacic M, Baric Rafaj R, Zvorc Z, Mrljak V: Systemic inflammatory response syndrome and multiple organ dysfunction syndrome in canine babesiosis. Vet arhiv 2010, 80:611–626.
- Matijatko V, Kis I, Torti M, Brkljacic M, Kucer N, Rafaj RB, Grden D, Zivicnjak T, Mrljak V: Septic shock in canine babesiosis. Vet Parasitol 2009, 162:263–270.
- Torti M, Cerlek M, Matijatko V, Brkljacic M, Kis I, Mayer I, Potocnjak D, Mrljak V: Arterial blood pressure values in dogs naturally infected with Babesia canis. Vet arhiv 2014, 84:563574.
- Baric Rafaj R, Marinculic A, Raic B, Mrljak V, Zvorc Z, Ramadan P: Activation du facteur Hageman chez les chiens atteints de babesiose. Revue Med Vet 2001, 152:545–547.
- Mrljak V, Baric Rafaj R, Susic V, Matijatko V, Kucer N, Kis I: Antithrombin III in Healthy Dogs and in Dogs Suffering from Babesiosis. Vet arhiv 2005, 75:477–486.
- Baric Rafaj R, Mrljak V, Kucer N, Brkljacic M, Matijatko V: Aktivnost proteina C u babeziozi pasa. Vet arhiv 2007, 77:1–8.
- Brkljacic M, Torti M, Pleadin J, Mrljak V, Smit I, Kis I, Mayer I, Crnogaj M, Matijatko V: The concentrations of the inflammatory markers the amino-terminal portion of C-type pronatriuretic peptide and procalcitonin in canine babesiosis caused by Babesia canis. Vet arhiv 2014, 84:575–589.
- Kules J, Gotic J, Mrljak V, Baric Rafaj R: Alteration of haemostatic parameters in uncomplicated canine babesiosis. Comp Immunol Microbiol Infect Dis 2017, 53:1–6.
- Bohm M, Leisewitz AL, Thompson PN, Schoeman JP: Capillary and venous Babesia canis rossi parasitaemias and their association with outcome of infection and circulatory compromise. Vet Parasitol 2006, 141:18–29.
- Keller N, Jacobson LS, Nel M, de Clerq M, Thompson PN, Schoeman JP: Prevalence and risk factors of hypoglycemia in virulent canine babesiosis. J Vet Intern Med 2004, 18:265–270.
- Nel M, Lobetti RG, Keller N, Thompson PN: Prognostic value of blood lactate, blood glucose, and hematocrit in canine babesiosis. J Vet Intern Med 2004, 18:471–476.
- Matjila PT, Carcy B, Leisewitz AL, Schetters T, Jongejan F, Gorenflot A, Penzhorn BL: Preliminary evaluation of the BrEMA1 gene as a tool for associating genotypes and clinical manifestation of canine Babesiosis. J Clin Microbiol 2009, 47:35863592.
- Birkenheuer AJ, Correa MT, Levy MG, Breitschwerdt EB: Geographic distribution of babesiosis among dogs in the United States and association with dog bites: 150 cases (2000–2003). J Am Vet Med Assoc 2005, 227:942–947.
- Ullal T, Birkenheuer A, Vaden S: Azotemia and Proteinuria in Dogs Infected with Babesia gibsoni. J Am Anim Hosp Assoc 2018, 54:156–160.
- Birkenheuer AJ, Levy MG, Stebbins M, Poore M, Breitschwerdt E: Serosurvey of antiBabesia antibodies in stray dogs and American pit bull terriers and American staffordshire terriers from North Carolina. J Am Anim Hosp Assoc 2003, 39:551–557.
- Kules J, Potocnakova L, Bhide K, Tomassone L, Fuehrer HP, Horvatic A, Galan A, Guillemin N, Nizic P, Mrljak V, Bhide M: The Challenges and Advances in Diagnosis of Vector-Borne Diseases: Where Do We Stand? Vector Borne Zoonotic Dis 2017, 17:285296.
- Schetters TP, Scholtes NC, Kleuskens JA, Bos HJ: Not peripheral parasitaemia but the level of soluble parasite antigen in plasma correlates with vaccine efficacy against Babesia canis. Parasite Immunol 1996, 18:1–6.
- Goo YK, Jia H, Aboge GO, Terkawi MA, Kuriki K, Nakamura C, Kumagai A, Zhou J, Lee EG, Nishikawa Y, Igarashi I, Fujisaki K, Xuan X: Babesia gibsoni: Serodiagnosis of infection in dogs by an enzyme-linked immunosorbent assay with recombinant BgTRAP. Exp Parasitol 2008, 118: 555–560.
- Matjila PT, Leisewitz AL, Oosthuizen MC, Jongejan F, Penzhorn BL: Detection of a Theileria species in dogs in South Africa. Vet Parasitol 2008, 157:34–40.
- Yisaschar-Mekuzas Y, Jaffe CL, Pastor J, Cardoso L, Baneth G: Identification of Babesia species infecting dogs using reverse line blot hybridization for six canine piroplasms, and evaluation of co-infection by other vector-borne pathogens. Vet Parasitol 2013, 191:367373.
- Jefferies R, Ryan UM, Irwin PJ: PCR—RFLP for the detection and differentiation of the canine piroplasm species and its use with filter paper-based technologies. Vet Parasitol 2007, 144:20–27.
- Duarte SC, Linhares GFC, Romanowsky TN, Neto OJ, Borges LMF: Assessment of primers designed for the subspecies-specific discrimination among Babesia canis canis, Babesia canis vogeli and by PCR assay. Vet Parasitol 2008, 152:16–20.
- Wang C, Ahluwalia SK, Li Y, Gao D, Poudel A, Chowdhury E, Boudreaux MK, Kaltenboeck B: Frequency and therapy monitoring of canine Babesia spp. infection by high resolution melting curve quantitative FRET-PCR. Vet Parasitol 2010, 168:11–18.
- Ikadai H, Tanaka H, Shibahara N, Matsuu A, Uechi M, Itoh N, Oshiro S, Kudo N, Igarashi I, Oyamada T: Molecular Evidence of Infections with Babesia gibsoni Parasites in Japan and Evaluation of the Diagnostic Potential of a Loop-Mediated Isothermal Amplification Method. J Clin Microbiol 2004, 42:2465–2469.
- Wolk DM, Kaleta EJ, Wysocki VH: PCR-electrospray ionization mass spectrometry: the potential to change infectious disease diagnostics in clinical and public health laboratories. J Mol Diagn 2012, 14:295–304.
- Adaszek L, Banach T, Bartnicki M, Winiarczyk D, Lyp P, Winiarczyk S: Application the mass spectrometry MALDI-TOF technique for detection of Babesia canis canis infection in dogs. Parasitol Res 2014, 113:4293–4295.
- Penzhorn BL, Lewis BD, de Waal DT, Lopez Rebollar LM: Sterilisation of Babesia canis infections by imidocarb alone or in combination with diminazene. J South Afr Vet Assoc 1995, 66:157–159.
- Kuttler KL: Chemotherapy of babesiosis. In: Ristic M. ed, Babesiosis of Domestic Animals and Man. Boca Raton, FL: CRC Press; 1988, 227–242.
- Uilenberg G, Verdiesen P, Zwart D: Imidocarb: a chemoprophylactic experiment with Babesia canis. Vet Q 1981, 3:118–123.
- Vercammen F, DeDeken R, Maes L: Duration of protective immunity in experimental canine babesiosis after homologous and heterologous challenge. Vet Parasitol 1997, 68:51–55.
- Ayoob AL, Hackner SG, Prittie J: Clinical management of canine babesiosis. J Vet Emerg Crit Care 2010, 20:77–89.
- Vial HJ, Gorenflot A: Chemotherapy against babesiosis. Vet Parasitol 2006, 138:147–160.
- Kock N, Kelly P: Massive hepatic necrosis associated with accidental imidocarb dipropionate toxicosis in a dog. J Comp Pathol 1991, 104:113–116.
- Jacobson LS, Reyers F, Berry WL, Viljoen E: Changes in haematocrit after treatment of uncomplicated canine babesiosis: a comparison between diminazene and trypan blue, and an evaluation of the influence of parasitaemia. J S Afr Vet Assoc 1996, 67:77–82.
- Suzuki K, Wakabayashi H, Takahashi M, Fukushima K, Yabuki A, Endo Y: A possible treatment strategy and clinical factors to estimate the treatment response in Babesia gibsoni infection. J Vet Med Sci 2007, 69:563–568.
- Sakuma M, Setoguchi A, Endo Y: Possible emergence of drug-resistant variants of Babesia gibsoni in clinical cases treated with atovaquone and azithromycin. J Vet Intern Med 2009, 23:493–498.
- Miller DM, Swan GE, Lobetti RG, Jacobson LS: The pharmacokinetics of diminazene aceturate after intramuscular administration in healthy dogs. J S Afr Vet Assoc 2005, 76:146–150.
- Lin MY, Huang HP: Use of a doxycycline-enrofloxacin-metronidazole combination with/ without diminazene diaceturate to treat naturally occurring canine babesiosis caused by Babesia gibsoni. Acta Vet Scand 2010, 52:27.
- Birkenheuer AJ, Levy MG, Breitschwerdt EB: Efficacy of combined atovaquone and azithromycin for therapy of chronic Babesia gibsoni (Asian genotype) infections in dogs. J Vet Intern Med 2004, 18:494–498.
- Goo YK, Terkawi MA, Jia H, Aboge GO, Ooka H, Nelson B, Kim S, Sunaga F, Namikawa K, Igarashi I, Nishikawa Y, Xuan X: Artesunate, a potential drug for treatment of Babesia infection. Parasitol Int 2010, 59:481–486.
- Aboulaila M, Nakamura K, Govind Y, Yokoyama N, Igarashi I: Evaluation of the in vitro growth-inhibitory effect of epoxomicin on Babesia parasites. Vet Parasitol 2010, 167:1927.
- Jacobson L, Swan G: Supportive treatment of canine babesiosis. J South Afr Vet Assoc 1995, 66:95–105.
- Pantchev N, Pluta S, Huisinga E, Nather S, Scheufelen M, Vrhovec MG, Schweinitz A, Hampel H, Straubinger RK: Tick-borne Diseases (Borreliosis, Anaplasmosis, Babesiosis) in German and Austrian Dogs: Status quo and Review of Distribution, Transmission, Clinical Findings, Diagnostics and Prophylaxis. Parasitol Res 2015, 114:S19–54.
- Beugnet F, Halos L, Larsen D, Labuschagne M, Erasmus H, Fourie J: The ability of an oral formulation of afoxolaner to block the transmission of Babesia canis by Dermacentor reticulatus ticks to dogs. Parasit Vectors 2014, 7:283.
- Kules J, Horvatic A, Guillemin N, Galan A, Mrljak V, Bhide M: New approaches and omics tools for mining of vaccine candidates against vector-borne diseases. Mol BioSyst 2016, 12: 2680–2694.
- Schetters T: Vaccination against canine babesiosis. Trends Parasitol 2005, 21:179–84.
- Schetters TH, Kleuskens J, Scholtes N, Bos HJ: Strain variation limits protective activity of vaccines based on soluble Babesia canis antigens. Parasite Immunol 1995, 17:215–218.
- Schetters TP, Kleuskens JA, Scholtes NC, Gorenflot A, Moubri K, Vermeulen AN: Vaccination of dogs against heterologous Babesia canis infection using antigens from culture supernatants. Vet Parasitol 2001, 100:75–86.
- Schetters TP, Moubri K, Cooke BM: Comparison of Babesia rossi and Babesia canis isolates with emphasis on effects of vaccination with soluble parasite antigens: a review. J S Afr Vet Assoc 2009, 80:75–78.
- Moubri K, Kleuskens J, Van de Crommert J, Scholtes N, Van Kasteren T, Delbecq S, Carcy B, Precigout E, Gorenflot A, Schetters T: Discovery of a recombinant Babesia canis supernatant antigen that protects dogs against virulent challenge infection. Vet Parasitol 2018, 249:21–29.
- Fukumoto S, Tamaki Y, Shirafuji H, Harakawa S, Suzuki H, Xuan X: Immunization with recombinant surface antigen P50 of Babesia gibsoni expressed in insect cells induced parasite growth inhibition in dogs. Clin Diagn Lab Immunol 2005, 12:557–559.
Источник: Acta Veterinaria-Beograd 2018, 68 (2), 127-160. Acta Veterinaria is an Open Access Journal. All articles can be downloaded free of charge and used in accordance with the Creative Commons Attribution 4.0 International (CC BY 4.0).
СВМ № 4/2019