Morten Tryland1, Javier Sanchez Romano1, Nina Marcin1,4, Ingebjørg Helena Nymo1, Terje Domaas Josefsen2,5, Karen Kristine Sørensen3 and Torill Mørk2
1 Arctic Infection Biology, Department of Arctic and Marine Biology, UiT-The Arctic University of Norway, POBox 6050, Langnes, 9037 Tromsø, Norway.
2 Norwegian Veterinary Institute, POBox 6050, Langnes, 9037 Tromsø, Norway.
3 Vascular Biology Research Group, Department of Medical Biology, Faculty of Health Sciences, UiT — The Arctic University of Norway, Tromsø, Norway.
4 Present Address: Clinique veterinaire de l’abbatiale, 14 bis Rue Thibaut, 52220 Montier En Der, France.
5 Present Address: Faculty of Bioscience and Aquaculture, Nord University, Bodø, Norway.
От редактора рубрики
Почему мы выбрали эту статью про оленей? Дело не только в том, что ветеринарному офтальмологу, как узкому специалисту, приходится лечить животных всех видов. К нам обращаются с экзотами, приматами, птицами, дикими и зоопарковыми животными. И клиентов не волнует, что в русскоязычной литературе вообще нет ни слова о герпесе оленей, только есть учебник 1986 года про коров. Проблема гораздо серьёзней, она связана с большим и чрезвычайно распространённым семейством герпесвирусов. Герпесвирус встречается у многих видов животных и человека, но не у всех ведёт себя одинаково. У кошек он является наиболее частым агентом, вызывающим кератоконъюнктивит и приводящим к язвам роговицы. Так вот, именно у оленей герпесвирус вызывает симптомы, сходные с течением болезни у кошек. Практикующему врачу будет небезынтересно пополнить свою базу знаний о герпесвирусах, приобретающих всё большее значение в инфекционной патологии животных и человека.
Екатерина Васильева
Ключевые слова
Альфа-герпесвирус, болезни глаз, ИКК, Moraxella, офтальмология, северный олень, дикая природа.
Введение
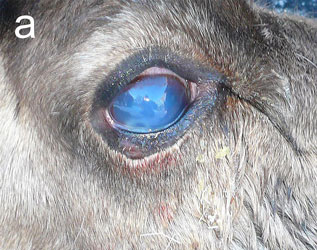
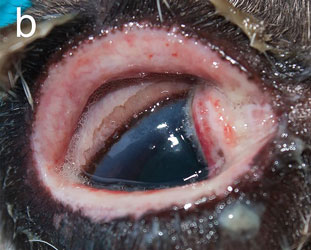
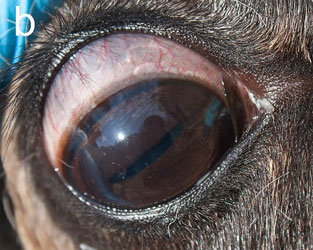
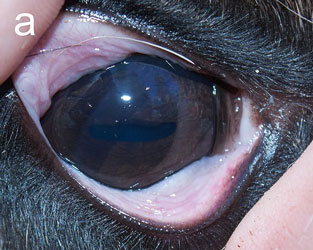
Инфекционный кератоконъюнктивит (ИКК) отмечается у полуодомашненных евразийских тундровых северных оленей (Rangifer tarandus tarandus) в Фенноскандии уже более века [1], вызывая вспышки у телят до года и особенно у молодых животных [2–4]. Первым клиническим признаком является слезотечение, выражающееся в загрязнении и изменении цвета шерсти вокруг глаза, далее развивается конъюнктивит и нарастающий отёк роговицы и периорбитальной области. Отёк роговицы придаёт глазу мутный беловатый или голубоватый вид (рис. 1а), по которому пастухи и распознают ИКК в полевых условиях. Если спонтанное выздоровление не происходит, инфекция прогрессирует с нарастанием тяжести конъюнктивита и отёка роговицы, появлением язв роговицы и панофтальмита, приводящего к необратимой слепоте (рис. 1b). Для северных оленей, проводящих большую часть года на свободном выпасе без присмотра, это заболевание представляет серьёзную угрозу здоровью, а для владельца стада является потенциальным источником экономических потерь [2, 4].
Несмотря на долгосрочную осведомлённость об инфекционном кератоконъюнктивите у северных оленей, возбудитель ещё не выявлен, и ИКК у этого вида животных рассматривается как многофакторная болезнь, аналогично инфекционному кератоконъюнктивиту крупного рогатого скота (ИКК КРС), обычно называемого «pinkeye». Грамотрицательная бактерия Moraxella bovis предполагается в качестве возбудителя ИКК КРС [5], хотя в последних исследованиях показано, что Moraxella bovoculi, первоначально идентифицированная в 2002 году и отличающаяся от M. bovis, также может быть связана с ИКК КРС [6, 7]. Заболевание, похожее на ИКК, также было зарегистрировано у овец и коз [8, 9] и у различных видов диких животных, таких как лось (Alces alces), чернохвостый олень (Odocoileus hemionus), альпийский горный козел (Capra ibex), серна (Rupicapra rupicapra), косуля (Capreolus capreolus) и благородный олень (Cervus elaphus). Множество различных инфекционных агентов ассоциированы с заболеванием у разных видов [10–14], большинство из них представлено бактериями, включая известные потенциальные патогены, такие как Mycoplasma spp.
Аналогично от оленей с инфекционным кератоконъюнктивитом было выделено множество разных бактерий, таких как M. bovoculi, M. ovis, Pasteurella multocida и Trueperella pyogenes [2–4, 15, 16]. В свежем исследовании северных оленей в Норвегии, Швеции и Финляндии, анализ мазков с конъюнктивы клинически здорового северного оленя и северного оленя с клиническим ИКК, показал, что М. bovoculi была наиболее распространённым бактериальным агентом [17].
Однако во время вспышки ИКК у оленей в округе Тромс, Норвегия, альфа-герпесвирус оленей типа 2 (CvHV2) был идентифицирован как первичный инфекционный агент, на основании обнаружения этого вируса на ранних стадиях заболевания. Бактерии, такие как M. bovoculi, казалось, доминировали на более поздних стадиях ИКК, наряду с уменьшением титров вируса в мазках с конъюнктивы поражённых животных [4].
Кроме того, факторы окружающей среды, такие как стресс, связанный с формированием стад, принудительным перемещением животных, обработкой и транспортировкой, снижение массы тела или истощение, воздействие ультрафиолета и сухая и пыльная среда могут влиять на патогенез инфекционного кератоконъюнктивита у северных оленей [2, 18, 19]. Во время естественных вспышек ИКК у северных оленей трудно выявить, какие потенциальные патогены присутствуют. Также сложно провести контролируемый отбор проб и зарегистрировать начало и развитие заболевания. Кроме того, трудно контролировать факторы окружающей среды. В этом исследовании телята до года были инфицированы CvHV2 и M. bovoculi, которые считаются наиболее вероятными первичными возбудителями ИКК [4, 17]. Целью этого исследования было изучение возможности вызвать клиническое признаки ИКК при экспериментальном заражении оленей CvHV2, M. bovoculi и комбинацией этих двух агентов.
Материалы и методы
Животные
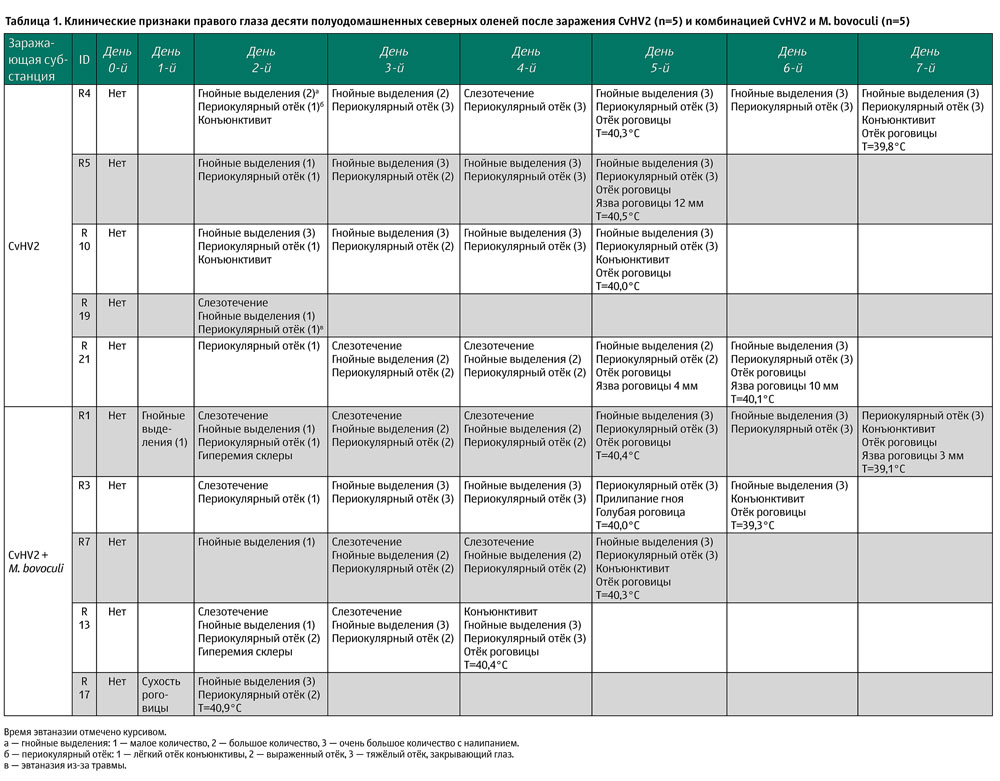
Телята полуодомашненных евразийских тундровых оленей (n=27) возраста около 11 месяцев были пригнаны с горных пастбищ для исследования. С помощью фиксации в загонах провели ID-маркировку (пластиковый ошейник) и отбор проб для проверки контакта с CvHV2 и М. bovoculi в прошлом. Кровь отбирали с помощью системы Vacutainer из яремной вены, сыворотку получали центрифугированием и хранили при 20°С. Для вирусологического исследования пробы были взяты стерильными ватными палочками с конъюнктивы обоих глаз, из ноздрей и влагалища (у самок). Затем образцы помещали в 1,8 мл криотрубки с 800 мкл среды Игла (EMEM), содержащей антибиотики (10 000 ЕД/мл пенициллина и 10 мг/мл стрептомицина; 1 мл/л гентамицина, 50 мг/мл и 10 мл/л амфотерицина В 250 мкг/мл; EMEMab 10 мл/л), и хранили при -80°С. Для бактериологического исследования пробы отбирали тампоном (TranswabR, Medical Wire & Equipment, Wiltshire, UK) с конъюнктивы обоих глаз и помещали их в контейнеры с транспортной средой. Образцы крови исследовали на антитела к CvHV2. Мазки с конъюнктивы и ноздрей были исследованы на наличие ДНК CvHV2 (вложенная полимеразная цепная реакция [ПЦР]), а пробы с конъюнктивы были исследованы на М. bovoculi (культивирование), как описано ниже. На основании результатов этих исследований 21 животное (5 самок и 16 самцов) без признаков предыдущего контакта с CvHV2 или M. bovoculi были отобраны для исследования. За 4 недели до заражения животных поместили в загон и содержали вместе для адаптации (см. ниже). Эксперимент продолжался в общей сложности 15 дней.
Все животные были седированы и взвешены дважды в течение исследования, то есть в день 0-й (заражение) и в день эвтаназии. Животные были седированы с помощью дротиков (Dan-Inject JM Special; Dan-Inject ApS, Børkop, Denmark) с комбинацией медетомидина (Zalopine® 10 мг/мл, Orion Corporation Animal Health, Espoo, Финляндия) и кетамина (Ketalar® 50 мг/мл, Pfizer AS, Oslo, Norway) в фиксированном соотношении 1:5 (мг:мг) медетомидин:кетамин. После завершения процесса заражения седативный эффект был обращён при помощи внутримышечной инъекции атипамезола (Antisedan™; Аtipamizole 5 мг/мл, Zoetis, UK) в фиксированном соотношении 5:1 атипамезол:медетомидин, и животных контролировали до тех пор, пока они не смогли стоять. Несмотря на использование для полуодомашненных оленей сниженных на треть доз препаратов для седации [20], три северных оленя (одна самка, двое самцов) умерли от острых шокоподобных осложнений. Подобных осложнений не возникло во время второго раунда седации с использованием тех же препаратов и доз. Во время седации температура тела измерялась цифровым клиническим термометром (Fluke Thermometer 51/52 II; Fluke Norge, Oslo, Norway), датчик которого был расположен ректально на глубине 30 см. Частота пульса и сатурация (SpO2) измерялась с помощью ручного пульсоксиметра (Masimo RAD 57; Masimo International Sàrl, Neuchatel, Switzerland), датчик которого фиксировался к языку. Частота дыхания регистрировалась путём подсчёта движений грудной клетки с помощью секундомера.
Животные были подвергнуты эвтаназии в разные моменты времени в течение эксперимента с использованием пневматического пистолета с ударным стержнем для оглушения с последующим обескровливанием через яремную вену. Животные R19 (группа CvHV2) и R16 (группа M. bovoculi) были эвтаназированы на 2-й и 3-й день соответственно из-за перелома бедра. Животные двух групп, инфицированные CvHV2 (отдельно или в сочетании с М. bovoculi), были подвергнуты эвтаназии в соответствии с определёнными конечными точками благополучия животных на 3–7-й дни после заражения (таблица 1). Остальные животные группы M. bovoculi были эвтаназированы на 6-й день (n=1) и 13-й день после заражения (n=3), тогда как контрольные животные (n=3) были эвтаназированы на 15-й день после заражения. Патологический материал от животных без других клинических симптомов, кроме глазных, был отобран в экспериментальном помещении, в то время как животные с травмой и дыхательной недостаточностью во время седации были отправлены для полного патологоанатомического вскрытия в попытке определить причины этих неожиданных осложнений.
Размещение, кормление и обработка животных
Животные были размещены в загоне под открытым небом для полевых исследований 6 мая 2014 года. Загон состоял из одного большого отсека (около 100×80 м) и четырёх меньших отсеков (около 50×50 м), отсеки были отделены друг от друга и от окружающей среды забором из стальной проволоки высотой 2,5 м. Земля внутри отсеков была покрыта глубоким слоем снега в начале наблюдений, но из-за таяния снега весной животным стало доступно пастбище со свежей травой. Животных помечали ушной биркой и нанесением номера на шерсть из распылителя с боков, чтобы обеспечить лёгкую идентификацию. Животные содержались вместе в течение первых четырёх недель (период привыкания) для адаптации к условиям содержания, корму и присутствию людей.
Животных кормили лишайником (Cladina spp.), который был постепенно заменён коммерческим гранулированным кормом для оленей (Reinsdyrfôr, Felleskjøpet, Trondheim, Norway). За неделю до заражения и в течение всего оставшегося времени эксперимента животных кормили гранулированным кормом ad libitum с добавкой лишайника. Пресная вода была предоставлена и менялась ежедневно. Упитанность оценивали при помощи визуального осмотра и пальпации, она варьировала от средней до худой, но увеличивалась в период адаптации. В день заражения животные весили 37–59 кг (в среднем 49,1 кг) и были разделены на четыре группы без дальнейшего контакта между группами (контроль, CvHV2, M. bovoculi и CvHV2 / M. bovoculi).
В течение всего исследования животных кормили и осматривали три раза в день ветеринарные врачи, лицензированные для экспериментальных исследований животных. Велись записи с описанием поведения каждого животного, упитанности, приёма пищи и взаимодействия между животными, а также развития клинических признаков.
За исключением дня 0-го (заражение) и дня эвтаназии, когда животных седировали, все осмотры и отбор проб проводились с использованием механической фиксации. В дни, когда животных не фиксировали никак, оценка развития клинических признаков проводилась с расстояния в несколько метров с биноклем.
Приготовление инфицирующей субстанции
CvHV2 был первоначально выделен из конъюнктивы северных оленей с клиническим инфекционным кератоконъюнктивитом [4]. Вирус был культивирован в клетках бычьей почки Madin-Darby (MDBK) (ATCC CCL22) в среде Игла с добавлением 10% сыворотки крови лошади (LGC Standards, Middlesex, UK). Вирусная культура была собрана, когда более 90% клеток показали цитопатический эффект (CPE). Клеточный мусор был удалён центрифугированием (7800 g, 30 мин), и вирусные частицы в надосадочной жидкости осаждали через 30%-ю сахарозную подушку (20 000 g, 1 час), ресуспендировали в 5 мл натрий-фосфатного буферного раствора, фильтровали через целлюлозный фильтр 0,45 мкм (Merck Millipore, Darmstadt, Germany) и замораживали при -80°C. Титр вируса в инфицирующей субстанции составлял 5,8×106 TCID50/мл.
Штамм M. bovoculi, используемый для заражения, был первоначально культивирован из мазка с конъюнктивы норвежского северного оленя с клиническим инфекционным кератоконъюнктивитом в 2014 году. Колонии были диаметром 2–3 мм, жёлтые/серые, круглые, с блестящим «жирным» внешним видом и демонстрировали бета-гемолиз через 24 ч роста на кровяном агаре. Колонии росли при 37°С, но только в аэробных условиях (без доступа СО2). Бактерии были грамотрицательными кокковидной формы, каталазный и оксидазный тесты были положительными. Потенциальные факторы вирулентности не исследовались. Изолят был идентифицирован как M. bovoculi секвенированием 16s рРНК. После хранения (при –80°С) изолят культивировали на 5%-м агаре с овечьей кровью при 37°С в аэробных условиях за 24 часа до заражения. Бактерия в общей сложности прошла 4 пассажа in vitro (от изоляции до заражения).
Заражение
Пока животные были седированы, оба глаза были сфотографированы и обследованы на общие клинические признаки заболеваний и наличие язв роговицы с помощью теста с флуоресцеином (Fluoresceinnatrium Minims 20 mg/ml; Chauvin, Surrey, UK). Одноразовые халаты и перчатки были использованы всеми участниками заражения и отбора проб. При любых манипуляциях с животными (кормление, заражение, отбор проб), контрольную группу исследовали до заражённых животных.
Перед заражением и при каждом из последующих осмотров глаза фотографировали, брали пробы и проверяли на наличие язв роговицы с использованием флуоресцеина, затем тщательно промывали глаз стерильной водой. Местное обезболивание (Oxibuprokain Minims 4 mg/ml; Chauvin) было применено для правого глаза за 4 минуты до лёгкого растирания слизистой оболочки стерильной наждачной бумагой (класс 60).
Вирус был внесён путём введения небольшого стерильного ватного диска, пропитанного CvHV2 в натрий-фосфатном буферном растворе, в конъюнктивальный мешок под нижнее веко, его удерживали там 4 минуты. М. bovoculi была внесена при отборе колонии M. bovoculi с агара стерильной ватной палочкой и распределении её по натёртой области конъюнктивы. Бактериальные колонии из той же чашки Петри были впоследствии пересеяны в новые чашки с агаром для проверки жизнеспособности. Эти процедуры для вирусного и бактериального заражения были проведены для улучшения доступа вируса и бактерии в достаточном количестве через слегка скарифицированные клетки конъюнктивы. При одновременном заражении CvHV2 и M. bovoculi сначала был введён вирус, а затем бактерия через 10 минут. Для животных контрольной группы стерильную ватную палочку смачивали в стерильной воде и наносили на натёртую область конъюнктивы. Левый глаз был обследован как описано выше, но без дальнейших манипуляций, и служил контролем для каждого животного (все группы).
Бактериальное культивирование
Мазки с конъюнктивы обоих глаз, полученные в день заражения (день 0-й) и на каждый второй день после заражения подвергали культивированию на 5%-м агаре с овечьей кровью. Чашки Петри были инкубированы аэробно при 37°С и исследованы через 24 и 48 часов. Бактериальные колонии были от жёлтого до серого цвета, диаметром 2–3 мм, с блестящим «жирным» внешним видом и были бета-гемолитическими, предположительно, это были Moraxella spp. Такие колонии субкультивировали для чистоты и дальнейшей характеристики (морфология, окрашивание по Граму, каталазный и оксидазный тест). Выбранные изоляты были впоследствии идентифицированы на видовом уровне (оценка >2) по масс-спектрометрии MALDI-TOF (Microflex; Bruker UK Limited, Coventry, UK).
Выделение ДНК, ПЦР и секвенирование
Чтобы убедиться, что вирус CvHV2 отсутствовал в конъюнктиве животных до эксперимента, ДНК была извлечена из проб, полученных с конъюнктивы (QIAamp® DNA Mini Kit, Hilden, Germany) со средним выходом 8,1 нг/мкл (SD=8,0), и вложенную ПЦР проводили, как описано ранее [21]. Набор внутренних праймеров амплифицировал область 294 bp гена UL27, кодирующую гликопротеин B (gB), которая представляет собой высококонсервативную область этого гена альфа-герпесвирусов жвачных животных [22]. CvHV2 (штамм Salla 82) [23] и BoHV1 [24] были использованы в качестве положительного контроля. Ампликоны ПЦР были отделены электрофорезом в агарозном геле и визуализированы с бромистым этидием (Sigma-Aldrich Norway AS, Oslo, Norway).
Количественная ПЦР в реальном времени на основе Taqman Probe (КПЦР), амплификацирующая фрагмент 95 bp в другой области гена UL27 по сравнению с вложенной ПЦР, показанной ранее для обнаружения герпесвируса северных оленей (обозначенного CvHV2), была выполнена, как описано ранее [25]. ПЦР была проведена с двумя небольшими изменениями: температура отжига была снижена до 58,9°С (после анализа теплового градиента) и объём безнуклеазной воды был увеличен с 4,0 до 4,5 мкл для достижения общего объёма реакции 25 мкл. Образцы исследовались в двух экземплярах. Положительный контроль (CvHV2, использовавшийся для заражения) [4], отрицательный контроль (ДНК, выделенная из мышечной ткани серонегативного по CvHV2 контрольного животного) и контроль без матрицы, содержащий все компоненты ПЦР, кроме ДНК, были включены в каждый тест. Эта техника была использована для анализа всех мазков с конъюнктивы и образцов плазмы, взятых в день 0-й и на протяжении всего эксперимента.
ПЦР-ампликоны были подготовлены для нуклеотидного секвенирования путём ферментативного удаления неиспользованных дезоксинуклеотидов и праймеров (ExoSAP-IT ™; Amersham Pharmacia Biotech, Sweden), после чего было проведено секвенирование (BigDye® Terminator v3.1 cycle sequencing kit; Applied Biosystems, Norway) на генетическом анализаторе Applied Biosystems 3130 XL (Applied Biosystems).
Серология
Образцы сыворотки крови были исследованы на антитела к альфа-герпесвирусу с использованием коммерческого бычьего фермент-связанного иммуноферментного анализа (ELISA; gB Blocking, LSI Laboratoire Service International, Lissieu, France) на основе BoHV1 гликопротеина B (gB) в качестве антигена. Комплект был предварительно проверен тестом на нейтрализацию вирусов (VNT) для анализа образцов сыворотки северных оленей на предмет антител к CvHV2 [26]. Все образцы сыворотки были протестированы в двух экземплярах и оценивались в отношении положительной контрольной сыворотки северных оленей [27] и крупного рогатого скота (предоставленной в наборе).
 |
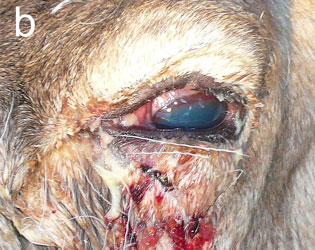 |
| Рис.1. Инфекционный кератоконъюнктивит у северного оленя (ИКК). |
а — отёк роговицы, b — тяжёлый ИКК с панофтальмитом, отёком и кровотечением |
Результаты
Клинические признаки
Тщательное клиническое обследование, включая измерение температуры тела, проводилось каждому животному, когда они были физически зафиксированы или седированы, то есть при помещении в загон, в день заражения через месяц после помещения в загон (день 0-й) и в дни: 2-й, 5-й, 7-й, 13-й и 15-й после заражения, а также после эвтаназии, если она проводилась не по этому графику. Температура тела (n=18) во время заражения (день 0-й) варьировала от 37,8 до 39,5°C (в среднем 39,0°C, SD 0,05). На 5-й день средняя температура тела у всех заражённых животных (кроме контрольных) увеличилась до 39,8–40,6°C (в среднем 40,2°C) и снова снизилась в течение следующих дней. Средняя температура также увеличилась у контрольных животных (n=3) от 39,0°С (день 0-й) до 39,9°С (день 7-й), после чего она снизилась до 39,6°С (день 10-й) и 39,3°С (день 15-й).
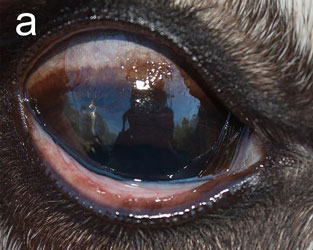
В группе CvHV2 не наблюдалось никаких клинических признаков в 1-й день (таблица 1). На 2-й день в заражённых глазах всех животных в этой группе проявился отёк конъюнктивы, у четырёх из пяти животных был гнойный экссудат из конъюнктивального мешка и у двух — гиперемия конъюнктивы (3). С 3-го по 5-й день тяжесть отёка обычно увеличивалась от лёгкой (степень 1-я) до тяжёлой степени (степень 3-я), затрагивая всю периорбитальную область к дню 5-му. Точно так же гнойное отделяемое увеличилось от лёгкого (1-я степень) до тяжёлого (3-я степень) (рис. 2). По результатам обследования на 5-й день, два животных (R5 и R10) были эвтаназированы с клиническими признаками отёка роговицы, высокой степенью периорбитального отёка и гнойного отделяемого, а также слегка повышенной температурой тела 40,5 и 40,0°С соответственно. Аналогичные клинические признаки наблюдались у R21 и R4, которых эвтаназировали на 6-й и 7-й день соответственно (рис. 2). У животных R5 и R21 к моменту эвтаназии были обнаружены язвы роговицы к 5-му и 6-му дням соответственно.
В группе M. bovoculi серый или беловатый экссудат из конъюнктивального мешка наблюдался в области нижнего века заражённого правого глаза у двух животных (R6 и R8) несколько часов после заражения (день 0-й) и в начале следующего дня (день 1-й), после этого экссудата не было замечено. Никаких клинических признаков не наблюдалось в этой группе на протяжении оставшегося периода эксперимента (рис. 3).
Клинические признаки, наблюдаемые в группе, заражённой CvHV2 и M. bovoculi были аналогичны тем, что описаны для группы CvHV2 (таблица 1). У всех животных в этой группе, кроме одного, эвтаназированного в 3-й день (R17), был отмечен гнойный экссудат и развился конъюнктивит, отёк роговицы и периорбитальный отёк (рис. 4). У одного животного (R1) развилась язва роговицы.
В группе контроля (R2, R18, R20) ни у одного животного не развилось клинических признаков в течение всего периода эксперимента (дни 0–15-й).
 |
 |
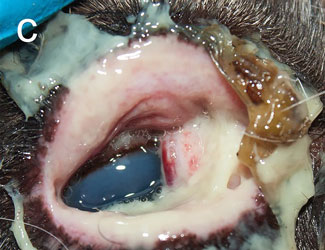 |
Рис.2. Полуодомашненный северный олень (R21), заражённый CvHV2. а — день 0-й, b — день 5-й, с — день 6-й |
 |
 |
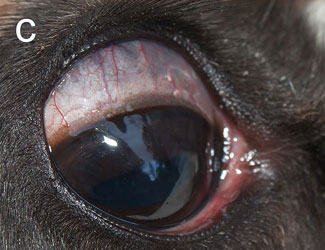 |
Рис.3. Полуодомашненный северный олень (R15), заражённый M. bovoculi. a — день 0-й, b — день 5-й, с — день 10-й |
 |
 |
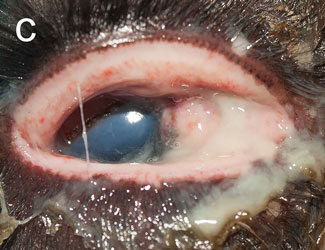 |
Рис.4. Полуодомашненный северный олень (R1), заражённый CvHV2 и M. bovoculi. a — день 0-й, b — день 2-й, с — день 5-й |
Бактериология
В 0-й день до заражения несколько колоний М. bovoculi были культивированы из проб с конъюнктивы двух животных (R6 и R8) из группы, подлежащей заражению M. bovoculi и от двух других животных (R1 и R17) из группы, подлежащей заражению CvHV2 и М. bovoculi. Все эти изоляты были идентифицированы с использованием MALDI-TOF масс-спектрометрия. Во время эксперимента M. bovoculi в разные моменты времени обнаруживали при бактериологическом исследовании мазков от всех пяти животных, заражённых бактерией. В группе, заражённой CvHV2 и M. bovoculi, бактерия обнаруживалась у трёх из пяти животных. В группе, заражённой только CvHV2, M. bovoculi была культивирована из проб от четырёх из пяти животных. В группе контроля M. bovoculi не обнаруживалась ни у одного животного. В большинстве случаев М. bovoculi была выявлена с несколькими колониями в смешанной культуре.
ПЦР
Несмотря на серо-негативность образца крови, CvHV2-специфичная ДНК была обнаружена в одном мазке с конъюнктивы (вложенная ПЦР; R21) до эксперимента, и это животное было определено в группу CvHV2. CvHV2-специфичная ДНК не была обнаружена в мазке с конъюнктивы этого животного и всех остальных (оба глаза), взятых в день 0-й эксперимента, то есть до заражения. У животных, заражённых CvHV2, отдельно или в комбинации с М.bovoculi, CvHV2-специфическая ДНК была обнаружена (КПЦР) во всех пробах как от заражённых, так и от контрольных глаз со второго дня и до последнего отбора проб от каждого животного (эвтаназия). Было два исключения: CvHV2 не была обнаружена в мазке из правого (заражённого) глаза животного R3 на 5-й день (за день до эвтаназии, хотя была обнаружена снова при эвтаназии, день 6-й), и из левого (незаражённого) глаза животного R21 на 6-й день (день эвтаназии).
У животных, заражённых только M. bovoculi, CvHV2-специфическая ДНК была обнаружена в одном образце из левого глаза животного R6 на 6-й день, но, кроме этого, все образцы от животных этой группы и контрольной группы были отрицательными по CvHV2. Вирусная ДНК была обнаружена в плазме одного животного (R7) из группы, заражённой CvHV2, в день 2-й, но далее на протяжении эксперимента в плазме этого и других животных не обнаруживалась.
Серология (CvHV2)
Все животные, отобранные для исследования, были серо-негативными по CvHV2 по прибытии и в день заражения (день 0-й). Животные R21 и R4 из группы, заражённой CvHV2, сероконвертировали на 6-й и 7-й день соответственно, и животное R1 из группы, заражённой CvHV2 и M. bovoculi сероконвертировали на 7-й день.
Обсуждение
Все животные, заражённые CvHV2 отдельно или в комбинации с M. bovoculi (рис. 2 и 4), продемонстрировали клинические признаки, характерные для инфекционного кератоконъюнктивита [2, 4], с острым началом (день 2-й) и быстрым прогрессированием со дня 2-го до дня 5-го, 6-го, 7-го (эвтаназия). Животные, заражённые только M. bovoculi, и контрольные животные оставались здоровыми на протяжении всего эксперимента. Эти однозначные клинические результаты, полученные при экспериментальном заражении годовалых северных оленей с аналогичными ответами у всех членов каждой группы животных, обеспечивают мощную поддержку предыдущих результатов во время вспышек ИКК [4], что CvHV2 способен вызвать клиническую картину, которая является характерной для инфекционного кератоконъюнктивита у северных оленей.
Титры вируса и бактерий в заражающей субстанции в этом исследовании, вероятно, были более высокими по сравнению с передачей в естественных условиях, особенно для вируса, в соответствии с предыдущим сообщением прививки BoHV1 у крупного рогатого скота [28]. Однако важно иметь в виду, что как вирус, так и бактерии являются репликативными агентами, которые после заражения будут размножаться в клетках, тогда как избыток вируса и бактерий будет смыт с поверхности глаза, что делает титры в заражающей субстанции менее значимыми.
Мы осторожно натёрли часть конъюнктивы нижнего века, чтобы обеспечить инфекционным агентам доступ к клеткам-мишеням при заражении, но мы решили не проводить скарифицирование роговицы, как было сделано в аналогичных экспериментах с крупным рогатым скотом и Moraxella spp. [29]. Натирание конъюнктивы может быть чем-то похожим на то, что северный олень может испытать при перемещении в загон и когда подвергается воздействию песка и пыли. Таким образом, мы думаем, что условия, при которых был проведён этот эксперимент, были во многих отношениях близки к естественной обстановке, в том числе тот факт, что животные были молоды (< 1 года) во время заражения и что они подверглись стрессу перемещения с их горных пастбищ, транспортировки и помещения в загоны, контакта с людьми и обработок, что соответствует естественным условиям выпаса.
При инфекционном кератоконъюнктивите КРС патогенность M. bovis основана на экспрессии белка пилина для прикрепления [30] и цитотоксина, который повреждает эпителиальные клетки роговицы [31]. Однако M. bovoculi также ассоциируется с ИКК КРС. В ретроспективном исследовании Moraxella spp., выделенная при вспышках ИКК КРС в 282 стадах в 30 штатах США, 701 образец был идентифицирован как М. bovoculi и 295 — как М. bovi [32]. Также было показано, что изоляты M. bovoculi, полученные от крупного рогатого скота, могут обладать как геном предполагаемого цитотоксина [33], так и геном пилина [34], сходными с теми, которые были обнаружены у М. bovis. Тем не менее, рандомизированное слепое исследование для оценки связи между М. bovis и М. bovoculi и ИКK у 31 молочного телёнка показали, что у 9 из 10 телят, заражённых M. bovis, развилась язва роговицы вследствие инфекционного кератоконъюнктивита, в то время как ни у одного из 10 телят, заражённых M. bovoculi, не было язв роговицы, хотя авторы утверждают, что патогенность именно этого штамма М. bovoculi ещё не установлена [29]. Похожая ситуация была с изолятом М. bovoculi, использованным в нашем исследовании, хотя она была первоначально выделена и идентифицирована как доминирующий вид при бактериологическом посеве образов с конъюнктивы северных оленей с клиническими признаками ИКК. Значительные генетические различия недавно были обнаружены между изолятами M. bovoculi из глаз крупного рогатого скота с ИКК по сравнению с изолятами из КРС без клинических признаков, поэтому предполагается, что определённые генетически отличные штаммы М. bovoculi связаны с инфекционным кератоконъюнктивитом у крупного рогатого скота [35], аналогичная ситуация может быть и у ИКК северных оленей.
В течение всего периода эксперимента M. bovoculi культивировали из проб от восьми из десяти животных, которые были заражены бактерией отдельно или в комбинации с CvHV2, но никаких клинических признаков не отмечали у животных, заражённых только M. bovoculi. Это может указывать на то, что изолят М. bovoculi, использованный для заражения, не был патогенным или что продолжительность бактериальной инфекции была слишком короткой для проявления клинических признаков. М. bovoculi также культивировали из проб от четырёх животных до заражения (день 0-й) и от четырёх животных, заражённых только CvHV2, из правого глаза всех четырёх животных и из обоих глаз одного животного. Это может указывать на передачу бактерий от других животных и означает, что M. bovoculi была перенесена от заражённых животных в другие загоны. Однако тот факт, что М. bovoculi не была культивирована из проб ни от одного из контрольных животных в разные периоды времени (день 0-й — день 13-й после заражения), указал, что М. bovoculi не заражала их, а встречалась спорадически у здоровых северных оленей без глазных болезней. Следовательно, бактерия может быть комменсалом в конъюнктивальном мешке северного оленя, что также было установлено при предыдущих бактериологических скринингах [17]. Поскольку серологическое исследование на антитела против М. bovoculi до заражения не проводилось, нельзя утверждать, что отсутствие клинических признаков у животных, заражённых только M. bovoculi, может быть объяснено ранее существовавшим иммунитетом против бактерии, но остаётся неопределённым, может ли присутствие бактерии на слизистых оболочках, таких как конъюнктива и носоглотка, вызывать выявляемый гуморальный иммунный ответ.
Животные R1 (CvHV2 и M. bovoculi), а также R4 и R21 (CvHV2) имели антитела против CvHV2 в день эвтаназии (6-й и 7-й день соответственно), тогда как другие животные, заражённые CvHV2, предположительно были подвергнуты эвтаназии до сероконверсии. Это соответствует предыдущим экспериментам по заражению оленей CvHV2 [36], в котором гуморальный иммунный ответ обычно был выявлен до 8–10 дней после заражения. Таким образом, быстрое наступление клинических признаков после заражения CvHV2 указывает на то, что первичный специфический иммунный ответ будет развиваться слишком поздно, чтобы защитить от болезни ранее не подвергавшихся воздействию вируса животных. Эти данные и также наблюдение, что серопревалентность среди оленей в возрасте <1 года в Графстве Финнмарк, Норвегия, составила всего 8% по сравнению с 77% среди взрослых оленей (2004–2006) [26], предрасполагают к быстрому распространению вируса среди молодых и иммунологически незрелых животных, что иногда приводит к вспышкам инфекционного кератоконъюнктивита, затрагивающим сотни животных [1, 18]. Гипотеза о том, что стресс вызывает реактивацию CvHV2 у латентно инфицированных животных [37] с последующим выделением вируса и заражением молодых и иммунологически незрелых животных кажется состоятельной. На поздних стадиях заболевания различные виды бактерий, включая M. bovoculi, были выявлены, но их роль может быть более оппортунистической при установлении инфекции, возможно, они становятся патогенными при предварительном воздействии на слизистую оболочку вируса CvHV2. На основании последних сообщений о патогенных свойствах М. bovoculi у КРС, патогенный потенциал изолятов M. bovoculi северного оленя должен быть дополнительно исследован.
Никаких клинических признаков не было обнаружено у трёх контрольных животных или в левом глазу (контроль) заражённых северных оленей (все группы). Это отсутствие клинических признаков на левом глазу (контроль) противоречило обнаружению CvHV2-специфической ДНК в пробах из левого глаза всех CvHV2-заражённых животных со дня 2-го до последнего дня отбора проб, за исключением животного R21 на 6-й день. В то же время не была выявлена виремия, так как CvHV2-специфическая ДНК была обнаружена в образце плазмы только у одного животного (R7) однократно (день 2-й) за время эксперимента. Таким образом, эти результаты показывают, что вирус был в состоянии распространиться из места заражения в конъюнктиву другого глаза в течение двух дней после заражения у всех животных, заражённых CvHV2.
Выводы
Экспериментальное заражение полуодомашненных северных оленей показало, что CvHV2 способен вызывать типичные клинические признаки инфекционного кератоконъюнктивита в течение 2–7 дней после заражения, что позволяет предполагать, что альфа-герпесвирус северного оленя, CvHV2, является возбудителем ИКК у северных оленей. Комбинированное заражение CvHV2 и M. bovoculi не изменило время начала, развитие или характер клинических признаков. Конъюнктивальное заражение только M. bovoculi не привело к развитию клинических признаков. М. bovoculi и другие бактерии могут, однако, иметь значение как оппортунистические патогены, особенно на поздних стадиях заболевания. На основании недавних находок о патогенных свойствах М. bovoculi у КРС [35, 38], патогенный потенциал изолятов М. bovoculi от северного оленя должен быть дополнительно исследован.
Литература
- Bergman A. Contagious keratitis in reindeer. Scand Vet J. 1912; 2:145–77.
- Rehbinder C, Nilsson A. An outbreak of kerato-conjunctivitis among corralled,
supplementary fed, semi-domesticated reindeer calves. Rangifer. 1995; 15:9–14.
- Oksanen A. Keratoconjunctivitis in a corralled reindeer. Proceedings of the seventh Nordic Workshop on Reindeer Research. Rangifer Report. 1993; 1:50.
- Tryland M, das Neves CG, Sunde M, Mørk T. Cervid herpesvirus 2 the primary agent in an outbreak of infectious keratoconjunctivitis in semidomesticated reindeer. J Clin Microbiol. 2009; 47:3707–13. doi:10.1128/ JCM.01198–09.
- Angelos JA. Infectious bovine keratoconjunctivitis (pinkeye). Vet Clin North Am Food Anim Pract. 2015; 31:61–79.
- Angelos JA, Spinks PQ, Ball LM, George LW. Moraxella bovoculi sp. nov., isolated from calves with infectious bovine keratoconjunctivitis. Int J Syst Evol Microbiol. 2007; 57:789–95.
- Angelos JA. Moraxella bovoculi and infectious bovine keratoconjunctivitis: cause or coincidence? Vet Clin North Am Food Anim Pract. 2010; 26:73–8. doi:10.1016/j.cvfa.2009.10.002.
- Еkerstedt J, Hofshagen M. Bacteriological investigation of infectious keratoconjunctivitis in Norwegian sheep. Acta Vet Scand. 2004; 45:19–26.
- Gupta S, Chahota R, Bhardwaj B, Malik P, Verma S, Sharma M. Identification of Chlamydia and Mycoplasma species in ruminants with ocular infections. Lett Appl Microbiol. 2015 ;60:135–9. doi:10.1111/lam.12362.
- Dubay SA, Williams ES, Mills K, Boerger-Fields AM. Association of Moraxella ovis with keratoconjunctivitis in mule deer and moose in Wyoming. J Wildl Dis. 2000; 36:241–7.
- Giacometti M, Janovsky M, Belloy L, Frey J. Infectious keratoconjunctivitis of ibex, chamois and other caprinae. Rev Sci Tech. 2002; 21:335–45.
- Gortazar C, Fernandez-de-Luco D, Frцlich K. Keratoconjunctivitis in a free-ranging red deer (Cervus elaphus) population in Spain. Z Jagdwiss. 1998; 44:257–61.
- Mavrot F, Vilei EM, Marreros N, Signer C, Frey J, Ryser-Degiorgis MP. Occurrence, quantification and genotyping of Mycoplasma conjunctivae in wild Caprinae with and without infectious keratoconjunctivitis. J Wildl Dis. 2012; 48:619–31.
- Grymer J. Infektiøs bovin keratokonjunktivitis hos kvag og rеdyr. Dansk Vet Tidsskr. 1984; 67:854–6.
- Kummeneje K. Isolation of Neisseria ovis and a Colesiota conjunctivae-like organism from cases of kerato-conjunctivitis in reindeer in northern Norway. Acta Vet Scand. 1976;1 7:107–8.
- Aschfalk A, Josefsen TD, Steingass H, Muller W, Goethe R. Crowding and winter emergency feeding as predisposing factors for kerato-conjunctivitis in semi-domesticated reindeer in Norway. Dtsch Tierarztl Wochenschr. 2003; 110:295–8.
- Sanchez Romano J, Marcin N, Josefsen TD, Nymo IH, Sørensen KK, Tryland M. Severe transmissible eye infection in reindeer: bacterium or virus? 64th Annual International Conference of the Wildlife Disease Association, Queensland; 2015; p. 26–30 (abstract 45, page 13).
- Skjenneberg S, Slagsvold L. Reindriften og dens naturgrunnlag. Oslo: Universitetsforlaget; 1968.
- Tryland M, Stubsjøen SM, Еgren E, Johansen B, Kielland C. Herding conditions related to infectious keratoconjunctivitis (IKC) in semi-domesticated reindeer (Rangifer t. tarandus) in Norway and Sweden — a questionnairebased survey among reindeer herders. Acta Vet Scand. 2016; 58:22. doi:10.1186/s13028-016-0203-x.
- Ryeng KA, Arnemo JM, Larsen S. Determination of optimal immobilizing doses of a medetomidine hydrochloride and ketamine hydrochloride combination in captive reindeer. Am J Vet Res. 2001; 62:119–26.
- Ros C, Belak S. Studies of genetic relationships between bovine, caprine, cervine, and rangiferine alphaherpesviruses and improved molecular methods for virus detection and identification. J Clin Microbiol. 1999;37:1247–53.
- Ros C, Belak S. Characterization of the glycoprotein B gene from ruminant alphaherpesviruses. Virus Genes. 2002; 24:99–105.
- Ek-Kommonen C, Pelkonen S, Nettleton PF. Isolation of a herpesvirus serologically related to bovine herpesvirus 1 from a reindeer (Rangifer tarandus). Acta Vet Scand. 1986; 27:299–301.
- Miller JM, van der Maaten MJ. Reproductive tract lesions in heifers after intrauterine inoculation with infectious bovine rhinotracheitis virus. Am J Vet Res. 1984; 45:790–4.
- Wang J, O’Keefe J, Orr D, Loth L, Banks M, Wakeley P, West D, Card R, Ibata G, Van Maanen K, Thoren P, Isaksson M, Kerkhofs P. Validation of a real-time PCR assay for the detection of bovine herpesvirus 1 in bovine semen. J Virol Meth. 2007; 144:103–8.
- Das Neves CG, Roger M, Yoccoz NG, Rimstad E, Tryland M. Evaluation of three commercial bovine ELISA kits for detection of antibodies against alphaherpesviruses in reindeer (Rangifer tarandus tarandus). Acta Vet Scand. 2009; 51:9. doi:10.1186/1751–0147–51–9.
- Das Neves CG, Thiry J, Skjerve E, Yoccoz N, Rimstad E, Thiry E, Tryland M. Alphaherpesvirus infections in semidomesticated reindeer: a crosssectional serological study. Vet Microbiol. 2009; 139:262–9. doi:10.1016/j. vetmic.2009/06.013
- Marin MS, Leunda MR, Verna AE, Moran PE, Odeуn AC, Perez SE. Distribution of bovine herpesvirus type 1 in the nervous system of experimentally infected calves. Vet J. 2016; 209:82–6. doi:10.1016/j. tvjl.2015.10.034.
- Gould S, Dewell R, Tofflemire K, Whitley RD, Millman ST, Opriessnig T, Rosenbusch R, Trujillo J, O`Connor AM. Randomized blinded challenge study to assess association between Moraxella bovoculi and Infectious Bovine Keratoconjunctivitis in dairy calves. Vet Microbiol. 2013; 164(1–2):108–15. doi:10.1016/j.vetmic.2013.01.038.
- Jayappa HG, Lehr C. Pathogenicity and immunogenicity of piliated and nonpili-ated phases of Moraxella bovis in calves. Am J Vet Res. 1986; 47:2217–21.
- Rogers DG, Cheville NF, Pugh GW Jr. Pathogenesis of corneal lesions caused by Moraxella bovis in gnotobiotic calves. Vet Pathol. 1987; 24:287–95.
- Loy JD, Brodersen BW. Moraxella spp. isolated from field outbreaks of infectious keratoconjunctivitis: a retrospective study of case submissions from to 2013. J Vet Diagn Invest. 2010; 2014(26):761–8. doi:10.1177/1040638714551403.
- Angelos JA, Ball LM, Hess JF. Identification and characterization of complete RTX operons in Moraxella bovoculi and Moraxella ovis. Vet Microbiol. 2007; 125:73–9.
- Calcutt MJ, Foecking MF, Martin NT, Mhlanga-Mutangadura T, Reilly TJ. Draft genome sequence of Moraxella bovoculi strain 237T (ATCC BAA-1259T) isolated from a calf with infectious bovine keratoconjunctivitis. Genome Announc. 2014; 2:e00612–4. doi:10.1128/genomeA.00612–14.
- Dickey AM, Loy JD, Bono JL, Smith TPL, Apley MD, Lubbers BV, DeDonder KD, Capik SF, Larson RL, White BJ, Blom J, Chitko-McKown CG, Clawson ML. Large genomic differences between Moraxella bovoculi isolates acquired from the eyes of cattle with infectious bovine keratoconjunctivitis versus the deep nasopharynx of asymptomatic cattle. Vet Res. 2016; 47:31. doi:10.1186/s13567–016–0316–2.
- Das Neves CG, Mørk T, Godfroid J, Sørensen KK, Breines E, Hareide E, Thiry J, Rimstad E, Thiry E, Tryland M. Experimental infection of reindeer with cervid herpesvirus 2. Clin Vaccine Immunol. 2009; 16:1758–65. doi:10.1128/CVI.00218–09.
- Das Neves CG, Mørk T, Thiry J, Godfroid J, Rimstad E, Thiry E, Tryland M. Cervid herpesvirus 2 experimentally reactivated in reindeer can produce generalized viremia and abortion. Virus Res. 2009; 145:321–8. doi:10.1016/j.virusres.2009.08.002.
- O’Connor AM, Shen HG, Wang C, Opriesnig T. Descriptive epidemiology of Moraxella bovis, Moraxella bovoculi and Moraxella ovis in beef calves with naturally occuring infectious bovine keratoconjunctivitis (pinkeye). Vet Microbiol. 2012; 155:374–80.
Источник: Acta Veterinaria Scandinavica (2017) 59:23. Обоснование перевода: This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/
Реферативная версия опубликована в СВМ №2/2019




