Hakhyun Kim, Ji-Houn Kang*, Byeong-Teck Kang, Mhan-Pyo Yang
Veterinary Medical Center and College of Veterinary Medicine, Chungbuk National University, Cheongju, Chungbuk, Republic of Korea
* Corresponding author: jhkang@chungbuk.ac.kr
Ключевые слова: псовые, глюкагон, гипогликемия, инсулиноподобный фактор роста-2, паранеопластический синдром.
От редактора: NICTH — Non-Islet-Cell Tumor Hypoglycemia (гипогликемия, вызванная опухолями, не связанными с островками Лангерганса, или гипогликемия, вызванная не β-клеточными опухолями, или неостровковоклеточная опухолевая гипогликемия); ИФР-2 — инсулиноподобный фактор роста-2 (англ. — IGF-2).
Биохимическим определением гипогликемии является понижение концентрации глюкозы крови до < 3,30 ммоль/л [14], однако клинические признаки часто не возникают, пока глюкоза крови не опустится до < 2,75 ммоль/л. Гипогликемия у собак может быть следствием различных заболеваний, но наиболее частой причиной серьёзной гипогликемии, вызванной опухолью, считается инсулинома. Однако серьёзная гипогликемия у взрослых собак также может быть вызвана опухолями, не относящимися к островкам Лангерганса, а выделяющими гормоны эктопически [17]. Гипогликемия — это довольно часто встречающаяся проблема в ветеринарной практике (13); и острая гипогликемия может являться причиной угрожающих жизни неврологических проблем и сердечно-сосудистого коллапса [17], а также является медицинским экстренным случаем [13]. Для устранения этих клинических признаков необходима срочная медицинская помощь с незамедлительной корректировкой гипогликемии.
Для выявления гипогликемии используется триада Уиппла, включающая клинические признаки, совместимые с гипогликемией, низкую концентрацию глюкозы крови и улучшение клинических признаков после корректировки гипогликемии [17]. Для устранения клинических признаков гипогликемии важны как быстрое симптоматическое лечение, так и лечение, фокусирующееся на причине гипогликемии [13]. В ветеринарной медицине первичное симптоматическое лечение гипогликемии обычно состоит из внутривенного введения раствора декстрозы, глюкагона и/или глюкокортикоидов [17, 18, 7]. Однако доступно мало информации об эффективности симптоматического лечения собак с гипогликемией, вызванной опухолями, не связанными с островками Лангерганса (NICTH), сведения о которых время от времени появляются в ветеринарной литературе. Главным методом лечения NICTH в медицине человека является хирургическое удаление, при его возможности [4], однако описания подобных процедур отсутствуют в ветеринарной литературе. Ранее отчёты описывали плохой прогноз развития заболевания, однако редкость данного заболевания у собак означает то, что сделать окончательные заключения трудно [3, 24, 20]. Таким образом, целью данной статьи было описать клиническое течение и успешное лечение NICTH у двух собак.
Разбор клинических случаев
Клинический случай 1
14-летняя некастрированная сука, метис, весом 8,5 кг, была представлена для дальнейшего обследования по причине вялости и опухоли печени, обнаруженной лечащим ветеринаром. У собаки в истории болезни в течение недели время от времени наблюдалась вялость и подавленное психическое состояние. Владелец отметил, что до появления этих клинических признаков собака была абсолютно здорова. В истории болезни не было отметок о доступе собаки к гипогликемическим препаратам или токсинам, таким как ксилитол.
Во время клинического осмотра у собаки с опухолью отмечались вялость, расширение брюшной полости, тетрапарез и изменение психического состояния, однако никаких других неврологических признаков выявлено не было. Частота сердцебиения, частота дыхания, ректальная температура и систолическое давление крови были в норме. В процессе аускультации не выявили сердечных шумов или адвентициальных дыхательных шумов. Слизистые оболочки были розового цвета, а скорость наполнения капилляров была менее 1 сек. В брюшной полости пальпировалось небольшое и неболезненное новообразование. Перед проведением дальнейших диагностических тестов провели измерение глюкозы крови с помощью портативного глюкометра (AlphaTrak®2, Zoetis Inc., NJ, UsA), который показал концентрацию глюкозы крови менее определяемого уровня (менее 0,83 ммоль/л). Таким образом, у собаки диагностировали гипогликемический кризис и незамедлительно болюсно ввели 0,5 г/кг 50%-й декстрозы, разбавленной в соотношении 1:1 физиологическим раствором, а затем 5%-й раствор декстрозы вводили внутривенно капельно. После этого из-за продолжающейся у собаки гипогликемии и вялости внутривенно ввели 50 нг/кг глюкагона (Garcon inj., Dalim BioTeck Inc, seoul, Republic of Korea). После этого концентрация глюкозы крови временно повысилась до 16,68 ммоль/л, и собака стала более активной, но спустя 3 часа концентрация глюкозы крови снова вернулась к уровню, неизмеримому с помощью портативного глюкометра.
Одновременно с симптоматическим лечением проводили и диагностические тесты, чтобы выявить причину гипогликемии. Изначально на основании диагноза опухоли печени у собаки подозревали нарушение функции печени и печёночную недостаточность из-за массивной инфильтрации её опухолью, однако позже от этой гипотезы отказались, так как концентрация желчных кислот в сыворотке крови находилась в пределах нормы и не было выявлено нарушений свёртываемости крови. К нарушениям показателей биохимии крови относились повышенная активность аланинаминотрансферазы (552 МЕ/л, эталонный интервал 21–102 МЕ/л) и активность щелочной фосфатазы (297 МЕ/л, референтный интервал 29–97 МЕ/л). При проведении гематологического анализа, измерении концентрации электролитов и базального кортизола патологических изменений выявлено не было, что указывало на малую вероятность того, что сепсис или гипоадренокортицизм были причинами гипогликемии у собаки. Кроме этого, результаты анализа мочи были в пределах нормы, а тест SNAP cPL (IDEXX Reference laboratory Inc., Seongnamsi, Republic of Korea) дал отрицательный результат. Вместе с пониженным содержанием глюкозы в крови (1,32 ммоль/л, эталонный диапазон 3,58–6,49 ммоль/л) было выявлено пониженное содержание инсулина в сыворотке крови (< 1,44 пмоль/л; эталонный диапазон 14,35–150,68 пмоль/л), таким образом, исключая вероятность инсулиномы. Рентгенографическое исследование брюшной полости выявило присутствие яйцевидного новообразования в верхней части брюшной полости, а ультразвуковое исследование выявило одиночное гипоэхогенное новообразование на печени, диаметром 29 мм с аморфными краями (рис. 1А).
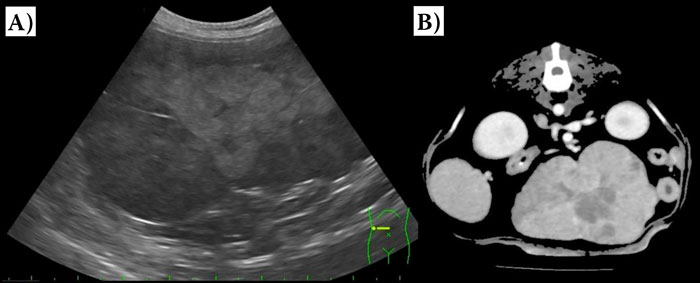 |
| Рис. 1. УЗИ печени в сагиттальной проекции, показывающее одиночное новообразование печени диаметром 29 мм с аморфными границами (А) и соответствующее пост-контрастное КТ изображение (В) клинического случая 1 |
Во время диагностических процедур и лечения гипогликемии у собаки с опухолью печени концентрация глюкозы крови варьировалась от < 0,83 до 2,53 ммоль/л, что сопровождалось изменением психического статуса и тетрапарезом. Таким образом, концентрацию декстрозы в капельнице увеличили до 10% и внутривенно каждые 12 часов вводили дексаметазон (натрия фосфат) (Dexamethasone inj., Je Il Pharm Co, Daegu, Republic of Korea) в дозе 0,1 мг/кг каждые 12 часов. После этого произошло улучшение клинических признаков, но гипогликемия держалась весь день (глюкоза крови 1,43–2,97 ммоль/л).
На следующее утро у собаки всё ещё отмечалось пониженное содержание глюкозы в крови, однако отсутствовали клинические признаки гипогликемии. Тем не менее при снижении концентрации или скорости внутривенного вливания декстрозы снова возникала вялость; также не удалось выявить других патологий, кроме опухоли печени, которые могли бы вызвать гипогликемию. Таким образом, у собаки подозревали паранеопластический синдром, вызванный опухолью печени, и провели компьютерную томографию (КТ) для определения возможности её хирургического удаления. Сканирование с помощью КТ выявило одиночную опухоль у собаки, расположенную в правой срединной доле печени (рис. 1В), и отсутствие метастазов. Впоследствии с согласия владельца была проведена диагностическая лапаротомия. Перед операцией собаке болюсно внутривенно ввели
50 нг/кг глюкагона для предотвращения дальнейшего снижения концентрации глюкозы крови. Одиночную опухоль удалили с помощью лобэктомии правой срединной печёночной доли (рис. 2А); метастатических образований на соседних органах обнаружено не было. Вскоре после лобэктомии концентрация глюкозы крови нормализовалась без внутривенного введения декстрозы, глюкагона или дексаметазона.
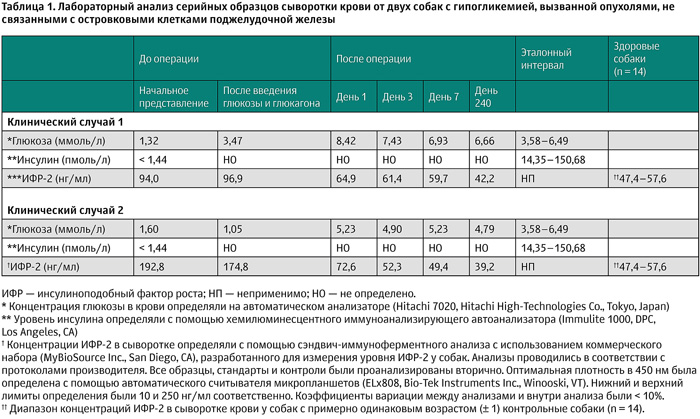
По результатам гистопатологического исследования был поставлен диагноз гепатоцеллюлярной аденомы (рис. 2В). Также проводили измерения концентрации инсулиноподобного фактора роста-2 (ИФР-2) в сыворотке крови с помощью иммуноферментного анализа, который показал повышение концентрации ИФР-2 в сыворотке крови по сравнению со здоровыми собаками (таблица 1), но концентрация ИФР-2 постепенно снизилась после удаления опухоли. На основании данных результатов собаке был поставлен диагноз NICTH как следствие гепатоцеллюлярной аденомы. Пять дней спустя концентрация глюкозы в крови была всё ещё в пределах нормы, собака не демонстрировала клинических признаков и поэтому была выписана. Собака оставалась живой без признаков гипогликемии 24 месяца спустя.
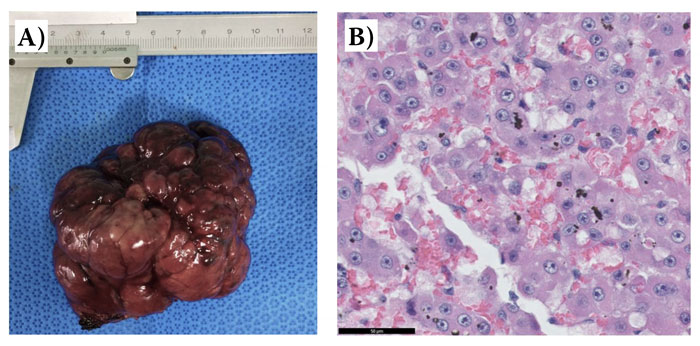 |
| Рис. 2. Фотография удалённой правой срединной печёночной доли, содержащей новообразование (А), и гистологические срезы новообразования (В) случая 1. Гистопатологическое исследование выявило, что новообразование не имело капсулы, отличалось экспансивным ростом и представляло собой обильное скопление полигональных неопластических клеток, собранных в группы по 2–5 клеток, с нерегулярными синусоидными капиллярами и трабекулами толщиной в 2–8 клеток. Неопластические клетки содержали обильное количество эозинофильной цитоплазмы и цитоплазматических вакуолей. Ядра были круглыми с грубым хроматином и 1–2 отчётливо выраженными ядрышками. Также были заметны анизоцитоз и анизокариоз небольшой степени. Присутствовали множественные участки кровоизлияния и воспаления. Гематоксилин и эозин, мерная полоска = 50 мкм |
Клинический случай 2
13-летняя некастрированная сука породы ши-тцу, весом 4,5 кг, была направлена в специализированную ветеринарную больницу из-за коллапса. В истории болезни собаки отсутствовали отметки о болезнях, за исключением операции по удалению опухоли левой каудальной молочной железы за год до направления в больницу. Владелец отметил, что у собаки два месяца назад появились подкожные образования в левой паховой области. За день до направления в больницу отметили один эпизод, походивший на эпилептический припадок.
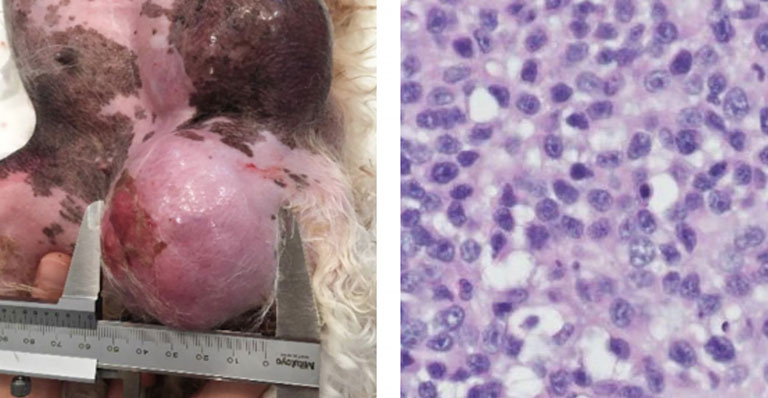
Во время клинического осмотра у собаки отметили вялость и изменение психического состояния. Жизненно важные показатели были в норме, а слизистые оболочки имели бледно-розовый цвет и нормальную скорость наполнения капилляров (< 2 сек.). Не было выявлено сердечного шума или адвентициальных дыхательных шумов, а краткий неврологический осмотр не выявил нарушений. В левой паховой области были выявлены два твёрдых подкожных новообразования (рис. 3А), размерами 5,6 × 5,8 см и 6,7 × 5,0 см. Не выявили увеличения лимфатических узлов.
Во время клинического осмотра у собаки появились генерализованные тонико-клонические судороги, и поэтому ей немедленно внутривенно ввели диазепам 0,5 мг/кг (Diazepam inj., Myungin Pharm., Seoul, Republic of Korea). Во время проведения противосудорожной терапии выявили пониженную концентрацию глюкозы в крови (1,16 ммоль/л) с помощью портативного глюкометра (AlphaTrak®2, Zoetis Inc., NJ, USA). Поэтому было проведено болюсное введение 0,5 г/кг 50%-й декстрозы, разбавленной физиологическим раствором в соотношении 1:1, после чего собаку поместили на капельницу с 5%-м раствором декстрозы. После этого судороги прекратились, но концентрация глюкозы в крови оставалась низкой (2,09 ммоль/л). Сепсис посчитали маловероятной причиной гипогликемии у собаки, потому что лихорадка или гипотермия не были обнаружены и другие жизненно важные параметры были в норме. Однако была выявлена нейтрофилия (37 800/мкл; эталонный диапазон 5050–16 760/мкл) со смещением влево и небольшими токсическими изменениями нейтрофилов и моноцитоз (1830/мкл; эталонный интервал 160–1120/мкл), поэтому начали профилактическую терапию цефотаксимом в дозе 30 мг/кг внутривенно (Cefotaxime inj., Dong-A ST, Seoul, Republic of Korea). Гематологический анализ крови также выявил лёгкую нормоцитарную нормохромную анемию (гематокрит 31,2%; эталонный интервал 37,3–61,7%), а биохимический анализ крови выявил повышение активности щелочной фосфатазы (358 МЕ/л; эталонный интервал 29–97 МЕ/л). Концентрация электролитов и базального кортизола, как и анализ мочи, были в норме, поэтому гипоадренокортицизм посчитали наименее вероятной причиной гипогликемии. Низкая концентрация инсулина в сыворотке крови (< 1,44 пмоль/л; эталонный интервал 14,35–150,68 пмоль/л) и низкая концентрация глюкозы крови (1,60 ммоль/л; эталонный интервал 3,58–6,49 ммоль/л) исключали вероятность инсулиномы. Не было выявлено патологий на рентгенографических снимках грудной и брюшной полостей, как и на ультразвуковом исследовании брюшной полости. Во время диагностических процедур из-за постоянной гипогликемии собаке капельно вводили раствор глюкагона в 5%-м растворе декстрозы со скоростью 10 нг/кг/мин, и дозу постепенно увеличивали до 50 нг/кг/мин (вместе с частыми измерениями концентрации глюкозы крови). Тем не менее концентрация глюкозы оставалась низкой, варьируясь от < 0,83 дo 1,16 ммоль/л, несмотря на введение раствора глюкагона с максимальной скоростью (50 нг/кг/мин), описанной в литературе [7]. Хотя это лечение помогло уменьшить проявления клинических признаков, связанных с гипогликемией, сама гипогликемия сохранялась; таким образом, необходимо было проводить лечение самой причины гипогликемии. Диагностические процедуры не выявили другой возможной причины гипогликемии, кроме быстро растущих опухолей в паховой области. Таким образом, поскольку подозревали связь NICTH с паховыми опухолями, для лечения гипогликемии было рекомендовано удаление опухолей, но владелец отклонил операцию.
Три дня спустя собаку вновь госпитализировали после коллапса и неспособности прийти в себя после судорог. Содержание глюкозы в крови было ниже предела её обнаружения на портативном глюкометре (< 0,83 ммоль/л). Было введено болюсно 0,5 г/кг 50%-й декстрозы с последующим капельным введением 5%-го раствора декстрозы. Время от времени у собаки всё ещё возникали судороги, поэтому внутривенно были введены диазепам, фенобарбитал (Phenotal Inj., Daehan New Pharm Co., Ltd., Hwasung-si, Republic of Korea) и маннитол (Mannitol inj., JW Pharmaceutical, Seoul, Republic of Korea). Однако концентрация глюкозы в крови оставалась низкой (< 0,83–1,54 ммоль/л); поэтому внутривенно болюсно ввели раствор глюкагона (50 нг/кг) и затем глюкагон вводили с помощью капельницы со скоростью 50 нг/кг/мин. Психическое состояние собаки постепенно улучшилось, но продолжались периодические тонико-клонические судороги, которые лечили с помощью внутривенного введения диазепама. Скорость введения глюкагона была постепенно увеличена до 5 мкг/кг/мин, что в 100 раз выше ранее описанной максимальной скорости [7], после чего не было отмечено судорог, хотя концентрация глюкозы крови оставалось пониженной.
Нами был сделан вывод, что для лечения гипогликемии собаке было необходимо удалить паховые опухоли. Перед операцией была проведена тонкоигольная аспирационная биопсия паховых опухолей, которая выявила множественные кластеры эпителиальных клеток, содержащих небольшое количество цитоплазмы и большие круглые ядра с грубым хроматином. На основании расположения и злокачественных характеристик подозревали карциному молочной железы. Поэтому были проведены полная мастэктомия и овариогистерэктомия. Сразу после операции концентрация глюкозы крови собаки постепенно увеличилась, даже после прекращения капельного введения глюкагона. Гипергликемия (11,99 ммоль/л) была выявлена спустя 5 часов после операции, но в то время капельное введение декстрозы было также прекращено.
К следующему дню концентрация глюкозы в крови собаки была в пределах нормы, и к собаке вернулась нормальная активность, поэтому она была выписана по желанию владельца. Гистопатологическое исследование удалённой опухоли собаки выявило сложный тип карциномы молочной железы промежуточной степени (степень II) злокачественности (рис. 3B). Иммуноферментный анализ выявил высокую концентрацию ИФР-2 в сыворотке крови, выше, чем у здоровых собак, которая постепенно снижалась после операции. Данные результаты соответствовали диагнозу NICTH вследствие карциномы молочной железы. Собака оставалась живой без повторного возникновения опухолей или гипогликемии 24 месяца спустя.
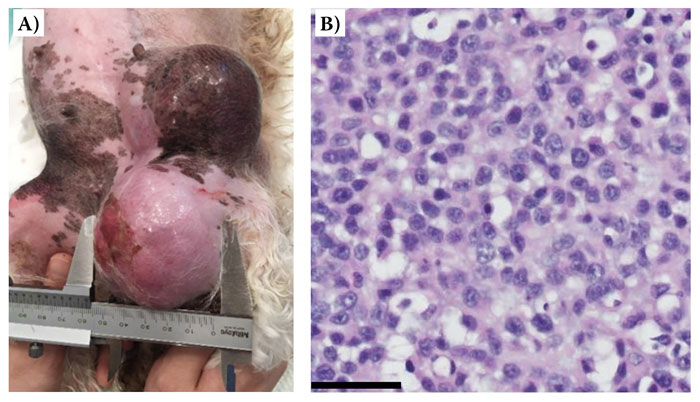 |
| Рис. 3. Макроскопический вид опухолей молочной железы (A) и гистологический срез опухоли (B) из клинического случая 2. Гистопатологическое исследование выявило, что опухоли внедрялись в ткани, имели множественные узелки, состояли из плотно упакованных плеоморфных клеток, организованных в пакеты с редкими одиночными железистыми структурами. Клетки опухоли имели средне-эозинофильную цитоплазму и круглые до овальных ядра. Их ядра имели мелкий или грубый хроматин и 1–2 больших ярко выраженных ядрышка. Был заметен небольшой анизоцитоз и анизокариоз. Присутствовали мультифокальные области неопластической миоэпителиальной дифференциации и множественные области некроза. Гематоксилин и зозин, мерная полоска = 50 мкм |
Обсуждение и выводы
Данный отчёт описывает случаи гипогликемии, вызванной опухолями, не связанными с островковыми клетками поджелудочной железы (NICTH) у двух собак. После симптоматического лечения введением растворов глюкагона и декстрозы, которые считались начальными методами лечения гипогликемического кризиса, в данных клинических случаях не произошло улучшения состояния пациентов. После хирургического удаления опухолей концентрация глюкозы в крови животных резко нормализовались и повторного возникновения гипогликемии у собак не наблюдали в течение двух лет, что наводит на мысль о том, что NICTH собак поддаётся окончательному лечению с помощью хирургического удаления опухоли. NICTH является паранеопластическим синдромом, вызывающим у собак серьёзную гипогликемию [24], однако в ветеринарной литературе не хватало информации об оптимальном лечении NICTH, несмотря на связанный с ним плохой прогноз. Клинические случаи, описанные здесь, в первую очередь дают информацию о том, что быстрое хирургическое удаление опухоли в качестве окончательного лечения вероятно улучшит шансы на успешный исход заболевания у собак с NICTH. Главным методом лечения NICTH в медицине человека является хирургическое удаление [9], однако доказательства успешности подобного лечения редки в ветеринарной литературе. Несмотря на лечение декстрозой и глюкагоном, собаки продолжали страдать от гипогликемии, что контрастирует с ситуацией, описанной в человеческой медицине, когда внутривенные введения растворов декстрозы достаточны для предотвращения последующей гипогликемии [9]. Однако, как описано в первом клиническом случае, концентрация глюкозы в крови оставалась пониженной 3 часа спустя после однократного внутривенного введения глюкагона в дозе 50 нг/кг, что является максимальной дозой, необходимой для нормализации гипогликемии в предыдущем исследовании [7]. Вероятно, трёхчасовая продолжительность действия глюкагона была недостаточной для улучшения ситуации с гипогликемий. Кроме этого, постоянное капельное введение 5%-го раствора декстрозы также было недостаточным для лечения NICTH у собак.
Глюкагон был рекомендован для лечения гипогликемии у людей [9], но в ветеринарной литературе имеется только один отчёт о клиническом случае и одно ретроспективное исследование, опубликованное о собаках с гипогликемией [12, 7]. Максимальная скорость введения глюкагона в 50 нг/кг/мин может быть достаточной, так как глюкагон является наиболее важным стимулятором печёночного производства глюкозы во время гипогликемии, вызванной инсулином [19].
Также на основании фармакологических данных рекомендуется введение глюкагона в виде капельницы вместо регулярных инъекций [23]. Тем не менее, как описано в клиническом случае 2, рекомендованная доза для капельного введения глюкагона была недостаточной для нормализации гипогликемии. Это можно объяснить специфическими особенностями описанного клинического случая: ранее описанная капельница может быть более подходящей для собак с гипогликемией и повышенной концентрацией инсулина [7]. Кроме того, у людей с NICTH концентрация глюкагона в крови часто пребывает в пределах нормы, возможно, потому, что гипогликемия частично вызвана тормозящим влиянием ИФР-2 на действие глюкагона [8]. Таким образом, скорость введения глюкагона в 50 нг/кг/мин, ранее описанная в ветеринарной литературе [7], может быть недостаточной для лечения собаки с NICTH, если гипогликемия вызвана тормозящим влиянием ИФР-2 на действие глюкагона. В подобной ситуации для успешного исхода заболевания необходимо немедленное хирургическое удаление, а не медикаментозное лечение.
В некоторых странах внутривенные введения глюкагона недоступны. Вместо этого используются растворы глюкозы различных концентраций. Также не всегда проверяется концентрация инсулина в сыворотке крови у собак с гипогликемией, и диагноз NICTH, возможно, не будет сразу доступным в общей практике. Таким образом, для улучшения клинического состояния пациента, уменьшения клинических признаков, связанных с гипогликемией, и стабилизации пациента перед наркозом может быть начато медикаментозное лечение до хирургического удаления опухоли. В зависимости от уровня глюкозы в крови глюкозу можно вводить внутривенно в форме декстрозы или в виде растворов различных концентраций [13]. Однако это может быть контрпродуктивным, так как повышение концентрации глюкозы вызывает гиперинсулинемию, обусловленную нормальным гомеостатическим механизмом у собак с инсулиномой или NICTH [13]. Это может вызвать ответную гипогликемию. Кроме этого, введение только глюкозы может быть недостаточным для собак с NICTH, как описано в данных клинических случаях. Можно применять диазоксид и аналоги соматостатина, такие как октреотид, но лечение диазоксидом может быть неэффективным в случаях NICTH с нормальной или пониженной концентрацией инсулина в крови [11]. Кроме этого, использование октреотида, предназначенного для использования в человеческой медицине, может усугубить клинические признаки из-за подавления синтеза гормона роста [11]. В человеческой медицине для противодействия инсулиноподобным эффектам предлагают применять глюкокортикоиды и гормоны роста [5]. В первом случае введение 10%-го капельного раствора декстрозы и дексаметазона (0,1 мг/кг каждые 12 часов) улучшили клинические признаки, но гипогликемия оставалась.
Для увеличения концентрации глюкозы в крови у собак с NICTH, лечение которых уже включает введение глюкокортикоидов и глюкозы, возможно введение гормона роста. Однако одновременное введение глюкокортикоидов и гормона роста не было исследовано в ветеринарной медицине. Таким образом, в качестве экстренного лечения перед хирургическим удалением опухоли у собак можно с осторожностью применять медленное введение глюкозы (для предотвращения ответной гипогликемии) вместе с глюкокортикоидами. Однако необходимы дополнительные исследования для выяснения ценности и безопасности подобного медикаментозного подхода к лечению.
NICTH была описана у собак с различными опухолями [2, 3, 1, 22, 24, 20], но только в трёх случаях NICTH, относящаяся к ИФР-2, была описана в ветеринарной литературе [3, 24, 20]. Кроме того, NICTH, связанная с гепатоцеллюлярной аденомой и высокими концентрациями ИФР-2, как описано в первом клиническом случае, не была описана у собак. ИФР-2 это одноцепочечный белок весом 7,4 кДа, который преимущественно синтезируется гепатоцитами [24, 12]. Структурные и функциональные схожести ИФР-2 с инсулином предполагают, что ИФР-2 может вызвать гипогликемию путём связывания с инсулиновыми рецепторами [11]. В исследовании на людях, целью которого было отличить злокачественные патологии печени от доброкачественных, все гепатоцеллюлярные аденомы демонстрировали цитоплазматическую экспрессию ИФР-2 с сильным иммуногистохимическим окрашиванием, которое наблюдали в 70% данных опухолей [15]. Механизм, ответственный за повышенный синтез ИФР-2 в случаях NICTH, не был хорошо описан, однако у человека с метастатической гемангиоперицитомой были выявлены аллели, содержащие 19-нуклеотидную делецию в экзоне 9 последовательности ИФР-2, а также отличия в использовании промоторов для ИФР-2, что говорит о возможности того, что повышение синтеза ИФР-2 может быть связано с потерей импринтинга гена ИФР-2 и использованием другого промотора [16]. Таким образом, NICTH может быть результатом повышенной продукции ИФР-2, связанной с активацией промоторов плода и потерей импринтинга при гепатоцеллюлярной аденоме, но дальнейшие исследования необходимы для подтверждения этого механизма и определения широты его распространения.
NICTH также была описана у собак с карциномой молочных желёз [Rossbodnari et al. 2010]. Но, хотя большинство ИФР-2 продуцируется гепатоцитами, он может синтезироваться несколькими типами клеток, включая фибробласты и эпителиальные клетки [11]. Действительно, экспрессия ИФР-2 ранее демонстрировалась в эпителиальных клетках карциномы молочных желёз у собак [20]. Обратное взаимоотношение между ИФР-2 сыворотки крови и концентрацией глюкозы в крови, наблюдаемое во втором случае, подводит к мысли о том, что NICTH могло быть результатом повышенной продукции ИФР-2 клетками карциномы молочной железы собаки.
У второго клинического случая были выявлены быстро растущие опухоли молочных желёз, которые могли быть результатом аутокринных и паракринных эффектов ИФР-2, стимулирующих клеточный рост и независимых от эффектов соматостатина [24]. В медицине человека присутствует мнение, что подобные опухоли должны достичь достаточно большого размера до развития гипогликемии [10]. В описанном здесь клиническом случае концентрация глюкозы в крови нормализовалась вскоре после операции, однако уровень циркулирующего ИФР-2 снижался постепенно, что свидетельствует о том, что для появления гипогликемии у собак с NICTH была необходима высокая концентрация ИФР-2 либо какой-либо другой фактор. Таким образом, механизм NICTH у собак может включать эффекты ИФР-2, утилизацию глюкозы клетками самой опухоли или оба этих фактора [3, 24]. Опухоли неостровковых клеток могут вызывать гипогликемию с помощью использования большого количества глюкозы ими самими, особенно в случаях больших опухолей [20], возможно, вовлекая в процесс повышение регуляции гексокиназ и переносчиков глюкозы, как это описано у онкологических больных в человеческой медицине [21].
Также возможно, что иммуноферментный анализ выявил только третичные комплексы ИФР-2 весом 150 кДа, из-за того, что они имеют более долгий период полураспада (12–16 часов), по сравнению с бинарными комплексами весом 50 кДа (20–30 минут) и свободными молекулами ИФР-2 (10–12 мин) [10]. Обычно около 80% ИФР-2 существует в виде третичных комплексов в 150 кДа с белком-3 (белок-ингибитор инсулиноподобного фактора роста, IGF-BP3), однако бинарные комплексы в 50 кДа являются главными циркулирующими комплексами при NICTH собак [3]. Кроме того, только свободные и бинарные комплексы ИФР-2 могут проникать сквозь стенку капилляров и вызывать гипогликемический эффект; таким образом, в будущем будет необходимо дифференцировать концентрации свободного и комплексного ИФР-2 для объяснения роли ИФР-2 в патофизиологии NICTH собак, и недостаток подобной информации является недостатком данного отчёта.
NICTH является редкой причиной гипогликемии у собак, и у большинства собак с не β-клеточными опухолями гипогликемия обычно не развивается. В медицине человека методические рекомендации Эндокринологического общества рекомендуют проведение полного комплексного исследования пациентов с характеристиками NICTH, такими как присутствие известного злокачественного образования или обнаружение нового большого новообразования [6]. Тем не менее доброкачественные опухоли также могут вызывать NICTH, что доказано аденомой печени в первом клиническом случае. Таким образом, ветеринарный врач должен знать, что быстро растущие опухоли, вне зависимости от того, доброкачественные ли они или злокачественные, могут вызывать гипогликемию у собак.
В заключение, описанные случаи демонстрируют, что у собак возможно успешное лечение NICTH. Хотя ранее были опубликованы несколько отчётов о NICTH собак, описанные случаи имели плохой прогноз [2, 3, 1, 22, 24, 20]. В данном отчёте некоторые клинические признаки улучшились после симптоматического лечения декстрозой и введения глюкагона, но биохимическая гипогликемия не нормализовалась после этого лечения. Кроме того, после прекращения этого лечения клинические признаки, вызванные гипогликемией, возобновились, что указывает на то, что одно лишь симптоматическое лечение может быть недостаточным для собак с NICTH, и успешное лечение NICTH может быть невозможно без хирургического удаления опухолей. Данное утверждение подкрепляется тем фактом, что обе собаки, описанные в данном отчёте, оставались живыми без возобновления гипогликемии в течение 24 месяцев после удаления опухолей. Таким образом, мы утверждаем, что быстрый диагноз NICTH необходим для собак с гипогликемией с быстро растущими опухолями и что хирургическое удаление опухолей может увеличить шансы на выживание у собак с NICTH.
Благодарности. Авторы хотели бы поблагодарить владельцев собак, включённых в данный отчёт.
Литература
- Battaglia L, Petterino C, Zappulli V, Castagnaro M (2005): Hypoglycaemia as a paraneoplastic syndrome associated with renal adenocarcinoma in a dog. Veterinary Research Communications 29, 671–675.
- Beaudry D, Knapp DW, Montgomery T, Sandusky GS, Morrison WB, Nelson RW (1995): Hypoglycemia in four dogs with smooth muscle tumors. Journal of Veterinary Internal Medicine 9, 415–418.
- Boari A, Barreca A, Bestetti GE, Minuto F, Venturoli M (1995): Hypoglycemia in a dog with a leiomyoma of the gastric wall producing an insulin-like growth factor II-like peptide. European Journal of Endocrinology 132, 744–750.
- Bodnar TW, Acevedo MJ, Pietropaolo M (2014): Management of Non-Islet-Cell Tumor Hypoglycemia: A Clinical Review. The Journal of Clinical Endocrinology and Metabolism 99, 713–722.
- Bourcigaux N, Arnault-Ouary G, Christol R, Perin L, Charbonnel B, Le Bouc Y (2005): Treatment of hypoglycemia using combined glucocorticoid and recombinant human growth hormone in a patient with a metastatic non-islet cell tumor hypoglycaemia. Clinical Therapeutics 27, 246–251.
- Cryer PE, Axelrod L, Grossman AB, Heller SR, Montori VM, Seaquist ER, Service FJ, Endocrine Society (2009): Evaluation and management of adult hypoglycemic disorders: an Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology and Metabolism 94, 709–728.
- Datte K, Guillaumin J, Barrett S, Monnig A, Cooper E (2016): Retrospective evaluation of the use of glucagon infusion as adjunctive therapy for hypoglycemia in dogs: 9 cases (2005–2014). Journal of Veterinary Emergency and Critical Care (San Antonio, Tex.: 2001) 26, 775–781.
- de Groot JW, Rikhof B, van Doorn J, Bilo HJ, Alleman MA, Honkoop AH, van der Graaf WT (2007): Non-islet cell tumor-induced hypoglycemia: a review of the literature including two new cases. Endocrine-related Cancer 14, 979–993.
- Dutta P, Aggarwal A, Gogate Y, Nahar U, Shah VN, Singla M, Khandelwal N, Bhansali A (2013): Non-islet cell tumor-induced hypoglycemia: a report of five cases and brief review of the literature. Endocrinology, Diabetes & Metabolism Case Reports 2013, 130046.
- Dynkevich Y, Rother KI, Whitford I, Qureshi S, Galiveeti S, Szulc AL, Danoff A, Breen TL, Kaviani N, Shanik MH, Leroith D, Vigneri R, Koch CA, Roth J (2013): Tumors, IGF-2 and hypoglycemia: insights from the clinic, the laboratory and the historical archive. Endocrine Reviews 34, 798–826.
- Finotello R, Ressel L, Arvigo M, Baroni G, Marchetti V, Romanelli G, Burrow R, Mignacca D, Blackwood L (2016): Canine pancreatic islet cell tumours secreting insulin-like growth factor type 2: a rare entity. Veterinary and Comparative Oncology 14, 170–180.
- Fischer JR, Smith SA, Harkin KR (2000): Glucagon constatrate infusion: a novel strategy for the management for the management of hyperinsulinemic–hypolglycemic crisis in the dog. Journal of the American Animal Hospital Association 36, 27–32.
- Idowu O, Heading K (2018): Hypoglycemia in dogs: Causes, management, and diagnosis. The Canadian Veterinary Journal 59, 642–649.
- Koenig A (2015): 66 Hypoglycemia. In: Silverstein DC, Hopper K (eds): Small Animal Critical Care Medicine. 2nd edn. Elsevier, St. Louis. 352–357 p.
- Lai JP, Chen ZM, Lok T, Chan OT, Himmelfarb E, Zhai Q, Lin F, Wang HL (2014): Immunohistochemical stains of proliferating cell nuclear antigen, insulin-like growth factor 2 and clusterin help distinguish malignant from benign liver nodular lesions. Journal of Clinical Pathology 67, 464–469.
- Lawson EA, Zhang X, Crocker JT, Wang WL, Klibanski A (2009): Hypoglycemia from IGF2 overexpression associated with activation of fetal promoters and loss of imprinting in a metastatic hemangiopericytoma. The Journal of Clinical Endocrinology and Metabolism 94, 2226–2231.
- Leifer CE, Peterson ME, Matus RE, Patnaik AK (1985): Hypoglycemia associated with nonislet cell tumor in 13 dogs. Journal of the American Veterinary Medical Association 186, 53–55.
- Loose NL, Rudloff E, Kirby R (2008): Hypoglycemia and its effect on the brain. Journal of Veterinary Emergency and Critical Care (San Antonio, Tex.: 2001) 18, 223–234.
- Rivera N, Ramnanan CJ, An Z, Farmer T, Smith M, Farmer B, Irimia JM, Snead W, Lautz M, Roach PJ, Cherrington AD (2010): Insulin-induced hypoglycemia increases hepatic sensitivity to glucagon in dogs. The Journal of Clinical Investigation 120, 4425–4435.
- Rossi G, Errico G, Perez P, Rossi G, Paltrinieri S (2010): Paraneoplastic hypoglycemia in a diabetic dog with an insulin growth factor-2-producing mammary carcinoma. Veterinary Clinical Pathology 39, 480–484.
- Smith TA (1999): Facilitative glucose transporter expression in human cancer tissue. British Journal of Biomedical Science 56, 285–292.
- Snead EC (2005): A case of bilateral renal lymphosarcoma with secondary polycythaemia and paraneoplastic syndromes of hypoglycaemia and uveitis in an English Springer Spaniel. Veterinary and Comparative Oncology 3, 139–144.
- Zeugswetter FK, Schornsteiner E, Haimel G, Schwendenwein I (2012): Metabolic and hormonal responses to subcutaneous glucagon in healthy beagles. Journal of Veterinary Emergency and Critical Care (San Antonio, Tex.: 2001) 22, 558–563.
- Zini E, Glaus TM, Minuto F, Arvigo M, Hauser B, Reusch CE (2007): Paraneoplastic hypoglycemia due to an insulinlike growth factor type-II secreting hepatocellular carcinoma in a dog. Journal of Veterinary Internal Medicine 21, 193–195.
Источник: Veterinarni Medicina, 64, 2019 (09): 407–416. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (http://creativecommons.org/ licenses/by/2.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
СВМ № 3/2020