Аннотация
Разрыв ахиллова сухожилия — весьма распространённая травма у собак. Для выбора наилучшей хирургической тактики врач должен руководствоваться этиологией, степенью повреждения, наличием или отсутствием потери ткани (укорочения) и временем, прошедшим с момента травмы. Процесс заживления после разрыва ахиллова сухожилия обычно труден и неустойчив. На прогноз влияют обширность травмы, время от момента травмы до начала лечения и слабая васкуляризация сухожилия. Тем не менее быстрое развитие тканевой инженерии и регенеративной медицины может в ближайшее время привести к разработке клеточных каркасов с биологически активными белками, позволяющих достичь полного заживления сухожилия без формирования фиброзной ткани.
Введение
Ахиллово сухожилие (tendo calcaneus communis) — самое мощное и крепкое сухожилие костно-мышечной системы собаки [1]. У собак tendo calcaneus communis происходит из различных мышечно-сухожильных структур, которые соединяются на пятке: сухожилий икроножной мышцы и поверхностного сгибателя пальцев и общего сухожилия двуглавой, тонкой и полусухожильной мышц бедра [1; 5; 12]. Его основная функция — приведение плюсны (участие в ходьбе и беге) и участие в пассивной поддержке скакательного сустава [1].
Повреждения ахиллова сухожилия обычно имеют травматическую природу. В зависимости от травмы тяжесть повреждений может значительно различаться — от растяжений и небольших надрывов до полного разрыва [3; 15]. Природа травмы влияет на тип повреждения сухожилия. Травма может привести к внезапному разрыву сухожилия с частичной или полной потерей целостности структуры, иногда с обнажением концов сухожилия (например, охотничья травма) [3]. Помимо этого, ослабление или повреждение структуры сухожилия может возникнуть вторично при системных заболеваниях (например, при болезни Кушинга) или по ятрогенной причине [15]. Meutstege [1993] предложил классификацию с тремя различными типами нарушений на основании анатомической локализации и тяжести повреждения ахиллова сухожилия: тип 1 — полный разрыв, тип 2 включает три подтипа частичного разрыва с удлинением системы ахиллова сухожилия, а к типу 3 относятся тендинит и перитендинит [14; 5].
Клинические проявления, связанные с нарушением целостности ахиллова сухожилия, могут сильно варьироваться в зависимости от тяжести повреждения, но при полном разрыве всегда отмечаются «плантиградное положение» (опора на всю плюсну) и отёк вокруг места разрыва.
Цель настоящей статьи — проанализировать ветеринарную литературу, посвящённую хирургическому лечению и новым перспективам в хирургии, и представить частный клинический случай полного разрыва ахиллова сухожилия. Для удобства описания хирургическое лечение будет разделено на два раздела: полный разрыв сухожилия без потери ткани и разрыв с выраженной потерей ткани.
Хирургическое лечение
Полный разрыв без потери ткани
Основная задача хирургического лечения разрывов сухожилий у собак заключается в восстановлении адекватной прочности для поддержания веса тела [5]. Задача первоочередной важности у человека — восстановление функции скольжения для ограничения подвижности и использования фаланг — у собаки, наоборот, вторичная цель [5]. Слабая васкуляризация сухожилия требует осторожности во время хирургического вмешательства. Необходимо минимизировать травмирование тканей и избегать чрезмерной послеоперационной весовой нагрузки [5]. Процесс заживления после повреждения сухожилия обычно труден и неустойчив. На прогноз влияют обширность травмы, время от момента травмы до начала лечения и слабая васкуляризация сухожилия. Осложнения при заживлении обычно связаны с:
а) низкой васкуляризацией сухожилия;
б) тенденцией к формированию спаек с окружающими тканями, ограничивающих подвижность;
в) растяжением и активной нагрузкой, которые могут спровоцировать диастаз концов сухожилия;
г) активными и пассивными движениями сухожилия [21].
В предоперационном периоде с целью предотвращения разделения концов необходима иммобилизация [21]. В ходе операции необходимо выделить и сопоставить все отдельные компоненты сложного сухожилия и поочерёдно их сшить. В случае хронического повреждения, однако, концы сухожилия втянуты, а между ними формируется рубцово-фиброзная ткань. По этой причине выделение каждого компонента не всегда возможно. В таких случаях фиброзная часть ахиллова сухожилия расценивается как отдельный компонент [7]. Разрыв сухожилия без потери ткани лечится под общей анестезией в позе лёжа на боку. Висячее натянутое положение конечности облегчает манипуляции в операционной ране [7]. Разрез кожи следует производить параллельно сухожилию, чтобы процесс заживления кожи не осложнил заживление сухожилия. После разреза выделяются, сопоставляются и сшиваются концы сухожилия. Наилучший результат достигается при идеальном сопоставлении концов сухожилия с тенорафией «конец-в-конец» [21]. Предпочтительнее использовать нерассасывающуюся нить, например нейлоновую или полипропиленовую, однако можно использовать также стальную проволоку, полидиоксаноновый или полиглюконатный шовный материал. Рекомендуются нити размером от 3 до 0 (шкала USP), потому что применение большей нити может негативно воздействовать на процесс заживления из-за более выраженной реакции ткани. Помимо этого, шов не должен затруднять кровоснабжение и способствовать диастазу концов сухожилия [7].
Техника наложения сухожильного анастомоза включает различные типы швов: по Баннелу-Майеру, по Мейсону-Аллену, простой прерывистый, простой узловой или модифицированный шов Кесслера, двойной узловой, трёхпетлевой затягивающийся, по Кракову, непрерывный крестообразный или шов по типу «дальше-ближе-ближе-дальше» (far-near-near-far) [5]. Moores и колл. сравнили двойной узловой шов с трёхпетлевым затягивающимся швом при восстановлении ахиллова сухожилия собаки. Результаты исследования показали, что трёхпетлевой затягивающийся шов быстрее накладывается и более устойчив к формированию зазора и нагрузке на растяжение [16].
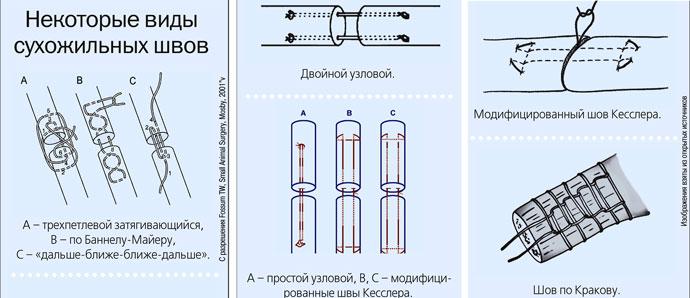 |
| Илл. 1. Некоторые виды сухожильных швов |
В послеоперационном периоде, особенно на ранних стадиях заживления, обязательна иммобилизация конечности. Движение может привести к выраженному расхождению концов сухожилия, уменьшению местного кровотока и увеличению фиброза, что может осложнить выздоровление и негативно повлиять на восстановление функции [3]. Иммобилизация может быть достигнута с помощью аппарата трансартикулярной внешней скелетной фиксации (TESF), установки пяточно-большеберцового винта, а также различных вариантов шин и гипсовых лангет [10; 17]. Иммобилизация на 6 недель способствует восстановлению 50% нормальной прочности сухожилия, но приводит к значительному ослаблению мышц. На самом деле фиксация сустава более чем на 3 недели может привести к варусной или вальгусной деформации. Fahie [2005] предлагает полную послеоперационную иммобилизацию на три недели с последующей трёхнедельной частичной иммобилизацией, что способствует приемлемому восстановлению функции и снижению риска нового повреждения.
Montgomery и Fitch отмечают, что прочность, достигаемая за 6 недель после тенорафии, достаточна для ограниченных упражнений, а через год после тенорафии прочность сухожилия позволяет неограниченную физическую нагрузку [15]. Наконец, Fossum [2004] предложил после 3–6 недель фиксации накладывать на конечность поддерживающий бандаж с мягкими вкладками для предотвращения дорсальной флексии плюсны и ограничить активность (водить собаку на поводке) в течение 10 недель. В недавнем исследовании Nielsen и Pluhar [2006] анализировали выздоровление и долгосрочные результаты после хирургического лечения, сравнивая различные методы большеберцово-плюсневой иммобилизации в группе из 28 собак с частичным (12 собак) и полным (16 собак) разрывом ахиллова сухожилия. В качестве техники иммобилизации использовались TESF (16 собак), пяточно-большеберцовый винт (1 собака), шина или полное гипсование (11 собак). Результаты исследования показали, что значимой разницы во времени выздоровления между TESF и наложением шины нет. Больше того, применение TESF увеличивало продолжительность хирургического вмешательства (116 мин. против 66 мин.) и стоимость в связи с более частыми визитами пациентов в дальнейшем [17]. Это исследование также показало, что собаки, получившие лечение в течение трех недель после травмы, выздоравливали быстрее и с меньшим числом осложнений. Среднее время применения иммобилизации составило 10 недель, тогда как среднее время восстановления до нормальной функции конечности было около 20 недель [17].
Полный разрыв с потерей ткани сухожилия
В ветеринарной литературе имеется несколько публикаций по исследованиям лечения разрыва ахиллова сухожилия, но информация о разрывах со значительной потерей ткани очень скудна. Полный разрыв сухожилия с потерей ткани требует корректной оценки хирурга из-за невозможности сопоставления концов сухожилия и наложения простого шва [15]. Хирургическая техника, предложенная Demirkan и колл. [2004], предполагает использование лоскутов широкой фасции для лечения разрыва ахиллова сухожилия. Исследование было проведено на 20 новозеландских кроликах, распределённых в две группы по 10 особей. В первой группе производилась трансплантация широкой фасции, а во второй кроликов оперировали по стандартной методике. По наблюдениям Demirkan и колл. (2004), широкая фасция значительно способствовала заживлению ахиллова сухожилия, особенно в случае выраженной потери ткани. Более того, даже если большинство лоскутов быстро дегенерировало после имплантации, лоскуты широкой фасции сохранялись более продолжительный период, вызывали меньше спаек и оказались намного более резистентными к бактериальной контаминации.
Лечение полного разрыва пяточного сухожилия с укорочением длины с помощью лоскутов широкой фасции также успешно производилось Shani и Sharar [2000]. Тем не менее в гуманитарной медицинской литературе эта методика не рекомендована в связи с тем, что у пожилых пациентов (как в нашем клиническом случае) приходится жертвовать здоровой тканью, что может привести к ослаблению конечности [2]. Это опасение было также высказано Shani и Sharar [2000]. Swidersky и колл. [2005] сообщили об успешном использовании широкой фасции и полипропиленовой сетки при лечении двустороннего частичного разрыва сухожилия икроножной мышцы у лабрадора-ретривера.
Недавно Maitre и др. [2009] описали клинический случай рецидивирующего разрыва пяточного сухожилия, пролеченного с помощью транспозиции заднего пучка портняжной мышцы в добавление к обычному сухожильному шву.
В 2007 году Gilbert и др. провели клиническое исследование использования гетерогенных имплантатов, взятых из подслизистого слоя тонкой кишки свиньи [8]. В ходе эксперимента 12 сук разных пород средним весом 20 кг были распределены на 6 групп по 2 собаки в каждой и подвергнуты искусственному разрыву ахиллова сухожилия с потерей 1,5 см ткани. Для реконструкции сухожилия с помощью полипропиленовой нити 4-0 были вшиты натуральные имплантаты 2–3 см с нахлёстом на края сухожилия около 2–3 мм [8]. Несмотря на более быструю деградацию, по сравнению с синтетическими материалами, использование имплантатов подслизистой ускоряет выздоровление. На самом деле функция восстановилась почти полностью вскоре после снятия повязки. Более того, содержание изотопа углерода 14С показало отсутствие контаминации других тканей продуктами деградации клеточного каркаса, которые выводились исключительно с мочой. Авторы сделали вывод, что использование имплантатов из подслизистой тонкой кишки свиньи является адекватной и эффективной альтернативой для реконструкции ахиллова сухожилия, потому что оно обеспечивает быстрое выздоровление и устранение привнесённой ткани благодаря хемотаксическим пептидам, которые выделяются при деградации имплантата. Однако в связи с быстрой дегенерацией в первые несколько недель после операции были строго показаны иммобилизация конечности и ограничение физической активности [8].
Полипропиленовая сетка широко используется в хирургии, особенно в восстановительной ортопедии, как синтетический имплантат [18; 11; 2; 22]. Она химически инертна, гипоаллергенна и способна выдержать механическое воздействие. К тому же пористая структура способствует прорастанию фиброзной ткани 22]. В 1991 году Hosey с коллегами продемонстрировали в экспериментальном исследовании на кроликах, что полипропиленовая сетка проявляет очень схожие физические свойства с нормальным ахилловым сухожилием [11]. Более того, они доказали, что этот материал служит основой или мостиком для прорастания коллагеновых пучков [11]. В 1996 году Choskey и др. описали удовлетворительные результаты восстановления запущенного разрыва ахиллова сухожилия у пятерых человек с помощью туннельной техники с сеткой из марлекса [патентованное название полимерных материалов (полиэтилен и полипропилен) — Прим. ред.] [2]. На основании этих сообщений мы обратились к использованию полипропиленовой сетки как метода восстановления сухожилия в следующем клиническом случае.
Клинический случай
12-летняя сука породы английский сеттер была доставлена в ветеринарную клинику с тяжёлой хромотой в связи с травмой, которая случилась за несколько часов до этого на охоте. При осмотре и физикальном исследовании обнаружилась открытая рана в области правой задней конечности. Были вовлечены кожа, подкожная ткань и ахиллово сухожилие, которое было полностью разорвано с выраженной потерей ткани, что привело к хромоте при отсутствии нагрузки. При рентгенологическом исследовании в медиально-латеральной проекции выявлен перелом пяточной кости без смещения отломков и без признаков отрыва сухожилия. Стандартные предоперационные анализы крови были без патологии.
После начала анестезии собака была помещена в позу лёжа на левом боку. Была произведена хирургическая обработка ткани, в ходе которой была удалена некротизированная ткань. Концы сухожилия были выделены из окружающих тканей, края были обработаны, обмыты и упорядочены. Сопоставление концов сухожилия было невозможно ни в физиологическом положении, ни при максимальном растяжении задней конечности, при котором диастаз составил 2 см. Для проведения анатомической ненапряжённой реконструкции использовалась полипропиленовая сетка (Prolene, Ethicon, Сомервилль, США). Сетка была сложена в два слоя и скручена в форме цилиндра длиной 7 см и 1 см в диаметре. Концы сухожилия были помещены внутрь сетки с помощью туннельной методики, в результате чего получился мостик между двумя концами (илл. 2). Синтетической нерассасывающейся мононитью (2-0 нейлон) был наложен прерывистый шов между сеткой и сухожилием с расстоянием между узлами около 3 мм. Процедура была выполнена при поддержании скакательного сустава в умеренном разгибании (угол около 130°). Кожа была ушита с помощью ненатянутого непрерывного шва.
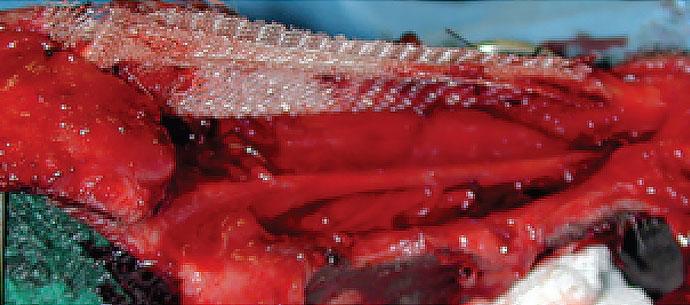 |
| Илл. 2. 12-летняя сука породы английский сеттер. Для создания мостика между двумя концами ахиллова сухожилия использовалась сетка из марлекса |
Для защиты конечности от инфекции, поддержки и иммобилизации скакательного сустава потребовалось наложение кранио-каудальной шины (в физиологическом положении) на 10 недель. После этого срока собака была повторно осмотрена и признана способной выдержать частичную нагрузку. При пальпации отмечались отёчность, уплотнение и неровность области сухожилия. Шина была удалена и наложена простая повязка ещё на месяц. Владелец был предупреждён об ограничении физической активности собаки и обучен пассивным физиотерапевтическим методикам (мягкое разгибание и сгибание сустава во избежание формирования спаек и мышечной гипотрофии).
Было назначено соответствующее противовоспалительное лечение (карпрофен, 2 мг/кг ˟ 2 р./д. per os) на первые 15 дней, тогда как антибактериальная терапия (амоксициллин/клавулановая кислота, 12,5 мг/кг × 2 р./д. per os) была продлена на 1 месяц во избежание послеоперационного инфицирования раны.
Каждые две недели до 2 месяцев и через 8 месяцев после операции проводилось УЗИ сухожилия. Через 8 месяцев констатировано полное восстановление с переносимостью нагрузки и отсутствием хромоты и отёчности в области операционного вмешательства (илл. 3). Биопсия не производилась, но при УЗИ и пальпации определялись очень схожие с сухожилием эхогенность и консистенция. Наш опыт показал, что полипропиленовая сетка относительно легко накладывается и не требует специального оборудования. Более того, здоровая ткань не была удалена и не потребовалась внешняя аппаратная иммобилизация скакательного сустава, что уменьшило инвазивность операции.
В нашем клиническом случае иммобилизация была достигнута наложением кранио-каудальной шины без каких-либо осложнений. Время выздоровления в нашем случае не превысило среднее время, определённое Nielsen. Однако в описанных им случаях потребовалось 12 месяцев для полного выздоровления [17]. Таким образом, мы оценили время выздоровления нашей пациентки как приемлемое, учитывая её возраст, хорошее восстановление функции и конкретную хирургическую методику.
Это описание, хотя и единичного случая, подтверждает эффективность полипропиленовой сетки для реконструкции сухожилия у собаки. Многие авторы подчёркивают, что для предотвращения спаечного процесса и мышечной атрофии в послеоперационном периоде необходима физиотерапия конечности [20; 15; 22].
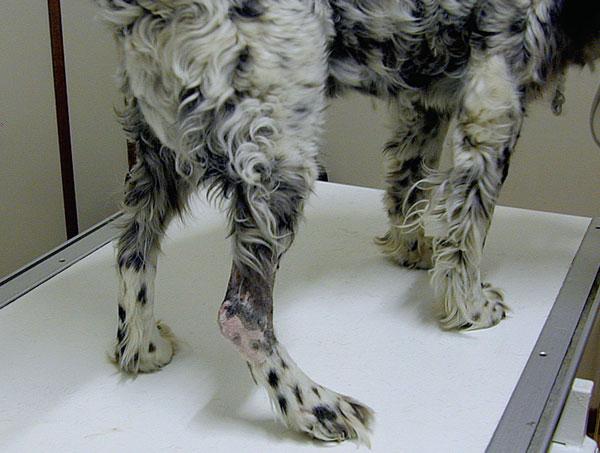 |
| Илл. 3. 8 месяцев после операции. Скакательные суставы находятся приблизительно на одной высоте от земли. |
Новые перспективы
Регенерация ткани сухожилия является основной задачей тканевой инженерии и регенеративной медицины. В регенерации покровных тканей, костей и связок уже достигнут большой прогресс. Последние исследования используют новый подход к лечению повреждений сухожилий и связок с использованием синтетического каркаса для роста клеток. Целью исследований в тканевой инженерии и регенеративной медицине является разработка и создание воспроизводимого, биологически активного и рассасывающегося трёхмерного клеточного каркаса со специфическими свойствами, способствующими поддержанию его целостности определённое время, даже в условиях весовой нагрузки.
Guarino и др. [2007] в недавнем обзоре проанализировали различные подходы к утилизации биологически активных клеточных каркасов для регенерации повреждённой ткани в костях и связках. Они предположили, что каркасы можно усовершенствовать включением в них нерастворимых и растворимых сигнальных белков, способных включить клеточную активность, направленную на регенерацию ткани [9].
При рассмотрении тканевой регенерации могут быть задействованы две различные стратегии: упоминавшаяся выше регенеративная медицина и тканевая инженерия. Эти две области исследований требуют специфической изоляции клеток путём забора небольшого биоптата у пациента и выращивания клеток в каркасе. Подход регенеративной медицины заключается в имплантации каркаса прямо в организм пациента, с целью стимуляции формирования новой ткани. Тканевая инженерия же проводится в два этапа: на первом компоненты каркаса собираются in vitro, а на втором имплантируются. Клеточные каркасы содержатся в биореакторах с регулируемыми физико-химическими культуральными параметрами (pH, температура, давление и т. д.), необходимыми для воспроизводства идеальной среды для роста ткани in vitro. При обоих подходах ключевым моментом является прорастание каркаса, который служит временной матрицей для клеточной пролиферации и обеспечивает депонирование внеклеточного матрикса [9].
На первом этапе исследования структурных свойств будет необходимо установить механизм клеточной адгезии, пролиферации и дифференцировки, который симулирует структурную сложность натуральной ткани. Следовательно, важнейшими свойствами клеточного каркаса, которые обеспечивают однообразное распределение клеток, их выживаемость, пролиферацию и миграцию, а также стимулируют неоваскуляризацию, являются пористость, взаимное расположение пор и их размер. Неоангиогенез — это ключевой момент в обеспечении адекватного транспорта питательных веществ и выведения токсичных метаболитов [9]. Для костной ткани был предложен размер пор 150 мкм, а для связок и сухожилий — 200–250 мкм [9].
Другим фундаментальным моментом в разработке клеточного каркаса является выбор подходящего материала. В зависимости от происхождения (синтетический или натуральный) и природы (органический или неорганический) материала можно управлять четырьмя различными характеристиками биоматериала, используемого при создании имплантата [9]: идеальный каркас для связок и сухожилий должен быть биологически разлагаемым, биологически совместимым и пористым, должен обладать значительной механической прочностью и способствовать формированию новой ткани [9]. Идеальные материалы для каркасов для связок и сухожилий — это коллаген, шёлк и биоразлагаемые полимеры. Основным препятствием к использованию этих материалов служит их архитектура. Для преодоления этого ограничения недавно была разработана матрица из волокон шелка, которая симулирует организацию коллагеновых волокон в естественных связках/сухожилиях. Эти каркасы с трёхмерной матрицей лучше приспосабливаются к месту имплантации и стимулируют рост и развитие новой ткани [9]. Основное направление современного развития биоматериалов — это использование биологической активности, адекватно отвечающей на внешние стимулы. Задача заключается в разработке
нового типа материала, который стимулирует биохимическую реакцию живой ткани для создания сильной биологической связи между имплантатом и тканью. В этом контексте
использование медленно разлагающихся материалов обеспечивает достаточно длительное сохранение биологически активных компонентов каркаса in situ, чтобы достичь
роста и созревания ткани [9].
К биологически активным молекулам относятся биологически активные белки и факторы роста (костные морфогенетические белки (КМБ), фактор роста β, инсулиноподобный фактор роста, фактор роста фибробластов). Альтернативный подход заключается в использовании олигосахаридов и олигопептидов. Клеточная адгезия к традиционным биоматериалам основана на распознавании белков, таких как фибронектин, фибриноген и витронектин, которые неспецифически абсорбируются и запускают клеточную адгезию, взаимодействуя с соответствующими рецепторами. Преимущество использования небольших пептидов вместо целых белков заключается в меньшей стоимости и большей маневренности [9]. Особенный интерес представляет исследование, проведённое Forslund [2003] на крысах и кроликах, в котором изучалось использование КМБ для лечения экспериментального разрыва ахиллова сухожилия. В исследовании оценивалась роль КМБ в процессе заживления сухожилия, устанавливались их оптимальная концентрация и эффективный способ введения, позволяющие предотвратить побочные эффекты, такие как дегенерация костной или хрящевой ткани в сухожильную. В экспериментах использовались три типа КМБ: КМБ-12, КМБ-13, КМБ-14. По результатам был сделан вывод, что КМБ-13 оказался наиболее эффективным, потому что он лучше способствовал дифференцировке мезенхимальных клеток в соединительную ткань, чем другие два типа, которые могут привести к формированию костных или хрящевых островков [9].
Последние данные позволяют заключить, что в будущем тесное взаимодействие между ветеринарными хирургами и биоинженерами может привести к созданию сухожильных клеточных каркасов со специфическими КМБ, которые ускорят процесс заживления и полную регенерацию ткани.
Литература
- Barone R. (1981). Comparative Anatomy in Domestic Animals (in Italian and French). Vol. 2. Edagricole, Bologna. 790–791.
- Choskey A., Soonawalla D., Murray J. (1996). Repair of neglected Achilles tendon ruptures with Marlex mesh. Injury 27, 215–217.
- Clark D. M. (2001). Tendon lesion and its treatment. In: Bojrab M. J. (ed.): Disease Mechanisms in Small Animal. Giraldi, Bologna. 1414–1418.
- Demirkan I., Atalan G., Cihan M., Sozmen M., Kankavi O. (2004). Replacement of ruptured Achilles tendon by fascia lata grafting. Veteriner Cerrahi Dergisi 10, 21–26.
- Fahie M. A. (2005). Healing, diagnosis, repair, and rehabilitation of tendon conditions. Veterinary Clinics Small Animal Practice 35, 1195–1211.
- Forslund C. (2003). BMP treatment for improving tendon repair: Studies on rat and rabbit Achilles tendons. Acta Orthopaedica Scandinavica, 74 (Suppl. 308), 1–30.
- Fossum T. W. (ed.) (2004). Small Animal Surgery. 2nd ed. Elsevier, Milano. 1150–1159.
- Gilbert T. W., Stewart-Akers A. M., Simmons-Byrd A., Badylak S. F. (2007). Degradation and remodeling of small intestinal submucosa in canine Achilles tendon repair. Journal of Bone & Joint Surgery 89, 621–630.
- Guarino V., Causa F., Ambrosio L. (2007). Bioactive scaffold for bone and legament tissue. Expert Review of Medical Devices 4, 405–418.
- Guerin S., Burbridge H., Firth E., Fox S. (1998). Achilles tenorrhaphy in five dogs: a modified surgical technique and evaluation of a cranial half cast. Veterinary and Comparative Orthopaedics and Traumatology 11, 205–210.
- Hosey G., Kowalchick E., Tesoro D., Balazsy J., Klocek J., Pederson B (1991). Comparison of mechanical and histologic properties of Achilles tendons in New Zealand white rabbits secondarily repaired with Marlex mesh. Journal of Foot Surgery 30, 214–233.
- Lamb C. R., Duvernois A. (2005). Ultrasonographic anatomy of the normal canine calcaneal tendon. Veterinary Radiology & Ultrasound 46, 326–330.
- Maitre P., Carozzo C., Genevois J. P., Fav D., Viguier E. (2009). Transposition of Sartorius muscle for treatment of recurrent common calcaneal tendon rupture. In: Proceedings of 18th Annual Scientific Meeting, Nantes, 371–374.
- Meutstege F. J. (1993). The classification of canine Achille’s tendon lesions. Veterinary and Comparative Orthopaedics and Traumatology 6, 53–55.
- Montgomery R., Fitch R. (2003). Muscle and tendon disorders. In: Slatter D. (ed): Textbook of Small Animal Surgery. 3rd ed. Saunders, Philadelphia. 2266–2267.
- Moores A. P., Owen M. R., Tarlton J. F. (2004). The three-loop pulley suture versus two locking-loop sutures for the repair of canine Achilles tendons. Veterinary Surgery 33, 131–137.
- Nielsen C., Pluhar G. E. (2006). Outcome following surgical repair of Achilles tendon rupture and comparison between post-operative tibiotarsal immobilization methods in dogs. Veterinary and Comparative Orthopaedics and Traumatology 19, 246–249.
- Ozaky J., Fujimoto S., Masuhara K., Tamai S., Yoshimoto S. (1986). Reconstruction of chronic massive rotator cuff tears with synthetic materials. Clinical Orthopaedics 202, 173.
- Robinson S. (2007). Understanding the Hock. In: “Darkstarr Rottweilers” online website
http://www.dkstarr. com/hock.thm. - Shani J., Sharar R. (2000). Repair of chronic complete traumatic rupture of the common calcaneal tendon in a dog, using a fascia lata graft — case report and literature review. Veterinary and Comparative Orthopaedics and Traumatology 13, 104–108.
- Spadari A. (2006). Notes on Veterinary Surgery (in Italian). 2nd ed. Societa Editrice Esculapio, Bologna. 233–242.
- Swiderski J., Fitch R. B., Staaz A., Lowery J. (2005). Sonographic assisted diagnosis and treatment of bilateral gastrocnemius tendon rupture in a Labrador retriever repaired with fascia lata and polyprolylene mesh. Veterinary and Comparative Orthopaedics and Traumatology 18, 258–263.
Источник: Veterinarni Medicina, 55, 2010 (7): 303–310. © G. Spinella et al. This is an Open Access article distributed under the terms of the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited
СВМ №4 / 2011
Вас также может заинтересовать статья:




