Kristin Opdal Seljetun1,2, Elin Eliassen1, Ritva Karinen3, Lars Moe2 and Vigdis Vindenes3,4
1 Department of Companion Animal Clinical Sciences, Faculty of Veterinary Medicine, Norwegian University of Life Sciences (NMBU), Norway.
2 Division of Environmental Medicine, Norwegian Poisons Information Centre, Norwegian Institute of Public Health, Oslo, Norway.
3 Department of Forensic Sciences, Division of Laboratory Medicine, Oslo University Hospital, Norway.
4 Institute of Clinical Medicine, Faculty of Medicine, University of Oslo, Norway.
Краткое содержание
Введение. Случаи интоксикации родентицидами-антикоагулянтами у собак — не редкость в ветеринарной практике. Однако существует очень мало публикаций на тему кинетики элиминации и времени полувыведения этих ядов в организме собак. Целью данной работы стало разработать новый метод количественной оценки содержания яда в организме животных по анализу крови и кала собак с помощью метода обращённо-фазовой ультра-высокоэффективной жидкостной хроматографии — тандемной масс-спектрометрии (reversed phase ultra-high performance liquid chromatography-tandem mass spectrometry, UHPLC-MS/MS) и применить этот метод в случае интоксикации родентицидом-антикоагулянтом.
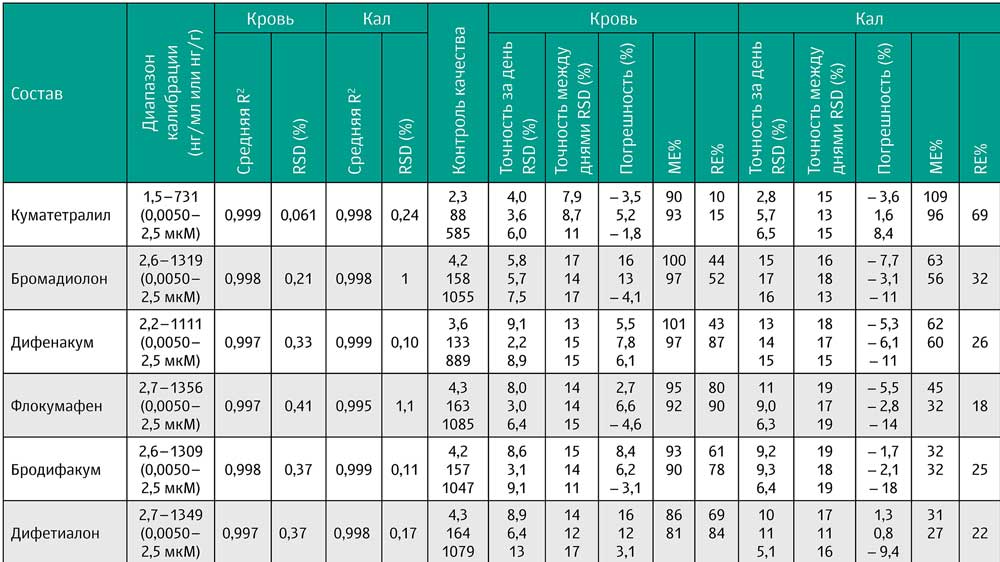
Результаты. Образцы подготавливались с помощью жидкость-жидкостной экстракции. Шесть родентицидов-антикоагулянтов были разделены с помощью UPLC® BEH C18- колонок с мобильной фазой, состоящей из 5 мМ аммониевого буфера с pH 10,2 и метанола. Тандемная масс-спектрометрия проводилась с положительной ионизирацией электроспрея с двумя MRM-переходами. Границы определения были установлены на уровне самого низкого калибратора (1,5–2,7 нг/мл крови или нг/г кала). Метод был успешно применён в случае случайного отравления собаки родентицидом-антикоагулянтом. Было проведено измерение концентраций куматетралила и бродифакума в серии образцов крови и кала. В результате измерений продолжительность полураспада куматетралила в крови составила как минимум 81 день, что превосходит описанное ранее в литературе время. Также был обнаружен длительный период элиминации бродифакума из образцов кала собак, составивший более 513 дней.
Выводы. Данное исследование представляет новый метод выявления и количественной оценки концентрации шести часто используемых родентицидов-антикоагулянтов в кале собак. Такие вещества могут нанести серьёзный вред организму, и их своевременное и точное обнаружение необходимо, чтобы начать правильную терапию. А при оценке степени загрязнённости родентицидами окружающей среды следует помнить об очень длительном времени полувыведения этих ядов, что было подтверждено в этом исследовании.
Введение
Родентициды-антикоагулянты (РА) широко используются в мире в борьбе с грызунами. РА первого поколения состояли из варфарина, хлорофацинона, дифацинона и куматетралила, разработанных в 1950-х годах.
Усиление резистентности у грызунов привело к созданию соединений второго поколения [1, 2]. Эти длительно действующие родентициды-антикоагулянты — бродифакум, бромадиолон, дифенакум, дифалион и флокумуфан, которые намного более токсичны и смертельны для видов грызунов, устойчивых к родентицидам первого поколения [2].
РА оказывает антикоагулянтный эффект путём ингибирования эпоксидредуктазы витамина K1. Это предотвращает регенерацию активного витамина K1 и, следовательно, ухудшает формирование К1-зависимых факторов свёртывания — II, VII, IX и X, и протеинов C и S в печени [3]. Антикоагулянтный эффект обусловлен главным образом истощением факторов II и X [4]. У собак период полураспада в плазме факторов II и X составляет 41 и 17 часов соответственно [5]. После истощения уже циркулирующих в кровотоке факторов свёртывания развивается спонтанная коагулопатия. Клинические признаки после проглатывания РА развиваются примерно через 3,5 дня, что соответствует минимум двум периодам полураспада фактора свёртывания II [4].
Проглатывание РА нередко встречается у собак и других нецелевых животных и неоднократно описывалось в литературе на протяжении многих лет [6–9]. Однако мы не знаем, сколько собак в популяции подвергается воздействию этих родентицидов в течение их жизни. В 2014 году в Норвежском университете естественных наук (NMBU) был проведён опрос о контактах с РА в анамнезе у поступавших в клинику собак [10]. Образцы печени были взяты у всех собак, которым проводилось вскрытие, за период 6 месяцев, независимо от причины смерти, болезни или клинических признаков. Из 63 собак, включённых в исследование, родентициды были обнаружены в печени у 20%. У 8% собак было выявлено более одного типа РА. Источник появления родентицидов в организме этих животных выявить не удалось.
В организме РА накапливаются преимущественно в печени, а выводятся — через желчь, вместе с калом [11–13]. Большая продолжительность действия объясняется энтерогепатической (кишечно-печёночной) циркуляцией и высокой растворимостью липидами [14, 15]. В эксперименте, проведённом с лисами с множественными дозами бромадиолона, остатки вещества сохранялись в печени даже после того, как оно перестало выявляться в плазме крови [16]. Экскреция с калом у собак продолжалась в течение всего периода исследования (31 день) и все ещё присутствовала по окончании исследования.
Для обнаружения РА требуются быстрые, высокочувствительные и специфичные методы. Варфарин и его метаболиты обычно выявляются с помощью газовой хроматографии или высокоэффективной жидкостной хроматографии, но
из-за большей массы и более низкой летучести некоторых из РА жидкостная хроматография и масс-спектрометрия считается более подходящим методом [17]. В ветеринарной литературе предлагается несколько лабораторных методик для обнаружения РА [18]. Однако методов, с помощью которых можно было бы измерить концентрацию вещества в кале собак, пока не существует. Кроме того, имеется относительно мало информации, описывающей токсикокинетику куматетралила в крови у собак.
Основная цель этого исследования заключалась в разработке лабораторного метода для анализа шести видов РА в образцах кала. Мы использовали этот метод для определения времени элиминации куматетралила из крови и кала после острого отравления РА у собаки; представлена история болезни.
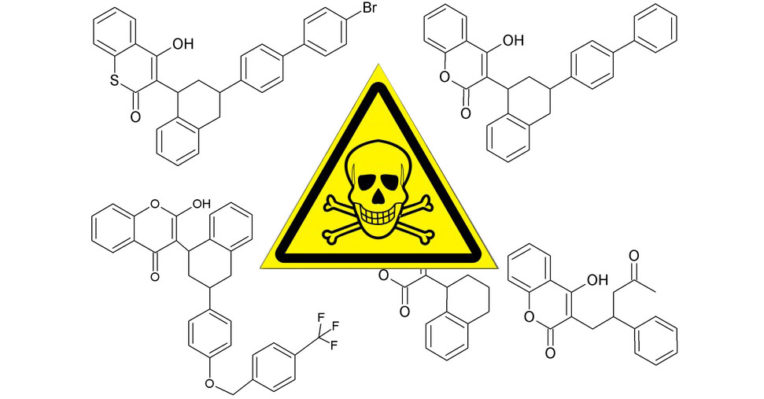
 |
| Рисунок 1. Молекулярные структуры отравляющих веществ и варфарина |
Описание случая
В университетскую клинику NMBU доставлена нестерилизованная сука таксы в возрасте 6 месяцев, весом 7,2 кг, после эпизода проглатывания 1,5 пачек РА, которые она нашла в кармане владельца. Информации о продукте или дозе РА получить не удалось. В течение полутора часов после проглатывания РА собаке дали апоморфин, чтобы вызвать рвоту, в которой было обнаружено несколько крупных кусков родентицида. Получила активированный уголь и была направлена в ветеринарную клинику для измерения протромбинового времени (ПВ) и активированного частичного тромбопластинового времени (АЧТВ) через 48 и 72 ч после отравления. По ошибке образцы крови не были обследованы в клинике, а отправлены в стороннюю лабораторию, поэтому замедленная коагуляция не была обнаружена.
Через пять дней после эпизода контакта с РА собака вернулась в университетскую клинику. Клинические признаки включали летаргию, слабость, тахикардию, слабый пульс, бледность слизистых оболочек, тахипноэ и одышку. Первичный анализ свёртываемости выявил значительное увеличение ПВ (51 с) и АЧТВ (131 с). Было назначено симптоматическое лечение и приём витамина К1 перорально. Клиническое состояние постепенно улучшалось в течение следующих 2 дней, а уровни ПТ и АЧТВ собаки возвращались к норме. Собака была выписана под наблюдение её хозяев на 9-й день. Собака продолжала получать витамин К1 ещё 36 дней. Это улучшило клиническое состояние, однако считается, что это не влияет на кинетику выведения РА [19]. На протяжении всего периода наблюдения собака оставалась здоровой, клинической симптоматики не отмечалось.
Методы
Сбор и хранение проб
Образцы кала собирали у отравленной собаки после естественного акта дефекации в один день с забором образцов крови и помещали в тёмные пластиковые контейнеры. Образцы хранились при температуре –20°С. В течение нескольких недель образцы лиофилизированы до сухого состояния. Остатки образцов были проанализированы в лаборатории кафедры судебных наук NMBU.
Кровь для анализа на содержание РА собирали в вакуумные трубки, содержащие фторид натрия в качестве консерванта, и оксалат калия в качестве антикоагулянта. Образцы крови замораживали (–20°C) вскоре после сбора и хранили до анализа.
Кровь для анализа АЧТВ и ПВ была собрана в вакуумную пробирку, содержащую натрий-цитрат (3,2%). Кровь анализировали в течение 2 ч от забора в NMBU с помощью анализатора Coag Dx (IDEXX Laboratories Europe B.V., Голландия).
Образцы крови и фекалий для выявления РА у нашей собаки были собраны на 6, 7, 11, 18, 22, 24, 32, 39, 50, 64, 93, 121, 204, 422, 470 и 513-й дни после отравления. Соответствующие измерения ПВ и АЧТВ были сделаны в острой фазе отравления.
Исходные вещества и химикаты
Бродифакум, бромадиолон, динефакум, флукомафен были предоставлены Fluka Chemika (Sigma-Aldrich Norway AS, Осло, Норвегия), дифалион и кумаметралил — доктором Эренсторфером (Dr. Ehrenstorfer GmbH, Аугсбург, Германия). На рисунке 1 представлены молекулярные структуры соединений. Варфарин-d5 (внутренний стандарт) был приобретён у Chiron AS (Chiron AS, Тронхейм, Норвегия). Этилацетат и дихлорметан были предоставлены Chemi-Teknik AS (Осло, Норвегия). Метанол (LC-MS Chromasolv®), ацетонитрил (ACN), формиат аммония и гептан (99%) были приобретены у SIGMA (Sigma-Aldrich Norway AS, Осло, Норвегия). Вода 1-го типа (18 МО-см) получена из системы очистки воды Milli-Q A10 (Millipore, Bedford, MA, USA). Человеческая цельная кровь была предоставлена банком крови в университетской больнице Ульлеваль, Осло, Норвегия, а «чистые» образцы кала были собраны авторами у других, здоровых, собак.
Запатентованные растворы аналитов подготавливались раздельно в ацетонитриле, а рабочие стандартные растворы бродифакума, бромадиолона, дифенакума, флокумафена и куматетралила были приготовлены в ацетонитриле из исходных растворов в семи разных концентрациях. Растворы рабочего стандарта для дифалиона были приготовлены отдельно из-за более низкой концентрации раствора исходного вещества. Диапазоны концентраций показаны в таблице 1. Образцы контроля качества (КК) были подготовлены независимо в трёх концентрациях.
Подготовка образцов крови
Подготовка образцов для калибраторов и контрольных измерений проводилась путём добавления 50 мкл каждого стандартного рабочего раствора в ацетонитрил до аликвоты 100 мкл цельной крови. 100 мкл ацетонитрила добавляли к неизвестным образцам (100 мкл). Во все образцы добавляли 50 мкл внутреннего стандарта (0,078 мг/л в воде 1 типа) с последующим немедленным перемешиванием в смесителе Multitube. Затем добавляли 100 мкл боратного буфера с рН 11 и 1,2 мл смеси этилацетат/гептан (4:1) и перемешивали в течение 10 мин. с последующим центрифугированием при 4500 об/мин. (3900×g) при 4°С в течение 10 мин. Органический слой переносили в чистую стеклянную трубку объёмом 5 мл, высушивали под N2 (газообразный азот) при 40°С, восстанавливали 100 мкл смеси метанола/воды типа 1 (20:80) и интенсивно встряхивали перед переносом в автоматические пробоотборники.
Подготовка образцов кала собак
Образцы кала собак гомогенизировались и взвешивались до точной аликвоты 100 мг (предел точности XS, © Mettler-Toledo International Inc., Великобритания). Подготовка калибраторов проводилась путём добавления 50 мкл каждого рабочего раствора к образцам чистого кала. К материалам исследуемого пациента добавляли 100 мкл ацетонитрила. Ко всем образцам добавляли 50 мкл внутреннего стандарта и 400 мкл боратного буфера с рН 11 с последующим немедленным перемешиванием в смесителе Multitube. Добавляли 1,0 мл ацетонитрила с последующим перемешиванием. После добавления 1,0 мл дихлорметана образцы перемешивали в течение 10 мин. с использованием смесителя для крови с последующим центрифугированием при 4500 об/мин. (3900×g) при 4°С в течение 10 мин. Тонкий верхний слой тщательно удаляли, дихлорметановую фазу переносили в чистую стеклянную трубку, сушили в атмосфере N2 при 40°С и восстанавливали с помощью 100 мкл смеси метанола /воды 1-го типа (20:80), встряхивали и центрифугировали перед переносом в автоматические пробоотборники.
Анализ
Анализ образцов проводился в системе Waters ACQUITY UPLC (Waters Corporation, Милфорд, Массачусетс, США), с использованием колонки Acquity UPLC® BEH C18 (2,1 мм х 50 мм, частицы размером 1,7 мкм, Waters Corporation, Milford, MA, USA), с использованием градиентного элюирования с подвижной фазой, состоящей из 5 мМ буфера формиата аммония с рН 10,2 (А) и метанола (В). Температуру колонки выдерживали при 65°С, а скорость подвижной фазы составляла 0,5 мл/мин. Профиль градиента составлял: 10% В в 0,00–1,50 мин., 30% В в 1,50–1,80 мин., 58% В в 1,80–1,81, 60% B в 1,81–3,50 мин., 60% B в 3,50–3,52 мин., 100% B в 3,52–4,00 мин., 100% B в 4,00–4,50 мин., и 10% B в 4,50–4,51 мин. Использовалось линейное профилирование состава подвижной фазы. Время работы составляло 6,00 мин., а объём инъекции — 3 мкл.
Масс-спектрометрию положительно ионизированного электроспрея (ESI+) проводили на тройном квадриполевом масс-спектрометре Xevo TQS от Waters (Milford, MA, США), используя два перехода с отслеживанием нескольких реакций (multiple reaction monitoring, MRM) для каждого аналита и внутренний стандарт. Сбор данных, интеграция максимумов и вычисления осуществлялись на компьютере с программным обеспечением MassLynx 4.1. Отслеживаемые MRM-переходы, соответствующие значения напряжения конуса и энергии столкновения, а также время выдержки аналитов приведены в таблице 2. Хроматограммы самого низкого образца КК и чистого образца с внутренними стандартами показаны на рисунке 2.
Подтверждение метода
Количественные результаты были получены путём интеграции высоты пика конкретной хроматограммы MRM в отношении к интегрированной высоте внутреннего стандарта. Из-за широкого диапазона концентраций (таблица 1) для количественной оценки использовалась калибровочная кривая 2-го порядка (y = ax2 + bx + c). Используемый коэффициент взвешивания равнялся 1/x. Пределы количественной оценки (Limits of quantification, LOQ) были установлены на уровне самых низких калибраторов, отношение сигнал-шум было выше 10. Вариации в течение дня (n = 6) и между днями (n = 6) определяли анализом образцов человеческой цельной крови и «чистых» образцов кала от здоровых собак при трёх разных концентрациях для всех соединений. Анализ кала собак проводили с использованием 3–6 параллелей для каждого образца. Восстановление материала после экстракции и матричный эффект изучали с использованием метода, разработанного Matuszewski et al. [20]. В этом исследовании для всех соединений анализировалось пять образцов крови и кала на двух уровнях концентрации. Исследования экстракции образцов крови изучались на двух уровнях концентрации и на одном уровне — для образцов кала.
Таблица 1. Проверка результатов анализа шести родентицидов
 |
| Рисунок 2. Хроматограммы образца с самым низким качеством контроля и чистого образца с внутренними стандартами |
Таблица 2. MRM-переходы ионов
| Состав | RT (min) | MRM-переходы (m/z) | Напряжение конуса (V) | Энергия столкновения (eV) |
| Куматетралил | 1,86 | 239,1 > 107,1/91,0 | 40/30 | 32/28 |
| Бромадиолон | 2,73 | 511,1 > 251,2/173,0 | 26 | 24/42 |
| Дифенакум | 2,83 | 445,3 > 179,1/257,2 | 30 | 32/22 |
| Флукомафен | 3,17 | 543,2 > 159,1/335,2 | 28 | 42/24 |
| Бродифакум | 3,27 | 525,2 > 337,1/178,2 | 34/55 | 34/55 |
| Дифетиалон | 3,33 | 539,1 > 178,1/335,1 | 36 | 32/22 |
| Варфарин-d5 | 1,62 | 314,2 > 163,1/256,0 | 24 | 14/22 |
Значения, выделенные курсивом, использовались для количественного анализа
Результаты
Калибровочные кривые были проанализированы, и средние значения R2 составили выше 0,995 для всех соединений как в крови, так и в кале у собак (таблица 1). Уровни самого низкого калибратора (1,5–2,7 нг/мл крови или нг/г кала) отвечали критериям LOQ для всех соединений. Точность и верность, определяемые через отклонения, приведены в таблице 1 и составили ±20% для всех соединений. Для крови не наблюдалось выраженных матричных эффектов, тогда как для кала наблюдалось подавление ионов для всех соединений, за исключением куматетралила. Степень экстракции вещества также была ниже для кала по сравнению с кровью.
Оценены кривые элиминации куматетралила в крови и кале собаки (рисунок 3). Поскольку анализ крови был впервые выполнен через 6 дней после отравления, выявить начальную фазу распределения в этом случае было невозможно. Тем не менее график выведения с 6-го по 11-й день указывает на первую фазу с предполагаемым периодом полураспада 1,8 дня, что указывает на начальную фазу элиминации. Через 18 дней после приёма крови концентрация крови была ниже LOQ, но продолжала изменяться в диапазоне ниже этого значения в течение 4 месяцев после отравления. Последний положительный образец крови был обнаружен через 64 дня после приёма.
Соответствующие фекальные анализы куматетралила были выполнены с использованием 3–6 параллелей для каждого образца. Относительные стандартные отклонения (Relative standard deviations, RSD) составили от 4 до 41% (в среднем 25%) для всех образцов из нашего случая. Перед приготовлением образца из материала удалялись крупные видимые части растений и прочие посторонние элементы, но изменчивость содержания аликвоты в этом типе образцов всегда остаётся довольно велика. Это отчасти объясняет относительно большие стандартные отклонения анализа между концентрациями, обнаруженными для аликвот образца. Поскольку первые образцы были взяты через 11 дней после отравления, первую фазу элиминации вещества с калом точно определить не удалось. Вторая фаза элиминации со дня 64 до 422 даёт расчётный период полувыведения не менее 81 дня. Куматетралил все ещё обнаруживался в кале через 204 дня после приёма внутрь, что демонстрирует значительно более длительное присутствие в кале по сравнению с кровью.
Поддающиеся выявлению уровни бродифакума были обнаружены в крови в течение всего периода исследования. Поскольку только одна из концентраций оказалась выше LOQ, эти результаты не представлены на рисунке 4. Соответствующие анализы бродифакума в кале собаки демонстрировали относительно высокие уровни в течение всего исследования (рисунок 4).
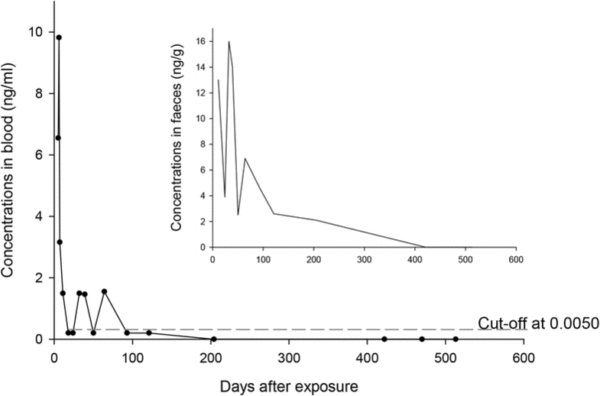 |
| Рисунок 3. Концентрации куматетралила в крови (нг/мл) и кале собаки (нг/г) |
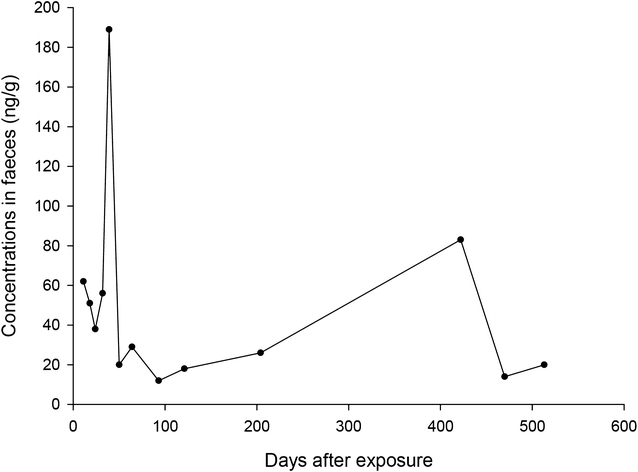 |
| Рисунок 4. Концентрации бродифакума в кале (нг/г) |
Обсуждение
Мы разработали новый метод анализа шести видов РА в кале собак, а также обнаружили с его помощью куматетралил и бродифакум в крови и кале и очень длительную элиминацию вещества с калом. Случайное отравление с помощью РА нередко бывает у собак, но в литературе встречается очень мало сообщений о кинетике элиминации и периодах полураспада.
Выведение куматетралила с калом у собаки
Энтерогепатическая циркуляция и выведение РА с калом у собаки делают методику определения РА в кале надёжным инструментом для определения содержания этих веществ в организме. Предыдущие исследования показали, что самая высокая концентрация РА наблюдается в печени, за которой следуют почки, мышцы и жир [13, 21]. Самая низкая концентрация была обнаружена в крови [13]. В нашем случае концентрация куматетралила в кале возрастала с 24-го дня до 32-го дня (рисунок 3). Одним из объяснений наличия второго пика может быть повторное поедание РА, но мы считаем это маловероятным, так как соответствующие концентрации в крови показывают только следовые количества куматетралила и отсутствие клинических признаков повторного попадания. Аналитическая ошибка была изучена, и с 32-го дня мы стали проводить шесть параллельных анализов одного образца, но концентрация в следующем образце продолжала повышаться. Объяснением является биологическая изменчивость между материалом, полученным от одного и того же животного [22–25]. Мы считаем более вероятным объяснением второго пика энтерогепатическую рециркуляцию. Желчь высвобождается из желчного пузыря вскоре после проглатывания пищи [26]. Наши образцы не собирались в одно и то же время после еды. Кроме того, на 32-й и 39-й день у собаки протекал первый эструс. Эстроген и прогестерон характеризуются интенсивной энтерогепатической рециркуляцией и, как сообщается, снижают скорость выведения желчи [27, 28], однако их влияние на выведение родентицидов-антикоагулянтов неизвестно.
Уровень куматетралила в кале у собаки 2,1 нг/г на 204-й день свидетельствует о достаточно долгом периоде его выведения из печени. Согласно нашим результатам, период его полувыведения у этого животного составил не менее 81 дня. Предыдущее исследование у крыс определило период полувыведения куматетралила в печени до 55 дней [29]. По сообщениям в литературе период полувыведения в печени мышей составляет 15,8 дня [30] и 18,9 дня у красных оленей (Cervus elaphus scoticus) [31]. Наши результаты показывают, что куматетралил может присутствовать в печени более чем через семь месяцев после однократного проглатывания отравляющего вещества у собак, в зависимости от его количества. Поскольку между днями 204 и 422 не было взято образцов кала, у нас нет более точных данных о длительности элиминации.
Обнаружение куматетралила в крови
Информации о фармакокинетике куматетралила в крови собак тоже весьма немного. Наш случай демонстрирует короткую начальную А-фазу с концентрациями, снижающимися с 9,8 до 1,5 нг/мл с 6-го по 11-й день, что говорит о периоде полураспада в 1,8 дня. Последующая фаза с более медленной элиминацией продолжалась до 204-го дня, когда его уже не удалось обнаружить. Это указывает на двухфазную элиминацию, предполагающую двухкомпонентную модель, что согласуется с данными по исследованиям на мышах [30]. По сравнению с исследованиями других РА первого поколения, наши результаты показывают, что куматетралил обнаруживается в крови собак в течение более длительного периода по сравнению с другими исследованными видами. У крыс однократная доза хлорофацинона полностью выводилась из организма в течение 4 дней [32]. Невозможно исключить потенциальное влияние бродифакума на выведение куматетралила, но на протяжении всего нашего исследования в крови были обнаружены только следовые концентрации бродифакума. Время обнаружения зависит от дозы принятого куматетралила.
Источники бродифакума
Источник бродифакума в нашем случае не может быть определён. Собака не проявляла никаких признаков болезни до этого текущего случая отравления, и владельцы не знали о поедании РА. Следовые количества в крови исключают недавнее поедание бродифакума в значимой дозе. В Норвегии нет РА, которые содержат как куматетралил, так и бродифакум [33]. Возможно, имело место предыдущее воздействие небольшого количества бродифакума. Другое объяснение небольшого количества бродифакума, обнаруженного у этой молодой собаки, может быть вызвано поеданием резистентного или сублетально отравленного грызуна. Устойчивость к РА второго поколения наблюдается у коричневой крысы (Rattus norvegicus) и домашней мыши (Mus musculus) в нескольких европейских странах [34, 35]. В Германии сублетально поражённые мыши обнаруживаются на больших участках вокруг приманок [36]. Fisher et al. продемонстрировал экскрецию до 19,4% поглощённого РА в фекалиях крыс перед смертью на 4–6-й день [37]. Другим источником бродифакума может быть воздействие фекалий отравленных животных. Отравление бродифакумом фекально-оральным путём предполагалось в одном случае хронического отравления бродифакумом человека [38]. Степень этого воздействия требует дальнейшего изучения.
Элиминация бродифакума с калом собаки
В нашем исследовании мы продемонстрировали достаточно высокий уровень остаточного содержания бродифакума в кале собаки (рисунок 4). Коэффициент извлечения для бродифакума составлял 25%, что увеличивает риск ложноотрицательных результатов в наших анализах. LOQ в нашем случае были установлены на уровнях самых низких калибраторов и составили 1,5–2,7 нг/г, что меньше использованного в предыдущем исследовании на лисицах количества сухого вещества в 3 мкг/кг [16]. Процедуры проверки наших вычислений дали положительный результат для «чистых» образцов, а точность и верность находились в пределах ±20%. Мы считаем, что это подтверждает точность нашего метода, несмотря на низкий уровень экстракции вещества. После первоначального снижения концентрация бродифакума увеличивалась с 24-го дня до 39-го дня, что соответствует аналогичному увеличению концентрации куматетралила. Для этого пика, вероятно, будут верны те же объяснения, которые были верны для куматетралила. Второй пик в концентрации бродифакума в кале был замечен на 422-й день, с соответствующей концентрацией в крови, отражающей следовые количества вещества. После первого отравления владельцы удалили из дома все родентициды, им не было известно о каком-либо повторном контакте животного с РА. У собаки не было никаких клинических признаков отравления в течение этих 7 месяцев, но поскольку образцы не были собраны между днями 204 и 422, нельзя исключить повторное воздействие РА.
Нам не удалось найти ни одного исследования, описывающего период полураспада бродифакума в печени собак, и мы предлагаем использовать серию анализов концентрации бродифакума в кале у собак для определения его содержания в печени. Бродифакум всё ещё обнаруживался по завершении исследования на 51-й день. Исследования бродифакума второго поколения РА на крысах после перорального приёма одной дозы говорят о двухфазности выведения вещества из печени с предполагаемым периодом полураспада 150–350 дней [32]. После одной дозы бродифакума у опоссумов обнаруживались его высокие концентрации в печени на вскрытии через 254 дня [39]. Эксперимент с одной пероральной дозой бродифакума у овец продемонстрировал обнаруживаемые уровни в печени в конце исследования на день 128, но ниже предела обнаружения в кале на 32-й день [40]. Это сравнительно короткое время элиминации можно объяснить пределом обнаружения вещества в кале 0,05 мг/кг (что эквивалентно 50 нг/г) по сравнению с нашим исследованием, где LOQ составил 1,5 нг/г. Важным фактором может быть также различие строения желудка жвачных животных и собаки.
Обнаружение бродифакума в крови
В нескольких исследованиях приводятся данные о полувыведении бродифакума из крови у собак. Исследование с четырьмя собаками, которые получали бродифакум в течение трёх последовательных дней, определило терминальный период полувыведения в 6–4 дня и продемонстрировало двухкомпонентную модель и двухфазную элиминацию [19]. В одном отчёте предлагается монокомпонентная модель с медианным периодом полураспада в плазме в 2,4 дня у семи отравленных собак [41]. Поскольку источник и время приёма бродифакума были неизвестны в нашем случае, и только следовые количества были обнаружены в крови в течение 513 дней, мы не смогли установить период полувыведения. Однако наши данные свидетельствуют о более продолжительном периоде полувыведения по сравнению с предыдущими исследованиями.
Отравление куматетралилом
Куматетралил классифицируется как антикоагулянт первого поколения, который требует многократного приёма, чтобы проявить свой эффект [42]. В нашем случае один приём вызывал тяжёлое отравление. Однако следовые количества бродифакума, обнаруженные в крови и кале собаки на момент отравления, могут быть фактором, способствующим сильному действию куматетралила в этом случае. Корреляция между остатками в печени и сублетальными эффектами у животного плохо описана [43]. Riley et al. [44] показали значительную связь между смертностью у заражённых нотоэдрозом рысей и вторичным воздействием антикоагулянтов, что указывает на то, что небольшие воздействия РА приводят к повышенной восприимчивости к другим заболеваниям. В другом исследовании [45] не было обнаружено взаимосвязи между воздействием РА и снижением иммунитета у кошек. Другие исследования у крыс продемонстрировали сильное отравление после однократного воздействия куматетралила [46, 47]. В ряде предыдущих исследований [42, 48] было выдвинуто предположение о различной восприимчивости к куматетралилу между видами. Chopra et al. [47] описывает, что летальной дозой куматетралила для крысы бенгальская бандикота (Bandicota bengalensis) является 0,5 мг/кг, но для достижения эквивалентного эффекта у чёрной крысы (Rattus rattus) потребовалось 176,5 мг/кг вещества. Разная восприимчивость к куматетралилу в зависимости от вида была также продемонстрирована на малазийских (Rattus rattus diardii) и серебристобрюхих крысах (Rattus argentiventer) [49]. Данных о токсичности куматетралила у собак пока недостаточно, но из нецелевых млекопитающих этот вид считается наиболее чувствительным к куматетралилу после однократного приёма [50]. В одном из сообщений было показано, что самая низкая доза, влияющая на коагуляцию, составляет 1 мг/кг у собак, тогда как аналогичный эффект у кошек достигается после 5 мг/кг [51]. Полученная доза куматетралила в нашем случае была неизвестна, так как продукт не был идентифицирован, и часть РА вышла вместе со рвотой через некоторое время после приёма внутрь.
Ограничения метода
Кал собак может содержать различные концентрации РА, что связано с неоднородностью аликвот образцов. Это будет дополнительно влиять на восстановление извлечённого вещества и его концентрацию. Из-за этических соображений исследования РА у нецелевых животных, таких как собаки, неприемлемы во многих странах. Таким образом, клинические исследования, подобные нашему, будут вносить ценный вклад в эту область.
Выводы
Мы разработали новый метод количественного определения шести видов родентицидов-антикоагулянтов в крови и кале у собак с использованием UPLC-MS/MS. Этот анализ содержания РА в кале предлагает быструю, точную и неинвазивную методику мониторинга воздействия яда и становится ценным инструментом в диагностике интоксикации. Метод успешно применялся при случайном отравления родентицидом у собаки с анализом кала и крови. На основании анализов уровня куматетралила в кале выявлен предполагаемый период его полувыведения у собак не менее 81 дня. Бродифакум всё ещё обнаруживался в конце исследования на 513-й день и показывал более длительный период полувыведения по сравнению с предыдущими исследованиями. Насколько нам известно, это первый отчёт о методе анализа родентицидов-антикоагулянтов в кале собак.
Сокращения
ACN: ацетонитрил; АЧТВ: активированное частичное тромбопластиновое время; РА: родентициды-антикоагулянты; LOQ: пределы количественной оценки; MRM: мониторинг множественных реакций; N2: газообразный азот; NMBU: Норвежский университет естественных наук; ПВ: протромбиновое время; КК: контроль качества; RSD: относительные стандартные отклонения; UHPLC-MS/MS: ультра-высокоэффективная жидкостная хроматография и тандемная масс-спектрометрия.
Вклад авторов
KOS и LM разработали дизайн исследования и собирали образцы. W утвердил дизайн исследования. EE проводил анализы. EE и RK провели статистический анализ. Рукопись была написана KOS и RK, проверена и утверждена EE, LM и W. Все авторы были ознакомлены с конечным вариантом работы и утвердили его.
Благодарности
Авторы выражают благодарность доктору Elizabeth Leereiestad за консультации по вопросом статистического анализа, а также Kaia Elizabeth Hunter за практическую помощь.
Конфликт интересов
Авторы не имеют конфликтных интересов.
Доступность данных и материалов
Исходные и статистические данные могут быть получены по запросу у одного из авторов.
Согласие на публикацию
Не требуется.
Финансирование
Финансирование проекта осуществлялось через кафедру судебных наук при Университете Осло и Факультет ветеринарной медицины при Отделе клинической ветеринарии мелких животных. Помимо этого, исследование получило дополнительную финансовую поддержку на сбор образцов от SVF Scientific & Professional Fund, Architect Finn Rahʼs Legacy и Veterinarian Smidtʼs Foundation. Авторы выражают признательность IDEXX Laboratories за финансовое обеспечение анализов свёртываемости крови (ПВ и АЧТВ).
Литература
- Rowe F.P., Redfern R. Toxicity tests on suspected warfarin resistant house mice (Mus musculus L.). J Hyg. 1965;63:417–25.
- Hadler M.R., Buckle A.P., editors. Forty five years of anticoagulant rodenticides — past, present and future trends. In: Proceedings of the 15th vertebrate pest conference 1992: paper 36.
- Hirsh J., Dalen J.E., Anderson D.R., Poller L., Bussey H., Ansell J., et al. Oral anticoagulants: mechanism of action, clinical effectiveness, and optimal therapeutic range. Chest. 2001;119:8S–21S.
- Baker R.I., Coughlin P.B., Gallus A.S., Harper P.L., Salem HH, Wood EM. Warfarin reversal: consensus guidelines, on behalf of the Australasian Society of Thrombosis and Haemostasis. Med J Aust. 2004;181:492–7.
- Hellemans J., Vorlat M., Verstraete M. Survival time of prothrombin and factors vii, ix and x after completely synthesis blocking doses of coumarin derivatives. Br J Haematol. 1963;9:506–12.
- Berny P., Caloni F., Croubels S., Sachana M., Vandenbroucke V., Davanzo F., et al. Animal poisoning in Europe. Part 2: companion animals. Vet J. 2010;183:255–9.
- Veterinary Poisons Information Service. Annual report 2015. London: Medical Toxicology and Information Services Ltd.; 2016.
- Schediwy M., Mevissen M., Demuth D., Kupper J., Naegeli H. New causes of animal poisoning in Switzerland [in German]. Schweiz Arch Tierheilkd. 2015;157:147–52.
- Martinez-Haro M., Mateo R., Guitart R., Soler-Rodriguez F., Perez-Lopez M., Maria-Mojica P., et al. Relationship of the toxicity of pesticide formulations and their commercial restrictions with the frequency of animal poisonings. Ecotoxicol Environ Saf. 2008;69:396–402.
- Olerud S., Pedersen J., Pettersen E. Prevalence of superwarfarins in dogs— a survey of background levels in liver samples of autopsied dogs [in Norwegian]. Akershus: In depth study Norwegian University of Life Sciences (NMBU), Department of Companion Animal Clinical Sciences; 2014.
- Huckle K.R., Hutson D.H., Warburton P.A. Elimination and accumulation of the rodenticide flocoumafen in rats following repeated oral administration. Xenobiotica. 1988;18:1465–79.
- CIRCABC. Directive 98/8/EC concerning the placing of biocidal products on the market. Bromadiolone. Product-type 14 (rodenticides). Sweden: Office for Official Publications of the European Communities; 2010.
- WHO. Anticoagulant rodenticides — environmental health criteria 175. Geneva: International Programme on Chemical Safety, World Health Organization. 1995. http://www.inchem.org/documents/ehc/ehc/ ehc175.htm. Accessed 13 July 2017.
- Bachmann K.A., Sullivan T.J. Dispositional and pharmacodynamic characteristics of brodifacoum in warfarin-sensitive rats. Pharmacology. 1983;27:281–8.
- Watt B.E., Proudfoot A.T., Bradberry S.M., Vale J.A. Anticoagulant rodenticides. Toxicol Rev. 2005;24:259–69.
- Sage M., Fourel I., Coeurdassier M., Barrat J., Berny P., Giraudoux P. Determination of bromadiolone residues in fox faeces by LC/ESI-MS in relationship with toxicological data and clinical signs after repeated exposure. Environ Res. 2010;110:664–74.
- Feinstein D.L., Akpa B.S., Ayee M.A., Boullerne A.I., Braun D., Brodsky S.V., et al. The emerging threat of superwarfarins: history, detection, mechanisms, and countermeasures. Ann N Y Acad Sci. 2016;1374:111–22.
- Yan H., Xiang P., Zhu L., Shen M. Determination of bromadiolone and brodifacoum in human blood using LC-ESI/MS/MS and its application in four superwarfarin poisoning cases. Forensic Sci Int. 2012;222:313–7.
- Woody B.J., Murphy M.J., Ray A.C., Green R.A. Coagulopathic effects and therapy of brodifacoum toxicosis in dogs. J Vet Intern Med. 1992;6:23–8.
- Matuszewski B., Constanzer M., Chavez-Eng C. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS. Anal Chem. 2003;75:3019–30.
- Eason C.T., Milne L., Potts M., Morriss G., Wright G.R.G., Sutherland O.R.W. Secondary and tertiary poisoning risks associated with brodifacoum. NZ J Ecol. 1999;23:219–24.
- Colyer A., Gilham M.S., Kamlage B., Rein D., Allaway D. Identification of intra- and inter-individual metabolite variation in plasma metabolite profiles of cats and dogs. Br J Nutr. 2011;106:S146–9.
- Carakostas M.C., Banerjee A.K. Interpreting rodent clinical laboratory data in safety assessment studies: biological and analytical components of variation. Fundam Appl Toxicol. 1990;15:744–53.
- Bertelsen M.F., Kjelgaard-Hansen M., Howell J.R., Crawshaw G.J. Short-term biological variation of clinical chemical values in Dumeril's monitors (Varanus dumerili). J Zoo Wildl Med. 2007;38:217–21.
- Jensen A.L., Aaes H. Critical differences of clinical chemical parameters in blood from dogs. Res Vet Sci. 1993;54:10–4.
- Shaffer E.A. Control of gall-bladder motor function. Aliment Pharmacol Ther. 2000;14:2–8.
- Roberts M.S., Magnusson B.M., Burczynski F.J., Weiss M. Enterohepatic circulation. Clin Pharmacokinet. 2002;41:751–90.
- Simon F.R. Hormonal regulation of bile secretion. In: Arias I, Alter HJ, Boyer JL, editors. The liver: biology and pathobiolology. New York: Wiley Blackwell; 2010. p. 323–39.
- Parmar G., Bratt H., Moore R., Batten P. Evidence from common binding site in vivo for the retention of anticoagulants in rat liver. Hum Toxicol. 1987;6:431–2.
- Vandenbroucke V., Bousquet-Melou A., De Backer P., Croubels S. Pharmacokinetics of eight anticoagulant rodenticides in mice after single oral administration. J Vet Pharmacol Ther. 2008;31:437–45.
- Crowell M., Eason C., Hix S., Broome K., Fairweather A., Moltchanova E., et al. First generation anticoagulant rodenticide persistence in large mammals and implications for wildlife management. NZ J Zool. 2013;40:205–16.
- Erickson W.A., Urban D.J. Potential risks of nine rodenticides to birds and nontarget mammals: a comparative approach. Washington, DC: US Environmental Protection Agency, Office of Prevention, Pesticides and Toxic Substances; 2004.
- Norwegian Environment Agency. List of authorised biocidal products in Norway. 2017. http://www.miljodirektoratet.no/no/Tema/Kjemikalier/ Kjemikalieregelverk/Biocider/Biocidprodukter/Godkjente-produkter-i- Norge/. Accessed 12 Mar 2017.
- Meerburg B.G., van Gent-Pelzer M.P., Schoelitsz B., Esther A., van der Lee T.A. Distribution of anticoagulant rodenticide resistance in Rattus norvegi- cus in the Netherlands according to Vkorc1 mutations. Pest Manag Sci. 2014;70:1761–6.
- Pelz H.J., Rost S., Muller E., Esther A., Ulrich R.G., Muller C.R. Distribution and frequency of VKORC1 sequence variants conferring resistance to anticoagulants in Mus musculus. Pest Manag Sci. 2012;68:254–9.
- Geduhn A., Esther A., Schenke D., Mattes H., Jacob J. Spatial and temporal exposure patterns in non-target small mammals during brodifacoum rat control. Sci Total Environ. 2014;496:328–38.
- Fisher P.M., Meiwen Z., Campion M., Pech R. Anticoagulant rodenticides in the environment: excretion as a residue transfer pathway. In: 17th Australasian vertebrate pest conference. Canberra, Australia; 2017.
- Watts R.G., Castleberry R.P., Sadowski J.A. Accidental poisoning with a super-warfarin compound (brodifacoum) in a child. Pediatrics. 1990;86:883–7.
- Eason C., Wright G., Batcheler D. Anticoagulant effects and the persistence of brodifacoum in possums (Trichosurus vulpecula). NZ J Agric Res. 1996;39:397–400.
- Laas F.J., Forss D.A., Godfrey M.E.R. Retention of brodifacoum in sheep tissues and excretion in faeces. NZ J Agric Res. 1985;28:357–9.
- Robben J.H., Kuijpers E.A., Mout H.C. Plasma superwarfarin levels and vitamin K1 treatment in dogs with anticoagulant rodenticide poisoning. Vet Q. 1998;20:24–7.
- Coumatetralyl. In: MacBean C., editor. The pesticide manual. 16th ed. London: British Crop Production Council; 2012. p. 238–9.
- Shore R.F., Birks J.D.S., Afsar A., Wienburg C.L., Kitchener A.C. Spatial and temporal analysis of second-generation anticoagulant rodenticide residues in polecats (Mustela putorius) from throughout their range in Britain, 1992-1999. Environ Pollut. 2003;122:183–93.
- Riley S.P.D., Bromley C., Poppenga R.H., Uzal F.A., Whited L., Sauvajot R.M. Anticoagulant exposure and notoedric mange in bobcats and mountain lions in urban southern California. J Wildl Manage. 2007;71:1874–84.
- Kopanke J.H., Horak K.E., Musselman E., Bennett K., VandeWoude S., Bevins S.E. Effects of low-level brodifacoum exposure on the feline immune response. In: 17th annual research day. Colorado State University's College of Veterinary Medicine and Biomedical Sciences; 2016.
- Yuanji S. Research on the control of forest rat using coumatetralyl. J Northeast For Univ. 1996;7:8–12.
- Chopra G., Parshad V.R. Evaluation of coumatetralyl against two predominant murid species. J Hyg. 1985;94:327–30.
- Eason C.T., Wickstrom M.L. Vertebrate pesticide toxicology manual (poisons). Department of Conservation Technical Series 23. Wellington: Department of Conservations; 2001. p. 122.
- Lam Y.M. Responses of three Malaysian rat species to regular intermittent feedings on first generation anticoagulant rodenticides. In: Richards CGJ, Ku TY, editors. Control of mammal pests. London: Taylor & Francis; 1987. p. 155–69.
- EU. Directive 98/8/EC concerning the placing biocidal products on the market. Assessment report: coumatetralyl. 2009.
- National Chemicals Inspectorate. Toxicological evaluation of the rodenticide coumatetralyl PM 931 123. Solna: National Chemicals Inspectorate; 1993. p. 1–17.
Источник: Acta Veterinaria Scandinavica (2018) 60:3. This article is distributed under the terms of the Creative Commons Attribution 4.0 International License CGntr3l (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/ publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
СВМ № 3/2018