Описание клинических проявлений, МРТ-находок и патологических изменений на примере четырёх случаев
John H. Rossmeisl Jr.1, Thomas E. Cecere2, Gregg D. Kortz3, David A. Geiger4, Richard L. Shinn1, Jonathan Hinckley1, David L. Caudell5 and Jessica A. Stahle6
1Veterinary and Comparative Neuro-Oncology Laboratory, Department of Small Animal Clinical Sciences, Virginia-Maryland College of Veterinary Medicine, Virginia Tech, Blacksburg, VA, United States
2Department of Biomedical Sciences and Pathobiology, Virginia-Maryland College of Veterinary Medicine, Virginia Tech, Blacksburg, VA, United States
3Department of Neurology VCA Sacramento Veterinary Referral Center, Sacramento, CA, United States
4Geiger Veterinary Neurology Redwood City, CA, United States
5Department of Pathology and Comparative Medicine, School of Medicine, Wake Forest University, Winston-Salem, NC, United States
6Department of Diagnostic Imaging, Red Bank Veterinary Hospital, Tinton Falls, NJ, United States
Ключевые слова: собаки, спинномозговой синдром, шейный отдел спинного мозга, миеломаляция, заболевания межпозвонковых дисков.
Вступление
Изменения проводимости МР-сигнала интрамедуллярным веществом (ИПИВ) часто наблюдаются как у людей, так и у собак с различными заболеваниями спинного мозга [7–8]. Интерпретация этих изменений служит одним из основных инструментов диагностики в таких случаях, поэтому с целью стандартизации и упрощения процесса расшифровки МРТ-картины было предпринято множество попыток дифференцировать ИПИВ. Одним из вариантов стало деление на полостные (ПИПИВ) и неполостные (НПИПИВ) на основании их внешнего вида и топографического распределения поражений в тканях спинного мозга и его паренхиме [3; 5–7]. Для ПИПИВ, наблюдаемых при повреждениях полостного характера, основными причинами которых являются травма и сирингомиелия (СМ), характерна картина чётко ограниченных интрапаренхимальных зон снижения интенсивности сигнала в режиме T1W и схожей или чуть сниженной интенсивности сигнала по сравнению со спинномозговой жидкостью (СМЖ) в режимах T2W и STIR (short tau inversion recovery) [5; 7; 8]. Хотя трудно дифференцировать различные типы ПИПИВ, основываясь только на МР-изображениях, существуют некоторые критерии, патогномоничные для определённых повреждений. Так, фокальные кистозные элементы всегда располагаются в непосредственной близости от эпицентра повреждения, в то время как при сирингомиелии они распространяются в прилегающие сегменты спинномозгового ствола и обычно наблюдаются в центральной зоне среза спинного мозга с вовлечением дорсальных рогов [8]. НПИПИВ не имеют такой строгой топографической привязки, они могут наблюдаться в любых отделах спинного мозга, в основном проявляясь в виде слабо очерченных зон снижения сигнала в T2W-режиме по сравнению с СМЖ, а в режиме T1W сигнал может не отличаться или быть немного слабее по сравнению с нормальной паренхимой спинного мозга в зависимости от тяжести и продолжительности заболевания. В ветеринарной литературе на данный момент существует лишь несколько отдельных докладов, касающихся описания ПИПИВ и НПИПИВ на МРТ у собак с заболеваниями неврологического профиля, и в большинстве из них описываются изменения у собак с сирингомиелией на фоне Киари-подобной мальформации (КПМ) или травмой спинного мозга, ассоциированной с грыжей или протрузией межпозвонкового диска [3; 8]. На основании этих, а также многих других исследований из гуманной медицины можно суммировать, что изменение проводимости МР-сигнала интрамедуллярным веществом наблюдается при широком спектре патологических процессов в спинном мозге, включая атрофию, кистозный или кавитационный некроз, отёк спинного мозга, демиелинизацию, глиоз, кровоизлияние и СМ [3; 8; 9].
Несмотря на ограниченность данных по этой теме, количественная и качественная характеристики ИПИВ имеют серьёзный потенциал в качестве прогностических факторов у собак с патологиями спинного мозга. К примеру, было установлено, что у собак с острой травмой спинного мозга, связанной с грыжей межпозвонкового диска, наличие и выраженность ИПИВ в T2W-режиме являются негативными прогностическими факторами [2; 10; 11]. Кроме того, выявлена корреляция между характеристиками ИПИВ в T2W и выраженностью клинической симптоматики у собак со спондиломиелопатией шейного отдела (ШСМ) [4], а также между прогрессированием ИПИВ, соответствующих глиозу или фиброзу, и манифестацией или нарастанием клинической симптоматики у собак с СМ на фоне КПМ [8]. У людей одним из редких видов ИПИВ является симптом «глаз змеи» (миелопатия по типу змеиных глаз, МЗГ), также называемый симптомом «глаз совы». МЗГ характеризуется двусторонними симметричными зонами гиперинтенсивности в режиме Т2, в основном затрагивающими вентральные рога на поперечном срезе спинного мозга, что напоминает пару змеиных глаз (илл. 1) [9]. При МЗГ в этих участках обычно наблюдаются изо- или гипоинтенсивность сигнала в режиме T1W и отсутствие реакции на контрастирование. Однако этот признак не патогномоничен и может наблюдаться при ШСМ, спорадической болезни нижних мотонейронов, ишемии спинного мозга, оссификации задней продольной связки позвоночника, боковом амиотрофическом склерозе, интоксикации кобальтом и болезни Хираяма [9; 12]. У людей с МЗГ симптоматика сводится к слабости нижних мотонейронов верхних конечностей, а прогноз зависит от этиологии заболевания.
В данной серии случаев на примере 4 собак с заболеваниями спинного мозга, сопровождающимися симптомом «глаз змеи» на МРТ, будет описана клиническая симптоматика, а также нейропатологические корреляции и исходы заболеваний.
Распространённость МЗГ
Для этого исследования были отобраны медкарты и МРТ-снимки 481 собаки с диагностированными заболеваниями спинного мозга в сегменте С6-Тh2 (см. справочные материалы). Этиологические диагнозы, установленные при помощи данных МРТ-сканирования, включали в себя: грыжи межпозвонковых дисков (339/481, 70 %), шейную спондиломиелопатию (32/481, 7 %), фиброзно-хрящевую эмболическую миелопатию (30/481, 6 %), неоплазии (30/481, 6 %), менингомиелит или миелит (21/481, 4 %), дискоспондилит (14/481, 3,5 %), неустановленные диагнозы (7/481, 1,5 %), а также переломы и смещения позвонков (4/481, 0,8 %). ИПИВ наблюдались в 169/481 (35 %) случаев, и у 4 собак они соответствовали симптому «глаз змеи», что говорит о распространённости МЗГ среди собак с диагностированной миелопатией спинного мозга в сегменте С6-Т2 в 0,8 %. Все собаки, у которых была выявлена МЗГ, прошли сканирование в аппаратах МРТ мощностью в 1.5Т (справочные материалы, стр. 1).
Описание случаев и исходы
Случай 1
Кобель породы лхасский апсо в возрасте 6 лет поступил с нарушением походки, прогрессирующим в течение последнего месяца. Описывая эти нарушения, владелец сказал, что собака как будто «ползает по-армейски» (army crawl). Клиническая симптоматика начала проявляться в опущенном положении головы, атаксии всех конечностей, а также предположительной болезненности в шейном отделе. Болезненность и атаксия прошли через 2 недели покоя в клетке и терапии карпрофеном, но в последующие 2 недели походка развилась в то, что владелец описывал как передвижение «ползком по-армейски».
При общем физикальном осмотре патологические находки ограничивались нервной системой. Наблюдались признаки тетрапареза с более выраженной слабостью в передних конечностях, однако собака могла самостоятельно передвигаться, согнув при этом передние конечности и перенося вес на предплечья. В передних конечностях наблюдался парез и дефицит постуральной реакции, а также снижение тонуса мышц и рефлексов трицепсов и мышц-сгибателей с обеих сторон. В задних конечностях отмечалось ослабление проприоцепции и задержка постуральной реакции слева и нормальные рефлексы справа. Спинальные рефлексы задних конечностей были сохранены. Признаков болезненности при пальпации шейного отдела выявлено не было. Мышцы передних конечностей были умеренно атрофированы. Диагноз включал миелопатию в сегменте С6-Т2 спинного мозга и двустороннюю нейропатию плечевых сплетений.
После седации собаке была проведена электромиография (ЭМГ) шейного сегмента слева и грудного отдела, а также МРТ шейного отдела позвоночника. В левом трицепсе, двуглавой мышце плеча, длинном лучевом разгибателе запястья и надостной мышце отмечалось усиление инсерционной активности, потенциалов фибрилляции и позитивных острых волн. В мышцах головы, дорсальных мышцах грудного отдела и левой задней конечности патологий на ЭМГ выявлено не было. На МРТ был обнаружен участок снижения сигнала в режиме T2W в позвоночном канале в зоне межпозвонкового диска С6-С7, соответствующий картине грыжи межпозвонкового диска с умеренной вентральной и левосторонней компрессией и дорсальным смещением спинного мозга. На сагиттальных снимках в T2W- и STIR-режимах визуализировалась чётко ограниченная продолговатая зона гиперинтенсивности в интрамедуллярном веществе от С5 до краниального полюса С7. На поперечных снимках в режимах T2W и FLAIR (илл. 1B) зоны гиперинтенсивности располагались двусторонне симметрично и ограничивались вентральными рогами серого вещества. В режиме T1W интенсивность сигнала в этих зонах была однородной с окружающим веществом, что сохранялось после внутривенного введения контраста. На основании этих снимков был поставлен диагноз экструзии межпозвонкового диска С6-С7 и ассоциированной мультисегментарной ИПИВ. Расположение зон ИПИВ было интерпретировано как свидетельство двустороннего поражения передних рогов спинного мозга по типу «глаз змеи» [9]. Дифференциальный диагноз с учётом наблюдаемых ИПИВ включал в себя полостные образования, отёк, глиоз и некроз.
Собаке была проведена декомпрессия нервного ствола хирургическим путём с вентральным доступом (Ventral slot) на уровне С6-С7. Собака была выписана под наблюдение хозяина через двое суток после операции без видимых изменений в её неврологическом статусе. На контрольном осмотре через 2 недели после выписки обнаружилось прогрессирование пареза передних конечностей и мышечной атрофии. На КТ-снимках шейного отдела позвоночника не было отмечено признаков экстрадурального сдавления спинного мозга на уровне С6-С7 или других осложнений, связанных с оперативным вмешательством. Собака была направлена на курс ЛФК. Несмотря на реабилитацию, моторная функция передних конечностей продолжала ухудшаться в течение последующих 4 недель, после чего собаку усыпили в связи с необратимым параличом передних конечностей. Было проведено вскрытие.
При визуальном осмотре не было обнаружено признаков выпирающего в просвет позвоночного канала межпозвонкового диска, на уровне С6-С7 отмечалась рана от операционного вмешательства, заполненная фиброзной тканью. В сегменте спинного мозга от краниального полюса позвонка С5 до С8 наблюдались двусторонне расположенные участки повреждений серого вещества полостного характера, затрагивающие передние рога (илл. 1С). При микроскопическом исследовании участки были симметричны, ограниченны сегментами VI–IX серого вещества и наиболее интенсивны в сегменте С5-С7 спинного мозга. Полостные образования в сером веществе, наиболее ярко выраженные в сегменте VI, в центре сегмента VII и дорсомедиальном участке сегмента VIII, содержали продукты клеточного распада, фагоциты, поглотившие клетки глии (gitter cells), астроциты и редкие нейроны с признаками хроматолиза. Нейроны в латеральной зоне сегмента VII, центральной зоне сегмента VIII и в сегменте IX демонстрировали признаки некроза: угловатая, сморщенная, ярко окрашенная эозинофином цитоплазма и кариопикноз. При окраске альциановым синим не было выявлено хрящевых тканей. Посмертным диагнозом стал регионарный двусторонний некроз серого вещества в сегментах С5-С8 спинного мозга и последующая нейрогенная мышечная атрофия передних конечностей.
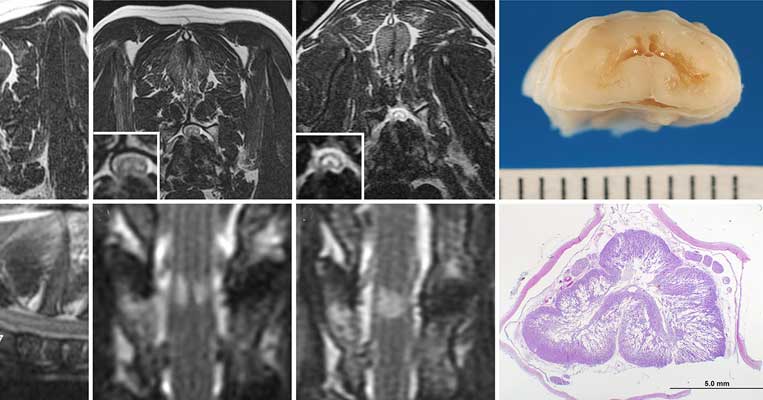
 |
| Илл. 1. Топографические, МР-признаки и общий вид на вскрытии при миелопатии собак по типу «глаз змеи». (А) Схематическое изображение МР-снимка в режиме T2W в норме на уровне сегмента спинного мозга С5. На изображении показана схема сосудистой сети и структура пластины Рекседа. Белыми овалами отмечены симметричные двусторонние зоны повреждений, распространённые в пластинках VI–IX, которые наблюдаются при симптоме «глаз змеи». (В) Поперечный срез в режиме T2W сегмента С5 в краниальном направлении, полученный в случае 1. На снимке виден характерный признак «глаз змеи» — симметричные двусторонние зоны повышения сигнала в вентральных рогах серого вещества и дорсо-вентральное уплощение спинного мозга. (С) Повреждения по типу «глаз змеи» патанатомически выглядят как двусторонние кавитации в вентральных рогах сегмента С5 и множественные очаги размягчения; случай 1 |
Случай 2
Беспородный кастрированный кобель в возрасте 8 лет поступил на приём с болями в шее в течение 3 дней и гемипарезом, переросшим в тетраплегию. На осмотре была зафиксирована тетраплегия с полным отсутствием постуральной реакции всех конечностей, снижение мышечного тонуса и рефлексов передних конечностей, а также гиперрефлексия и спазм мышц задних конечностей. Болезненность в шее проявлялась при её сгибании. Первичным диагнозом была миелопатия на участке С6-Тh2.
Под общим наркозом было проведено МРТ-сканирование шейного отдела позвоночника. На снимках определялись ИПИВ на участке С5-С6, связанные со сдавлением нервного ствола экстрадуральной гематомой (илл. 2А, В). В паренхиме спинного мозга патологических изменений не наблюдалось. Собаке была проведена декомпрессия нервного ствола путём хирургического вмешательства с вентральным доступом на уровне С5-С6 (ventral slot). На момент выписки спустя 3 суток после операции собака передвигалась самостоятельно, отмечалась атаксия задних конечностей.
Через 7 дней после операции на контрольном осмотре собака уже не могла самостоятельно передвигаться, отмечался тяжёлый парез нижних мотонейронов и мышечная атрофия передних конечностей, тонус мышц и рефлексы задних конечностей были в норме. Было проведено повторное МРТ-сканирование шейного отдела позвоночника, и в этот раз на снимках не было выявлено признаков наблюдаемой ранее компрессии спинного мозга в зоне С5-С6, однако при введении контрастного вещества наблюдались ИПИВ в виде «глаз змеи» (илл. 2С-F). В качестве предположительных причин этого явления рассматривались интрамедуллярное кровоизлияние, подострое нарушение кровоснабжения, отёк и миелит. Исследование спинномозговой жидкости выявило повышение уровня белка до 101 мг/дл (норма < 45 мг/дл). Непрямое артериальное давление, показатели коагулограммы и время кровотечения на слизистой поверхности щеки были в пределах нормы. Собака проходила физическую реабилитацию и получала преднизолон (0,5 мг/кг/день), но положительной динамики не наблюдалось, способность передвигаться самостоятельно не восстановилась. После того как у собаки была зафиксирована необратимая потеря функции нижних моторных нейронов и критическое снижение мышечной массы, её усыпили. Вскрытие было произведено спустя 3 месяца после операции. Патоморфологические находки в сером веществе были похожи на описанные в случае 1, но в данном случае помимо этого в месте соединения передних и боковых рогов серого вещества с белым веществом также наблюдалась вакуолизация белого вещества с отёчностью аксонов разной выраженности (илл. 2G). Заключительным диагнозом стал мультисегментарный двусторонний симметричный некроз серого вещества спинного мозга на уровне С5-С8.
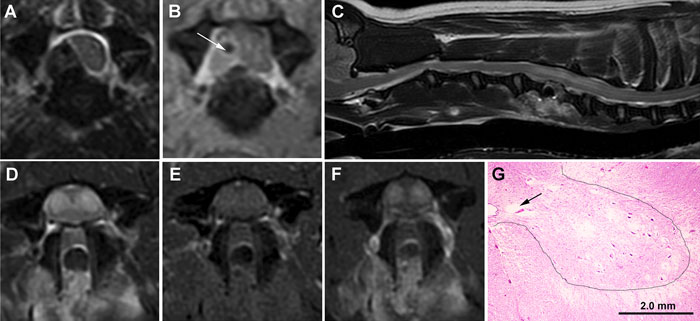 |
| Илл. 2. Серия МР-изображений и гистологический препарат в случае 2. (А) Поперечный срез в режиме T2W. Определяется повышение сигнала в области повреждения межпозвонкового диска С5-С6 со смещением в правую часть позвоночного канала, приводящего к выраженному сдавлению и смещению спинного мозга. На поперечных снимках в TWI (В) после контрастирования смешанная интенсивность сигнала указывает на наличие экстрадурального кровоизлияния в совокупности с выпирающим межпозвонковым диском (отмечено стрелкой). (С) Сагиттальный срез в режиме T2W, снимок выполнен через 7 дней после операции. Виден послеоперационный дефект в области С5-С6 и тубулярные интрамедуллярные зоны повреждений, растягивающиеся от краниального края С5 до краниального края С7. В аксиальной проекции ИПИВ по типу «глаз змеи» выглядят как симметричные зоны повышения сигнала в режиме T2W (D) в сером веществе и умеренного повышения сигнала в режиме T1W (E) и после контрастирования (F). Несмотря на разрешение предшествовавшей экстрадуральной компрессии, спинной мозг в области поражения отёчен, а зона субарахноидального пространства затемнена. (G) На гистологическом исследовании тканей из сегмента С6 спинного мозга отмечаются зоны различной степени кавитации (чёрная стрелка) и некроза серого вещества; нейроны латеральных отделов пластинок VII–IX демонстрируют ацидофильный некроз, выражающийся в угловатой цитоплазме гиперэозинофильной окраски и кариопикнозе. На границе между средними и вентральными рогами (пунктирная линия) и белым веществом спинного мозга также отмечается вакуолизация белого вещества. Окраска гематоксилин-эозином. |
Случай 3
Стерилизованная сука доберман-пинчера в возрасте 4 лет в первый раз была представлена на осмотр с клиникой лёгкого тетрапареза с сохранением подвижности и болезненностью в шее на уровне С6-Тh2. На тот момент МРТ-сканирование выявило признаки сдавления нервного ствола на уровне С6-С7 за счёт грыжи межпозвонкового диска. Патологических ИПИВ выявлено не было (илл. 3А, В). Собаке была проведена декомпрессия путём оперативного вмешательства с вентральным доступом на уровне С6-С7. В результате лечения неврологические функции полностью восстановились.
Собака поступила повторно спустя примерно 6 лет с похожей клиникой лёгкого тетрапареза, соответствующей миелопатии на уровне С6-Тh2, а также генерализованной мышечной атрофией.
На МР-снимках обращало на себя внимание снижение интенсивности сигнала в тканях всех межпозвонковых дисков шейного отдела позвоночника. Отмечались умеренные протрузии дисков С5-С6 и С6-С7, приводящие к незначительному сдавлению спинного мозга. Дорсальнее мозга определялось незначительное снижение сигнала в спинномозговой жидкости и дорсальной эпидуральной жировой клетчатке в режиме T2W. Двусторонне симметричные зоны гиперинтенсивности в T2W- и STIR-режимах в виде «глаз змеи» наблюдались чуть выше диска С6-С7 (илл. 3С, D), а в телах позвонков С6 и С7 — изменения, соответствующие перенесённому оперативному вмешательству. МРТ-находки были интерпретированы как проявления прогрессирующей шейной спондиломиелопатии и гипертрофии связочного аппарата шейного отдела. Для выявления возможных нейромышечных расстройств, которые могли участвовать в патогенезе генерализованной мышечной атрофии, была взята биопсия мышц. В образцах, взятых из трицепсов и двуглавых мышц бедра, была выявлена умеренная генерализованная мышечная атрофия и избыточное скопление жира в мышечных волокнах 1-го типа, что указывало на метаболическую миопатию, вызванную кислородным голоданием, дефицитом карнитина или эндокринопатией. В качестве диагноза собаке был поставлен гипотиреоз и назначена лекарственная терапия, включавшая левотироксин (0,1 мг/4,5 кг ПО 2 р/сут), ацетил-L-карнитин (5 мг/кг ПО 2 р/сут), коэнзим Q10 (1 мг/кг ПО 1 р/сут), рибофлавин (5 мг/кг ПО 1 р/сут), витамин Е (200 МЕ ПО 1 р/сут) и габапентин (5 мг/кг ПО 2 р/сут).
Собака была повторно представлена на осмотр 10 месяцев спустя по поводу медленно прогрессирующей выраженной слабости передних конечностей и мышечной атрофии. Собака с трудом передвигалась самостоятельно, находки на неврологическом осмотре соответствовали картине миелопатии в сегменте С6-Тh2, однако преимущественное поражение передних конечностей указывало на вероятное сопутствующее поражение центрального компонента спинного мозга или на прогрессирование ранее выявленного генерализованного нейромышечного расстройства. Нарушений со стороны эндокринной системы не наблюдалось. На снимках с очередного МРТ-сканирования прослеживались те же нарушения, которые были выявлены на предыдущих, за исключением появления симптома «глаз змеи» в сегментах С5-С6 и С6-С7, а также прогрессирования атрофии спинного мозга, что было установлено на основании измерения диаметра нервного ствола на уровне эпицентров повреждений [3]. В связи с наличием изменений, свидетельствующих о прогрессировании глиоза или полиомиеломаляции, дополнительных оперативных вмешательств решено было не проводить. Клиническая симптоматика продолжала прогрессировать, и через 16 месяцев собака полностью утратила способность к самостоятельному передвижению в связи с тяжёлой мышечной атрофией. МРТ-сканирование было выполнено в четвёртый раз, его результаты подтвердили дальнейшее прогрессирование шейной спондиломиелопатии, выраженное в усилении протрузии межпозвонковых дисков С5-С6 и С6-С6 и выраженной атрофии спинного мозга на этих уровнях.
Зоны поражений на уровне С5-С6 и С6-С7, ранее располагавшиеся симметрично с двух сторон в форме глаз змеи, теперь слились в одну солидную зону гиперинтенсивности МР-сигнала в режимах T2W/STIR в сером веществе (илл. 3Е, F). Собаку усыпили и направили на вскрытие.
При визуальном осмотре наблюдались протрузии межпозвонковых дисков С4-С5, С5-С6 и С6-С7 в позвоночный канал. На уровне С6 в спинном мозге отмечался участок размягчения и уплощения в дорсо-вентральном направлении. При препарировании в этом участке были выявлены двусторонне расположенные обширные полости, полимиеломаляция и слабое окрашивание серого вещества красителем (илл. 3G). В сегментах С5 и С7 наблюдались похожие поражения, но не столь выраженные.
Микроскопическое исследование тканей спинного мозга показало, что кавитационный процесс в сегментах С6-С7 разрушил значительное количество серого вещества и перешёл на прилежащие ткани белого вещества в виде поражений симметричной решетчатой формы, наиболее выраженных в сегменте С6 (илл. 3Н). Зоны кавитаций в сером веществе в основном содержали неокрашенные плохо дифференцируемые остатки разрушенных клеток, внеклеточные волокна тау-белков («призраки нейронов», ghost form neurons), фагоциты (gitter cells) и астроглиоз. В вакуолизированном белом веществе определялись набухшие аксоны, астроглиоз и разрушение миелиновой оболочки в зонах наиболее выраженных повреждений. В вентральных корешках спинного мозга, соответствующих этим сегментам, отмечался выраженный внутриклеточный отёк и фиброз. Фиброзное кольцо в межпозвонковом диске С6-С7 не определялось, межпозвонковое пространство занимали хрящевые массы с базофильным матриксом и соединительной тканью, формирующими зрелую фиброзную ткань. На замыкательных пластинках было несколько фокальных надрывов, через которые хрящевые и фиброзные массы выходили в просвет позвоночного канала. Эти локальные протрузии были прикрыты выраженно оссифицированной задней продольной связкой. Заключительным диагнозом стал выраженный двусторонний кавитационный некроз серого вещества с вовлечением белого вещества в сегментах спинного мозга С5-С7, предположительно вторичный на фоне шейной спондиломиелопатии.
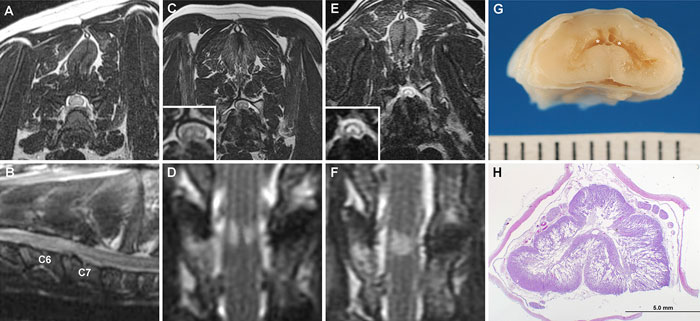 |
| Илл. 3. Серия МР-снимков и гистологический препарат в случае 3. T2W аксиальный (А) и парасагиттальный (В) снимки на момент постановки первичного диагноза шейной спондиломиелопатии С6-С7. Признаков ИПИВ в тканях спинного мозга не наблюдается. Поперечный (С) снимок в T2W и дорсальный (D) в STIR, сделанные через 6 лет после операции. Видны двусторонние симметричные зоны повышения сигнала по типу «глаз змеи» в вентральных рогах серого вещества на уровне межпозвонкового диска С6-С7. На аналогичных снимках, сделанных спустя ещё 2 года, замеченные ранее ИПИВ по типу «глаз змеи» слились в одну зону повышения сигнала T2W/STIR, охватывающую все области серого вещества (E, F). Также наблюдается прогрессирование атрофии спинного мозга на уровне С6-С7. При визуальном осмотре сегмента спинного мозга С6 (G) видны «географические» кавитации (звёздочки) и некроз серого вещества. (H) При гистологическом исследовании тканей спинного мозга сегмента С6 тоже видны двусторонние зоны некроза и кавитации, а также вакуолизация белого вещества. Окраска гематоксилин-эозином |
Случай 4
Кастрированный кобель породы боксёр в возрасте 3 лет поступил на осмотр по поводу нарушения походки в течение последних 6 недель, выраженного в слабости передних конечностей. Владелец сообщил, что не отметил никаких травмирующих эпизодов, предшествовавших началу заболевания. Неврологический осмотр выявил признаки, описанные в случае 1, за исключением того, что тонус мышц и рефлексы на задних конечностях были в норме, в связи с чем собака стояла и передвигалась в «позе молящегося». Кроме того, парез передних конечностей, неврологический дефицит и атрофия мышц носили ассиметричный характер с преимущественным поражением правой лапы. Неврологическим диагнозом стала миелопатия на участке С6-Т2 с вовлечением центрального нервного ствола или обоих плечевых сплетений.
Под общим наркозом было выполнено МРТ-сканирование шейного отдела (илл. 4), на котором были выявлены ИПИВ по типу «глаз змеи» в каудальной части шейного отдела нервного ствола. Единственным отклонением в анализе спинномозговой жидкости оказалось повышенное содержание белка (68 мг/дл, при норме < 45 мг/дл). На ЭМГ обращало на себя внимание присутствие позитивных острых волн на левом трицепсе, ромбовидной, подостной и надостной мышцах. Анализ на инфекционные заболевания проводился путём оценки титров антител к токсоплазме, неоспорам, Ehrilichia canis и риккетсиям (вызывающим у собак пятнистую лихорадку Скалистых гор) (Лаборатория инфекционных заболеваний в Афинах, штат Джорджия, США). Сыворотка крови также проверялась на криптококковый антиген (латексный анализ), а спинномозговая жидкость — на вирус бешенства собак (RT-PCR). Признаков инфекционной этиологии выявлено не было, и было решено назначить лечение по поводу предположительного диагноза аутоиммунного миелита с циклоспорином (5 мг/кг/день ПО) и преднизолоном (1 мг/кг ПО 2 р/сут), однако на контрольном осмотре через одну неделю никакой динамики в состоянии пациента не наблюдалось.
Спустя 5 недель собака умерла вскоре после поступления в клинику с септическим шоком на фоне незаживающих язв на разгибательной поверхности предплечий. Хозяин собаки сообщил, что с момента последнего осмотра её состояние постепенно ухудшалось, и при последнем поступлении атрофия мышц передних конечностей была значительно более выражена. На вскрытии были обнаружены двусторонне симметричные зоны миеломаляции в сегментах С5-С8 спинного мозга, а также нейрогенная мышечная атрофия передних конечностей. Визуальная и микроскопическая картина соответствовали описанной в случае 1. Других повреждений и возможных причин симптома «глаз змеи» найдено не было.
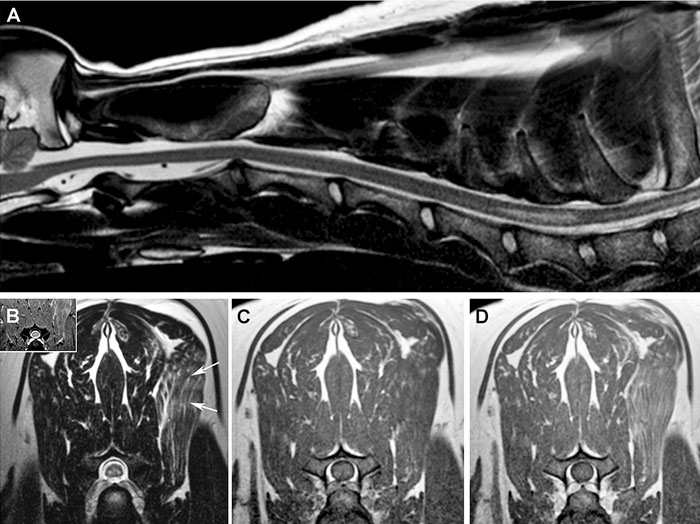 |
| Илл. 4. ИПИВ по типу «глаз змеи», случай 4. (А) Сагиттальный снимок в T2W показывает линейный участок повышения сигнала в интрамедуллярных тканях на протяжении от краниального края С6 до краниального края С7. На поперечных снимках ИПИВ по типу «глаз змеи» выглядят как двусторонне симметричные зоны гиперинтенсивности в T2W и T2*GRE (B) в вентральных рогах серого вещества, однородной интенсивности с окружающими тканями в T1W (C) и не реагирующие на контрастирование гадолинием (D). Заметно гетерогенное повышение сигнала в T2W [(B), стрелка] и контрастное усиление (D) левой передней зубчатой мышцы |
Обсуждение
В представленной серии случаев симптом «глаз змеи» был редким проявлением ИПИВ, которые клинически выражались в повреждении центрального нервного ствола с парезом и атрофией мышц передних конечностей. На МР-снимках этот симптом проявлялся в виде двусторонне симметричных зон повышения сигнала в T2W-режиме в сером веществе в вентральных рогах каудальных сегментов шейного отдела, которые на вскрытии соответствовали участкам кавитаций и некроза в VI–IX спинномозговых пластинах. Эта серия случаев демонстрирует, что клинико-патологическая картина при симптоме «глаз змеи» у собак имеет много общего с таковой у людей и собак с искусственно индуцированной в ходе эксперимента компрессией спинного мозга [9; 12; 13].
В 3 из 4 описанных здесь случаев описание МР-картины симптома «глаз змеи» соответствовало классическому: двусторонне симметричные зоны повышения интенсивности сигнала в сером веществе вентральных рогов в режимах T2W/STIR, изоинтенсивность с окружающими тканями в режиме T1W и отсутствие реакции на введение контрастного вещества [9; 12; 13]. Случай 2 несколько отличался от остальных — характерная картина «глаз змеи» была обнаружена спустя 7 дней после операции по декомпрессии нервного ствола; наблюдался отёк спинного мозга, в отличие от характерных для этого симптома участков его сдавления или атрофии; было вовлечено больше участков серого вещества по сравнению с классическим описанием; а также наблюдаемое усиление контрастности в ответ на введение гадолиния. У людей и собак подострая ишемическая миелопатия бывает ассоциирована с отёком спинного мозга и контрастным усилением участков ИПИВ, а у людей с подострым течением, сопровождающимся симптомом «змеиных глаз», усиление контрастности при введении гадолиния может носить очаговый или «пятнистый» характер [14; 15]. В гуманной медицине встречаются описания случаев предполагаемого нарушения кровоснабжения, приводящего к повреждениям в виде «глаз змеи», после успешных операций на шейном отделе позвоночника, что подходит под описание случая 2, где картина «глаз змеи» появилась после операции на межпозвонковом диске, которая прошла без осложнений [16]. К тому же, в случае 2 на вскрытии было обнаружено, что участки поражений ограничивались вентральными и боковыми рогами, а это значит, что усиление МР-сигнала в дорсальных рогах отражало обратимые изменения тканей, такие как локальный отёк.
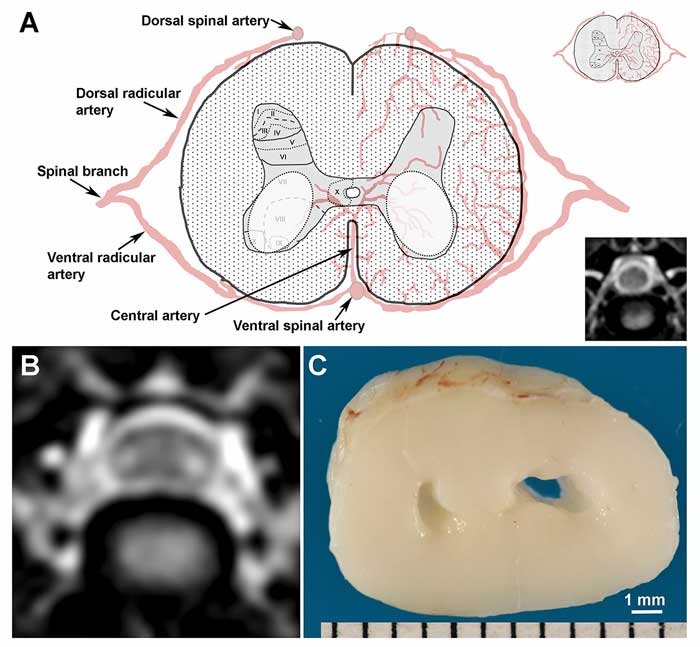
Топографическое распределение нейропатологических изменений ишемического характера, которые наблюдаются преимущественно в пределах серого вещества, свидетельствует о том, что ИПИВ по типу «глаз змеи» имеют хронический сосудистый генез с поражением на уровне бассейна центральных ветвей вентральной позвоночной артерии (илл. 1). Центральная спинномозговая артерия кровоснабжает значительную часть серого вещества, однако у собак она может формироваться по-разному: в виде единого ствола, отходящего от вентральной позвоночной артерии, который разделяется надвое и питает обе стороны нервного ствола, или же иметь отдельные сегментарные ветви, расходящиеся на правую и левую сторону [17]. При условии, что симптом «глаз змеи» имеет сосудистую этиологию, двусторонний характер поражения серого вещества даёт основания предполагать, что первый вариант строения спинномозговой артерии — единым стволом с бифуркацией — является предрасполагающим фактором для такого состояния. В экспериментах с искусственно спровоцированной компрессионной миелопатией у собак нарушение кровоснабжения спинного мозга в шейном отделе было ассоциировано с прогрессированием клинических, нейропатологических и МР-признаков, соответствующих паттерну «глаз змеи» [13]. Поскольку мы не обнаружили признаков венозного инфаркта, фиброзно-хрящевой эмболии или других сосудистых патологий, то, как и многие другие авторы, считаем, что это может быть вызвано преходящей венозной окклюзией у собак со стенозом позвоночного канала или нарушением биомеханики движений в шейном отделе позвоночного столба [13].
ИПИВ, связанные с компрессией спинного мозга грыжей межпозвонкового диска, которые наблюдались в случаях 1–3, имели характерный вид «глаз змеи», что соответствует описанию устойчивых изменений в гуманной медицине у людей с экстрадуральной компрессией спинного мозга [9; 12; 18]. Оперативное вмешательство с целью декомпрессии с использованием вентрального доступа было выполнено в случаях 1–3, и МР-снимки, сделанные после операции, подтвердили, что для достижения удовлетворительной декомпрессии было достаточно операционной раны размером в пределах 36–48 % от толщины поражённого межпозвонкового диска [19; 20]. Однако, как известно, у собак такой доступ часто приводит к нестабильности шейного отдела позвоночника, что потенциально может приводить к временным нарушениям кровоснабжения, ишемии или сдавлению нервного ствола [16; 19]. Динамическая компрессия спинного мозга является характерным отличительным признаком при шейной спондиломиелопатии у доберманов и на МРТ зачастую выражается в НПИПИВ [4]. Другим возможным механизмом развития ИПИВ в виде «глаз змеи» являются повторные сотрясения спинного мозга за счёт динамических протрузий МПД или гипертрофии связочного аппарата, что связано с повышенными метаболическими потребностями серого вещества. Изменения, наблюдаемые на серии МР-исследований в случае 3, выражались в хроническом прогрессирующем повреждении серого вещества по типу «глаз змеи», связанном с динамической шейной спондиломиелопатией и гипертрофией связочного аппарата. Это подтверждалось находками на вскрытии — в патогенезе сужения позвоночного канала участвовала как протрузия МПД, так и гипертрофия и оссификация связок. У людей шейная стенотическая миелопатия и оссификация задней продольной связки также являются состояниями, ассоциированными с ИПИВ по типу «глаз змеи» [9; 12].
В случае 4, где наблюдались быстро прогрессирующая и асимметричная слабость и мышечная атрофия передних конечностей, этиологию развития симптома «глаз змеи» определить не удалось. У людей изменения, описанные в случае 4 — клинические, электрофизиологические, а также МР-симптом «глаз змеи» — могут наблюдаться как при болезни нижних мотонейронов, так и при болезни Хираяма [21; 22]. Хотя не исключено, что симптом «глаз змеи» у собак без явной этиологии может быть манифестацией спорадического варианта атрофии шейных мышц, наблюдаемые в случае 4 МР-проявления, клиника, течение, неврологические проявления и топографическое распределение поражений не соответствовали ни одному из описанных до сих пор вариантов болезни нижних мотонейронов собак [23–25]. К тому же, у людей при спорадической БНМН чаще всего наблюдается вялопрогрессирующее течение, а у некоторых пациентов она может даже спонтанно затухать [21]. При болезни Хираяма смещение дурального мешка кпереди и уплощение нижних сегментов шейного отдела спинного мозга возникают при сгибании шеи [22]. Это приводит к сужению передней позвоночной артерии и последующей ишемии передних рогов спинного мозга [22; 26]. В отсутствие адекватного лечения болезнь Хираяма приводит к атрофии спинного мозга и симптому «глаз змеи», что считается негативными прогностическими факторами [26]. Ограничением данного исследования стало то, что в данной серии случаев не было проведено ни динамического МРТ-сканирования, ни ангиографии шейного отдела для определения потенциальной этиологии симптома «глаз змеи».
В гуманной медицине существует множество исследований, целью которых было связать определённый тип ИПИВ и степень их выраженности с клиническим прогнозом. В нескольких из них утверждается, что симптом «глаз змеи» у людей является необратимым изменением, ассоциированным с плохим прогнозом в плане восстановления неврологических функций [9; 13; 26], в то время как в других высказывается предположение, что эти изменения обратимы в зависимости от причины и своевременности принятых лечебных мер [12; 21]. Чтобы лучше понять патогенез и этиологию симптома «глаз змеи», в случае его обнаружения на статических снимках следует выполнять ангиографию шейных сосудов. Мы пришли к выводу, что этот симптом является признаком необратимых повреждений шейного отдела спинного мозга у собак. Результаты данного исследования говорят о том, что выявление этого симптома на МР-снимках означает плохой прогноз в плане сохранения или восстановления неврологических функций передних конечностей, учитывая распространённость некроза нервных клеток по протяжённости и по объёму повреждённых тканей в поперечном сечении.
Заявление об этике
Данное исследование следует правилам Virgina Tech и Колледжа ветеринарной медицины Вирджинии-Мэриленда о ретроспективных исследованиях; соглашение на публикацию было получено у всех хозяев собак в описанных случаях.
Вклад авторов
JR, GK, RS и DG подбирали клинические случаи. JR, GK, RS, DG и JS проверяли описание МР-снимков. TC, DC и JH занимались подготовкой нейропатологических образцов, снимков и описанием нейропатологических находок. JR и TC подготовили рукопись. Вклад всех авторов соответствует критериям авторства. Все авторы участвовали в редакции и подготовке статьи.
Благодарности
Авторы выражают благодарность доктору Роберту Дункану за патанатомический осмотр и интерпретацию находок в случае 1 и докторам Бернарду Джотнеру и Брайану Саммерсу за их помощь в интерпретации патанатомических находок в случае 3.
Справочные материалы
Справочные и дополнительные материалы по теме этой статьи можно найти онлайн здесь.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие любых финансовых или коммерческих взаимоотношений, которые могут расцениваться как конфликт интересов.
Литература
- Jeffery ND, Smith PM, Lakatos A, Ibanez C, Ito D, Franklin RJ. Clinical canine spinal cord injury provides an opportunity to examine the issues in translating laboratory techniques into practical therapy. Spinal Cord. (2006) 44:584–93. doi: 10.1038/sj.sc.3101912.
- Levine JM, Levine GJ, Porter BF, Topp K, Noble-Haeusslein J. Naturally occurring disk herniation in dogs: an opportunity for pre-clinical spinal cord injury research. JNeurotrauma. (2011) 28:675–88. doi: 10.1089/neu.2010.1645.
- Alisauskaite N, Spitzbarth I, Baumgartner W, Dziallas P, Kramer S, Dening R, et al. Chronic post-traumatic intramedullary lesions in dogs, a translational model. PLoS ONE. (2017) 12: e0187746. doi: 10.1371/journal.pone.0187746.
- da Costa RC, Parent JP, Dobson H, Holmberg D, Partlow G. Comparison of magnetic resonance imaging and myelography in 18 Doberman pinscher dogs with cervical spondylomyelopathy. Vet Radiol Ultrasound. (2006) 47:52331. doi: 10.1111/j.1740-8261.2006.00180.x.
- Lewis MJ, Cohen EB, Olby NJ. Magnetic resonance imaging features of dogs with incomplete recovery after acute, severe spinal cord injury. Spinal Cord. (2018) 56:133–41. doi: 10.1038/s41393–017–0004–8.
- Silberstein M, Hennessy O. Implications of focal spinal cord lesions following trauma: evaluation with magnetic resonance imaging. Paraplegia. (1993) 31:160–7. doi: 10.1038/sc.1993.31.
- Edgar R, Quail P. Progressive post-traumatic cystic and non-cystic myelopathy. Br J Neurosurg. (1994) 8:7–22. doi: 10.3109/02688699409002388.
- Hu HZ, Rusbridge C, Constantino-Casas F, Jeffery N. Histopathological investigation of syringomyelia in the Cavalier King Charles Spaniel. J Comp Path. (2012) 146:192–201. doi: 10.1016/j.jcpa.2011.07.002.
- Mizuno J, Nakagawa H, Chang HS, Hashizume Y. Postmortem study of the spinal cord showing snake-eyes appearance due to damage by ossification of the posterior longitudinal ligament and kyphotic deformity. Spinal Cord. (2005) 43:503–7.
doi: 10.1038/sj.sc.3101727. - Ito D, Matsunaga S, Jeffery ND, Sasaki N, Nishimura R, Mochizuki M, et al. Prognostic value of magnetic resonance imaging in dogs with paraplegia caused by thoracolumbar intervertebral disk extrusion: 77 cases (2000–2003). J Am Vet Med Assoc. (2005) 227:1454–60. doi: 10.2460/javma.2005.227.1454.
- Levine JM, Fosgate GT, Chen AV, Rushing R, Nghiem PP, Platt SR, et al. Magnetic resonance imaging in dogs with neurologic impairment due to acute thoracic and lumbar intervertebral disk herniation. J Vet Intern Med. (2009) 23:1220–6. doi: 10.1111/j.1939-1676.2009.0393.x.
- Zhang Z, Wang H. Is the «snake-eye» MRI sign correlated to anterior spinal artery occlusion on CT angiography in cervical stenotic myelopathy and amyotrophy? Eur Spine J. (2014) 23:1541–7. doi: 10.1007/s00586-014-3348-1.
- Al-Mefty O, Harkey HL, Marawi I, Haines DE, Peeler DF, Wilner HI, et al. Experimental chronic compressive cervical myelopathy. J Neurosurg. (1993) 79:550–61. doi: 10.3171/jns.1993.79.4.0550.
- De Risio L, Adams V, Dennis R, McConnell F, Platt S. Magnetic resonance imaging findings and clinical associations in 52 dogs with suspected ischemic myelopathy. J Vet Intern Med. (2007) 21:12908. doi: 10.1111/j.1939-1676.2007.tb01951.x.
- Vuong SM, Jeong WJ, Morales H, Abruzzo TA. Vascular diseases of the spinal cord: infarction, hemorrhage, and venous congestion myelopathy. Semin Ultrasound CTMR. (2016) 37:466–81. doi: 10.1053/j.sult.2016.05.008.
- Lee KY, You SG, Kim KW. Suspicious reperfusion injury of spinal cord after multilevel cervical posterior decompression without remarkable surgical insult — Two case reports. J Korean Soc Spine Surg. (2014) 21:97102. doi: 10.4184/jkss.2014.21.2.97.
- Caulkins SE, Purinton PT, Oliver JE Jr. Arterial supply to the spinal cord of dogs and cats. Am J Vet Res. (1989) 50:425–30.
- Takahashi M, Yamashita Y, Sakamoto Y, Kojima R. Chronic cervical cord compression: clinical significance of increased intensity on MR images. Radiology. (1989) 173:219–24. doi: 10.1148/radiology.173.1.2781011.
- Fauber AE, Wade JA, Lipka AE, McCabe GP, Aper RL. Effect of width of disk fenestration and a ventral slot on biomechanics of the canine C5-C6 vertebral motion unit. Am J Vet Res. (2006) 67:1844–48. doi: 10.2460/ajvr.67.11.1844.
- Rossmeisl JH Jr, White C, Pancotto TE, Bays A, Henao-Guerrero PN. Acute adverse events associated with ventral slot decompression in 546 dogs with cervical intervertebral disc disease. Vet Surg. (2013) 42:795806. doi: 10.1111/j.1532-950X.2013.12039.x.
- Sasaki S. Sporadic lower motor neuron disease with a snake eyes appearance on the cervical anterior horns by MRI. ClinNeurolNeurosurg. (2015) 136:12231. doi: 10.1016/j.clineuro.2015.06.006.
- Hirayama K, Tokumaru Y. Cervical dural sac and spinal cord in juvenile muscular atrophy of distal upper extremity. Neurology. (2000) 54:192226. doi: 10.1212/WNL.54.10.1922.
- Awano T, Johnson GS, Wade CM, Katz ML, Johnson GC, Talyor JF, et al. Genome-wide association analysis reveals a SOD1 mutation in canine degenerative myelopathy that resembles amyotrophic lateral sclerosis. Proc Natl Acad Sci USA. (2009) 106:2794–99. doi: 10.1073/pnas.0812297106.
- Cork LC, Griffin JW, Munnell JF, Lorenz M, Adams RJ. Hereditary canine spinal muscular atrophy. J Neuropathol Exp Neurol. (1979) 38:20921. doi: 10.1097/00005072-197905000-00002.
- Hartley WJ. Lower motor neurone disease in dogs. Acta Neuropathol. (1963) 2:334–42. doi: 10.1007/BF00685990.
- Xu H, Shao M, Zhang F, Noe C, Wang H, Zhu W, et al. Snake-eyes appearance on MRI occurs during the late stage of Hirayama disease and indicates poor prognosis. BioMed Res Int. (2019) 2019:9830243. doi: 10.1155/2019/9830243.
Источник: Frontiers in Veterinary Science 6:219. This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY).
СВМ № 4/2021
Вам также может быть интересна статья:
Патологоанатомические изменения у метиса таксы с нейроаксональной дистрофией