Ксения Лисицкая, кандидат биологических наук, ветеринарный врач-гистолог, цитолог, заведующая отделением патоморфологической диагностики ветеринарной клиники «Биоконтроль», Москва, lisksenia@mail.ru
 Лектор MVC
Лектор MVC
Введение
Опухоли желудка и кишечного тракта являются распространёнными онкологическими заболеваниями у собак и кошек, составляя суммарно до 10% всех злокачественных новообразований у кошек и до 1% у собак [1]. Локализацией с преобладающей инцидентностью новообразований является кишечник, тогда как на опухоли желудка приходится всего до 1% всех злокачественных опухолей у собак и кошек. Развитие современных методов визуальной и морфологической диагностики позволили в значительной степени расширить информацию о биологическом поведении опухолей желудочно-кишечного тракта, хотя аспекты терапии опухолей данной локализации всё ещё остаются достаточно слаборазвитыми и нуждаются в дальнейшем изучении их эффективности.
Опухоли желудка
Эпидемиология и клинические данные
Опухоли желудка чаще всего встречаются у животных среднего и пожилого возраста. Средний возраст собак с раком желудка — преобладающим типом опухолей желудка — равняется 8 годам, лейомиомы у собак возникают в ещё более позднем возрасте (средний возраст — 15 лет) [1]. Отмечена предрасположенность к раку желудка у кобелей, соотношение самцов и самок с данной опухоль составляет 2,5:1.
Точная этиология опухолей желудка не ясна. В различных исследованиях описана породная предрасположенность у собак пород чау-чау, стаффордширский бультерьер, бельгийская овчарка тервюрен, фландрский бувье, стандартный пудель, керн-терьер, вест-хайленд-уайт терьер, норвежский лундехунд, колли [2, 3], что говорит о возможном вкладе генетических факторов в канцерогенез рака желудка. У кошек в исследовании Bridgeford E.C. с соавт. (2009) в качестве этиологического фактора лимфомы желудка предположена Helicobacter spp. [4]. У собак предположенным этиологическим фактором рака желудка является длительное поедание нитрозаминов [1].
Преобладающим типом опухолей желудка у собак является аденокарцинома, составляя 70–80% случаев всех новообразований [1]. Реже встречаются лейомиомы и лейомиосаркомы, хотя в недавних исследованиях значительная их часть была переклассифицирована в опухоли другого гистогенеза — в гастроинтестинальные стромальные опухоли (ГИСО) [5]. Лимфомы желудка редко встречаются у собак, составляя менее 10% всех опухолей, редко также выявляются другие типы опухолей — плазмацитомы, карциноиды, различные саркомы [5]. Преобладающим типом опухолей желудка у кошек является лимфома. Рак желудка у кошек встречается нечасто, в 20 раз реже, чем рак кишечника [6].
Клинически рак желудка у собак чаще всего проявляется неспецифической симптоматикой прогрессирующих рвоты, анорексии и снижения массы тела, реже отмечается гематомезис и мелена, развивающиеся при наличии язвенного дефекта слизистой оболочки [7]. Хроническая рвота ассоциирована со стенозом, изъязвлением слизистой или нарушением моторики желудка. Похудание возникает как результат анорексии, нарушения переваривания и всасывания корма, потери белка и крови в результате развития язвенных дефектов слизистой. Клиническая симптоматика может длиться неделями и даже месяцами до постановки диагноза. Схожую симптоматику можно выявить у кошек при наличии опухолей желудка. В клиническом анализе крови у собак с раком желудка можно обнаружить гипопротеинемию, железо-дефицитную анемию с микроцитозом и гипохромией как результат хронической кровопотери [7]. Гладкомышечные опухоли у собак (лейомиомы и лейомиосаркомы) могут сопровождаться паранеопластической гипогликемией, в особенности при образованиях большого объёма [8]. После хирургической резекции данных опухолей уровень глюкозы в крови восстанавливается самопроизвольно.
Диагностика опухолей
Рак желудка у собак может иметь различные формы роста. Редким, но благоприятным является экзофитный рост в просвет органа на узком основании (на «ножке»). Такая форма роста хорошо визуализируется при гастроскопии и позволяет получить диагностичный материал при щипковой биопсии. Более часто раки желудка имеют бляшковидный рост с кратерообразным центральным дефектом (так называемый «рак-язва»), при этом клинически опухоль может быть недодиагностирована по причине схожести с длительно существующей язвой. Другим неблагоприятным типом роста является диффузный инфильтративный рост по подслизистому и мышечному слоям без формирования экзофитных образований. Стенка желудка при этом резко утолщается, что приводит к обозначению данной опухоли как «кожаный мешок» (linitis plastica).
Ультразвуковое исследование (УЗИ) и гастроскопия считаются наиболее эффективными методами диагностики рака желудка у собак. Рентгенографическое исследование, несмотря на его доступность, даёт достаточно низкую чувствительность и специфичность диагностики опухолей желудка [7]. В ходе УЗИ оценивают состоянию стенки органа, его толщину и равномерность. Типичная ультрасонографическая картина рака желудка включает трансмуральное утолщение стенки желудка (толщиной до 4 см) с соответствующим сужением просвета органа [9]. Наиболее распространённой локализацией рака желудка при этом у собак является область пилоруса и тела. Важной находкой является отсутствие правильной слоистости стенки желудка; часто отмечают слои пониженной эхогенности на самых внутренних и/или внешних участках стенки желудка, разделённые более эхогенной центральной зоной, что обозначают термином «псевдослоистость» [9]. Также часто можно выявить регионарную лимфоаденопатию.
Стромальные опухоли чаще всего локализуются в области пилоруса и выявляются на УЗИ как гипоэхогенные массы, растущие из мышечного слоя. Лейомиома при этом имеет гомогенную структуру, небольшой объём, эхогенную структуру, тогда как лейомиосаркома обычно имеет большой объём и часто содержит в центре неравномерную полость (соответствующую участку некроза или геморрагий) [7]. Лимфомы желудка обычно характеризуются трансмуральным утолщением стенки желудка с потерей нормальной слоистости и снижением эхогенности, а также лимфоаденопатией [7]. Также лимфома может проявляться наличием очаговой гипоэхогенной эксцентричной массы.
Самой частой находкой при гастроскопии при раке желудка у собак является наличие глубокой язвы с валикообразным неравномерным утолщением стенок органа вокруг неё [10]. При наличии инфильтративных опухолей щипковые биоптаты, взятые для морфологического исследования, могут не содержать информативный материал в связи с тем, что рак желудка часто сопровождается выраженным фиброзом и имеет глубокий инвазивный рост. В этом случае для окончательной диагностики часто требуется взятие полностеночных биоптатов желудка — только в них можно будет выявить опухолевые комплексы, в большинстве случаев на момент диагностики уже поражающие мышечную оболочку.
Терапия и прогнозы при раке желудка
Основным методом лечения рака желудка и гладкомышечных опухолей является хирургическое лечение. Средняя выживаемость после резекции рака желудка у 17 собак составила в одном исследовании два месяца, хотя описана выживаемость до шести месяцев и единичные случаи — до трёх лет [1]. В целом рак желудка имеет неблагоприятный прогноз у собак и кошек, а химиотерапия не показала эффекта. Прогноз лейомиом и плазмацитом хороший в связи с доброкачественным поведением опухолей.
Опухоли кишечника у домашних животных
Эпидемиология и клинические данные
Опухоли кишечника у домашних животных составляют до 1% от всех новообразований у собак, тогда как у кошек, по разным данным, они составляют 5–10% всех новообразований [1]. К опухолям кишечника предрасположены самцы и животные среднего и пожилого возраста — у кошек средний возраст составляет 10–12 лет, у собак 6–9 лет [1]. У кошек сиамской породы отмечена предрасположенность к развитию лимфомы и рака кишечника, у собак к раку кишки предрасположены колли и немецкие овчарки [1].
Клиническая симптоматика опухолей кишечника включает анорексию, потерю веса, рвоту, тенезмы, диарею. Опухоли, сопровождающиеся изъязвлением стенки органа, могут сопровождаться анемией, гематохезией, меленой, а при прободении кишечной стенки — септическим перитонитом. Симптоматика при раке кишки у собак в среднем длится около двух месяцев до постановки диагноза.
У собак наиболее распространёнными типами опухолей кишечника являются аденокарциномы, лимфомы и гастроинтестинальные стромальные опухоли. Ранее описанные как лейомиоимы и лейомиосаркомы, после активного внедрения иммуногистохимии в ветеринарную морфологическую диагностику большая часть опухолей была переклассифицирована у собак в гастроинтестинальные стромальные опухоли (ГИСО) [5]. Происхождением ГИСО являются не гладкомышечные клетки, а интерстициальные клетки Кахаля, относящиеся к пейсмейкерной системе кишечника, локализующейся между внутренним и наружными гладкомышечными слоями. Несмотря на внешнюю морфологическую схожесть с лейомиомой, ГИСО имеют агрессивное биологическое поведение и высокий уровень метастазирования, достигающий 30% (метастазы наиболее часто развиваются в лимфатических узлах, печени, по сальнику). Для постановки диагноза ГИСО и дифференцировки с гладкомышечными опухолями требуется ИХГ, и более чем 50% клеток ГИСО имеют положительную иммунореактивность к KIT (CD117) [6].
У кошек преобладают лимфомы кишки, и алиментарный анатомический тип лимфомы является самым часто встречающимся у данного вида животных. У кошек аденокарциномы и мастоцитомы находятся на втором и третьем местах по частоте встречаемости среди всех опухолей кишечника, соответственно, а мезенхимальные опухоли, в отличие от собак, выявляются редко [1].
А |
Б |
В |
Г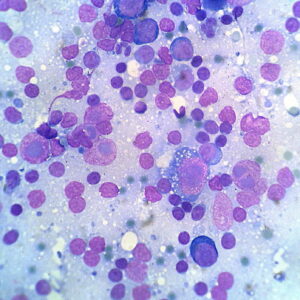 |
| Рис. Микрофотографии цитологических препаратов лимфокишечника кошек. А — Большая гранулярная лимфома. Клетки среднего и крупного размера, с глыбчатым рисунком хроматина. В цитоплазме — крупные азурофильные гранулы. Б — Мелкоклеточная лимфома. Клетки мелкого размера, морфологически плохо отличимые от малых лимфоцитов, с грубым рисунком хроматина и ободком слабо базофильной цитоплазмы. В–Г — Крупноклеточная лимфома. В — В-крупноклеточная лимфома; клетки с резко базофильной цитоплазмой с вакуолизацией и крупными ядрами с центральной макронуклеолой (морфологически схожи с иммунобластами). Г — То же животное, диссеминация опухоли в лимфатическом узле. Среди малых лимфоцитов — крупные лимфоидные клетки с центральной макронуклеолой. (Окраска по Лейшману, увеличение: объектив ×100, окуляр ×10) | |
Диагностика опухолей кишки
Раки и лимфомы кишки у кошек в большинстве случаев могут быть пропальпированы через брюшную стенку, тогда как пальпация диагностична у собак примерно в 20–40% случаев лимфомы и в 20–50% при нелимфомных опухолях [1, 11].
Большинство раков кишки у собак локализуются в тонком отделе с наибольшей частотой в двенадцатиперстной и тощей кишке. Аденокарциномы также часто встречаются в колоректальной области, а стромальные опухоли наиболее распространены в слепой кишке [1]. Макроскопически рак кишки может быть экзофитным образованием на узком основании, иметь циркулярный рост или в виде «булыжной мостовой» [1]. Макроскопические характеристики не только рефлектируют находки при эндоскопическом исследовании и УЗИ, но и играют важную прогностическую роль. Так, лучший прогноз имеют экзофитные образования, тогда как инвазивный рост с циркулярным утолщением стенки кишки имеет неблагоприятный прогноз.
Биопсия является важным методом диагностики опухолей кишечника. При наличии большой опухоли может быть выполнена тонкоигольная биопсия под контролем УЗИ для взятия материала с последующим цитологическим исследованием. Цитологическое исследование даёт примерно 70% совпадений с гистологическим, по данным исследования, проведённого Bonfanti U. с соавт. (2009) на 53 собаках и кошках с различными опухолями кишки [12].
Развитие современных методов морфологической диагностики, таких как иммуногистохимия и проточная цитометрия, а также методики определения клональности лимфоцитов (PARR), позволило значительно расширить представления о лимфоме кишечника (рис). У кошек наиболее распространённый тип лимфом кишки — это Т-мелкоклеточные лимфомы (энтеропатия-ассоциированные Т-клеточные лимфомы, тип 2), источником развития которых является мукоза-ассоциированная лимфоидная ткань [6]. Данные опухоли поражают вначале только собственную пластинку слизистой оболочки с дальнейшим трасмуральным распространением; наиболее частой локализацией является тонкая кишка. При взятии поверхностных эндоскопических биоптатов дифференцировка мелкоклеточной лимфомы с воспалительными заболеваниями (ВЗК) может быть затруднительной, поскольку опухолевые клетки имеют морфологию, сопоставимую с таковой у нормальных малых лимфоцитов (рис. Б); в этом случае решающую роль играет ИХГ или проточная цитометрия. Всё большую роль в дифференциальной диагностике ВЗК и МАЛТ-лимфом имеет определение клональности лимфоцитов — для лимфом типично наличие моноклональной популяции, тогда как воспаления характеризуются поликлональностью. Эффективность PARR для дифференцировки данных процессов на данный момент оценивается примерно в 70% у собак [13].
У кошек до 10% случаев лимфом кишки представлены большой гранулярной лимфомой (БГЛ), при которой опухолевые клетки содержат в цитоплазме эозинофильные гранулы (рис. А). БГЛ обычно характеризуются трансмуральным поражением стенки кишки. Данные опухоли имеют агрессивное поведение и часто диагностируются в состояние диссеминации в печени, селезёнке, крови и костном мозге.
Основным источником В-крупноклеточных лимфом являются В-лимфоциты Пейреровых бляшек. Из них наиболее распространены диффузные В-крупноклеточные лимфомы (ДВККЛ) в илеоцекальной области и желудке, чаще всего имеющие трансмуральную диссеминацию [6]. Цитологическая и гистологическая диагностика их, как правило, не представляет сложности, в связи с наличием в биоптатах крупных атипичных лимфоидных клеток (рис. В, Г).
Терапия и прогноз
Основным методом лечения раков кишечника и гастроинтестинальных стромальных опухолей является хирургический, хотя периоперативная смертность достаточно высока (30–50%) [1]. Крупных рандомизированных исследований об эффективности химиотерапии при раке кишки не проводилось, хотя в исследовании Slawienski M.J. с соавт. (1997) адъювантная химиотерапия доксорубицином способствовала увеличению медианы выживаемости кошек с раком толстой кишки до 280 сут. в сравнение с 56 сут. без химиотерапии [15].
Ведущим методом терапии лимфом является химиотерапия. Выживаемость при лимфоме кишки у кошек в значительной мере ассоциирована с морфологическим типом опухоли, степенью поражения кишечной стенки и диссеминированности заболевания. Так, медиана выживаемости кошек с Т-мелкоклеточной лимфомой составляет больше года [14] в сравнении с 3,5 мес. при ДВККЛ. Большие гранулярные лимфомы имеют неблагоприятный прогноз и небольшую выживаемость (медиана менее 2 мес.).
Литература
- Withrow S.J. Gastric cancer. In Withrow S.J., Vail D.M., Page R.L. eds: Withrow and MacEwen's Small Animal Clinical Oncology. 5th ed. St Louis, Saunders Elsevier 2013; 402–405.
- Bilek A., Hirt R.A. Breed-associated increased occurrence of gastric carcinoma in chow-chows. Wiener Tierarztl Monat. 2007; 94: 71–79.
- Seim-Wikse T., Jörundsson E., Ndtvedt A., Grotmol T., Bjornvad C.R., Kristensen A.T., Skancke E. Breed predisposition to canine gastric carcinoma-a study based on the Norwegian canine cancer register. Acta Vet Scand. 2013; 55: 25.
- Bridgeford E.C., Marini R.P., Feng Y., Parry N.M., Rickman B., Fox J.G. Gastric Helicobacter species as a cause of feline gastric lymphoma: a viable hypothesis. Vet Immunol Immunopathol. 2008;123 (1–2): 106–113.
- Maas C.P., ter Haar G., van der Gaag I., Kirpensteijn J. Reclassification of small intestinal and cecal smooth muscle tumors in 72 dogs: clinical, histologic, and immunohistochemical evaluation. Vet Surg. 2007; 36 (4): 302–313.
- Munday J.S., Lohr C.V., Kiupel M. Tumors of the alimantery system. In Meuten D.J. ed.: Tumors in domestic animals. 5th ed. Ames, Iowa, Wiley Blackwell 2017: 554–592.
- Terragni R., Vignoli M., van Bree H.J., Gaschen L., Saunders J.H. Diagnostic imaging and endoscopic finding in dogs and cats with gastric tumors: a review. Schweiz Arch Tierheilkd. 2014; 156 (12): 569–576.
- Beaudry D., Knapp D.W., Montgomery T., Sandusky G.S., Morrison W.B., Nelson R.W. Hypoglycemia in four dogs with smooth muscle tumors. J Vet Intern Med. 1995; 9(6): 415–418.
- Penninck D.G., Moore A.S., Gliatto J. Ultrasonography of canine gastric epithelial neoplasia. Vet Radiol Ultrasound. 1998; 39(4): 342–348.
- Sullivan M., Lee R., Fisher E.W., Nash A.S., McCandlish I.A. A study of 31 cases of gastric carcinoma in dogs. Vet Rec. 1987; 120 (4): 79–83.
- Couto C.G., Rutgers H.C., Sherding R.G., Rojko J. Gastrointestinal lymphoma in 20 dogs. A retrospective study. J Vet Intern Med. 1989; 3(2): 73–78.
- Bonfanti U., Bertazzolo W., Bottero E., De Lorenzi D., Marconato L., Masserdotti C., Zatelli A., Zini E. Diagnostic value of cytologic examination of gastrointestinal tract tumors in dogs and cats: 83 cases (2001–2004). J Am Vet Med Assoc. 2006; 229(7): 1130–1133.
- Ohmura S., Leipig M., Schöpper I., Hergt F., Weber K., Rütgen B.C., Tsujimoto H., Hermanns W., Hirschberger J. Detection of monoclonality in intestinal lymphoma with polymerase chain reaction for antigen receptor gene rearrangement analysis to differentiate from enteritis in dogs. Vet Comp Oncol. 2017; 15(1): 194–207.
- Wolfesberger B., Skor O., Hammer S.E., Flickinger I., Kleiter M., Rütgen B.C., Schwendenwein I., Tichy A., Hittmair K.M., Degasperi B., Fuchs-Baumgartinger A. Does categorisation of lymphoma subtypes according to the World Health Organization classification predict clinical outcome in cats? J Feline Med Surg. 2017; 19(8): 897–906.
- Slawienski M.J., Mauldin G.E., Mauldin GN, et al. Malignant colonic neoplasia in cats: 46 cases (1990–1996). J Am Vet Med Assoc 1997; 211: 878–881.
- Moore P.F., Rodriguez-Bertos A., Kass P.H. Feline gastrointestinal lymphoma: mucosal architecture, immunophenotype, and molecular clonality. Vet Pathol. 2012 Jul;49(4):658–668.
СВМ № 2/2018




