Sinisa D. Grozdanic1,2,3, Tatjana Lazic1,2,3, Helga Kecova1,2, Kabhilan Mohan1, Grazyna Adamus4, Markus H. Kuehn5,6
1Department of Veterinary Clinical Sciences, College of Veterinary Medicine, Iowa State University, Ames, IA, USA
2Animal Eye Consultants of Iowa, Hiawatha, IA, USA
3TL VetPath International Consultants, Hiawatha, IA, USA
4Department of Ophthalmology, Oregon Health & Science University, Portland, OR, USA
5Department of Ophthalmology and Visual Sciences, Roy J. and Lucille A. Carver College of Medicine, University of Iowa, Iowa City, IA, USA
6Center for the Prevention and Treatment of Visual Loss, Iowa City VA Health Care System, Iowa City, IA, USA
Введение
Синдром внезапной приобретённой дегенерации сетчатки (СВПДС) признан одной из самых частых необратимых причин слепоты у собак. Он характеризуется внезапной потерей зрения, полностью отсутствующей электрофизиологической активностью сетчатки и аномальными хроматическими зрачковыми рефлексами (ХЗР) (отсутствие рефлекса на красный — хороший рефлекс на синий) [1–3]. Было высказано предположение, что ВПДС — аутоиммунное заболевание, подобное аутоиммунной ретинопатии у человека (АИР), связанное с аутоантителами к сетчатке [4–8].
Аутоиммунные ретинопатии (АИР) — редкие, но разрушительные аутоиммунные заболевания человека, характеризующиеся внезапным началом серьёзного нарушения зрения (или полной слепоты), сниженной электрической активностью сетчатки, относительно нормальным внешним видом глазного дна и наличием в сыворотке аутоантител к сетчатке [9–11]. АИР могут развиваться как форма паранеопластического синдрома (т. е. РАР: рак-ассоциированная ретинопатия; МАР: ретинопатия, ассоциированная с меланомой) или в отсутствие рака (непаранеопластические аутоиммунные ретинопатии: нпАИР) [12–15]. Пациенты, страдающие нпАИР, могут сочетать черты РАР и МАР; однако считается, что это заболевание сетчатки не развивается как прямой результат рака [13].
Аутоантитела (аутоАТ) к антигенам сетчатки считаются основной причиной патологии при РАР и нпАИР [15–18]. АутоАТ к сетчатке также вовлечены в патологический процесс макулярной дегенерации [17; 19–21], пигментного ретинита [20–22] и глаукомы [23; 24]. При этих заболеваниях, однако, неясно, предшествует ли продукция антител заболеванию сетчатки, или иммунная реактивность является следствием дегенеративного процесса сетчатки и воздействия дегенерирующих элементов сетчатки на иммунную систему [25]. Отсутствие исследований, посвящённых детальному гистологическому и молекулярному анализу тканей сетчатки людей с РАР, также вносит свой вклад в относительно плохое понимание механизмов, связанных с функциональными и структурными повреждениями сетчатки [26–28].
Хотя существует много публикаций, описывающих функциональные и морфологические свойства РАР и МАР у людей [14; 27; 29–31], описание РАР отсутствует в литературе по ветеринарной офтальмологии. Единственная статья описывает особенности возможного иммуноопосредованного ретинита (ИОР)-РАР у собак [2].
Целью этого исследования было описание клинических, морфологических и молекулярных свойств предполагаемой рак-ассоциированной ретинопатии у собак. Кроме того, из-за чрезвычайного сходства клинической картины СВПДС и РАР второй целью стало описание потенциальных диагностических параметров, которые могли бы использоваться для дифференциации этих патологий. Наконец, мы оценивали успех различных стратегий лечения собак с РАР, с особым акцентом на совершенно новый метод — интравитреальное введение внутривенного иммуноглобулина (ввИГ).
Материалы и методы
Все исследования проводились в соответствии с Постановлением ARVO об использовании животных в офтальмологии и исследовании зрения. Процедуры были одобрены Институциональным комитетом по уходу за животными университета штата Айова с протоколом номеров 2-07-6307-К и 5-07-6362-К, а владельцы животных, проходивших лечение в частных клиниках, подписывали форму согласия на варианты диагностики и лечения, включая интравитреальное лечение ввИГ, возможные риски и осложнения, связанные с интравитреальными инъекциями. В общей сложности 17 собак были обследованы в клиниках на предмет СВПДС в период с сентября 2006 года по апрель 2017 года (таблицы 1, 2 и 3). Пациенты были из восьми штатов США и Канады, и у них были диагностированы СВПДС или иммуноопосредованный ретинит (ИОР) восемью офтальмологами. У 16 пациентов были диагностированы злокачественные новообразования до или во время развития проблем со зрением, в то время как у одного пациента было диагностировано злокачественное новообразование через 24 месяца после развития слепоты.
Девять глаз от семи ИОР-РАР пациентов, эвтаназированных в течение 2 месяцев — 5 лет после постановки офтальмологического диагноза, были отобраны для гистологического исследования, анализа на микрочипах (microarray) или иммуногистохимического (ИГХ) анализа (таблица 1, номера пациентов 1, 2, 3, 4, 5, 6 и 7). Половина правого и половина левого глаза были отобраны у двух пациентов ИОР-РАР для анализа на микрочипах (пациенты № 1 и 2), при этом оставшиеся половины использовали для гистологического или ИГХ анализа. Дополнительные 10 контрольных глаз от здоровых собак (бигли, кастрированные самки, 6 лет) без признаков глазных аномалий отобрали для анализа на микрочипах и ИГХ анализа. Образцы сыворотки крови от 10 глаукомных бассет-хаундов из колонии Университета штата Айова и семи здоровых биглей были использованы для определения сывороточных аутоантител к сетчатке.
Таблица 1. Порода, возраст и пол пациентов с РАР и данные первичного клинического обследования
| Порода | Пол | Возраст (лет) | Длительность потери зрения | ЭРГ | ХЗР | Глазное дно (непрямая офтальмоскопия) | |
| 1 | Золотистый ретривер (ОКТ, МЧ ОД и ОС, ИГХ, Г, ВБ-с, ВБ-ст) |
КС | 9 | 30 дней (постепенная прогрессия) |
Первый офтальмолог: нормальная (а-волна 83 мкВ, b-волна 144 мкв, ритмическую — не проводили) Второй офтальмолог: сильное снижение максимальной и ритмической ЭРГ (а-волна 41 мкВ, b-волна 55 мкВ, ритмическая 14 мкВ, илл. 9А) |
К- С+ |
Первично: без патологии, далее: бледный диск зрительного нерва, сужение сосудов сетчатки |
| 2 | Чау-чау (МЧ ОД и ОС, ИГХ, Г, ВБ-с) |
КК | 8 | Отсутствие ночного зрения в течение 3 лет | «Плоская» | К+ С+/- (10–8 мм) |
Гиперрефлективность тапетума периваскулярная и фокальная, периваскулярная экссудация, периваскулярный отёк сетчатки |
| 3 | Бордер-колли (ОКТ, Г) |
КК | 5 | Нарушение глубины восприятия с 2 лет, ухудшение зрения в течение 2 мес. | Первый офтальмолог: b-волна максимальной ЭРГ 20 мкВ Второй офтальмолог: нормальные амплитуды (а-волна 43 мкВ, b-волна 130 мкВ, илл. 9С) |
К- С+/- (10–6 мм) |
Гиперрефлективность тапетума периваскулярная, гиперпигментированные пятна, бледный диск зрительного нерва, сужение сосудов сетчатки |
| 4 | Боксёр (Г) |
КС | 7 | Отсутствие ночного зрения, нарушение глубины восприятия в течение 1 мес. | Нормальная общая, сниженная ритмическая (b-волна 44 мкВ) | ОД: К+, С- ОС: К+, С+/- |
Без патологии |
| 5 | Эскимосская собака (ОКТ, Г) | КК | 4,5 | Внезапная потеря зрения 1 мес. назад | «Плоская» | К- С- |
Отёк диска зрительного нерва |
| 6 | Миниатюрный пинчер (ОКТ, Г, ИГХ, ВБ-с) | КК | 7 | 7 дней | Отсутствует палочковая ЭРГ, снижена b-волна максимальной ЭРГ, снижены амплитуды колбочковой и ритмической ЭРГ, отсутствует паттерн-ЭРГ, снижена мультифокальная, илл. 1С) | ОД: К+/- (10–7 мм), С+ (10–3 мм) ОС: К+/- (10–9 мм), С+/- (10–7 мм) |
Сужение сосудов сетчатки |
| 7 | Бретонский эпаньоль (ВБ-с, Г) |
С | 9 | Нарушение глубины восприятия и перемежающиеся нарушения ночного зрения в течение 6 мес., внезапная слепота 2 недели назад (через 7–10 дней после вакцинации) | Первый офтальмолог: плоская Второй офтальмолог: максимальная ЭРГ b-волна 20 мкВ, ОС: амплитуда b-волны 36 мкВ, но время пика 30 мс, ОД: b-волна максимальной ЭРГ 40 мкВ, илл.1D) |
ОД: К+, С+ ОС К+/- (10–8 мм), С+ |
Гиперпигментированные пятна |
| 8 | Лабрадор-ретривер | К | 9 | Внезапная слепота 4 дня назад, на приёме — нормальное зрение | «Плоская» | К- С+/- (10–6 мм) |
Гиперрефлективность тапетума периваскулярная и диффузная, гиперпигментированные пятна, бледный диск зрительного нерва, сужение сосудов сетчатки |
| 9 | Ши-тцу | КК | 11 | 10 дней (слепота после чистки зубов) | «Плоская» | К- С+/- (10–7 мм) |
Бледный диск зрительного нерва, сужение сосудов сетчатки |
| 10 | Боксёр | КС | 7 | Внезапная слепота 14 дней назад | ОС: снижение а-волны и b-волны (максимальной ЭРГ до 65 мкВ), ОД: норма (84 мкВ), отсутствует ритмическая ОД, ОС | К- С+ | Без патологии |
| 11 | Итальянский грейхаунд | КС | 10 | 14 дней, правый глаз слепой, левый — ночная слепота | Нормальная максимальная ЭРГ, сниженная ритмическая (b-волна 47 мкВ) | К- С+ | ОС: без патологии, ОД: офтальмоскопия не возможна |
| 12 | Выжла | К | 7 | Перемежающиеся проблемы со зрением в течение 90 дней, отвечала на стероиды и циклоспорин | Первый офтальмолог: «плоская»; b-волна 40 мкВ | ОД: К-, С+/- (10–8 мм), ОС: К-, С+/- (10–6 мм) | ОД: без патологии, ОС: радиальные гиперрефлективные полосы на тапетуме |
| 13 | Метис | КК | 9 | Снижение зрения в течение 3 мес., особенно в сумерках, на приёме — нормальное зрение | «Плоская» | К+/- (10–7 мм), С+ | Бледный диск зрительного нерва, сужение сосудов сетчатки |
| 14 | Манчестерский той-терьер | КС | 8 | Перемежающиеся нарушения ночного зрения, на приёме зрение нормальное | Нормальная общая, сниженная ритмическая (32 мкВ) | К- С+/- (10–5 мм) | Без патологии |
| 15 | Метис | КС | 9 | Перемежающиеся нарушения ночного зрения | – | К- С+ | Гиперрефлективность диффузная, периваскулярная и фокальная |
| 16 | Такса (ОКТ, ВБ-с) |
КК | 10 | Внезапно ослеп 21 день назад | «Плоская» | К+ С+ | Бледный диск зрительного нерва, сужение сосудов сетчатки |
| 17 | Метис | КК | 14 | Внезапно ослеп 7 дней назад | «Плоская» | К+ С+ | Периваскулярный отёк сетчатки |
Проведённые исследования: ОКТ — оптическая когерентная томография, МЧ — анализ ткани сетчатки на микрочипах, ВБ-с — Вестерн-блот анализ сыворотки,
ВБ-ст — Вестерн-блот анализ стекловидного тела, ИГХ — иммуногистохимический анализ тканей глаза, Г — гистологическое исследование тканей глаза
Пол: КС — кастрированная сука, КК — кастрированный кобель, К — кобель, С — сука
ОД — правый глаз, ОС — левый глаз
ХЗР: К+ — нормальный ЗР на красный свет, С+ — нормальный ЗР на синий свет, К- –отсутствие ЗР на красный свет, С- –отсутствие ЗР на синий свет, К+/- — ЗР на красный свет снижен, С+/- –ЗР на синий свет снижен, 10 (начальный размер зрачка) — 8 (размер зрачка после освещения)
Норма ЭРГ: максимальный ответ — b-волна более 75 мкВ, ритмической ЭРГ — более 60 мкВ
Диагностика предположительно РАР-фенотипа
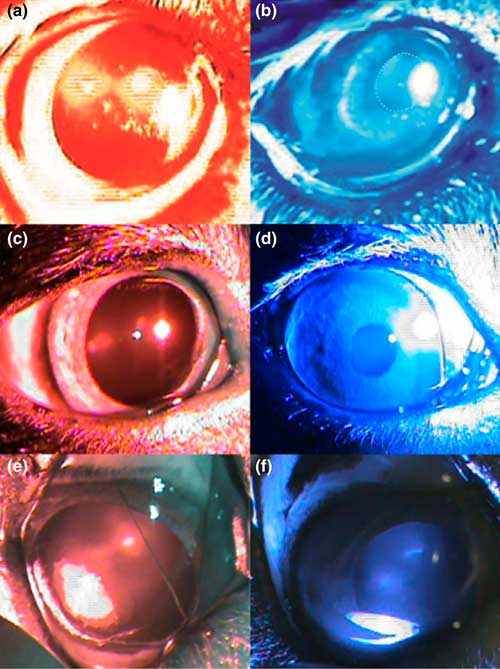
Ранее опубликованные критерии диагностики СВПДС были использованы для характеристики всех пациентов: полностью отсутствовал ответ при электроретинографии (ЭРГ) («плоская» ЭРГ) в комбинации с отсутствием рефлекса зрачка при освещении красным светом (К-) и хорошо выраженным рефлексом зрачка при освещении синим светом (С+) [2]. Все пациенты с РАР и здоровые контрольные собаки прошли полное офтальмологическое обследование: биомикроскопия с помощью щелевой лампы, непрямая офтальмоскопия, оценка слезопродукции и внутриглазного давления и базовое нейроофтальмологическое обследование (пальпебральный и роговичный рефлексы, подвижность глазных яблок). Проверка реакции на угрожающий жест, на ослепляющий свет, зрачкового рефлекса и тест лабиринта были проверены для оценки зрения.
Оценка системного состояния
Всем пациентам были проведены общий анализ крови, биохимический анализ сыворотки крови, анализ мочи (10 из 17, все пробы отобраны при помощи цистоцентеза), измерение систолического артериального давления (10 из 17, систолическое артериальное давление оценивалось с помощью ультразвукового доплера; модель 811-L, Parks Medical Electronics Inc, Las Vegas, NV, USA) и рентгенография грудной клетки и брюшной полости (17 из 17). Семи из 17 пациентов была проведена компьютерная томография головного мозга (КТ) или магнитно-резонансная томография (МРТ). Рентгенограммы брюшной полости и грудной клетки и КТ головного мозга оценивались сертифицированными радиологами и резидентами учреждений, где проводились эти исследования. Проводилась КТ/МРТ только головы (КТ грудной клетки или брюшной полости не проводилась).
Таблица 2. Системные патологии и отклонения лабораторных показателей у пациентов с РАР
| ПУ/ПД-ПФ-НМ | Биохимический анализ сыворотки | Анализ мочи | ОАК | АД | Аллергии и аутоиммунные заболевания | Прочее | |
| 1* | Нет | Холестерол, липиды, АЛТ | – | Норма | – | Нет | Мембранозный гломерулонефрит, вакуольная дегенерация печени (гликогеновый тип) |
| 2 | Нет | ЩФ | – | Норма | Норма | Атопия | Нет |
| 3* | Нет | Норма | Норма | Норма | Норма | Атопия | Панкреатит через 11 мес. после первичного диагноза |
| 4 | Нет | Норма | Норма | Норма | Норма | Атопия | Нет |
| 5 | ПУ/ПД | Холестерол | Микроальбуминурия, протеинурия | Норма | Норма | Атопия | Атаксия, нарушение проприоцепции, нистагм |
| 6 | ПФ, НМ 6 мес. |
АЛТ, ЩФ*, Са, общий белок | Протеинурия, следы крови | Лейкопения | – | Атопия | Мембранозный гломерулонефрит, вакуольная дегенерация печени (гликогеновый тип) |
| 7 | Нет | Норма | – | Норма | Норма | Атопия | Атрофия коры головного мозга (МРТ), угнетение |
| 8 | Нет | Норма | Микроальбуминурия, протеинурия | Норма | 180–200 | Нет | Нет |
| 9 | ПУ/ПД, ПФ 2 мес. |
Холестерол, ЩФ* | – | Норма | – | Атопия / ПА, СКК | Нет |
| 10 | Нет | Липаза | – | Норма | Норма | Нет | Панкреатит |
| 11 | Нет | – | – | – | – | Атопия | Нет |
| 12* | Нет | Холестерол, ЩФ | Микроальбуминурия | Норма | Норма | Атопия | Нет |
| 13 | Нет | Норма | Микроальбуминурия, протеинурия | Норма | 185 | Нет | Нет |
| 14 | Нет | ЩФ, АЛТ | – | Нейтрофилия | – | Атопия, бактериальная инфекция кожи | Маленькая печень |
| 15 | Нет | Азот мочевины | – | Норма | – | Атопия | Нет |
| 16 | Нет | ЩФ | Микроальбуминурия, протеинурия | Норма | – | ПА, аллергический бронхит, СКК | Нет |
| 17 | ПУ/ПД 1 год | ЩФ, холесетрол, ПЛ, Т4 | Протеинурия | Норма | Норма | Нет | Нет |
ПУ/ПД — полиурия/полидипсия, ПФ — полифагия, НМ — набор массы, ЩФ — щелочная фосфатаза, АЛТ — аланинаминотрансфераза, ПЛ — панкреатическая липаза, ПА — пищевая аллергия, СКК — сухой кератоконъюнктивит
*До отбора проб пациент получал лечение стероидами.
Функциональная и структурная оценка сетчатки in vivo
Зрение оценивали по следующим параметрам в условиях сумерек и яркого освещения: реакция на угрожающий жест, тест с ватным шариком и тест лабиринта. Прохождение одного или нескольких тестов расценивалось как присутствие зрения.
Оценка зрачкового рефлекса (ЗР), хроматических зрачковых рефлексов (ХЗР), фотографирование глазного дна и электроретинография (ЭРГ) были выполнены у клинических пациентов и экспериментальных собак, как описано в предыдущих исследованиях [2; 32–34]. Анализ данных оптической когерентной томографии (ОКТ) у собак был проведён, как описано ранее [32].
Протокол общей анестезии для ЭРГ и ОКТ
Для ЭРГ и ОКТ использовалась общая анестезия, как описано ранее [5; 32; 33].
Электроретинография (ЭРГ)
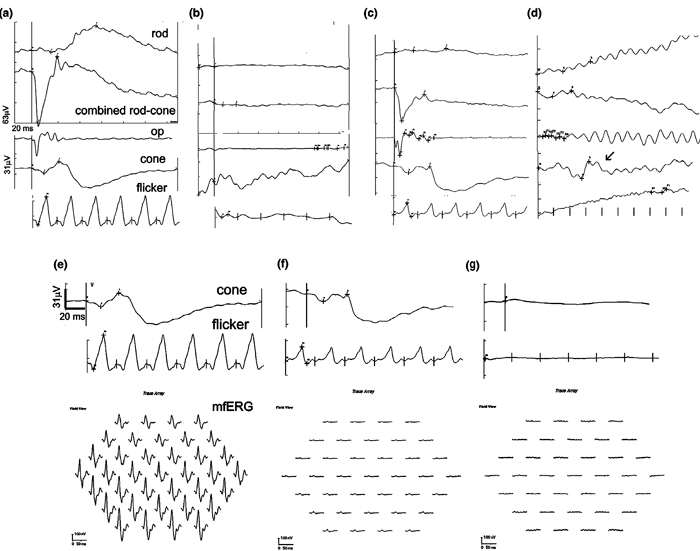
Электроретинография (общая и паттерн) использовалась для оценки функции сетчатки у собак с ИОР-РАР (n = 16). Система Roland Consult ERG (Бранденбург, Германия) была использована для паттерн-ЭРГ и протокола ЭРГ Международного общества клинической электрофизиологии зрения (ISCEV), проводимых с использованием общей анестезии, а система Retinographics (Norwalk, CT) использовалась для проведения ЭРГ без анестезии и седации. Обе системы использовались для подачи световых стимулов и получения сигналов от чашечного роговичного электрода для записи общей ЭРГ, как сообщалось ранее [2; 5; 32].
Протокол мультифокальной ЭРГ
Мф-ЭРГ проводили после 15-минутной темновой адаптации с использованием системы VERIS Science (Edi Inc, Redwood City, CA, USA) с фундус-камерой для проекции стимула на сетчатку у одного клинического пациента. Для записи мф-ЭРГ использовался педиатрический биполярный Burian-Allen электрод (Hansen Ophthalmic Development Laboratory, Iowa City, IA). Поскольку для проецирования стимула использовалась фундус-камера, электрическая активность регистрировалась только на одном глазу за раз. Референтный электрод располагался в области лба между глазами, а заземляющий электрод располагался с задней части головы (затылочная область). Оба электрода были расположены подкожно.
Ответ первого порядка мф-ЭРГ был проанализирован у собак с РАР и контрольных собак. Стимулятор состоял из 37 чёрных и белых шестиугольников с временными настройками: частота = 75 Гц, последовательность M = 15, кадры = 1, количество сегментов = 16, время предварительной экспозиции = 1 с, образцов в кадре = 16. Частота усилителя низких частот была установлена на 3 Гц, в то время как частота высокочастотного усилителя была установлена на 300 Гц.
Фотографирование глазного дна
Фотографирование глазного дна проводилось фундус-камерой RetCam Fundus Camera system (Massie Research Laboratories, Pleasanton, CA), как было описано ранее [5].
Оптическая когерентная томография (ОКТ)
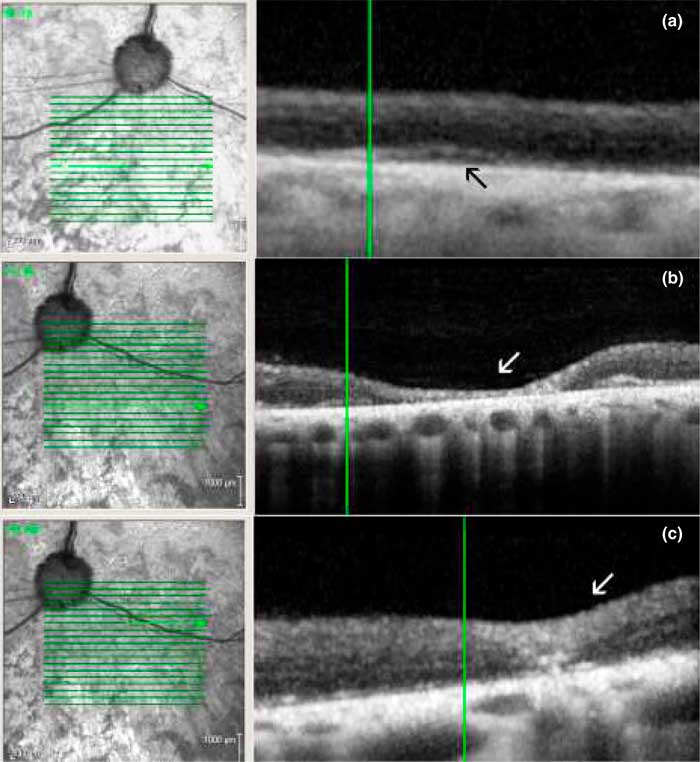
Оптическая когерентная томография и анализ толщины различных слоёв сетчатки проводились с помощью прибора Heidelberg Spectralis SD-OCT, как сообщалось ранее [5; 33]. Были получены следующие сканы: горизонтальное объёмное сканирование через area centralis (в пределах зрительной полосы, расположенной дорсо-темпорально от диска зрительного нерва) в верхне-височной (тапетальной) части сетчатки, с соответствующим объёмным сканированием вентро-темпоральной (нетапетальной) части сетчатки. Дополнительные горизонтальные объёмные сканирования проводились в соответствующих зонах при обнаружении поражений сетчатки: гиперпигментированных, гиперрефлексивных и экссудативных. Целью сканирования было выявление возможных поражений сетчатки, которые не были очевидны при обычной офтальмоскопии, как ранее сообщалось для собак с ВПДС [5].
Гистологическое и иммуногистохимическое (ИГХ) исследование
Для гистологического исследования отобрали шесть глаз от четырёх эвтаназированных пациентов с ИОР-РАР и шесть глаз от здоровых биглей, которым ранее было проведено офтальмологическое обследование, чтобы исключить наличие глазных патологий, ткани глаза были зафиксированы и подготовлены к гистологическому исследованию, как описано ранее [5; 35].
Гистологическое и иммуногистохимическое исследование шести глаз от трёх пациентов с ИОР-РАР (отобранных через 1–35 месяцев после постановки диагноза ИОР-РАР) и шести глаз здоровых биглей были выполнены, как и сообщалось ранее, с использованием анти-CD3 (маркер Т-лимфоцитов); анти-CD79 (маркер В-лимфоцитов); анти-CD11b (маркер микроглии) и коктейля из IgG, IgM и IgA для обнаружения плазматических клеток, продуцирующих иммуноглобулин, как и было ранее описано [5; 35].
Выявление антител к сетчатке в сыворотке и стекловидном теле — Вестерн-блот анализ
Проводился первичный скрининг сыворотки крови собак с ИОР-РАР (n = 5), проб стекловидного тела собак с ИОР-РАР (n = 1), сыворотки крови контрольных здоровых собак (n = 7) и сохранённых замороженных образов сыворотки крови собак с первичной глаукомой (n = 10) с использованием протеинов сетчатки собак, полученных, как было описано ранее [36].
Анализ на микрочипах
Анализ тканей сетчатки на микрочипах проводился, как было описано ранее [5]. Вкратце, сразу после энуклеации глаз помещали в раствор RNAlater (Thermo Fisher). Сетчатку отпрепаровывали и РНК извлекали и гибридизировали на чипах Canine Genome 2.0 (Thermo Fisher) по инструкции производителя. Данные были получены для двух глаз нелеченого пациента с ИОР-РАР, двух глаз пациента с ИОР-РАР, получавшего ввИГ и ответившего на терапию, трёх глаз от трёх пациентов с СВПДС (ранее опубликованные данные анализа на микрочипах пациентов с СВПДС использовали для сравнения с данными пациентов с ИОР-РАР) и двух глаз от двух здоровых контрольных собак без признаков глазных патологий.
Статистический анализ
Полученные данные анализа на микрочипах были нормализованы с использованием модуля надёжного усреднения по нескольким массивам (RMA) в R (версия 3.6) [37]. Наборы проб, которые дали низкие значения экспрессии во всех выборках, были удалены из набора данных. Иерархическая кластеризация и PCA (метод главных компонент) проводились с использованием программного обеспечения ClustVis (версия 2.0) [38]. Функциональные категории были созданы с использованием DAVID (база данных для аннотаций, визуализации и интегрированного обнаружения, v6.8) [39] и STRING [40].
Расчёт среднего, стандартного отклонения и медианного значения и парный t-тест проводились с помощью коммерческого программного обеспечения (Prism, версия 5.0; GraphPad, Сан-Диего, Калифорния). Значение P < 0,05 считалось статистически значимым.
Таблица 3. Медикаментозное лечение и ответ на терапию пациентов с РАР
| Порода | Пол | Возраст (лет) | Общее время наблюдения (мес.) | Время сохранения зрения (мес.) | Новообразование | Лечение | Ответ на лечение | |
| 1 | Золотистый ретривер | КС | 9 | 6 | 6 | Менингиома ГМ (в области гипофиза)* | Первичный ответ на преднизон 1 мг/кг 2 р/день внутрь, затем ухудшение, нет ответа на преднизон + хлорамбуцил внутрь; ответ на преднизолон и ввИГ интравитерально | Зрение сохранилось до смерти (лёгочная тромбоэмболия, патологоанатомическое вскрытие) |
| 2 | Чау-чау | КК | 8 | 36 | 35 | Меланома слизистой ротовой полости (за 3 года до офт. диагноза), гемангиома в сердце и изолированные метастазы в головном мозге (на момент смерти)* | Нет | Нет, эвтаназия из-за неврологических симптомов, патологоанатомическое вскрытие |
| 3 | Бордер-колли | КК | 5 | 36 | 30 | Менингиома ГМ (в области гипофиза)* | Преднизон + доксициклин 2 р/день внутрь 3 мес. — улучшение зрения и ЭРГ, затем ухудшение. ВвИГ + тримацинолон интравитреально + преднизон внутрь — зрение в течение года, затем ухудшение, затем интравитреально стероиды каждые 6–8 мес + низкие дозы преднизона внутрь |
Зрение сохранено в различной степени 2,5 года, последние 6 мес. — слепота, получал лучевую терапию по поводу новообразования гипофиза, по патологоанатомическому вскрытию — менингиома |
| 4 | Боксёр | КС | 7 | 11 | 0 | Менингиома ГМ (в области гипофиза, хиазмы)* | ВвИГ + триамцинолон интравитреально, преднизон 0,5–1 мг/кг 2 р/день внутрь, доксициклин 2 р/день внутрь | Полная потеря зрения после кратковременной анестезии, слабая способность к ориентации в пространстве через 2 недели после инъекции, неврологические симптомы и эвтаназия через 11 мес. после лечения, патологоанатомическое вскрытие |
| 5 | Эскимосская собака | КК | 4,5 | 1 | 0 | Карцинома гипофиза* | Преднизон 1 мг/кг 2 р/день внутрь в течение 3 недель | Без ответа, по результатам патологоанатомического вскрытия — карцинома гипофиза |
| 6 | Миниатюрный пинчер | КК | 7 | 3 | 0 | Плоскоклеточная карцинома ротовой полости (миндалин), орбиты левого глаза, лобных костей* | Преднизон 0,5–1 мг/кг 2 р/день внутрь в течение 3 мес. | Без ответа, эвтаназия через 3 мес. |
| 7 | Бретонский эпаньоль | С | 9 | 12 | 0 | Аденокарцинома молочной железы (за 3 года до офт. диагноза), на момент потери зрения — множественные узловые поражения молочных желёз на УЗИ (данные ТИАБ неубедительны)* | Преднизон 0,5–1 мг/кг 1–2 р/день внутрь + доксициклин 2 р/день внутрь | Без ответа, эвтаназия через 12 мес. из-за ухудшения неврологических признаков |
| 8 | Лабрадор-ретривер | К | 9 | 6 ПН | 6 | Карцинома семенника* | Циклоспорин 1 р/день внутрь, беназеприл, аспирин, амлодипин внутрь | Нормальное зрение без эпизодов слепоты, потерян из наблюдения через 6 мес. |
| 9 | Ши-тцу | КК | 11 | 3 ПН | 0 | Менингиома или глиома ГМ | Преднизон 1 мг/кг | Без ответа, потерян из наблюдения через 3 мес. |
| 10 | Боксёр | КС | 7 | 2 | 2 | Новообразование гипофиза | Лефлуномид 1 р/день, микофенолат 2 р/день, маропитант цитрат 1 р/2 дня внутрь | Зрение в течение 2 мес., далее эвтаназия из-за судорог и неврологического ухудшения |
| 11 | Итальянский грейхаунд |
КС | 10 | 3 ПН | 3 | Новообразование цилиарного тела/ собственно сосудистой оболочки ОД | Нет | Слепота на протяжении 3 мес. после постановки диагноза |
| 12 | Выжла | К | 7 | 6 ПН | 3 | Мастоцитома за 3 года до офт. диагноза* | Преднизон 0,5–1 мг/кг 2 р/день внутрь | Первичный ответ в течение 3 мес., ослеп через 6 мес. |
| 13 | Метис | КК | 9 | 4 ПН | 4 | Саркома или гемангиоперицитома плеча | Эналаприл, аспирин внутрь | Потерян из наблюдения через 4 мес. |
| 14 | Манчестерский той-терьер | КС | 8 | 1 | 1 | Диффузная плоскоклеточная карцинома* | Антибиотики внутрь из-за бактериальной инфекции кожи | Эвтаназия через 1 мес. из-за ухудшения общего состояния |
| 15 | Метис | КС | 9 | 4 | 4 | Диффузная мастоцитома с вовлечением костного мозга* |
Преднизон 0,5–1 мг/кг внутрь | Зрение сохранено до эвтаназии через 4 мес. от первичного диагноза |
| 16 | Такса | КК | 10 | 24 | 16 | Первично: КТ, рентген грудной клетки и брюшной полости — без патологии. Через 24 мес. после офт. диагноза — саркома мышц | Преднизон 1,5 мг/кг 2 р/день внутрь + доксициклин 1 мес. — без ответа. ВвИГ интравитреально + преднизон 1 мг/кг 1 р/день внутрь, далее 1 р/2 дня — ответ, далее циклоспорин 1 р/день внутрь (после второго эпизода слепоты — без ответа) | Зрение сохранено в течение 16 мес. после лечения, затем — слепота (преднизон отменён) |
| 17 | Метис | КК | 14 | 6 | 2 | Веретеноклеточная саркома, удалена за 2 года до офт. диагноза | Преднизон 1 мг/кг 2 р/день внутрь + доксициклин –- возврат зрения, билатеральная отслойка сетчатки (по аспирату — субретинальное скопление макрофагов) | Слепота через 2 мес. от начала лечения |
КС — кастрированная сука; КК — кастрированный кобель; К — кобель; С — сука; ОД — правый глаз; ОС — левый глаз; ПН — потерян из наблюдения; ГМ — головной мозг.
ВвИГ — интравитреально = 0,2 мл Gammaguard 10 % (Baxter International INC, Deerfield, IL) .
* Диагноз подтверждён гистологически.
Результаты
Популяция пациентов
Были исследованы 17 собак из восьми штатов США и Канады, у которых были диагностированы СВПДС или ИОР на основании анамнеза и результатов офтальмологического и общего осмотра, проведённых восемью офтальмологами (таблицы 1 и 2). Пациенты-самцы преобладали в популяции (10 из 17 пациентов, 59 %) над самками (41 %, таблица 1). Средний возраст составил 8,4 ± 2,2 года (среднее ± стандартное отклонение, медианное значение = 9 лет, диапазон 4,5–14 лет). Не было выявлено конкретной породной предрасположенности (таблица 1). В равной степени были представлены собаки крупных и мелких пород: 41 % собак крупных пород, 41 % собак мелких пород и 18 % собак средних пород (таблица 1). По клинической картине 59 % пациентов были полностью слепыми (10 из 17), 17 % имели периодические нарушения зрения (3 из 17) и 24 % (4 из 17) пациентов имели нарушение сумеречного зрения (таблица 1).
У 16 пациентов были диагностированы злокачественные новообразования до или во время появления проблем со зрением, в то время как у одного было диагностировано злокачественное новообразование через 24 месяца после первоначального развития слепоты (таблица 3). Самые частые новообразования были следующие: менингиома (n = 4), саркома (n = 3), новообразование гипофиза (n = 2) и плоскоклеточная карцинома (n = 2). Среднее время выживания составляло 6 месяцев с момента постановки диагноза (диапазон 1–36 месяцев). К маю 2017 года все пациенты скончались (таблица 3).
Функциональные тесты
У 56 % (9 из 16) пациентов полностью отсутствовали электрические ответы сетчатки («плоская» ЭРГ), 18,7 % (3 из 16) имели нормальные ответы общей ЭРГ, но сниженные или отсутствующие ответы ритмической ЭРГ, у 18,7 % (3 из 16) были снижены ответы как общей ЭРГ, так и ритмической, в то время как у одного пациента были почти нормальные данные максимальной и колбочковой ЭРГ, но отсутствовал ответ палочек и паттерн-ЭРГ и снижен ответ мф-ЭРГ (таблица 1, илл. 1). Проверка хроматических зрачковых рефлексов выявила полное отсутствие рефлекса на красный свет и нормальный рефлекс на синий свет у 23,5 % пациентов (4 из 17; таблица 1, илл. 2). Два пациента имели полностью нормальные ХЗР (у обоих полностью отсутствовали ответы ЭРГ), у одного — полностью отсутствовал ХЗР на красный и синий свет, в то время как у остальных пациентов была разная комбинация дефицитов ХЗР на одном или обоих глазах, наиболее типичным было отсутствие рефлекса на красный свет и сниженный — на синий свет (всего семь глаз). Ни у одного из этих у пациентов не было классической комбинации данных для СВПДС: «плоская» ЭРГ в сочетании с отсутствием рефлекса на красный свет и хорошим — на синий (таблица 1).
Данные офтальмоскопии
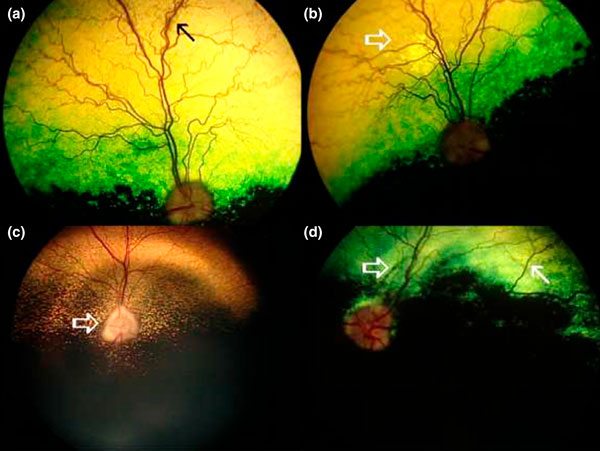
При осмотре глазного дна были выявлены различные изменения. Наиболее часто наблюдаемым изменением глазного дна было сужение сосудов сетчатки, выраженное в уменьшении диаметра кровеносных сосудов и спорадической потере третичных ветвей вен сетчатки, что наблюдалось у 41 % пациентов (7 из 17; таблица 1, илл. 3). Кроме того, бледность диска зрительного нерва наблюдалась у 23,5 % пациентов (4 из 17; таблица 1, илл. 3). Нормальное глазное дно наблюдалось у 23,5 % пациентов (4 из 17), а ещё у двоих — нормальное глазное дно было в одном глазу. Изменения рефлективности тапетума, периваскулярные гиперрефлективные поражения, хориоретинальные рубцы, гиперпигментированные пятна и отёк сетчатки наблюдались у 23,5 % пациентов (4 из 17). У одного пациента был выявлен двусторонний отёк диска зрительного нерва.
ОКТ и гистологическое исследование
ОКТ была выполнена пяти пациентам, и сравнение её данных с изображениями глазного дна показало, что зоны гиперрефлективности соответствовали фокальным участкам утраты фоторецепторов сетчатки (илл. 4 и 5). Диффузная потеря внутренних и наружных сегментов фоторецепторов была очевидна (илл. 4 и 5). Зоны периваскулярных экссудативных поражений соответствовали экссудативной отслойке сетчатки, отёчным и кистозным изменениям сетчатки или периваскулярному истончению сетчатки (илл. 4 и 5). Гистологическое исследование выявило утрату фоторецепторов, которая в отдельных случаях носила очаговый периваскулярный характер, активацию пигментного эпителия сетчатки и активный вид макрофагов (илл. 5).
Системные изменения
Анализ системных изменений (повышение аппетита/полифагия, прибавка в весе, полидипсия/полиурия) проводился на основании данных анамнеза со слов владельцев, направивших ветеринарных врачей, а также обзора медицинских карт пациентов. Клинические признаки полидипсии/полиурии (ПД/ПУ), полифагии (ПФ) и набор массы тела (НМ) наблюдались у 23,5 % пациентов (4 из 17; таблица 2). Оценка химического состава сыворотки выявила повышение сывороточной щелочной фосфатазы (ЩФ) и/или аланинаминотрансферазы (АЛТ) у 47 % пациентов (8 из 17).
Анализ сыворотки крови пациентов с ИОР-РАР выявил повышенный уровень холестерола у 23,5 % пациентов (4 из 17). Анализ мочи выявил протеинурию/микроальбуминурию у 77,7 % пациентов (7 из 9; данные анализа мочи отсутствовали для восьми пациентов; таблица 2). Панкреатит в анамнезе наряду с патологическим уровнем панкреатической липазы, или повышенным специфической липазы, или повышением липазы сыворотки крови присутствовал в 30 % (3 из 10; это не оценивалось у семи пациентов). Кальций в сыворотке был повышен у 5 % пациентов (1 из 17). Оценка артериального давления выявила системную гипертензию у 20 % пациентов (2 из 10; АД не оценивалось у семи пациентов; таблица 2). Системная гипертензия диагностировалась при систолическом артериальном давлении, равном или выше 160 мм рт. ст. Наличие аллергии и аутоиммунных заболеваний было зарегистрировано у 70,5 % пациентов (12 из 17, таблица 2). Атопия (91,6 %, 11 из 12), пищевая аллергия (16,6 %, 2 из 12) и сухой кератоконъюнктивит (16,6 %, 2 из 12) были наиболее часто встречающимися аллергическими/аутоиммунными заболеваниями (таблица 2).
(Окончание в следующем номере)
Литература
- Van der Woerdt ANM, Davidson MG. Sudden acquired retinal de-generation in the dog: clinical and laboratory findings in 36 cases. Prog Vet Comp Ophthalmol. 1991;1:11–18.
- Grozdanic SD, Harper MM, Kecova H. Antibody-mediated retinopathies in canine patients: mechanism, diagnosis, and treatment modalities. Vet clin N Am Small Animal Pract. 2008;38:361–387, vii.
- Komaromy AM, Abrams KL, Heckenlively JR, et al. Sudden acquired retinal degeneration syndrome (SARDS) – a review and proposed strategies toward a better understanding of pathogenesis, early diagnosis, and therapy. Vet Ophthalmol. 2016;19:319–331.
- Bellhorn RW, Murphy CJ, Thirkill CE. Anti-retinal immunoglobulins in canine ocular diseases. Semin Vet Med Surg (Small Anim). 1988;3:28–32.
- Grozdanic SD, Lazic T, Kecova H, et al. Optical coherence tomography and molecular analysis of sudden acquired retinal degeneration syndrome (SARDS) eyes suggests the immune-mediated nature of retinal damage. Vet Ophthalmol. 2019;22:305–327.
- Stromberg SJ, Thomasy SM, Marangakis AD, et al. Evaluation of the major histocompatibility complex (MHC) class II as a candidate for sudden acquired retinal degeneration syndrome (SARDS) in Dachshunds. Vet Ophthalmol. 2019;22:751–759.
- Braus BK, Hauck SM, Amann B, et al. Neuron-specific enolase antibodies in patients with sudden acquired retinal degeneration syndrome. Vet Immunol Immunopathol. 2008;124:177–183.
- Mowat FM, Avelino J, Bowyer A, et al. Detection of circulating anti-retinal antibodies in dogs with sudden acquired retinal degeneration syndrome using indirect immunofluorescence: A case-control study. Exp Eye Res. 2020;193:107989.
- Grewal DS, Fishman GA, Jampol LM. Autoimmune retinopathy and antiretinal antibodies: a review. Retina. 2014;34:827-845.
- Thirkill CE, FitzGerald P, Sergott RC, et al. Cancer-associated retinopathy (CAR syndrome) with antibodies reacting with retinal, optic-nerve, and cancer cells. N Engl J Med. 1989;321:1589–1594.
- Makiyama Y, Kikuchi T, Otani A, et al. Clinical and immunological characterization of paraneoplastic retinopathy. Invest Ophthalmol Vis Sci. 2013;54:5424–5431.
- Thirkill CE. Experimental, cancer-induced retinopathy. Ocul Immunol Inflamm. 1997;5:55–65.
- Fox AR, Gordon LK, Heckenlively JR, et al. Consensus on the diagnosis and management of nonparaneoplastic autoimmune retinopathy using a modified Delphi approach. Am J Ophthalmol. 2016;168:183-190.
- Elsheikh S, Gurney SP, Burdon MA. Melanoma-associated retinopathy. Clin Exp Dermatol. 2020;45:147–152.
- Grewal DS, Fishman GA, Jampol LM. Autoimmune retinopathy and anti-retinal antibodies. Retina. 2014;34:827–845.
- Adamus G, Ren G, Weleber RG. Autoantibodies against retinal proteins in paraneoplastic and autoimmune retinopathy. BMC Ophthalmol. 2004;4:5.
- Patel N, Ohbayashi M, Nugent AK, et al. Circulating anti-retinal antibodies as immune markers in age-related macular degeneration. Immunology. 2005;115:422–430.
- Cherepanoff S, Mitchell P, Wang JJ, et al. Retinal autoantibody profile in early age-related macular degeneration: preliminary findings from the Blue Mountains Eye Study. Clin Experiment Ophthalmol. 2006;34:590–595.
- Umeda S, Suzuki MT, Okamoto H, et al. Molecular composition of drusen and possible involvement of anti-retinal autoimmunity in two different forms of macular degeneration in cynomolgus monkey (Macaca fascicularis). Faseb J. 2005;19:1683–1685.
- Heckenlively JR, Aptsiauri N, Nusinowitz S, et al. Investigations of antiretinal antibodies in pigmentary retinopathy and other retinal degenerations. Trans Am Ophthalmol Soc. 1996;94:179–200; discussion 200–176.
- Heckenlively JR, Jordan BL, Aptsiauri N. Association of antiretinal antibodies and cystoid macular edema in patients with retinitis pigmentosa. Am J Ophthalmol. 1999;127:565–573.
- Heckenlively JR, Solish AM, Chant SM, et al. Autoimmunity in hereditary retinal degenerations. II. Clinical studies: antiretinal antibodies and fluorescein angiogram findings. Br J Ophthalmol. 1985;69:758–764.
- Romano C, Barrett DA, Li Z, et al. Anti-rhodopsin antibodies in sera from patients with normal-pressure glaucoma. Invest Ophthalmol Vis Sci. 1995;36:1968–1975.
- Tezel G, Edward DP, Wax MB. Serum autoantibodies to optic nerve head glycosaminoglycans in patients with glaucoma. Arch Ophthalmol. 1999;117:917–924.
- Adamus G. Are anti-retinal autoantibodies a cause or a consequence of retinal degeneration in autoimmune retinopathies? Front Immunol. 2018;9:765.
- Sen HN, Grange L, Akanda M, et al. Autoimmune retinopathy: current concepts and practices (An American Ophthalmological Society Thesis). Trans Am Ophthalmol Soc. 2017;115:T8.
- Khan N, Huang JJ, Foster CS. Cancer associated retinopathy (CAR): An autoimmune-mediated paraneoplastic syndrome. Semin Ophthalmol. 2006;21:135–141.
- Ohguro H, Yokoi Y, Ohguro I, et al. Clinical and immunologic aspects of cancer-associated retinopathy. Am J Ophthalmol. 2004;137:1117–1119.
- Anastasakis A, Dick AD, Damato EM, et al. Cancer-associated retinopathy presenting as retinal vasculitis with a negative ERG suggestive of on-bipolar cell pathway dysfunction. Doc Ophthalmol. 2011;123:59–63.
- Bazhin AV, Dalke C, Willner N, et al. Cancer-retina antigens as potential paraneoplastic antigens in melanoma-associated retinopathy. Int J Cancer. 2009;124:140–149.
- Mesiwala NK, Shemonski N, Sandrian MG, et al. Retinal imaging with en face and cross-sectional optical coherence tomography delineates outer retinal changes in cancer-associated retinopathy secondary to Merkel cell carcinoma. J Ophthalmic Inflamm Infect. 2015;5:53.
- Grozdanic SD, Kecova H, Harper MM, et al. Functional and structural changes in a canine model of hereditary primary angle-closure glaucoma. Invest Ophthalmol Vis Sci. 2010;51:255–263.
- Hernandez-Merino E, Kecova H, Jacobson SJ, et al. Spectral domain optical coherence tomography (SD-OCT) assessment of the healthy female canine retina and optic nerve. Vet Ophthalmol. 2011;14:400–405.
- Grozdanic SD, Matic M, Sakaguchi DS, et al. Evaluation of retinal status using chromatic pupil light reflex activity in healthy and diseased canine eyes. Invest Ophthalmol Vis Sci. 2007;48:5178–5183.
- Ostojic J, Sakaguchi DS, de Lathouder Y, et al. Neuroglobin and cytoglobin: oxygen-binding proteins in retinal neurons. Invest Ophthalmol Vis Sci. 2006;47:1016–1023.
- Jiang B, Harper MM, Kecova H, et al. Neuroinflammation in advanced canine glaucoma. Mol Vis. 2010;16:2092–2108.
- Irizarry RA, Hobbs B, Collin F, et al. Exploration, normalization, and summaries of high density oligonucleotide array probe level data. Biostatistics. 2003;4:249–264.
- Metsalu T, Vilo J. ClustVis: a web tool for visualizing clustering of multivariate data using Principal Component Analysis and heat-map. Nucleic Acids Res. 2015;43:W566–570.
- da Huang W, Sherman BT, Lempicki RA. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources. Nat Protoc. 2009;4:44–57.
- Calderon-Gonzalez KG, Hernandez-Monge J, Herrera-Aguirre ME, et al. Bioinformatics tools for proteomics data interpretation. Adv Exp Med Biol. 2016;919:281–341.
- Sawyer RA, Selhorst JB, Zimmerman LE, et al. Blindness caused by photoreceptor degeneration as a remote effect of cancer. Am J Ophthalmol. 1976;81:606-613.
- Montgomery KW, van der Woerdt A, Cottrill NB. Acute blindness in dogs: sudden acquired retinal degeneration syndrome versus neurological disease (140 cases, 2000–2006). Vet Ophthalmol. 2008;11:314–320.
- Pepple KL, Cusick M, Jaffe GJ, et al. SD-OCT and autofluorescence characteristics of autoimmune retinopathy. Br J Ophthalmol. 2013;97:139–144.
- Sepah YJ, Sadiq MA, Hassan M, et al. Assessment of retinal structural and functional characteristics in eyes with autoimmune retinopathy. Curr Mol Med. 2015;15:578–586.
- Ferreyra HA, Jayasundera T, Khan NW, et al. Management of auto-immune retinopathies with immunosuppression. Arch Ophthalmol. 2009;127:390–397.
- Carter RT, Oliver JW, Stepien RL, et al. Elevations in sex hormones in dogs with sudden acquired retinal degeneration syndrome (SARDS). J Am Anim Hosp Assoc. 2009;45:207–214.
- Leis ML, Lucyshyn D, Bauer BS, et al. Sudden acquired retinal degeneration syndrome in western Canada: 93 cases. Can Vet J. 2017;58:1195–1199.
- Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013;39:1–10.
- Ramos-Ruperto L, Busca-Arenzana C, Boto-de Los Bueis A, et al. Cancer-associated retinopathy and treatment with intravenous immunoglobulin therapy. A seldom used approach? Ocul Immunol Inflamm. 2019;1–4.
- Galeotti C, Kaveri SV, Bayry J. IVIG-mediated effector functions in autoimmune and inflammatory diseases. Int Immunol. 2017;29:491–498.
- Lunemann JD, Nimmerjahn F, Dalakas MC. Intravenous immunoglobulin in neurology-mode of action and clinical efficacy. Nat Rev Neurol. 2015;11:80–89.
- Parente R, Clark SJ, Inforzato A, et al. Complement factor H in host defense and immune evasion. Cell Mol Life Sci. 2017;74:1605–1624.
- Toomey CB, Johnson LV, Bowes RC. Complement factor H in AMD: Bridging genetic associations and pathobiology. Prog Retin Eye Res. 2018;62:38–57.
- Grozdanic S, Kecova H, Lazic T. Cancer incidence in dogs with clinical presentation of Sudden Acquired Retinal Degeneration Syndrome – SARDS. Abstracts: 48th Annual Conference of the American College of Veterinary Ophthalmologists, Baltimore, MD October 11-14, 2017. Baltimore, MD: Veterinary Ophthalmology (2017) 20, 6, E1–E19, 2017.
- Grozdanic S, Lazic T.Early detection of auto-immune retinopathies (SARDS and IMR) in dogs with normal day vision. Abstracts: 44th Annual Meeting of the American College of Veterinary Ophthalmologists, Puerto Rico, November 4–9, 2013: Veterinary Ophthalmology (2013) 16, 6, E26–E50, 2013.
- Grozdanic S, Kecova H, Chatzistefanou M, et al.Therapeutic outcomes in SARDS dogs with presence of normal day vision and completely absent retinal electrical activity. Abstracts: 47th Annual Meeting of the American College of Veterinary Ophthalmologists, Monterey, CA October 26–29, 2016: Veterinary Ophthalmology (2016) 19, 6, E21–E43.
Источник: Veterinary Ophthalmology. 2021;24:125–155. © 2020 The Authors. This is an open access article under the terms of the Creative Commons Attribution License, which permits use, distribution and reproduction in any medium, provided the original work is properly cited. Статья переведена и печатается с сокращениями.
СВМ № 4/2021