BoazArzi1, Derek D. Cissell1,2, Rachel E. Pollard1 and Frank J. M. Verstraete1
1 Department of Surgical and Radiological Sciences, School of Veterinary Medicine, University of California Davis, Davis, CA, USA
2 Department of Biomedical Engineering, University of California Davis, Davis, CA, USA
Edited by: Christopher R. Byron, Virginia-Maryland College of Veterinary Medicine, USA
Reviewed by: Yoav Bar-Am, The Hebrew University of Jerusalem, Israel Christopher John Snyder, University of Wisconsin-Madison, USA Nadine Fiani, Cornell University, USA
Обширная ростральная мандибулэктомия у собак обычно приводит к нестабильности нижней челюсти, что может привести к малокклюзии, затруднениям при захватывании корма и жевании, а также боли в височно-нижнечелюстном суставе. Обширные ростральные дефекты нижней челюсти являются затруднительными для реконструкции из-за сложной геометрии в этой области. Для того, чтобы восстановить целостность и стабильность нижней челюсти после обширной ростральной мандибулэктомии, мы разработали хирургическую технику, используя комбинацию интраорального и экстраорального подходов, скрепляющую титановую пластину и компрессионно-резистентную матрицу (CRM), заполненную костным морфогенетическим протеином 2 (rhBMP-2). Кроме того, применялось хирургическое планирование, которое включало компьютерную томографию (КТ) и модельную 3D-печать. Мы описываем регенеративную хирургическую технику при немедленной или отложенной реконструкции при ростральных дефектах нижней челюсти критического размера у пяти собак. Трём собакам для лечения применяли интактное гингивальное покрытие поверх дефекта нижней челюсти, после чего происходило немедленное восстановлении функции и прикуса. У двух собак имели место осложнения в виде выпирания фокальной пластины и растрескивания, что было скорректировано применением лоскута слизистой и наложением швов; эти собаки были вылечены с применением интактной гингивальной пластины, наложенной поверх дефекта нижней челюсти. Минерализованные тканевые образования пальпировались клинически через 2 недели, твёрдые костные образования – через 3 месяца. Результаты КТ через 6 месяцев после операции демонстрировали, что вновь образованная кость нижней челюсти имела повышенный уровень минерализации по сравнению с КТ, проведённым сразу после операции, также присутствовали признаки сращения изначальной кости, новообразованной кости и CRM. Мы делаем вывод, что ростральная реконструкция нижней челюсти с использованием регенеративного подхода является превосходным методом лечения для восстановления целостности нижней челюсти и предотвращает её нестабильность у собак.
Ключевые слова: нижняя челюсть, реконструкция, костные морфогенетические протеины, 3D-печать, восстановление, собака
Введение
Обширные ростральные дефекты нижней челюсти могут являться вторичными следствиями травмы, иссечения новообразований или других патологических, врождённых или связанных с развитием организма нарушений. Ростральные костные дефекты нижней челюсти критических размеров (напр., костный дефект, который из-за своего размера не восстанавливается путём формирования кости в течение жизни животного) приводят к малокклюзии и нестабильности [1–7]. Обширные потери кости в этом регионе могут приводить к затруднениям в захвате корма и жевании. Кроме того, нарушение ростральной целостности нижней челюсти в результате резекции и последующей малокклюзии могут влиять на конгруэнтность ямки нижнечелюстного сустава и приводить к возникновению боли и дегенерации височно-челюстного сустава (ВЧС) [1–3, 8–10]. Существенным является то, что реконструкция ростральной нижней челюсти может быть крайне сложной вследствие сложной анатомической геометрии в данной области. В первую очередь, ростральная часть нижней челюсти у собак имеет форму остроугольной арки, что совершенно отличается от геометрической формы тела нижней челюсти и закруглённой формы у людей [11].
Реконструкция дефектов нижней челюсти критических размеров требует жёсткой фиксации, в обычном случае в форме пластины с винтами, а также хорошей васкуляризации мягких тканей. Существуют различные стратегии заполнения костных дефектов критических размеров, включая трансплантацию собственной костной ткани, трансплантацию заменителей кости и клапанную пересадку свободных тканей бедра [4, 11-14]. Тем не менее, эти методы не идеальны, поскольку ведут к смерти донора, ограничены размером трансплантата (особенно у маленьких собак) и сложны в плане придания нужной формы [12, 15, 16]. Вдобавок, исход упомянутых методов может быть непредсказуем. Наша группа и другие авторы демонстрировали, что регенеративный подход к реконструкции дефектов нижней челюсти критического размера у собак с использованием каркаса и ростовых факторов, таких как rhBMP-2, может осуществляться с успехом и представляет собой превосходное функциональное лечение [3, 17–19]. Кроме того, регенерация кости нижней челюсти позволяет восстановить её целостность и, таким образом, обеспечивает должное биомеханическое и функциональное безболевое восстановление прикуса [12, 20].
Восстановление кости с использованием биоактивного каркаса и биоинженерных поддерживающих конструкций широко изучается с различным успехом. Ключевое исследование было впервые проведено Urist более 40 лет назад; в нём автор обнаружил, что костные морфогенетические протеины (BMPs) являются биоактивными смесями, которые способствуют костной регенерации [21, 22]. Эта работа продемонстрировала, что осуществимо использование нативного регенеративного объёма тела с экзогенными сигналами для создания собственных тканей предварительно заданной [23]. Позже Reddi показал, что BMPs ответствен за сигнальный каскад событий, которые ведут к индукции исходных клеток в создающуюся новую кость [24, 25]. Эти поразительные открытия привели к клиническому использованию BMPs в области лечения переломов, инженерии тканей зуба и сращиванию позвоночника [26, 27]. Кроме того, по современным данным, rhBMP-2 и rhBMP-7, доставляемые в ткани имплантируемой коллагеновой матрицей, показаны для сращивания позвоночника [26, 28–30].
Ранее мы описывали реконструкцию сегментарных костных дефектов нижней челюсти, которые были следствием несрастаемых переломов или иссечения новообразований, с использованием титановых запирающих пластин и rhBMP-2, доставляемых в ткани с использованием компрессионно-резистентного матричного (CRM) каркаса у собак [17, 19]. Таким образом, мы расширили этот хирургический подход к реконструкции ростральных участков нижней челюсти после обширной ростральной мандибулэктомии. В данной работе мы описываем серию случаев у пяти собак, которые подверглись билатеральной ростральной реконструкции нижней челюсти после мандибулэктомии с использованием внутренней фиксации и CRM, наполненной rhBMP-2. Также мы сообщаем о важном использовании 3D-биомодельной печати как методе хирургического планирования.
Материалы и методы
В данную статью об исследовании реконструкции нижней челюсти были включены собаки, которым требовалась обширная ростральная мандибулоэктомия вследствие одонтогенетических или неодонтогенетических опухолей, доставленные для обследования в Учебную клинику ветеринарной медицины Уильяма Р. Причарда Калифорнийского университета в Дейвисе. От владельцев собак было получено информированное согласие. Предоперационная подготовка для всех собак включала сбор минимальных необходимых данных (напр., полный анализ крови, биохимический анализ сыворотки крови и анализ мочи), которые дополнялись результатами абдоминальной ультрасонографии и торакальной радиографии или компьютерной томографии (КТ) [31]. Также проводилось исследование лимфатических узлов методом КТ, осуществлялась игольная аспирация их содержимого для цитологического анализа. Послеоперационно у собак проводилась оценка состояния через постоянные интервалы в течение всего последующего периода, описываемого в статье.
Компьютерная томография и модельная 3D-печать
Всем собакам до операции по реконструкции нижней челюсти и сразу после неё проводили поперечную 0,625-мм коллимированную компьютерную томографию головы с контрастом и без. У двух собак было проведено дополнительное КТ-исследование через 6 месяцев после операции, для одной собаки КТ-исследование было сделано через 2 месяца после операции. КТ проводилась с использованием КТ-сканера LightSpeed 16 (GE Healthcare, Milwaukee, WI, USA) при kVp = 120 и авто-мА. Все изображения были реконструированы с использованием костного фильтра. Во время получения изображений в поле зрения помещались калибровочные КТ-фантомы, содержащие пять эталонных стержней известной плотности (Mindworks Software, Inc.; San Francisco, CA, USA).
КТ-изображения оценивались по качественным и количественным параметрам с использованием программного обеспечения для просмотра изображений DICOM (OsiriX v. 4.1.2 32-bit; Geneva, Switzerland) и программного обеспечения для анализа данных (MAT-LAB R2013a; Mathworks®, Natick, MA, USA). Объём восстанавливаемой минеральной ткани, средняя минеральная плотность и порозность измерялись для восстановленных ростральных участков нижней челюсти сразу же после операции и через 6 месяцев. После визуальной калибровки объём восстанавливаемой минеральной ткани рассчитывался определением числа пикселей со значением минеральной плотности между 255 и 1260 мг/мл K2HPO4 в рассматриваемом участке (РУ), включавшем CRM-каркас, ассоциированные хирургические импланты, вновь сформированную кость и смежные мягкие ткани. Значения этих минеральных плотностей ранжировались с исключением пикселей, соответствующих мягкой ткани или металлу. Число «минеральных» пикселей подсчитывалось для всех поперечных изображений, находящихся рострально от участков мандибулэктомии; объём восстанавливаемой минеральной ткани после этого подсчитывался умножением числа «минеральных» пикселей на индивидуальный объём вокселей. Средняя минеральная плотность и порозность нативной кости и восстановленной ткани определялись по четырём репрезентативным непоследовательным поперечным КТ-изображениям с использованием РУ свободной формы, которые включали нативную кость или CRM-каркас / восстановленную ткань, но исключая зубы и металлические хирургические импланты. Результаты для четырёх изображений усреднялись для исключения ошибки, связанной с измерениями и вариабельностью между изображениями. Порозность рассчитывалась как число пикселей с минеральной плотностью <255 мг/мл K2HPO4, разделённое на общее число пикселей в РУ.
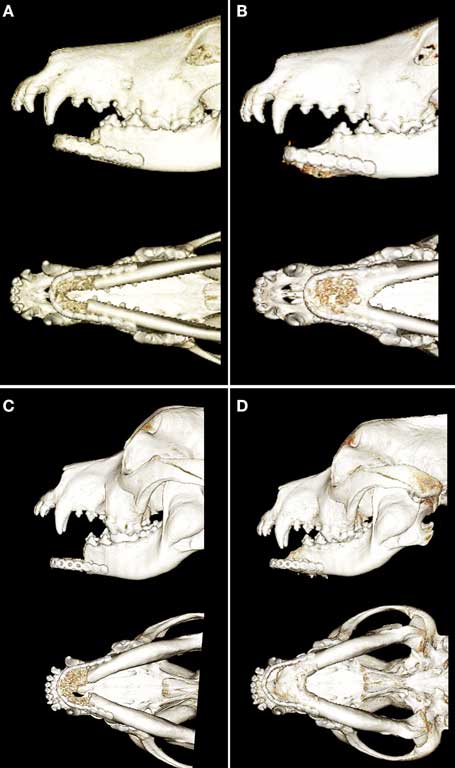
Для всех пациентов были сгенерированы объёмные 3D-изображения поперечных КТ-снимков для хирургического планирования операции по реконструкции нижней челюсти. После этого было создано поверхностное изображение костей на основе поперечных изображений DICOM и собрано в ячейку стандартного мозаичного языка (STL). Была напечатана 3D-модель в натуральную величину с использованием принтера Objet Connex 260V Polyjet Printer (Objet/Stratasys, Реховот, Израиль). У трёх собак до операций на пациентах хирургическая процедура проводилась на 3D-модели, при этом была сформирована единичная титановая скрепляющая пластина (2.4/3.0 mm, Synthes® Maxillofacial, Паоли, Пенсильвания, США) в форме подковы для продления рострально до уровня первого премоляра/клыка верхней челюсти (рис. 1). Базируясь на нашем понимании конфигурации черепа у собак, мы решили, что изгиб пластины под острым углом может привести к преждевременной поломке, поэтому следует избегать этого. В двух случаях пластина была сформирована без 3D-модели во время операции.
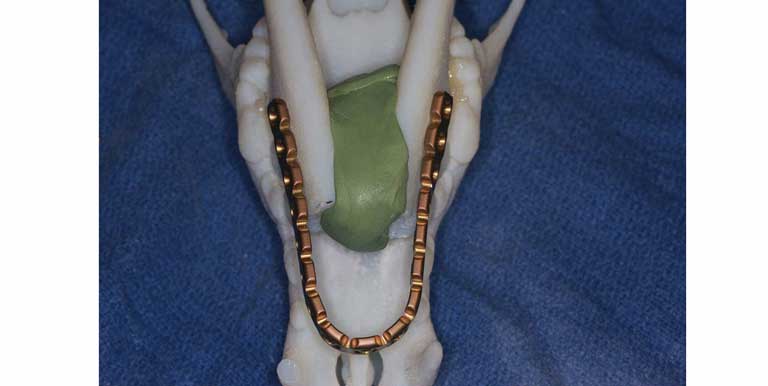 |
| Рисунок 1. Хирургическое планирование с использованием напечатанного на 3D-принтере черепа с демонстрацией регулирования и адаптации титановой соединительной пластины к модели ростральной части нижней челюсти |
Подготовка CRM и rhBMP-2
CRM и rhBMP-2 были приготовлены способами, описанными в изданных ранее работах [17, 19]. Вкратце, в данной работе были использованы CRM (коллагеновая губка с вкраплением гранул гидроксиапатита (ГА) и фосфата кальция, Master- Graft Matrix® Medtronic, Мемфис, Теннеси, США) и rhBMP-2 (Medtronic, Мемфис, Теннеси, США). Объём дефекта оценивался по трём измерениям, отмерялось количество CRM, достаточное для обеспечения восстановления от половины до высоты нижней челюсти и длины на 2 см больше, чем объём дефекта. За 10 минут до имплантации CRM инфильтрировался 0,5 мг/мл раствором rhBMP-2 в объёме, обеспечивающем заполнение до 50% объёма приготовленного CRM-каркаса. Например, для каркаса 4,5 см в длину, 1 см ширины нижней челюсти и 1,5 см высоты нижней челюсти (4,5 см × 1 см ×1,5 см) общий объём дефекта был 6,75 см3; соответственно, использовалось 3,38 мл раствора rhBMP-2.
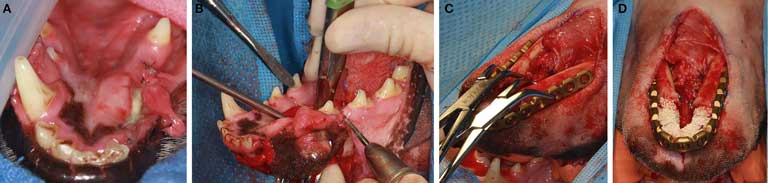 |
| Рисунок 2. Собака в стернальной позиции, подготовленная для остеотомии с интраоральным доступом (A, B). После завершения остеотомии собака размещена в дорсальной позиции, для размещения пластины (C) использован экстраоральный доступ (C, D). После того, как пластина закреплена титановыми крепёжными винтами, CRM, пропитанная rhBMP2, введена в область дефекта и закреплена на пластине |
Хирургическая техника
Перед операцией по реконструкции нижней челюсти проводилась интубация с фаринготомией, как описано в ранее опубликованных работах [32]. Затем предпринималась регистрация каудального прикуса (проводили тест прикуса смыканием челюстей — прим. ред.) от участка дистальнее четвёртых премоляров нижней челюсти до третьего моляра с использованием винилполисилоксанового штамповочного материала (3M ESPE, Сент-Пол, Миннесота, США). Это делалось для того, чтобы точно смоделировать прикус перед билатеральной ростральной мандибулэктомией. Область нижней челюсти изолировалась и обрабатывалась для асептической операции. Предоперационно вводился ампициллин в дозе 20 мг/кг в/в. Билатеральная ростральная мандибулэктомия проводилась собакам в стернальном положении, как описывалось в ранее опубликованных работах (рис. 2А) [32]. Иссекаемый участок измерялся и маркировался хирургическим маркером. Затем ростральные участки нижней челюсти, включая кости и окружающие ткани, иссекались (рис. 2В) в гарантированных хирургических границах (10 мм или более), после чего проводилось интраоральное закрытие дефекта одним слоем с использованием 4-0 полиглекапрона 25 (Monocryl®, Ethicon, Сомервиль, Нью-Джерси, США). Собаки фиксировались в дорсальном положении, и предварительно подготовленные отпечатки размещались в ротовой полости для восстановления нормального прикуса удалённых участков нижней челюсти. Применялся экстраоральный подход к обоим участкам нижней челюсти через однократный разрез по средней линии. Затем проводилось острое и тупое препарирование, челюсти обнажались и предварительно контурированная пластина (2,4/3,0 мм нижнечелюстная замыкающая реконструктивная пластина, Synthes® Maxillofacial, Паоли, Пенсильвания, США) размещалась и адаптировалась к кости при помощи костных щипцов (рис. 2С), после чего закреплялась 3-мм замыкающими винтами. При планировании размещения пластины должно приниматься во внимание усечение кожи после ампутации и то, что кожа не должна натягиваться на пластину. Во избежание ятрогенной травмы зубов важно, чтобы пластина позиционировалась вентрально к корням зубов. Перед имплантированием rhBMP-2 вводилась CRM, место операции обильно орошалось стерильным физиологическим раствором. Затем вводимая CRM имплантировалась в дефект для плотного облегания и закреплялась по окружности 4-0 полиглекапроном 25 (Monocryl®, Ethicon, Сомервиль, Нью-Джерси, США) для предотвращения смещения после имплантации (рис. 2D). Окружающие мягкие ткани подшивались вокруг пластины и CRM для обеспечения мягкотканного облегания. Подкожная клетчатка и кожа закрывались стандартным образом.
Послеоперационное лечение включало дачу мягкого корма в течение 2 недель и введение амоксициллина/клавулоновой кислоты перорально (Clavamox, Pfizer Animal Health, Нью-Йорк, США) дважды в день также в течение 2 недель. Обеспечивалась анальгезия применением опиоидов и противовоспалительное лечение в течение 7–14 дней.
Таблица 1. Суммарные данные пяти собак, которым была проведена ростральная реконструкция нижней челюсти
| Собака | Возраст (лет) | Вес (кг) | Порода | Тип опухоли | Период постоперационного наблюдения (месяцев) |
| 1 | 8 | 38,2 | Метис немецкого дога | Оссифицирующая фиброма | 24 |
| 2 | 10 | 25,7 | Колли | Сквамозно-клеточная карцинома | 10 |
| 3 | 4 | 23,7 | Лабрадор-ретривер | Сквамозно-клеточная карцинома | 2 |
| 4 | 9 | 22,2 | Стандартный пудель | Периферийная одонтогенная фиброма | 2 |
| 5 | 3 | 64,5 | Мастино-наполитано | Акантоматозная амелобластома | 9 |
Результаты
Суммарные данные по собакам представлены в таблице 1. В общей сложности сюда были включены 5 собак в возрасте 3–10 лет (в среднем 6,8 лет) и весом от 22,2 до 64,5 кг (в среднем 34,9 кг), которым была осуществлена мандибулэктомия и реконструкция нижней челюсти. Все собаки были в хорошем физическом состоянии. Результаты гематологических и биохимических анализов крови, а также анализов мочи были в целом в пределах нормы для всех собак, за исключением одной, у которой в анамнезе было хроническое заболевание почек 3-й стадии, ранее тщательно пролеченное. КТ грудной клетки и абдоминальная ультросонография, проводившиеся во время определения степени новообразования, не выявили нарушений у всех собак. Ни у одной собаки не наблюдалось интраоперационных осложнений, а извлечённые при хирургическом вмешательстве ткани в результате гистопатологического анализа показали отсутствие неопластических клеток. У одной собаки со сквамозной клеточной карциномой процедура была проведена в несколько стадий из-за размера и протяжённости опухоли. Первая стадия представляла собой билатеральную ростральную мандибулэктомию с обширной (минимально 10 мм) резекцией кожи и слизистой оболочки ротовой полости. После того, как гистопатологически было подтверждено отсутствие опухолевых клеток в окружающей ткани, 4 недели спустя была проведена вторая операция для реконструкции ростральных участков нижней челюсти, как описано выше.
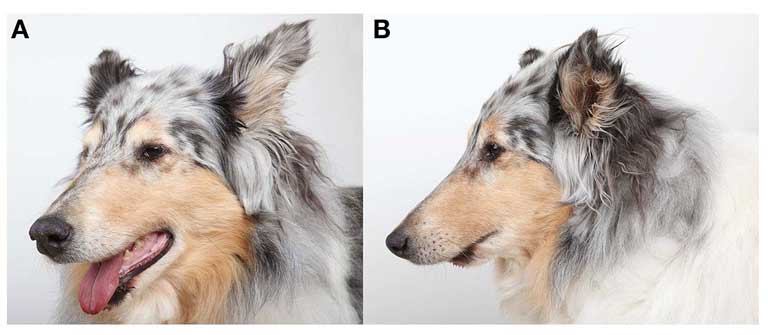 |
| Рисунок 3. Фотография собаки при контрольной проверке через 2 и 6 месяцев, показывающая состояние нижней челюсти и черепа после успешной реконструкции ростральных участков нижней челюсти |
Последующий период
Период последующих наблюдений после реконструкции нижней челюсти длился 2 – 24 мес. (в среднем 9,4 мес). Все собаки обследовались клинически, что подразумевало осмотр ротовой полости и пальпацию сразу после операции и на протяжении всего последующего периода; во всех случаях был констатирован правильный прикус (рис. 3). Кроме того, все собаки сразу же вернулись к нормальной активности, за исключением ограничения жевания в течение 2–3 месяцев. Две недели спустя после операции твёрдые ткани, заполнявшие всю область дефекта, были пальпируемы и закрыты интактными дёснами у трёх собак. В течение 4 недель после операции дефекты ощущались полностью отвердевшими и никаких отклонений обнаружено не было. В описанном периоде наблюдения пальпация реконструируемых зон показывала присутствие твёрдых тканей без признаков опухолей.
Осложнения
У одной собаки после операции по реконструкции нижней челюсти было выявлено выпячивание пластины сквозь слизистую оболочку через 14 дней после операции. Был подготовлен клапан (лоскут) из участка слизистой оболочки, смежного с местом выхода пластины, и после обильного орошения стерильным физиологическим раствором пластина была закрыта, клапан (лоскут) подшит с использованием 4-0 полиглекапрона 25 (Monocryl®, Ethicon, Сомервилль, Нью-Джерси, США) единичным прерывистым швом. Часть материала каркаса проксимально ростральной её части была удалена в процессе орошения. У одной собаки было выявлено растрескивание раны через 6 дней после операции и CRM-материал был выдавлен. Была проведена хирургическая ревизия с повторным ушиванием кожи и слизистой оболочки рта. В результате присутствующей контаминации и возможной инфекции имплантация новой CRM с инфузией rhBMP-2 не проводилась. 8 недель спустя был осуществлён осмотр полости рта под общей анестезией, проведены КТ и дентальная рентгенография. Клинически наблюдались правильный прикус и закрытие дефекта интактной слизистой оболочкой, твёрдые ткани пальпировались в ростральных участках нижних челюстей. KT выявила интактную костную пластину и костные винты без признаков остеолизиса нативной нижней челюсти. CRM-каркас отсутствовал, но при этом он был замещён гомогенной, слегка окаймлённой минеральной непроницаемой тканью, соединяющей межчелюстное пространство между правым и левым участками удалённой кости нижней челюсти. Эта минеральная непроницаемая ткань отличалась по виду от оригинального CRM-каркаса, прилегала к нативной челюсти и совмещалась с регенерированной костью. Минеральный объём оригинального CRM-каркаса был 2,653 см со средней минеральной концентрацией K2HPO4 460,8 мг/мл и порозностью 8,8 %. Несмотря на полную потерю CRM-каркаса вновь сформированная кость через 8 недель после хирургической ревизии имела объём 1,87 см3, среднюю минеральную концентрацию K2HPO4 490,4 мг/мл и порозность 6,5%. Имелось небольшое пространство (~6–9 мм) между ростральным объёмом новой минеральной непрерывной ткани и ростральной стороной костной пластины. На протяжении того же временного интервала в нативной части нижней челюсти увеличилось среднее минеральное содержание K2HPO4 с 769,2 до 844,5 мг/мл и снизилась порозность с 22,4 до 18,6%. В общей сложности результаты контрольной КТ показали выздоровление в областях мандибулэктомии без каких-либо признаков остеомиелита, связанного с постоперационным растрескиванием раны.
В оставшийся период наблюдения не было обнаружено других отклонений, не было отмечено выходов пластины сквозь слизистую оболочку. Также все владельцы сообщили, что их собаки имеют превосходное качество жизни.
КТ-оценка
На КТ-изображениях присутствовали рентгенологические доказательства неравномерного формирования новой кости с интенсивностью от лёгкой до средней на аксиальной, вентральной и дорсальной поверхностях имплантируемых материалов (рис. 4 и 5). Участки остэктомии намного меньше отличались от других участков через 6 месяцев по сравнению с КТ, проведённой сразу после операции по реконструкции нижней челюсти. Кроме того, через 6 месяцев новая кость соединила аксиальную и вентральную части нативной нижней челюсти и имплантный материал, создав интеграцию между имплантным материалом и нативной нижней челюстью (рис. 4 C, F). У одной собаки наблюдалось значительное количество гетерогенной, слегка окаймлённой восстановленной ткани гипоаттенуированной минеральной матовости, заполняющей ростральное межчелюстное пространство спустя 6 месяцев после операции (рис. 4C). У одной собаки, для которой потребовалось удаление части имплантируемого материала, на КТ просматривалось небольшое пространство между ростральной частью искривлённой костной пластины и имплантированным материалом (рис. 4F).
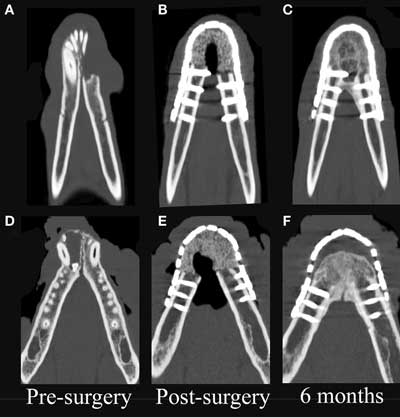 |
| Рисунок 4. Дорсальное реконструированное КТ-изображение нижних челюстей двух пациентов до операции (A, D), сразу после операции (B,E), и 6 месяцев спустя после операции (C,F). Правая сторона пациентов отображена в левой части изображений. Отмечается географический остеолизис ростральной части левой ветви нижней челюсти у пациента 1 (A) и ростральной части правой ветви нижней челюсти у пациента 2 (D), связанный со сквамозно-клеточным раком и акантоматозной амелобластомой, соответственно. Через 6 месяцев границы между каркасом и нативной костью нижней челюсти стали менее отличимы и новая регенерированная костная ткань заполняет ростральное межчелюстное пространство |
Количественные КТ-измерения у двух собак, у которых не проявлялось никаких осложнений после реконструкции нижней челюсти, показывали ремоделирование обеих нативных ветвей нижней челюсти и CRM-каркаса / восстановленных тканей. Важно, что у обоих пациентов между послеоперационным КТ и контрольным КТ через 6 месяцев проявлялся рост объёма минеральной восстановленной ткани на уровне 43–53%. Средняя минеральная плотность (483 ± 16518 ± 52 мг K2HPO4/мл) и порозность (7,4 ± 2,3-9,3 ± 5,9%) CRM-каркаса у обоих пациентов сразу после операции были сходными. Каркасы были менее плотными и менее порозными по сравнению с нативной костью нижней челюсти, которая имела средние значения минеральной плотности 577 ± 5 – 713 ± 47 мг/мл K2HPO4 и порозности 27.0 ± 4.0 – 33.0 ± 2.0%. Оба пациента демонстрировали пониженную среднюю минеральную плотность (–11,0 до –23,0%) и повышенную порозность (+6,0 до +10,0%) восстановленной ткани на КТ 6 месяцев спустя. У одного пациента при проверке через некоторое время в отношении нативной кости нижней челюсти наблюдались неизменённая в целом минеральная плотность (+2,0%) и снижение порозности на 6,6%, при этом у второго пациента кость нативной нижней челюсти демонстрировала среднюю минеральную плотность, сниженную на 16%, и порозность, повышенную на 10,4%. Несмотря на различия в реакции нативной кости у двух пациентов, восстановленная ткань демонстрировала повышенный уровень минерализации, сниженную среднюю плотность и повышенную порозность у обоих.
 |
| Рисунок 5. Латеральная и вентральная проекции объёмного 3D-изображения, созданного на основе КТ-изображений сразу после операции (A, C) и 6 месяцев спустя после операции (B, D). Следует обратить внимание на новообразованную кость в межчелюстном пространстве и заполнение участков остеоэктомии у обоих пациентов через 6 месяцев после операции |
Обсуждение
Это первое сообщение о группе собак, которым была проведена неотложная или отложенная ростральная реконструкция нижней челюсти с использованием интернальной фиксации и CRM, инфузированной rhBMP-2. Кроме того, мы приводим описание хирургической техники и клинического опыта по использованию rhBMP-2 при билатеральной ростральной реконструкции нижней челюсти, а также сообщаем о клиническом и рентгенографическом исходе. Важно, что эта статья иллюстрирует положительные стороны регенеративного подхода к реконструкции дефектов кости нижней челюсти у собак.
Обширная билатеральная ростральная мандибулэктомия приводит к брахигнатизму нижней челюсти и нестабильности оставшейся нижнечелюстной кости [32]. Кроме того, поскольку исчезает ростральная поддержка языка, последний начинает высовываться из ротовой полости и появляется слюнотечение. В целом, чем более обширной является резекция, тем более выражены функциональные затруднения. Существенным является то, что присутствие нестабильности нижней челюсти приводит к ненормальному механическому воздействию на височно-челюстной сустав, что, в свою очередь, может привести к его дегенерации [10, 33, 34]. Хотя эти изменения могут не проявляться клинически в краткосрочном периоде после операции, длительная дегенерация височно-челюстного сустава может приводить к боли и дисфункции [35, 36]. Таким образом, идеальным решением для устранения функциональных осложнений после обширной билатеральной ростральной мандибулэктомии является реконструкция и восстановление целостности, насколько это возможно.
В нашем институте проводилась реконструкция нижней челюсти, использующая регенеративный подход, сегментных дефектов нижнечелюстной кости после резекции опухоли или несобираемых дефектов вследствие переломов [17, 19]. Ранее мы сообщали, что такая комбинированная хирургическая и регенеративная стратегия приводит к быстрому возврату к нормальному функционированию. Хотя ранее осуществлялись попытки устранить нестабильность нижней челюсти путём использования ортопедических пинов, винтов и костных трансплантатов, ни один из этих подходов не привёл к восстановлению целостности ростральных участков нижней челюсти [32, 37, 38]. Таким образом, введение в практику регенеративного хирургического подхода к реконструкции нормальной или почти нормальной анатомии нижней челюсти и прикуса является решающим моментом в восстановлении должной биомеханической и безболезненной функциональности. Тем не менее, как видно из данной статьи, реконструкция нижней челюсти полноценной длины может не быть достигнута в результате укорочения мягких тканей после ампутации, а сгибание пластины под острым углом может привести к раннему отторжению импланта или поломке пластины.
В согласии с нашим предыдущим сообщением, формация твёрдой ткани пальпировалась уже через 2 недели после операции. К 6 месяцам эта ткань была рентгенологически хорошо интегрирована, но менее плотна и менее порозна, чем нативная ткань нижней челюсти. Хотя мы не оценивали гистологические характеристики этой новой костной формации, предыдущие сообщения подтверждают, что rhBMP-2, введённая в CRM-каркас, приводит к развитию минерализованной трабекулярной кости, соответствующей по строению здоровой кости и ремоделированной [3, 39, 40]. КТ-исследование на большей частоте и в более отдалённые сроки после операции является необходимым, чтобы определить, достигает ли и на каком уровне достигает регенерированная ткань нижней челюсти плотности и порозности нативной кости.
Регенерация костных дефектов критических размеров требует возможности повторить биологические процессы развития и контролировать морфогенез ткани [41]. Кроме того, развитие функционирующей кости путём регенерации зависит от доставки физических и химических стимулов [41]. Эти стимулы доставлялись rhBMP-2, введённым в CRM-каркас. Кроме того, rhBMP-2 отвечает за репликацию нативных сигналов микросреды в пространственно-временной манере для осуществления адекватной локализованной остеоиндукции. Тем не менее применение rhBMP-2 в критичной степени зависит от каркаса и концентрации дозы, а также времени применения [42, 43]. Каркас, использованный в этом исследовании, представляет собой CRM, который успешно использовался в ряде других работ [3, 17–20, 30]. Примечательно, что доза, использованная в настоящем исследовании (0,5 мг/мл с 50% объёмом впитанной жидкости) такая же, как и в предыдущих работах и, таким образом, рекомендуется нами как клинически выверенная доза для собак [3, 17, 19]. Тем не менее более высокая дозировка rhBMP-2 может приводить к обширным костным формированиям [44]. Однако требуется доработка использования rhBMP-2 в длительном периоде для ростральной реконструкции нижней челюсти с целью понимания процессов ремоделирования кости, регенерации кости и возможного влияния на окружающие мягкие ткани.
У двух собак наблюдались осложнения в виде частичного выхода пластины через слизистую оболочку рта и расхождения операционной раны. Возможно, что ростральная локация пластины и/или недостаток здоровых смежных тканей (т. е. мышц, жира, подкожной жировой клетчатки) для покрытия пластины могли быть причиной этих осложнений. Выход пластины через слизистую оболочку был впервые описан для экспериментальных состояний [45] Кроме того, в различных статьях также описывают выход пластины через слизистую оболочку у собак, которым проводили сегментные реконструкционные операции. Однако в этих работах собакам ставились две пластины для двухсторонней фиксации дефекта [3, 8]. В этих случаях выпирание пластины было устранено путём её удаления [3, 8]. В настоящей группе собак мы продемонстрировали, что при выпячивании пластины через слизистую оболочку закрытие лоскутом в сочетании с обильным орошением стерильным физиологическим раствором может сохранить фиксирующую пластину. Одна из собак в настоящей работе перенесла ступенчатую операцию, при этом ростральная мандибулэктомия была проведена за 4 недели до реконструкции из-за размера и протяжённости опухоли, а также попытки выявить хирургические границы, свободные от опухоли, путём гистологического анализа. Важно подчеркнуть, что введение фактора роста, каковым является rhBMP-2, в область оперативного вмешательства с присутствующими опухолевыми клетками противопоказано, поскольку это, вероятно, может ускорить восстановление опухоли. Таким образом, мы рекомендуем, чтобы тщательный выбор пациента основывался на размере, биологическом поведении и инвазивной природе опухоли.
Настоящее исследование приводит пример использования 3D-печати как возможности хирургического планирования при реконструкции нижней челюсти у собак. Реконструкция верхнечелюстно-лицевой области может представлять серьёзную проблему даже для опытных хирургов в силу своей сложной формы [46]. Мы обнаружили, что наличие 3D-модели дала хирургу возможность провести тщательное предоперационное планирование и практику виртуальной остеотомии, а также создать до операции имплант, учитывающий особенности пациента [46–48]. Хотя рентгенологическая 3D-визуализация является ведущим методом при организации верхнечелюстно-лицевой реконструкции, она имеет ограничения в использовании на плоском экране. 3D-печать повреждённого участка черепа преодолевает это ограничение и позволяет осязаемо оценить нарушение и должное оперативное лечение [46]. В дальнейшем это может быть признано наилучшим предоперационным методом планирования, который позволит снизить время и общую стоимость операции [49].
В заключение следует отметить, что регенеративный подход к ростральной реконструкции нижней челюсти с использованием CRM с введённой rhBMP-2, как было продемонстрировано здесь, является возможным и имеет предсказуемо хороший исход. Кроме того, применение 3D-печати как части хирургического планирования является важным для всестороннего понимания расстройства и тщательного хирургического лечения. На основании настоящего и предыдущих сообщений можно говорить, что сфера регенеративной хирургической реконструкции дефектов нижней челюсти критического размера у собак является вполне оправданной, поскольку ведёт к воспроизводимому и предсказуемому росту новой кости и устраняет необходимость отбора собственной кости и связанной с этим процессом смертности и боли.
Благодарности. Авторы благодарят компанию Medtronic® за великодушное дарение rhBMP-2 и CRM в порядке благотворительности для лечения животных.
Сообщение о конфликте интересов. Авторы заявляют, что исследование проводилось в отсутствие какой-либо коммерческой или финансовой заинтересованности, которая могла бы быть истолкована как потенциальный конфликт интересов.
Литература
- Arzi B, Verstraete FJ. Mandibular rim excision in seven dogs. Vet Surg (2010) 39(2):226–31. r-Am Y, Verstraete FJ. Elastic training for the prevention of mandibular drift following mandibulectomy in dogs: 18 cases (2005-2008). Vet Surg (2010) 39(5):574–80.
- Spector DI, Keating JH, Boudrieau RJ. Immediate mandibular reconstruction of a 5 cm defect using rhBMP-2 after partial mandibulectomy in a dog. Vet Surg (2007) 36(8):752–9.
- Lantz GC. Mandibulectomy techniques. In: Verstraete FJ, Lommer MJ, editors. Oral and Maxillofacial Surgery in Dogs and Cats. Edinburgh: Elsevier (2012). p. 467–80.
- Hollinger JO, Kleinschmidt JC. The critical size defect as an experimental model to test bone repair materials. J Craniofac Surg (1990) 1(1):60–8.
- Huh JY, Choi BH, Kim BY, Lee SH, Zhu SJ, Jung JH. Critical size defect in the canine mandible. Oral Surg Oral Med Oral Pathol Oral Radiol Endod (2005) 100(3):296–301. doi:10.1016/j.tripleo.2004.12.015
- Schmitz JP, Hollinger JO. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clin Orthop Relat Res (1986) 205:299–308.
- Boudrieau RJ, Mitchell SL, Seeherman H. Mandibular reconstruction of a partial hemimandibulectomy in a dog with severe malocclusion. Vet Surg (2004) 33(2):119–30.
- Barrera-Mora JM, Espinar Escalona E, Abalos Labruzzi C, Llamas Carrera JM, Ballesteros EJ, Solano Reina E, et al. The relationship between malocclusion, benign joint hypermobility syndrome, condylar position and TMD symptoms. Cranio (2012) 30(2):121–30.
- Umphlet RC, Johnson AL, Eurell JC, Losonsky J. The effect of partial rostral hemimandibulectomy on mandibular mobility and temporomandibular joint morphology in the dog. VetSurg (1988) 17(4): 186–93.
- Tsai MJ, Wu CT. Study of mandible reconstruction using a fibula flap with application of additive manufacturing technology. Biomed Eng Online (2014) 13:57.
- Carter TG, Brar PS, Tolas A, Beirne OR. Off-label use of recombinant human bone morphogenetic protein-2 (rhBMP-2) for reconstruction of mandibular bone defects in humans. J Oral Maxillofac Surg (2008) 66(7):1417–25.
- Burchardt H,EnnekingWF. Transplantation of bone. Surg Clin North Am (1978) 58(2):403–27.
- Hollinger JO, Brekke J, Gruskin E, Lee D. Role of bone substitutes. Clin Orthop RelatRes (1996) 324:55–65.
- Heary RF, Schlenk RP, Sacchieri TA, Barone D, Brotea C. Persistent iliac crest donor site pain: independent outcome assessment. Neurosurgery (2002) 50(3):510–6.
- Marx RE, Morales MJ. Morbidity from bone harvest in major jaw reconstruction: a randomized trial comparing the lateral anterior and posterior approaches to the ilium. J Oral Maxillofac Surg (1988) 46(3):196–203.
- Arzi B, Verstraete FJ, Huey DJ, Cissell DD, Athanasiou KA. Regenerating mandibular bone using rhBMP-2: part 1-immediate reconstruction of segmental mandibulectomies. Vet Surg (2014).
- Boudrieau RJ. Initial experience with rhBMP-2 delivered in a compressive resistant matrix for mandibular reconstruction in 5 dogs. Vet Surg (2014).
- Verstraete FJ, Arzi B, Huey DJ, Cissell DD, Athanasiou KA. Regenerating mandibular bone using rhBMP-2: part 2-treatment of chronic, defect non-union fractures. Vet Surg (2014).
- Herford AS, Boyne PJ. Reconstruction of mandibular continuity defects with bone morphogenetic protein-2 (rhBMP-2). J Oral Maxillofac Surg (2008) 66(4):616–24.
- Urist MR. Bone: formation by autoinduction. Science (1965) 150(3698):893–9.
- Urist MR, Strates BS. The classic: bone morphogenetic protein. Clin Orthop RelatRes (2009) 467(12):3051–62.
- Tatara AM, Wong ME, Mikos AG. In vivo bioreactors for mandibular reconstruction. J Dent Res (2014) 93(12):1196–202.
- Reddi AH, Huggins C. Biochemical sequences in the transformation of normal fibroblasts in adolescent rats. Proc Natl Acad Sci USA (1972) 69(6):1601–5.
- Reddi AH. Cell biology and biochemistry of endochondral bone development. Coll RelatRes (1981) 1(2):209–26.
- Nakashima M, Reddi AH. The application of bone morphogenetic proteins to dental tissue engineering. Nat Biotechnol (2003) 21(9):1025–32.
- Seeherman H, Wozney JM. Delivery of bone morphogenetic proteins for orthopedic tissue regeneration. Cytokine Growth Factor Rev (2005) 16(3):329–45.
- Bessa PC, Casal M, Reis RL. Bone morphogenetic proteins in tissue engineering: the road from the laboratory to the clinic, part I (basic concepts). JTissue Eng Regen Med (2008) 2(1):1–13.
- Reddi AH. Role of morphogenetic proteins in skeletal tissue engineering and regeneration. Nat Biotechnol (1998) 16(3):247–52.
- Herford AS, Lu M, Buxton AN, Kim J, Henkin J, Boyne PJ, et al. Recombi- nant human bone morphogenetic protein 2 combined with an osteoconductive bulking agent for mandibular continuity defects in nonhuman primates. J Oral Maxillofac Surg (2012) 70(3):703–16.
- Arzi B, Verstraete FJ. Clinical staging and biopsy of maxillofacial tumors. In: Verstraete FJ, Lommer MJ, editors. Oral and Maxillofacial Surgery in Dogs and Cats. Edinburgh: Elsevier (2012). p. 373–80.
- Lantz GC. Pharyngotomy and pharyngostomy. In: Verstraete FJ, Lommer MJ, editors. Oral and Maxillofacial Surgery in Dogs and Cats. Edinburgh: Elsevier (2012). p. 543–6.
- de Bont LG, Boering G, Liem RS, Eulderink F, Westesson PL. Osteoarthritis and internal derangement of the temporomandibular joint: a light microscopic study. J Oral Maxillofac Surg (1986) 44(8):634–43.
- Mongini F. Influence of function on temporomandibular joint remodeling and degenerative disease. Dent Clin North Am (1983) 27(3):479–94.
- Arzi B, Cissell DD, Verstraete FJ, Kass PH, DuRaine GD, Athanasiou KA. Computed tomographic findings in dogs and cats with temporomandibular joint disorders: 58 cases (2006–2011). JAm Vet Med Assoc (2013) 242(1):69–75.
- Tanaka E, Detamore MS, Mercuri LG. Degenerative disorders of the tem- poromandibular joint: etiology, diagnosis, and treatment. J Dent Res (2008) 87(4):296–307.
- Bradney IW, Hobson HP, Stromberg PC. Rostral mandibulectomy combined with intermandibular bone graft in treatment of oral neoplasia. J Am Anim Hosp Assoc (1987) 23:611–5.
- Vernon FF, Helphrey M. Rostral mandibulectomy — case reports in dogs. Vet Surg (1983) 12:26–9.
- Boyne PJ, SalinaS, NakamuraA, AudiaF, ShabahangS. Bone regeneration using rhBMP-2 induction in hemimandibulectomy type defectsofelderlysub-human primates. Cell Tissue Bank (2006) 7–10.
- Zara JN, Siu RK, Zhang X, Shen J, Ngo R, Lee M, et al. High doses of bone morphogenetic protein 2 induce structurally abnormal bone and inflammation in vivo. Tissue Eng Part A (2011) 17(9–10):1389–99.
- Gothard D, Smith EL, Kanczler JM, Rashidi H, Qutachi O, Henstock J, et al. Tissue engineered bone using select growth factors: a comprehensive review of animal studies and clinical translation studies in man. Eur Cell Mater (2014) 28:166–207.
- King GN, Cochran DL. Factors that modulate the effects of bone morphogenetic protein-induced periodontal regeneration: a critical review. JPeriodontol (2002) 73(8):925–36.
- Pang EK, Im SU, Kim CS, Choi SH, Chai JK, Kim CK, et al. Effect of recombinant human bone morphogenetic protein-4 dose on bone formation in a rat calvarial defect model. J Periodontol (2004) 75(10):1364–70.
- Lewis JR, Boudrieau RJ, Reiter AM, Seeherman HJ, Gilley RS. Mandibular reconstruction after gunshot trauma in a dog by use of recombinant human bone morphogenetic protein-2. J Am Vet Med Assoc (2008) 233(10):1598–604.
- Verstraete FJ, Ligthelm AJ. Dental trauma caused by screws in internal fixation of mandibular osteotomies in the dog. Vet Comp Orthop Traumatol (2015) 5(3):19–23.
- Parthasarathy J. 3D modeling, custom implants and its future perspectives in craniofacial surgery. Ann Maxillofac Surg (2014) 4(1):9–18.
- Jardini AL, Larosa MA, Maciel Filho R, Zavaglia CA, Bernardes LF, Lambert CS, et al. Cranial reconstruction: 3D biomodel and custom-built implant created using additive manufacturing. J Craniomaxillofac Surg (2014) 42(8):1877–84.
- Rengier F, Mehndiratta A, von Tengg-Kobligk H, Zechmann CM, Unterhinninghofen R, Kauczor HU, et al. 3D printing based on imaging data: review of medical applications. Int J Comput Assist Radiol Surg (2010) 5(4):335–41.
- D’Urso PS, Barker TM, Earwaker WJ, Bruce LJ, Atkinson RL, Lanigan MW, et al. Stereolithographic biomodelling in cranio-maxillofacial surgery: a prospective trial. J Craniomaxillofac Surg (1999) 27(1):30–7.
Источник: This article was submitted to Veterinary Dentistry and Oromaxillofacial Surgery, a section of the journal Frontiers in Veterinary Science. This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY). The use, distribution or reproduction in other forums is permitted, provided the original author(s) or licensor are credited and that the original publication in this journal is cited, in accordance with accepted academic practice. No use, distribution or reproduction is permitted which does not comply with these terms.
СВМ № 1/2019



