Согласно исследованию, опубликованному в журнале Science Translational Medicine, американским учёным удалось найти один из механизмов, ответственных за реакцию иммунитета на силиконовые импланты. Ключевая роль оказалась у сенесцентных клеток, которые стимулируют образование провоспалительных Т-лимфоцитов. Исследователям удалось замедлить образование фиброзной капсулы вокруг имплантата с помощью сенолитика — препарата, который убивает «старые» клетки. Теоретически это могло бы стать методом профилактики осложнений после установки имплантатов, в том числе грудных.
Несмотря на то что имплантация синтетических материалов в тело человека превратилась в рутинную операцию, она продолжает вызывать побочные эффекты и в некоторых случаях даже заболевания. Как бы мы ни старались «спрятать» поверхность имплантата от иммунной системы, время от времени у пациентов возникает реакция на инородное тело: вокруг него скапливаются иммунные клетки — в первую очередь макрофаги, а фибробласты из окрестных соединительных тканей начинают выделять волокна межклеточного вещества. В результате имплантат покрывается плотной фиброзной (соединительнотканной) капсулой. Из-за этого он может сморщиться и потерять форму, но это ещё полбеды — по некоторым данным, в случае грудных имплантатов фиброз повышает риск развития ревматологических патологий и даже опухолей.
Группа учёных под руководством Дженнифер Елисеефф (Jennifer Elisseeff) из Медицинской школы университета Джонса Хопкинса предположила, что в процессе реакции организма на силиконовый имплантат задействована система не только врождённого, но и приобретённого иммунитета, поскольку они тесно связаны друг с другом. Чтобы проверить свои предположения, они взяли пробы у 12 пациенток во время операции замены грудного имплантата. В тканях, окружающих силикон, они подсчитали количество иммунных клеток разных типов. Оказалось, что среди них преобладают Т-хелперы 17 — это группа регуляторных Т-лимфоцитов, которые стимулируют воспаление и часто появляются при аллергиях и аутоиммунных процессах. В пробах также обнаружили повышенную концентрацию интерлейкина-17 — провоспалительного белка, который производит эта группа Т-клеток.
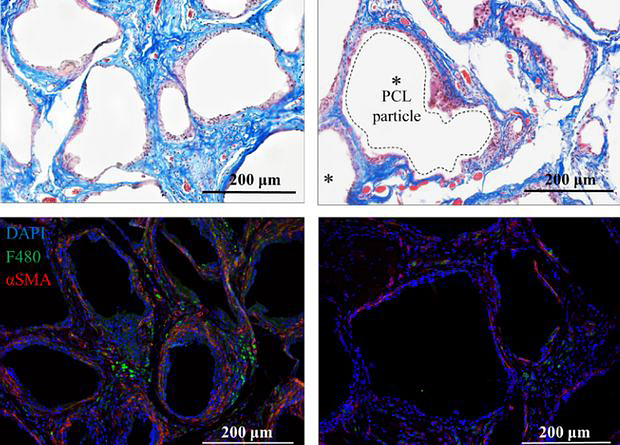
Затем исследователи задались вопросом, универсален ли этот процесс для разных имплантатов. Они имплантировали под кожу мышей несколько типов синтетических материалов: поликапролактон («стандарт» иммуногенного имплантата), полиэтилен, полиэтиленгликоль и силикон. Сила иммунного ответа (уровень экспрессии провоспалительных белков) различалась в зависимости от материала, но во всех случаях учёные обнаружили повышенное производство интерлейкина-17. Его выделяли несколько клеточных типов, но в конечном счёте — через полтора месяца после имплантации — первое место среди них заняли Т-хелперы 17.
Чтобы выяснить, участвует ли интерлейкин-17 в образовании фиброзной капсулы, авторы работы повторили эксперимент на нокаутных мышах — у них отсутствовал или сам интерлейкин-17 или рецептор к нему. У таких животных вокруг имплантата скапливалось меньше соединительнотканных клеток, а экспрессия белков внеклеточного матрикса в их оказалась в 1,5-2 раза меньше, чем у обычных мышей с имплантатом. Тогда исследователи предположили, что достаточно заблокировать работу интерлейкина-17, чтобы воспрепятствовать фиброзу. И действительно, когда они ввели антитела к этому белку в организм животных, экспрессия белков внеклеточного матрикса снизилась — примерно до того же уровня, что и у нокаутных по интерлейкину-17 мышей.
Образование Т-хелперов 17, среди прочего, запускается провоспалительным интерлейкином-6. А его источником часто являются сенесцентные клетки — «старые» клетки, которые не размножаются, зато способны спровоцировать перестройку и воспаление в ткани. Авторы работы предположили, что они могут накапливаться в тканях, окружающих имплантат. Окрасив ткани контрольных мышей и мышей с имплантатом, они заметили, что у последних через 6 недель сенесцентных клеток действительно стало существенно больше (p < 0,0001), чем в контроле. Тем не менее этого не произошло у животных, дефицитных по интерлейкину-17 или рецептору к нему, — у них количество сенесцентных клеток не отличалось существенно от контроля.
Но если сенесцентные клетки способствуют образованию фиброзной капсулы, то их удаление должно смягчить иммунный ответ на имплантат. Через 6 недель после имплантации исследователи ввели в организм мышей навитоклакс — препарат, известный как сенолитик, то есть «убийца» сенесцентных клеток. Под его действием в клетках, окружающих имплантат, снизилась экспрессия как маркеров сенесцентных клеток, так и провоспалительных белков и белков внеклеточного матрикса. А совместное действие навитоклакса и антител к интерлейкину-17 оказалось ещё эффективнее, чем каждый из двух препаратов в отдельности.
Таким образом, исследователи нашли ещё одно потенциальное применение для сенолитиков. Ранее их использовали для борьбы с фиброзом лёгких, диабетом, остеоартритом и другими возрастными болезнями, а теперь, возможно, их научатся применять и для профилактики осложнений после протезирования или имплантации. Впрочем, авторы работы отмечают, что исследования на животных не стоит напрямую переносить на людей, поскольку детали работы иммунной системы у нас могут отличаться.
Часто говорится о том, что риски отторжения имплантата присутствуют всегда, даже при пересадке клеток от генетически совместимого донора. Но недавно учёным удалось его избежать — для этого они применили тактику, которую подсмотрели у раковых клеток.
Источник: nplus1.ru