Дарья Зубкова, ветеринарный врач, терапевт, Клиника неврологии, травматологии и интенсивной терапии, Санкт-Петербург
Ольга Смирнова, к. б. н., ветеринарный врач, эндокринолог, Клиника неврологии, травматологии и интенсивной терапии, Санкт-Петербург
Сокращения: АКТГ — адренокортикотропный гормон; ГКС — глюкокортикостероиды; ЖКТ — желудочно-кишечный тракт; КРГ — кортикотропин-рилизинг-гормон; КТ — компьютерная томография; ОЦК — объём циркулирующей крови; СКФ — скорость клубочковой фильтрации; УГК — уровень глюкозы крови: УЗИ — ультразвуковое исследование.
Введение
Гипоадренокортицизм — относительно редко встречающееся эндокринное заболевание собак и крайне редкое заболевание кошек. Хотя следует отметить, что в нашей практике частота его выявления возрастает с каждым годом — по мере развития диагностических возможностей и распространения знаний о патологии и отчасти благодаря пропаганде заболевания и нюансов его диагностики среди ветеринарных специалистов. По литературным данным, в большинстве случаев причиной гипоадренокортицизма у собак и кошек является идиопатическая атрофия коркового слоя надпочечников, при этом клинические проявления развиваются при поражении более 90% коры за счёт дефицита глюкокортикоидов и минералокортикоидов.
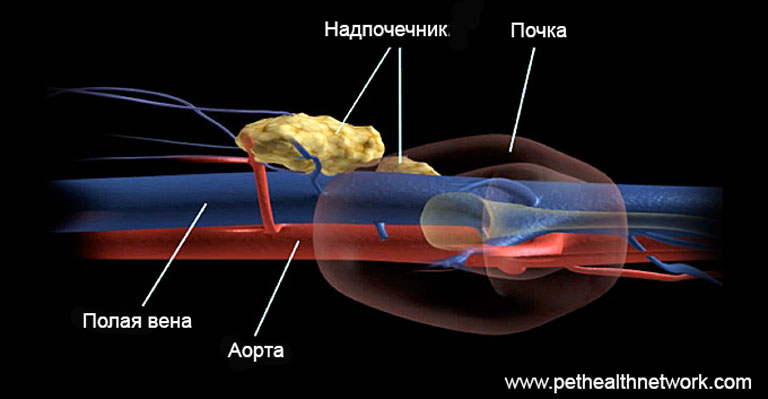
Вспомним анатомию и физиологию
Надпочечники состоят из мозгового вещества, секретирующего катехоламины (но в рамках данной статьи эти гормоны мы не будем рассматривать), и коры, секретирующей глюкокортикоиды, минералокортикоиды и половые стероиды.
Основной представитель минералкортикоидов, синтезируемых в клубочковой зоне коры надпочечников, — альдостерон. Синтез и секреция альдостерона регулируется ренин-ангиотензиновой системой, концентрацией калия в плазме и, в меньшей степени, концентрациями натрия и АКТГ в плазме. Повышение концентраций калия и ангиотензина 2 в плазме заметно усиливает высвобождение альдостерона корой надпочечников. Полное отсутствие АКТГ снижает секрецию альдостерона, однако АКТГ почти не влияет на контроль скорости секреции альдостерона, поэтому, например, и удаление гипофиза не приводит к недостаточности минералокортикоидов [5].
Минералокортикоиды усиливают всасывание натрия и секрецию калия в почках, потовых железах, слюнных железах и эпителиальных клетках кишечника. Но основное место действия альдостерона — дистальные участки нефронов [11]. В соединительном сегменте и собирательных трубочках коркового вещества посредством влияния альдостерона увеличивается число натриевых и калиевых каналов и повышается активность натриево-калиевого насоса в базолатеральной мембране. Калий обменивается на натрий благодаря его работе и далее секретируется из клеток в просвет канальцев. Поэтому при дефиците минералокортикоидов так распространена гиперкалиемия наряду с гипонатриемией. Гиперкалиемии также способствует снижение почечной перфузии, что уменьшает СКФ и подавляет катионный обмен в дистальных извитых канальцах почек.
Хлориды всасываются пассивно через параклеточный путь. Метаболический ацидоз развивается в результате нарушения способности к реабсорбции ионов бикарбоната и хлорида в почечных канальцах, а также из-за ухудшения способности почек с нарушенной перфузией выводить конечные продукты метаболизма и ионы водорода. Как правило, он редко требует специфического лечения, инфузионная терапия и заместительная терапия минералокортикоидами восстанавливают почечную перфузию это, в свою очередь, усилит выведение ионов водорода с мочой.
Таким образом, при недостаточности минералокортикоидов характерны гипонатриемия и гипохлоремия, гиперкалиемия и метаболический ацидоз. Каждый из этих механизмов провоцирует ряд последствий, влияющих на клинические проявления заболевания.
Потеря натрия и хлоридов приводит к потере воды, снижению объёма внеклеточной жидкости и, следовательно, к гиповолемии, гипотензии, снижению сердечного выброса и СКФ, что становится причиной преренальной азотемии, часто выявляемой при гипоадренокортицизме у собак и кошек. Из-за выведения натрия почками и потери градиента концентрации в мозговом веществе почек также развиваются полиурия и полидипсия — характерные проявления этой патологии [5].
Гиперкалиемия сама по себе очень опасна, так как влияет на функцию сердца: снижает возбудимость миокарда, удлиняет рефрактерный период, снижает проводимость. С другой стороны, недостаточная перфузия тканей и гиповолемия приводят к гипоксии, что также способствует нарушению функции миокарда. При значительном повышении калия в плазме возможны даже фибрилляция желудочков и остановка сердца.
Основной глюкокортикоидный гормон, синтезируемый в пучковой зоне коры надпочечников, — кортизол. Синтез и секреция кортизола регулируется гипоталамо-гипофизарно-надпочечниковой системой. Нейроны гипоталамуса, секретирующие КРГ, имеют аксоны, которые заканчиваются в передней доле гипофиза. КРГ стимулирует секрецию АКТГ гипофизом. АКТГ, в свою очередь, высвобождается в кровь и соединяется с рецепторами в коре надпочечников и стимулирует синтез и секрецию кортизола.
Глюкокортикоиды выполняют множество функций и играют важную роль в поддержании гомеостаза: стимулируют глюконеогенез в печени, усиливают катаболизм белков и жиров, служат пусковым сигналом для многих метаболических реакций (липолиза, производства тепла), играют роль в поддержании способности сосудов реагировать на катехоламины, участвуют в поддержании артериального давления, противодействуют эффектам стресса, поддерживают нормальную функцию слизистой оболочки ЖКТ, влияют на переваривание и всасывание питательных веществ в кишечнике и т. д.
При недостаточности глюкокортикоидов возникает гипогликемия, гипотензия, анорексия, рвота, диарея, потеря веса, снижение мобилизации белков и жиров из тканей. Это ведёт к мышечной слабости, повышенной чувствительности к стрессу и неспособности поддержания сосудистого тонуса и целостности эндотелия. У людей и животных с болезнью Аддисона и удалёнными надпочечниками описаны атрофия и лёгкие воспалительные изменения слизистой оболочки желудка. Полагают, что при гипоадренокортицизме у собак, кошек и людей патогенез изменений ЖКТ многофакторный и включает снижение моторики ЖКТ, повышение проницаемости сосудов, слабую перфузию тканей, гиповолемию, сосудистый стаз, которые приводят к кровоизлияниям в слизистую оболочку, язвам, атрофии или воспалениям слизистой [10].
Гипонатриемия возможна не только при недостаточности минералокортикоидов, она бывает и при недостаточности глюкокортикоидов на фоне стимуляции секреции вазопрессина. Её провоцирует гиповолемия и отсутствие подавляющего действия кортизола на паравентрикулярное ядро. Гипонатриемия и потеря градиента концентрации в мозговом веществе почек при изолированной недостаточности глюкокортикоидов могут привести к полиурии [5].
Поскольку дефицит половых стероидов не вызывает значимых клинических проявлений у наших пациентов, мы не будет рассматривать нарушение синтеза этих гормонов в сетчатой зоне коры надпочечников.
Типы гипоадренокортицизма
Первичный гипоадренокортицизм развивается в результате двустороннего разрушения коры надпочечников и составляет большинство (более 95%) случаев гипоадренокортицизма собак, при этом возможны типичные и атипичные проявления заболевания. Чаще всего причиной является аутоиммунное разрушение коры надпочечников или их идиопатическая атрофия.
Вторичный гипоадренокортицизм, обусловленный недостаточной секрецией АКТГ гипофизом, — редкая причина недостаточности коры надпочечников. Отсутствие АКТГ приводит к атрофии коры надпочечников и нарушению секреции глюкокортикоидов, но не минералокортикоидов.
Причинами для него могут быть:
— влияние ятрогенных факторов;
— нарушения на уровне гипоталамо-гипофизарной оси;
— в редких случаях заболевание развивается вследствие травмы, сопутствующих заболеваний.
Как проявляется гипоадренокортицизм
Клинические симптомы гипоадренокортицизма у собак и других животных неспецифические, и ни один из них не является патогномоничным. Часто отмечаются рвота, диарея, анорексия, вялость, слабость, потеря веса, дрожь, озноб, полиурия, полидипсия, боль в животе. Эти клинические симптомы могут быть вызваны недостаточностью глюкокортикоидов, а при наличии сопутствующего дефицита минералокортикоидов характерны такие симптомы, как полиурия, полидипсия, гиповолимический шок, коллапс, обезвоживание, и в принципе увеличивается тяжесть проявления клинических признаков. Реже встречаются судороги вследствие развития гипогликемии, мышечные спазмы и кровотечения из желудочного-кишечного тракта [12, 5].
Во время клинического осмотра отмечаются такие признаки, как низкая упитанность, вялость, слабость, эксикоз, боли в животе, систолическая гипотензия, в случае гиповолемического шока — брадикардия, слабый пульс, гипотермия, увеличение СНК и другие его признаки. Реже бывают мелена или гематурия, которые могут быть дополнительной причиной бледности слизистых оболочек, слабости и коллапса из-за анемии. У некоторых собак с гипоадренокортицизмом, особенно с недостаточностью только глюкокортикоидов, при клиническом осмотре не обнаруживается отклонений [10, 13, 5].
Классические отклонения лабораторных показателей у собак
Конечно же, самыми ожидаемыми отклонениями при типичной форме гипоадренокортицизма у собак являются электролитные нарушения: гиперкалиемия наряду с гипонатриемией и значительным снижением соотношения натрия и калия.
Азотемия часто развивается из-за гиповолемии, гипотензии и снижения почечной перфузии. Повышению уровня мочевины может способствовать также кровотечение в просвет ЖКТ.
Повышение концентрации общего кальция встречается у 30–40% собак с гипоадренокортицизмом [10, 1], у 18% собак повышается концентрация ионизированного кальция [2]. Предположительный механизм развития гиперкальциемии включает уменьшение ОЦК, снижение СКФ, усиление всасывания кальция в кишечнике и замедление его выведения с мочой.
Низкий удельный вес мочи у собак наблюдается по причине хронической потери натрия с мочой, вследствие этого — снижения содержания натрия в мозговом веществе почек, утраты нормального градиента концентрации и нарушения способности к реабсорбции воды собирательными трубочками почек.
Гипогликемия встречается примерно у 30% собак с гипоадренокортицизмом и может быть достаточно тяжёлой, чтобы вызвать судороги [5]. Недостаточность глюкокортикоидов снижает глюконеогенез в печени и повышает чувствительность периферических тканей к инсулину. Концентрация инсулина у собак с гипоадренокортицизмом не отличается от таковой у собак с заболеваниями, не относящимися к надпочечникам [8].
Гипохолестеринемия может быть результатом снижения всасывания жира либо сопутствующей гепатопатии.
Причина гипоальбуминемии у собак неизвестна, однако предположены такие варианты, как анорексия, кровопотеря через ЖКТ, снижение синтеза из-за гепатопатии или энтеропатии с потерей белка.
У 30% собак отмечается лёгкое повышение активности ферментов печени, у некоторых собак описаны отклонения концентрации желчных кислот, результатов теста на толерантность к аммиаку. Поражение печени, вероятнее всего, вторично развивается вследствие гипотензии и снижения перфузии тканей. Специальное лечение, как правило, не требуется.
Лабораторные отклонения при гипоадренокортицизме у собак могут быть сходны с таковыми при других заболеваниях, таких как печёночная недостаточность (гипогликемия, гипоальбуминемия, гипохолестеринемия, повышение АЛТ, ЩФ), почечная недостаточность (анемия, азотемия, гиперкальциемия, низкий удельный вес мочи), инсулинома (гипогликемия, повышение АЛТ, ЩФ), энтеропатия с потерей белка (гипоальбуминемия, гипохолестеринемия, нерегенераторная анемия).
Гипоадренокортицизм следует дифференцировать от заболеваний ЖКТ, заболеваний с проявлениями гиперкалиемии, которая может быть при панкреатите, быстром высвобождении калия из клеток по причине ацидоза, разрушения тканей после операции, травм, воспалений, при диабетическом кетоацидозе, тромбозе аорты, рабдомиолизе, тепловом ударе, длительных физических нагрузках, когда снижается выведение калия с мочой [5].
Как поставить диагноз
При гипоадренокортицизме у собак и других животных возможны множественные не патогномоничные, но характерные диагностические находки.
Рентгенологическое исследование часто выявляет уменьшение размеров сердца, уменьшение краниальной долевой лёгочной артерии, сужение каудальной полой вены и уменьшение печени. Эти изменения обусловлены гиповолемией, вероятность их проявления выше у собак с электролитными отклонениями. У небольшого количества собак с классическим гипоадренкортицизмом, а также с недостаточностью только глюкокортикоидов, описан мегаэзофагус, обратимый при лечении. Причиной может быть недостаточность кортизола и связанная с ней мышечная слабость.
При проведении УЗИ у большинства собак обнаруживается уменьшение размеров надпочечников, иногда их не удаётся визуализировать совсем. Обнаружение надпочечников нормального размера не исключает диагноза «гипоадренокортицизм», ровно как малый размер надпочечников ни в коем случае не является подтверждением диагноза.
Вследствие гиперкалиемии обнаруживается характерная последовательность изменений на ЭКГ. Гиперкалиемия вызывает нарушение сердечных сокращений, что может привести к брадикардии, фибрилляции и остановке сердца.
Измерение базальной концентрации кортизола — метод, который можно использовать только для исключения диагноза «гипоадренокортицизм» у собак. Обнаружение низкой концентрации кортизола является недостаточным для подтверждения диагноза, у некоторых собак с нормально функционирующими надпочечниками базальная концентрация кортизола низкая, однако реакция на введение АКТГ в норме. Поэтому подозрение на гипоадренокортицизм всегда следует подтверждать измерением уровня кортизола при проведении стимулирующей пробы с АКТГ [5]. Концентрация альдостерона измеряется реже, так как предполагается, что она низка у собак с гипокортизолемией и специфическими электролитными нарушениями.
Стимулирующая проба с АКТГ проводится для оценки резерва надпочечников и является «золотым стандартом» для подтверждения диагноза «гипоадренокортицизм» у собак. Пробу следует проводить с целью подтверждения диагноза до начала долговременного лечения. Рекомендуемая доза синтетического АКТГ — 5 мкг/кг (что значительно дешевле) или 250 мкг на собаку [7, 3, 9]. При внутривенном и внутримышечном введении различий в пике концентрации кортизола не обнаружено [4]. Кровь для определения концентрации кортизола в сыворотке следует брать до и через 60–90 минут после введения АКТГ [7]. Секреция кортизола у собак не зависит от суточного ритма, поэтому пробу с АКТГ можно проводить в любое время суток. Критерием подтверждения диагноза «гипоадренокортицизм» считается концентрация кортизола ниже нормального диапазона базальных концентраций до и после введения АКТГ. Стимулирующая проба с АКТГ у собак не позволяет дифференцировать первичное заболевание коры надпочечников от вторичного, обусловленного недостаточностью синтеза АКТГ гипофизом. Важно понимать, получал ли пациент ГКС, так как это может повлиять на полученные результаты теста с АКТГ и сделать их сомнительными.
Концентрация эндогенного АКТГ в плазме рекомендуется к измерению у собак с подтверждённым гипоадренокорицизмом и нормальной концентрацией электролитов для дифференциации первичного и вторичного гипоадренокортицизма. На сегодняшний день у нас есть возможность проведения этого исследования, хотя ещё несколько лет назад в ветеринарии этот тест был недоступен. Концентрация АКТГ выше нормы подтверждает диагноз «первичный гипоадренокортицизм», концентрация АКТГ в пределах нормы или ниже нормы соответствует диагнозу «вторичный гипоадренокортицизм». Собакам с вторичным гипоадренокортицизмом вряд ли когда-либо потребуется заместительная терапия минералокортикоидами, в то время как при первичном гипоадренокортициме существует риск прогрессирования болезни до полной недостаточности коры надпочечников [5].
Нормальная концентрация электролитов при гипоадренокортицизме, атипичное проявление гипоадренокортицизма
В литературе гипоадренокортицизм с изолированной недостаточностью глюкокортикоидов называется «атипичный гипоадренокортицизм» и описано, что нормальная концентрация электролитов на момент постановки диагноза встречается по крайней мере у 30% собак [5].
К вероятным причинам нормальной концентрации электролитов при гипоадренокортицизме относятся:
— Вторичный гипоадренокортицизм.
Секреция минералокортикоидов сохраняется, так как АКТГ играет лишь незначительную роль в контроле секреции альдостерона, поэтому электролитные нарушения не характерны, хотя гипонатриемия возможна при изолированной недостаточности глюкокортикоидов.
— Ранняя стадия заболевания, когда клубочковая зона ещё не разрушена полностью.
Предполагается, что нормальная концентрация альдостерона у таких собак обусловлена сохранностью клубочковой зоны. Но в большинстве описанных случаев измерения концентрации альдостерона не проводили. В недавнем исследовании секреции альдостерона у собак с гипоадренокортицизмом у четырёх животных без гипонатриемиии и гиперкалиемии была обнаружена низкая концентрация альдостерона. Это даёт основание полагать, что поддержание нормальной концентрации альдостерона не может быть единственной причиной сохранения в норме электролитов у собак с атипичным гипоадренокортицизмом [6].
У некоторых собак с первичной недостаточностью надпочечников концентрация электролитов изначально соответствует норме, а через несколько недель или месяцев появляются отклонения, указывающие на недостаточность минералокортикоидов. У большинства собак это происходит в первый год после постановки диагноза.
— Возможно, у некоторых из пациентов усиленное поступление пищевого натрия компенсирует повышенные потери натрия с мочой.
Существует также гипоадренокортицизм с недостаточной секрецией минералокортикоидов при нормальной секреции глюкокортикоидов, но он встречается достаточно редко [5].
Описание клинического случая
Анамнез жизни. Собака, самка, американский стаффордширский терьер, возраст на момент постановки диагноза — 4 года, кастрирована, вакцинирована, выездов за пределы региона не было, от наружных паразитов и гельминтов обрабатывается регулярно, содержание домашнее, рацион — промышленный сбалансированный корм.
Жалобы владельцев. В день приёма, придя с работы, владельцы обнаружили, что собака вялая и с трудом ходит. Владельцы обратились в стороннюю клинику, в которой взяли кровь для проведения исследований. Было отмечено незначительное повышение концентрации маркеров уремии: мочевина — 10,5 ммоль/л (референтный диапазон 4–8,6 ммоль/л), креатинин 153 мкмоль/л (референтный диапазон — 44–114 мкмоль/л); незначительное повышение трансаминаз: АЛТ — 76 МЕ/л (референтный диапазон 6–70 МЕ/л), АСТ 102 МЕ/л (референтный диапазон 10–43 МЕ/л); выявлен низкий уровень глюкозы при исследовании экспресс-методом с применением медицинского глюкометра — 2 ммоль/л. Остальные показатели в результатах биохимического и гематологического исследования крови (в том числе — концентрация электролитов) были в пределах нормы. На момент первичного обращения температура тела составила 39,7оС, также были отмечены тремор, одышка, сгорбленность. На приёме в сторонней клинике был предложен корм, который собака съела с аппетитом.
Результаты физикального осмотра при обращении в нашу клинику выявили наличие слабости, тремора, одышки. Вес составил 27 кг при средней упитанности. Температура тела составила 37,9оС, видимые слизистые оболочки были бледные. При аускультации выявлена брадикардия, артериальное давление было в норме. УГК составил 1,4 ммоль/л при экспресс-гликометрии медицинским глюкометром, что было подтверждено измерением УГК в плазме в лаборатории. После введения раствора глюкозы внутривенно (в дозе 14 граммов или 35 мл в виде 40%-го раствора, разведённого раствором хлорида натрия 0,9% до концентрации 20%) собака стала более активной.
УЗИ брюшной полости выявило признаки умеренно выраженных хронических изменений структуры паренхимы почек, умеренно выраженного хронического панкреатита. Размеры и форма надпочечников были без ультрасонографических изменений. Однозначных данных за клинически значимые патологии отмечено не было. Рентгенограмма грудной и брюшной полости — без видимых патологий.
УЗИ сердца выявило эксцентрическую гипертрофию левого желудочка, регургитацию на митральном клапане I–II степени, систолическую дисфункцию левого желудочка, правого желудочка. Кардиологом была назначена симптоматическая терапия: пимобендан, рамиприл, верошпирон.
С целью проведения диагностики, контроля состояния и коррекции гипогликемии собака была помещена в ОРИТ.
На момент поступления основным предположительным диагнозом была инсулинома или не бета-клеточная опухоль, провоцирующая гипогликемию, поэтому была проведена специфическая дополнительная диагностика:
— измерение уровня инсулина в момент гипогликемии (результат ожидался через несколько дней и был готов уже после выписки собаки из ОРИТ);
— КТ с целью визуализации новообразований (признаков неоплазии, в том числе поджелудочной железы, не выявлено; субъективно врачом визуальной диагностики отмечено изменение структуры надпочечников при сохранении их нормальных размеров: правый 23,37×4,13 мм в области каудального полюса, при этом краниальная часть — шириной до 8,30 мм; левый 26,26×6,39 мм).
На момент поступления собаки в ОРИТ гипоадренокортицизм у собаки не рассматривался в качестве вероятного дифференциального диагноза, поскольку у животного не было ожидаемых для типичной формы клинических и лабораторных проявлений этого заболевания. По этой причине диагностика гипоадренокортицизма не проводилась.
Во время нахождения собаки в ОРИТ были отмечены полиурия, болезненность брюшной стенки при пальпации и скованность походки. В течение суток отмечено несколько эпизодов гипогликемии со снижением УГК до 1,3 ммоль/л (экспресс-гликометрия медицинским глюкометром) и развитием апатии, проводилась инфузия глюкозы с постоянной скоростью, что вызывало стабилизацию самочувствия. Дополнительно была назначена симптоматическая терапия глюкокортикостероидами с целью контроля гипогликемии (после взятия крови для определения уровня инсулина) и анальгетиками.
На следующий день после поступления УГК, а также активность, аппетит и жажда были в пределах нормы. Собака была выписана с назначением глюкокортикостероидов (преднизолона перорально в уточной дозировке 1 мг на кг веса) с целью профилактики рецидивов гипогликемии.
Через несколько дней был готов результат измерения уровня инсулина в сыворотке крови. Он составил 12,1 мкЕд/мл, что соответствует средней степени вероятности наличия инсулиномы у пациента (см. таблицу 1). По этой причине предположительный диагноз «инсулинома» нельзя было исключить, несмотря на отсутствие образований, выявленных при проведении КТ и УЗИ.
Таблица 1. Интерпретация базального уровня концентрации инсулина у собак с гипогликемией [14]
| Концентрация инсулина в сыворотке крови |
Вероятность опухоли бета-клеток |
| выше 20 мкЕД/мл | высокая |
| 10–20 мкЕД/мл | средняя |
| 5–10 мкЕд/мл | низкая |
| ниже 5 мкЕД/мл | инсулинома исключена |
Следующим шагом с целью дальнейшей диагностики инсулиномы рассматривалась диагностическая лапароскопия. Но перед её проведением необходимо было с использованием неинвазивных методов диагностики исключить все другие дифференциальные диагнозы. Поэтому, перед проведением инвазивного вмешательства у собаки с повышенным анестезиологическим риском по причине заболевания сердца, лечащий врач принял решение исключить гипоадренокортицизм (подозревая его атипичную форму течения, учитывая отсутствие электролитных нарушений и других признаков недостаточности минералокортикоидов).
В первую очередь была произведена отмена глюкокортикостероидов (к тому моменту собака находилась в стабильном состоянии, признаков гипогликемии в течение недели их применения отмечено не было, гликемический контроль в домашних условиях медицинским глюкометром не выявил биохимической гипогликемии).
С целью исключения атипично проявляющегося гипоадренокортицизма у собаки сначала было рекомендовано определение уровня базального кортизола (он был измерен в образце сыворотке крови, взятой через 2 недели после отмены преднизолона), который оказался значительно ниже нормы: <10 нмоль/л при референтном диапазоне 25–250 нмоль/л.
Диагноз «гипоадренокортицизм» у собаки подтвердился после получения результатов пробы с АКТГ: уровень базального кортизола составил <5,5 нмоль/л при референтном диапазоне 25–250 нмоль/л, уровень кортизола после стимуляции АКТГ не изменился.
Проба проводилась через 3,5 недели после отмены преднизолона, к этому времени состояние собаки уже начало ухудшаться. На момент постановки диагноза общее состояние собаки было лучше, чем до первичного обращения, но периодически отмечалась мышечная слабость, бледность слизистых оболочек, УГК не опускался ниже 3,2 ммоль/л на голодный желудок (по результатам гликометрии в домашних условиях). В лабораторных тестах появились новые примечательные отклонения: в клиническом анализе крови отмечались признаки стойкой лёгкой-умеренной степени нормоцитарной нормохромной нерегенераторной анемии, но уровень электролитов до сих пор находился в норме, а также не были изменены другие показатели биохимического профиля сыворотки крови (за исключением незначительного повышения уровня АЛТ и мочевины). После постановки диагноза была назначена терапия глюкокортикостероидами. Был использован преднизолон в максимальной дозе, рекомендованной для проведения заместительной терапии: 0,22 мг/кг/сутки за два приёма. Этой дозировки было достаточно для поддержания хорошего общего самочувствия собаки. Некоторым собакам требуется и меньшая доза преднизолона для проведения заместительной терапии (описан диапазон дозы при проведении заместительной терапии от 0,05 до 0,22 мг на кг веса в сутки [5]).
К сожалению, по субъективным причинам у данного животного не было проведено определение уровня эндогенного АКТГ, поэтому происхождение (центральный или периферический) гипоадренокортицизма у этой собаки не было выяснено.
Поскольку у некоторых собак с первичной недостаточностью коры надпочечников концентрация электролитов изначально соответствует норме, а через несколько недель или месяцев появляются отклонения, указывающие на недостаточность минералокортикоидов, в течение нескольких месяцев у данного животного производился регулярный контроль электролитов, но изменения их концентрации отмечены не были.
К сожалению, через несколько месяцев лечения связь с владельцами собаки была утеряна. От коллег нам известно, что владельцы собаки обратились в стороннюю клинику с признаками ятрогенного гиперадренокортицизма (в том числе с кальцинозом кожи и гипотрихозом), развившимися на фоне проведения заместительной терапии преднизолоном в суточной дозировке 0,5 мг на кг веса. Наши коллеги провели коррекцию дозировки преднизолона в меньшую сторону, чего было достаточно для устранения ятрогенной патологии.
Заключение
Эта собака с гипоадренокортицизмом, как и многие другие сложные пациенты нашей клиники, требовал от нас коллегиальной и слаженной диагностической работы (в диагностике были задействованы терапевт, эндокринолог, врачи ОРИТ, врач визуальной диагностики — КТ). На его примере мы лишний раз убедились в том, что редкие болезни встречаются в повседневной жизни и никогда не стоит вычёркивать заболевание из списка дифференциальных только лишь потому, что оно выглядит не так, как мы его привыкли видеть в повседневной практике или в классическом литературном описании. Большой нашей ошибкой стало намерение вычеркнуть гипоадренокортицизм из списка причин для развития гипогликемии у собаки только лишь по тому поводу, что не хватало «обычных» для врачебного мышления его клинических и лабораторных проявлений. Этот случай стал первым в нашей практике подтверждённым атипичным гипоадренокортицизмом. С момента постановки диагноза прошёл почти год, и более пациенты с таким заболеванием (именно с атипичной формой течения) нам не встречались, хотя болезнь Аддисона с её типичным проявлением мы встречаем в среднем ежемесячно. От коллег из другой клиники мы знаем, что дефицит минералокортикоидов у собаки так и не развился и для контроля заболевания достаточно только лишь преднизолона, хотя надо учитывать, что преднизолон обладает некой минералокортикоидной активностью (правда, она ничтожно низка по сравнению, например, с флудрокортизоном, используемым для лечения пациентов с типичной формой болезни Аддисона).
Литература
- Adamantos S., Boag A. Total and ionized calcium concentrations in dogs with hypoadrenocortycism. // Vet Rec. — 2008, 163. — P. 25–26.
- Alder J.A. et al. Abnormalities of serum electrolyte concentrations in dogs with hypoadrenocortycism. //J Vet Intern Med — 2007, 21. — P. 1168–1173.
- Behrend E.N. et al. Intramuscular administration of a low dose of ACTH for ACTH stimulation testing in dogs. // J Am Vet Med Assoc. — 2006, 229 (4). — P. 528—530.
- Cohen T.A., Feldman E.C. Comparison of IV and IM formulations of synthetic ACTH for ACTH stimulation test in healthy dogs. //J Vet Intern Med — 2012, 26. P. 412–414.
- Feldman E.C., Nelson R.W., Reusch C. and Scott-Moncrieff J.C. Canine and Feline Endocrinology, 4th Edition. -Imprint: Saunders, 2015. — 800 р.
- Frank C.B. et al.: Correlation of inflammation with adrenocortycal atrophy in canine adrenalitis. // J Cop Path. — 2013, 149. — P. 268–279.
- Frank L.A. et al. Cortisol concentrations following stimulation of healthy and adrenopathic dogs with two doses of tetracosactrin. //J Sall Aim Pract. — 2000, 41 (7). — P 308–311.
- Gow A.G. et al. Insulin concentrations in dogs with hypoadrenocortycism. //Res Vet Sci 2012. — P. 93–97.
- Lathan P. et al. Use of a low dose ACTH stimulation test for diagnosis of hypoadrenocortycism in dogs. // J Vet Intern Med. — 2008, 22. — P. 1070–1073.
- Peterson M.E. et al. Pretreatment clinical and laboratory fidings in dogs with hypoadrenocorticism: 225 cases (1997-1993). // J Am Vet Med Assoc. — 1996, 208 (1). — P 85–91.
- Rose B.D., Post T.W.: Clinical Physiology of Acid-Base and Electrolyte Disorders, ed 5. — New York: McGraw-Hill, 2001. — 672 p.
- Saito M. et al. Muscle cramps in two standard poodles with hypoadrenocortycism. // J Am Anim Hosp Assoc. — 2002, 38. — P. 437—443.
- Thompson A.L. et al. Comparison of class hypoadrenocortycism with glucocorticoid deficient hypoadrenocortycism in dogs: 46 cases (1998-2005). //J Am Vet Med Assoc. — 2007, 230 (8). — P. 1190–1194
- Нельсон Р., Фельдман Э. Эндокринология и репродукция собак и кошек. — М: Софион, 2008. — 1256 с.
СВМ № 5/2019