Аннотация
Практическая значимость. Болезни, передаваемые трансмиссивным путём, всё чаще выявляются у кошек, принесённых в ветеринарные клиники на осмотр с лихорадкой и связанными с ней вторичными эффектами, такими как признаки депрессии и потеря аппетита. И это происходит практически по всему миру.
Цель: обобщить клинически значимую информацию о лихорадке у кошек, связанной с возбудителями болезней, которые общепризнанно или предположительно переносятся блохами, с акцентом на клиническую картину и оптимальные стратегии диагностики, лечения и профилактики. Лихорадка у кошек, связанная с возбудителями, передаваемыми клещами или москитами (песчаными мухами), обсуждается во второй части этой серии статей.
Ключевые слова: Bartonella, Rickettsia, Yersinia, Ctenocephalides, бартонеллы, риккетсии, йерсинии, гемоплазмы, блоха.
Вступление
Двумя основными вариантами повышения температуры тела > 39,2°C у кошек являются гипертермия и лихорадка (пирексия) [1]. Гипертермия может быть результатом повышенной мышечной активности, повышенной температуры окружающей среды, стресса или ускоренного метаболизма (например, при гипертиреозе) [1]. При лихорадке установочная точка терморегуляции в гипоталамусе сдвигается от исходного уровня вверх, вторично по отношению к высвобождению пирогенов, что приводит к повышению температуры тела из-за физиологических механизмов, стимулирующих выработку эндогенного тепла или сохранение тепла. Лихорадка развивается, когда лейкоциты, а именно мононуклеарные клетки и нейтрофилы, активируются для высвобождения пирогенов, таких как интерлейкин [1].
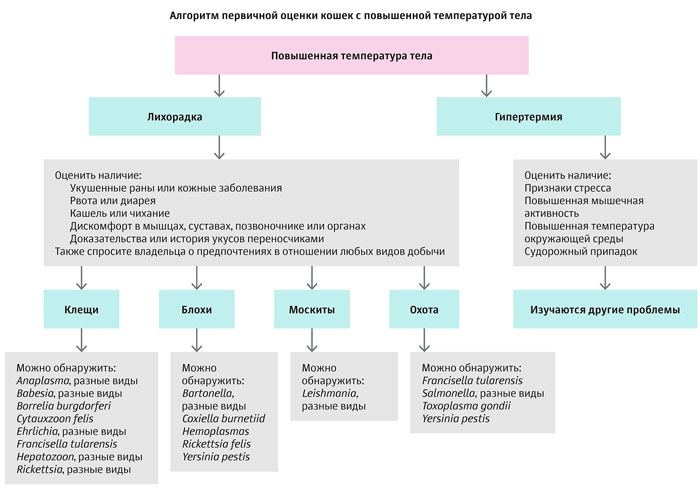
Выработка лейкоцитов обычно стимулируется контактом с бактериальными, вирусными, грибковыми и паразитарными агентами, появлением новообразования, некрозом тканей (например, при обширной травме, панкреатите), а также при первичных иммуноопосредованных заболеваниях, таких как иммуноопосредованная гемолитическая анемия, иммуноопосредованная тромбоцитопения и системная красная волчанка (см. алгоритм первоначальной оценки кошек с повышенной температурой тела). Множество растворимых факторов, таких как интерлейкин 1 и фактор некроза опухоли, которые выделяются активированными клетками, попадают в центральную нервную систему и сдвигают установочную точку терморегуляции [2]. Установка терморегуляции также может быть изменена внутричерепным заболеванием, включая травмы и новообразования, а также лекарствами, такими как тетрациклин. Дрожь и сужение сосудов являются двумя наиболее важными физиологическими реакциями на сдвиг установочной точки терморегуляции и приводят к выработке и сохранению тепла соответственно.
Дифференциальный список лихорадки у кошек обширен. В недавнем обзоре 106 случаев поступления кошек с температурой тела > 39,2°C самую распространённую категорию составили инфекционные причины лихорадки [3]. Существует ряд инфекционных агентов, передаваемых несколькими членистоногими, которые являются известными причинами лихорадки у кошек (или рассматриваются как допустимые при дифференциальной диагностике). До сих пор неясно, как часто лихорадка связана с некоторыми из этих агентов, такими как риккетсии и C. burnetii.
Последующее обсуждение предоставляет ветеринарным врачам обновлённую информацию о возбудителях, которые могут быть связаны с лихорадкой у кошек и передаются блохами. Особое внимание уделяется клиническим и лабораторным данным, оптимальным диагностическим тестам, лечению и стратегиям профилактики (таблица 1). Как и в обновлённой информации о возбудителях болезней, переносимых клещами и москитами [4], делается упор на круглогодичную борьбу с блохами и клещами в эндемичных районах, поскольку лучше предотвратить эти инфекции, чем лечить больных кошек.
Таблица 1. Сопутствующие находки и рекомендации по диагностическому плану для выявления патогенов, переносимых блохами и связанных с лихорадкой у кошек
| Диагностика | ||||
| Находки | Методы прямой идентификации |
Серологические методы | Примечания | |
| Возбудители, передаваемые блохами | ||||
| Bartonella виды | Эндокардит
Гиперглобулинемия Лимфаденопатия Миокардит Остеомиелит Увеит Другое |
Окрашивание серебром препарата экссудата или тканей
Посев крови или тканей ПЦР-анализ крови или тканей |
В некоторых лабораториях доступно несколько методов | Наибольшую диагностическую чувствительность даёт сочетание результатов серологических реакций, посева и ПЦР |
| Coxiella burnetii | Аборт
Мертворождение |
ПЦР-анализ крови | Доступны в некоторых лабораториях | Трудно культивировать
Роль блох в передаче этого возбудителя всё ещё изучается |
| Hemoplasmas | Гемолитическая анемия | Цитология мазка крови
ПЦР-анализ крови |
Нет в продаже | Микроорганизмы на поверхности эритроцитов
Цитология во многих случаях даёт ложноотрицательный результат и не позволяет определить вид возбудителя Предпочтительный метод диагностики — ПЦР |
| Rickettsia felis
Rickettsia typhi |
На данный момент неизвестно |
ПЦР-анализ крови | Нет в продаже | |
| Yersinia pestis | Лимфаденопатия
Кашель |
Цитология
Иммунофлуоресцентный анализ Посев ПЦР-анализ |
Доступны в некоторых лабораториях | Для методов прямой идентификации используют образцы из лимфатических узлов, абсцессов и смывов из дыхательных путей
Рост титров можно использовать для подтверждения недавней инфекции, если прямые методы дают отрицательный результат |
* Результаты прямых тестов (цитология ± методы окрашивания, посев, ПЦР-анализ) подтверждают наличие инфекции, когда они положительны. Однако для некоторых возбудителей, таких как виды Bartonella и гемоплазмы, у многих здоровых кошек существует фаза носительства, поэтому положительные результаты анализов не подтверждают заболевание, вызванное возбудителем. Точно так же большинство положительных результатов теста на антитела просто указывает на прошлую или текущую инфекцию, но не подтверждает текущую инфекцию или заболевание.
Болезнетворные микроорганизмы, передаваемые блохами
Бартонеллы (несколько видов)
Ряд видов Bartonella, в том числе Bartonella henselae, Bartonella clridgeiae, Bartonella koehlerae и Bartonella bovis, были культивированы или их ДНК была амплифицирована от принадлежащих клиенту кошек с лихорадкой [5–7]. Блохи, в частности Ctenocephalides felis, — известные переносчики B. henselae, B. clarridgeiae и B. koehlerae [8]. Bartonella quintana связана с лихорадкой у людей, была обнаружена у кошек и передаётся людям через вшей. Однако было показано, что C. felis также заражается и выделяет B. quintana [9]. Доказательства воздействия видов Bartonella были обнаружены у кошек во многих странах, особенно в регионах с высокой влажностью и блохами [10–22].
Лихорадка после экспериментальной инокуляции B. henselae была задокументирована в ряде исследований, включая одно, в котором у 3 из 6 кошек развилась инфекция B. henselae с сопутствующей лихорадкой, которая длилась не менее 2 дней после контакта с инфицированным C. felis [23]. У этих 3 кошек лихорадка исчезла после введения энрофлоксацина. Несколько других исследований связывают экспозицию видов Bartonella или инфекцию с лихорадкой у кошек, подвергшихся естественному воздействию [5–7]. Однако большинство кошек, инфицированных разными видами Bartonella, остаются клинически здоровыми.
Возникновение лихорадки при заражении видами Bartonella, вероятно, зависит от сложного взаимодействия особенностей микроорганизма и хозяина. Лимфаденопатия, эндокардит, миокардит, гиперглобулинемия, остеомиелит и увеит являются другими хорошо задокументированными проявлениями бартонеллёза у кошек [24]. Связь с гиперглобулинемией и лихорадкой заметна, поскольку инфекционный перитонит кошек также часто встречается у кошек с лихорадкой и гиперглобулинемией [3].
Поскольку B. henselae, B. clarridgeiae и B. koehlerae передаются блохами, то в районах, эндемичных по блохам, уровень бактериемии и положительных антител может быть очень высоким. Например, сывороточные антитела были обнаружены у 93 % кошек, содержащихся в приюте для животных в Северной Каролине, США [25]. Большинство этих кошек считались здоровыми, что подчёркивает, что лихорадка от бартонеллёза не может быть подтверждена только результатами тестов. В одном исследовании пар кошек с лихорадкой или без неё сывороточные антитела к бартонеллам, обнаруженные с помощью ELISA или иммуноблоттинга, не коррелировали с наличием лихорадки [6]. Кроме того, результаты анализа сывороточных антител отрицательны у 3–15 % кошек с бактериемией, особенно в её острой фазе [23]. Таким образом, если кошка с лихорадкой должна быть обследована на инфекцию видами бартонелл, только комбинация посева крови и/или анализа крови с помощью ПЦР и серологического тестирования позволит выявить наибольшее количество кошек, которые инфицированы в настоящее время или были инфицированы ранее (таблица 1; www.dlab.colostate.edu; www.galaxydx.com) [26]. Лаборатории, проводящие исключительно серологические, бактериологические или ПЦР-анализы, возможно, неправильно диагностируют некоторые случаи лихорадки, связанной с бартонеллёзом. У кошек, которые являются серонегативными и отрицательными по видам бартонелл в крови при культивировании или ПЦР, этот микроорганизм вряд ли является причиной лихорадки.
Если у кошки есть подозрение на лихорадку или другие клинические признаки бартонеллёза, обычно эффективно введение доксициклина или фторхинолона [5; 7; 23]. Отчёт Американской ассоциации практикующих врачей медицины кошек рекомендует в качестве пробной терапии доксициклин в дозе 10 мг/кг перорально каждые 24 часа в течение 7 дней [26]. Если достигнут положительный ответ, лечение следует продолжать в течение 2 недель после исчезновения клинических признаков или в течение минимум 28 дней [26]. Если ответ, достигнутый к 7-му дню, плохой или доксициклин не переносится пациентом, а бартонеллёз до сих пор не исключён в процессе дифференциальной диагностики, подходящим средством второго выбора являются фторхинолоны. В экспериментальных или полевых исследованиях введение энрофлоксацина или орбифлоксацина приводило к быстрому исчезновению лихорадки у кошек с предполагаемым бартонеллёзом [7; 23]. Азитромицин в настоящее время считается противопоказанным для лечения бартонеллёза у кошек из-за быстрого развития лекарственной устойчивости к нему [27]. Новый ветеринарный фторхинолон — прадофлоксацин — с наименьшей вероятностью вызывает резистентные штаммы B. henselae и поэтому может быть предпочтительным хинолоном для лечения этого патогена [27]. Однако в некоторых хронических случаях бартонеллёза кошек из-за наличия коинфекций может потребоваться введение двух препаратов, а хинолоны неэффективны для лечения потенциальных патогенов, таких как виды Anaplasma, Borrelia burgdorferi или виды Ehrlichia [28].
- henselae часто встречается у блох и выживает по крайней мере в течение 9 дней в блошиных экскрементах, и поэтому борьба с блохами необходима, чтобы уменьшить заражение других кошек, собак или людей [12–14; 29–31]. Были проведены экспериментальные исследования, показывающие, что использование имидаклоприд-содержащих соединений может блокировать передачу B. henselae среди кошек C. felis [23; 31]. Ошейник от блох и клещей, содержащий имидаклоприд, хорошо переносился кошками, принадлежащими студентам-ветеринарам [32]. Вопрос о том, эффективны ли другие средства борьбы с блохами, не изучался. Хотя несколько видов Bartonella были от клещей выделены или амплифицированы с помощью ПЦР, роль клещей в передаче бартонелл среди кошек неясна [33]. Однако наличие у кошек нескольких передаваемых клещами заболеваний (описанных в части 2) [4] подтверждает необходимость использования акарицидов при защите кошек от внешних паразитов.
Coxiella burnetii
Coxiella burnetii — это риккетсия, носителями которой могут быть кошки, наряду с многими другими млекопитающими [21; 34; 35]. Является зоонозом, опасным для человека, но люди заражаются обычно воздушно-капельным путём [36; 37]. Клещи долгое время считались исключительными векторами трансмиссии этого возбудителя, однако C. burnetii также была обнаружена у блох на Кипре [38]. Кроме того, важность роли клещей в передаче заболевания подвергалась сомнению [39].
Хотя C. burnetii ассоциируется с лихорадкой у людей, требуются дополнительные исследования, чтобы определить важность этого патогена как причины трансмиссивной лихорадки у кошек.
Гемоплазмы
Гемолитическая анемия (как с лихорадкой, так и без неё) может развиться после заражения патогенными гемоплазмами, особенно Mycoplasma haemofelis, но иногда также Candidatus Mycoplasma haemominutum и Candidatus Mycoplasma turicensis [3; 40–43]. Как и в случае с видами бартонелл, ДНК гемоплазм были амплифицированы из крови кошек, а также из блох, собранных с кошек во многих регионах мира [13–17; 42; 44–46].
Основываясь на многочисленных исследованиях экспериментально заражённых кошек, наиболее патогенным видом гемоплазм обычно признают M. haemofelis [47; 48]. Двойное инфицирование гемоплазмами может потенцировать патогенез заболевания. В одном исследовании, когда кошек с хронической инфекцией Candidatus M. haemominutum дополнительно экспериментально инфицировали M. haemofelis, у них развилась более тяжёлая и длительная анемия, по сравнению с кошками, заражёнными только M. haemofelis [47]. Клинические проявления заболевания зависят от степени анемии, стадии заражения и иммунного статуса инфицированных кошек. В одном неопубликованном исследовании один из авторов (ML) обнаружил связь между M. haemofelis и лихорадкой у кошек без анемии.
Прямая передача возбудителя возможна. Исследования обнаружили некоторые из патогенов в слюне, а также документально подтвердили передачу инфекции после подкожной инокуляции крови, содержащей гемоплазму. Следовательно, этот патоген должен быть в дифференциальном списке для кошек с лихорадкой и драками в истории болезни, особенно если лихорадка не реагирует на бета-лактамные антибиотики [49; 50].
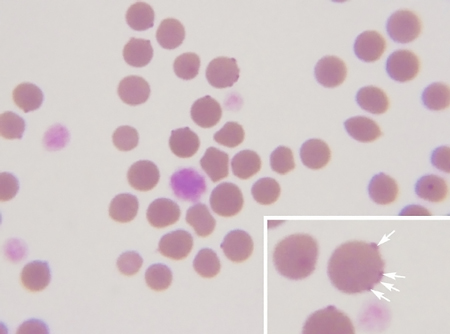
Диагностика гемоплазмоза может быть основана на обнаружении микроорганизма на поверхности эритроцитов при исследовании тонкого мазка крови (рисунок 1) или, что гораздо более надёжно, на результатах анализа ПЦР (таблица 1). Количество микроорганизмов колеблется, поэтому исследование мазка крови может оказаться очень нечувствительным для постановки диагноза (0–37,5 %) [47; 51–53]. Определение специфичности также может быть проблемой при исследовании мазка крови, особенно если его проводит кто-то, не имеющий достаточного опыта. При правильной подготовке и проведении ПЦР гораздо более чувствительна и специфична, чем цитология, и в настоящее время обычно используются видоспецифические анализы [54]. Однако здоровые кошки также могут быть положительными на ДНК гемоплазмы в крови, и поэтому результаты ПЦР не всегда коррелируют с наличием клинических проявлений болезни (как и в случае интерпретации многих ПЦР-тестов) [41; 55; 56].
Доксициклин, который часто назначают в виде ароматизированной суспензии (во избежание эзофагита и стриктур пищевода) в дозе 10 мг/кг перорально каждые 24 часа или 5 мг/кг перорально каждые 12 часов, как правило, эффективен для лечения клинически проявленного гемоплазмоза кошек. Продолжительность рекомендованной терапии варьируется, но обычно составляет 2–4 недели [57; 58]. У кошек с непереносимостью доксициклина также эффективны фторхинолоны. Введение марбофлоксацина или орбифлоксацина дало результаты, аналогичные результатам доксициклина, в двух исследованиях [7; 59]. Прадофлоксацин показал многообещающие результаты в элиминации инфекции M. haemofelis у некоторых экспериментально заражённых кошек [60]. Недавнее исследование показало, что для облегчения ликвидации M. haemofelis, когда это необходимо, лечение доксициклином проводится в течение 28 дней с мониторингом количества копий в крови с помощью количественной ПЦР [61]. Если у кошки остаётся положительный результат ПЦР и необходимо продолжить очищение организма от возбудителя, лекарство следует сменить на фторхинолон (в исследовании использовался марбофлоксацин) в течение 14 дней. Владельцев следует проинформировать о том, что при лечении могут возникать рецидивы, но редко.
Энрофлоксацин, как показывает история применения, эффективен при лечении гемоплазмоза; тем не менее, необходимо учитывать некоторые аспекты безопасности (см. вставку). Азитромицин же, по результатам одного исследования, при гемоплазмозе эффективен не был [47].
Хотя гемоплазмы, по-видимому, представляют низкий риск для людей, были сообщения об инфицировании аналогичными организмами и об одном описанном заражении человека гемоплазмозом, которое могло произойти от кошки [62; 63].
ДНК гемоплазмы кошек была амплифицирована от блох и клещей [13; 14; 29; 33; 40; 64; 65]. Однако это не равняется векторно-опосредованной передаче, поскольку присутствие ДНК гемоплазм просто отражает их активное питание на инфицированных хозяевах. Исследования с участием кошачьей блохи, C. felis, показали только очень преходящую передачу инфекции M. haemofelis у кошек, экспериментально заражаемых через активно питающихся блох, при этом клинические и гематологические признаки инфекции M. haemofelis не были вызваны у кошки-реципиента [66]. Однако географические очаги распространения инфекции в некоторых исследованиях убедительно подтверждают роль членистоногих-переносчиков в передаче гемоплазмы, поэтому гемоплазмозы часто рассматриваются как трансмиссивные инфекции [22; 67]. Недавно было показано, что Aedes aegypti засасывает M. haemofelis или Candidatus M. haemominutum, но передача неподготовленным кошкам не была задокументирована, что позволяет предположить, что этот комар не является биологическим переносчиком [68]. Борьба с блохами и избегание драк с другими кошками должны снизить риск заражения гемоплазмозом.
Риккетсии (разные виды)
Риккетсии — грамотрицательные бактерии, облигатные внутриклеточные паразиты. Наибольшее значение имеет группа пятнистой лихорадки и группа сыпного тифа. Rickettsia felis была обнаружена у блох, заражающих кошек, почти во всех охваченных исследованиями странах [12; 13; 21; 29; 30; 69; 70]. ДНК R. felis была амплифицирована от C. felis, Ctenocephalides canis и Pulex Irritans; эти блохи распространены по всему миру. C. felis является биологическим вектором R. felis; этот патоген может передаваться трансовариально и трансстадиально внутри популяции блох. ДНК Rickettsia typhi была амплифицирована от блох в Испании и США [69; 71–73]. Некоторые блохи C. felis были положительными как на R. felis, так и на R. typhi, что позволяет предположить, что кошки могут подвергаться воздействию обоих инфекций одновременно [69; 72]. Кроме того, из блох, собранных с кошек, был получен ДНК, наиболее совместимый с Rickettsia asembonensis или Candidatus Rickettsia senegalensis [73].
Попытка связать лихорадку с воздействием R. felis была предпринята при исследовании небольшой группы кошек в США, и, хотя серопозитивные кошки были обнаружены, связи с лихорадкой не выявлено [74]. На сегодняшний день изучено лишь небольшое количество кошек на предмет связи заболевания с R. typhi [69], и таковая связь с клинически проявленным заболеванием, насколько известно авторам, не выявлена. Поскольку переносимые блохами виды риккетсий связаны с лихорадкой у других видов млекопитающих, вполне возможно, что они могут вызывать лихорадку также и у кошек, как предполагали другие исследователи [75]; однако необходимы дополнительные данные для определения достоверности этих связей.
В настоящее время рутинное тестирование для кошек недоступно, если не используются панели ПЦР с праймерами, способными амплифицировать R. felis, R. asembonensis, Candidatus R. senegalensis и R. typhi.
Поскольку у кошек не было зарегистрировано клинически проявленных заболеваний, вызываемых риккетсиями, передающимися блохами, оптимальное лечение неизвестно. Однако, основываясь на результатах для других видов, доксициклин или фторхинолон были бы логичным выбором. Поскольку и R. felis, и R. typhi связаны с заболеванием у людей, крайне важно обеспечить круглогодичный контроль над блохами кошек, чтобы потенциально снизить риск заражения [76].
Yersinia pestis
Yersinia pestis у людей является причиной чумы, а при заражении повышается температура как у людей, так и у кошек [77–80]. Однако передача этого патогена среди кошек или людей через C. felis считается редкой из-за различных факторов, которые включают быстрое удаление бактерий из средней кишки этого вида блох [81]. Хотя вполне возможно, что блохи грызунов могут передавать Y. pestis кошкам, при этом наиболее распространённым путём передачи является попадание бактерий грызунов внутрь. Таким образом, Y. pestis следует рассматривать в дифференциальном списке для лихорадки у уличных кошек в эндемичных районах.
Биполярно окрашенные палочки часто видны при цитологической оценке мазков аспиратов лимфатических узлов заражённых Y. pestis (особенно хорошо видна биполярность при окрашивании метиленовым синим по Лёффлеру. — Ред.). Диагноз может быть подтверждён посевом (в лабораториях с соответствующей сертификацией), флуоресцентным окрашиванием антител или анализом ПЦР; последние методы доступны во многих диагностических лабораториях, особенно на западе США. В США следует связаться с ветеринарным врачом штата и отправить образцы в диагностическую лабораторию с чёткой пометкой, как от кошки с подозрением на чуму, чтобы можно было использовать соответствующие методы и меры предосторожности (nasphv.org).
У кошек с инфекцией Y. pestis эффективен ряд противомикробных препаратов, включая аминогликозиды и доксициклин. Неопубликованные данные одного из авторов (ML) зарегистрировали успешное лечение 6 кошек инъекциями энрофлоксацина в дозе 5 мг/кг подкожно каждые 24 часа в течение 3–5 дней (меры безопасности при применении энрофлоксацина у кошек см. во врезе), с последующим введением доксициклина в 10 мг/кг перорально каждые 24 часа в течение 7–21 дней. Кошкам следует обеспечивать круглогодичную борьбу с блохами и сводить к минимуму возможность охотиться, особенно для кошек, живущих в районах с подтверждёнными случаями чумы.
Меры предосторожности при применении энрофлоксацина
Сообщалось о диффузной дегенерации сетчатки и острой слепоте после применения фторхинолона энрофлоксацина у кошек. Хотя это происходит очень редко и связано с передозировкой (более 5 мг/кг/день), следует соблюдать осторожность при его применении у кошек в более высоких дозах [57]. Риск дегенерации сетчатки при применении других хинолонов у кошек может быть ниже, чем при применении энрофлоксацина, и о рисках не сообщалось при применении прадофлоксацина.
Ключевые моменты
- Некоторые переносимые блохами патогены могут быть связаны с лихорадкой у кошек, а соответствующая история болезни и сопутствующие клинические признаки могут инициировать диагностическое исследование и, в конечном итоге, соответствующую терапию.
- Доказано, что борьба с блохами может блокировать передачу B. henselae среди кошек.
- Профилактика инфекций, передаваемых блохами, всегда предпочтительнее лечения клинически больных кошек, поэтому средства от блох следует использовать круглый год.
- Следует мыть руки после контакта с кошками, имеющими блох.
- Следует избегать укусов и царапин кошек, особенно при наличии блох.
Благодарности
Авторы благодарят доктора Susanne Siebert и доктора Annette Boegel за их поддержку и ободрение, а также за редакторские комментарии.
Конфликт интересов
Авторы заявляют об отсутствии потенциальных конфликтов интересов в отношении исследования, авторства и/или публикации этой статьи.
Финансирование
Авторы не получили финансовой поддержки для исследования, написания и/или публикации этой статьи.
Этическое одобрение
В этой работе не использовались животные, и поэтому не требовалось этического одобрения.
Информированное согласие
В этой работе не использовались животные, поэтому информированное согласие не требовалось. В публикации нельзя идентифицировать животных или людей, поэтому дополнительное согласие на публикацию не требовалось.
Литература
1 Ramsey I and Tasker S. Fever. In: Ettinger SJ, Feldman EC and Cote E (eds). Textbook of veterinary internal medicine. 8th ed. St Louis, MO: Elsevier, 2016, pp 195–203.
2 Hasday JD, Fairchild KD and Shanholtz C. The role of fever in the infected host. Microbes Infect 2000; 2: 1891–1904.
3 Spencer SE, Knowles T, Ramsey IK, et al. Pyrexia in cats: retrospective analysis of signalment, clinical investigations, diagnosis and influence of prior treatment in 106 referred cases. J Feline Med Surg 2017; 19: 1123–1130.
4 Lappin MR, Tasker S and Roura X. Role of vector-borne pathogens in the development of fever in cats. 2. Tick- and sandfly-associated diseases. J Feline Med Surg 2020; 22: 41–48.
5 Breitschwerdt EB, Broadhurst JJ and Cherry NA. Bartonella henselae as a cause of acute-onset febrile illness in cats. JFMS Open Rep 2015; 1. DOI: 10.1177/2055116915600454.
6 Lappin MR, Breitschwerdt E, Brewer M, et al. Prevalence of Bartonella species DNA in the blood of cats with and with-out fever. J Feline Med Surg 2009; 11: 141–148.
7 Lappin MR, Miller W and Sellins D. Effect of doxycycline or orbifloxacin administration on Bartonella spp. and Hemoplasma assay results in naturally exposed cats. Intern J Appl Res Vet Med 2012; 10: 225–233.
8 Breitschwerdt EB, Maggi RG, Chomel BB, et al. Bartonellosis: an emerging infectious disease of zoonotic importance to animals and human beings. J Vet Emerg Crit Care 2010; 20: 8–30.
9 Kernif T, Leulmi H, Socolovschi C, et al. Acquisition and excretion of Bartonella quintana by the cat flea, Ctenocephalides felis felis. Mol Ecol 2014; 23: 1204–1212.
10 Solano-Gallego L, Hegarty B, Espada Y, et al. Serological and molecular evidence of exposure to arthropod-borne organisms in cats from northeastern Spain. Vet Microbiol 2006; 118: 274–277.
11 Tabar MD, Altet L, Francino O, et al. Vector-borne infections in cats: molecular study in Barcelona area (Spain). Vet Parasitol 2008; 151: 332–336.
12 Lappin MR and Hawley J. Presence of Bartonella species and Rickettsia species DNA in the blood, oral cavity, skin and claw beds of cats in the United States. Vet Dermatol 2009; 20: 509–514.
13 Barrs VR, Beatty JA, Wilson BJ, et al. Prevalence of Bartonella species, Rickettsia felis, haemoplasmas and the Ehrlichia group in the blood of cats and fleas in eastern Australia. Aust Vet J 2010; 88: 160–165.
14 Assarasakorn S, Veir JK, Hawley JR, et al. Prevalence of Bartonella species, hemoplasmas, and Rickettsia felis DNA in blood and fleas of cats in Bangkok, Thailand. Res Vet Sci 2012; 93: 1213–1216.
15 Ayllon T, Diniz PP, Breitschwerdt EB, et al. Vector-borne diseases in client-owned and stray cats from Madrid, Spain. Vector Borne Zoonotic Dis 2012; 12: 143–150.
16 Lobetti R and Lappin MR. Prevalence of Toxoplasma gondii, Bartonella species and haemoplasma infection in cats in South Africa. J Feline Med Surg 2012; 14: 857–862.
17 Maia C, Ramos C, Coimbra M, et al. Bacterial and protozoal agents of feline vector-borne diseases in domestic and stray cats from southern Portugal. Parasit Vectors 2014; 7: 115. DOI: 10.1186/1756–3305–7–115.
18 Gracia MJ, Marcen JM, Pinal R, et al. Prevalence of Rickettsia and Bartonella species in Spanish cats and their fleas. J Vector Ecol 2015; 40: 233–239.
19 Bergmann M, Englert T, Stuetzer B, et al. Prevalence of Bartonella species infections in cats in Southern Germany. Vet Rec 2017; 180: 325.
20 Alaman VM, Simon VC, Fuertes NH, et al. Molecular epidemiology of Bartonella henselae in stray and sheltered cats of Zaragoza, Spain [article in Spanish]. Rev Esp Salud Publica 2016; 90: e1-e11.
21 Bessas A, Leulmi H, Bitam I, et al. Molecular evidence of vector-borne pathogens in dogs and cats and their ectoparasites in Algiers, Algeria. Comp Immunol Microbiol Infect Dis 2016; 45: 23–28.
22 Persichetti MF, Pennisi MG, Vullo A, et al. Clinical evaluation of outdoor cats exposed to ectoparasites and associated risk for vector-borne infections in southern Italy. Parasit Vectors 2018; 11: 136. DOI: 10.1186/s13071–018–2725–8.
23 Bradbury CA and Lappin MR. Evaluation of topical application of 10 % imidacloprid-1 % moxidectin to prevent Bartonella henselae transmission from cat fleas. J Am Vet Med Assoc 2010; 236: 869–873.
24 Whittemore JC, Hawley JR, Radecki SV, et al. Bartonella species antibodies and hyperglobulinemia in privately owned cats. J Vet Intern Med 2012; 26: 639–644.
25 Nutter FB, Dubey JP, Levine JF, et al. Seroprevalences of antibodies against Bartonella henselae and Toxoplasma gondii and fecal shedding of Cryptosporidium spp, Giardia spp, and Toxocara cati in feral and pet domestic cats. J Am Vet Med Assoc 2004; 225: 1394–1398.
26 Brunt J, Guptill L, Kordick DL, et al. American Association of Feline Practitioners 2006 Panel Report on diagnosis, treatment, and prevention of Bartonella spp. infections. J Feline Med Surg 2006; 8: 213–226.
27 Biswas S, Maggi RG, Papich MG, et al. Comparative activity of pradofloxacin, enrofloxacin, and azithromycin against Bartonella henselae isolates collected from cats and a human. J Clin Microbiol 2010; 48: 617–618.
28 Qurollo BAB, Balakrishnan N, Cannon CZ, et al. Co-infection with Anaplasma platys, Bartonella henselae, Bartonella koehlerae and ‘Candidatus Mycoplasma haemominutum’ in a cat diagnosed with splenic plasmacytosis and multiple myeloma. J Feline Med Surg 2014; 16: 713–720.
29 Shaw SE, Kenny MJ, Tasker S, et al. Pathogen carriage by the cat flea Ctenocephalides felis (Bouche) in the United Kingdom. Vet Microbiol 2004; 102: 183–188.
30 Slapeta J, Lawrence A and Reichel MP. Cat fleas (Ctenocephalides felis) carrying Rickettsia felis and Bartonella species in Hong Kong. Parasitol Int 2018; 67: 209–212.
31 Lappin MR, Davis WL, Hawley JR, et al. A flea and tick collar containing 10 % imidacloprid and 4.5 % flumethrin prevents flea transmission of Bartonella henselae in cats. Parasit Vectors 2013; 6: 26. DOI: 10.1186/1756–3305–6–26.
32 Fink H, Wennogle S, Davis WL, et al. Field comparison of tolerance of a collar containing 10.0 % imidacloprid/ 4.5 % flumethrin (Seresto) and a placebo collar placed on cats. J Feline Med Surg 2016; 18: 1031–1033.
33 Duplan F, Davies S, Filler S, et al. Anaplasma phagocytophilum, Bartonella spp., haemoplasma species and Hepatozoon spp. in ticks infesting cats: a large-scale survey. Parasit Vectors 2018; 11: 201. DOI: 10.1186/s13071–018–2789–5.
34 Cairns K, Brewer M and Lappin MR. Prevalence of Coxiella burnetii DNA in vaginal and uterine samples from healthy cats of north-central Colorado. J Feline Med Surg 2007; 9: 196–201.
35 Candela MG, Caballol A and Atance PM. Wide exposure to Coxiella burnetii in ruminant and feline species living in a natural environment: zoonoses in a human-livestock-wildlife interface. Epidemiol Infect 2017; 145: 478–481.
36 Shapiro AJ, Norris JM, Bosward KL, et al. Q fever (Coxiella burnetii) knowledge and attitudes of Australian cat breeders and their husbandry practices. Zoonoses Public Health 2017; 64: 252–261.
37 Mori M and Roest HJ. Farming, Q fever and public health: agricultural practices and beyond. Arch Public Health 2018; 76: 2. DOI: 10.1186/s13690–017–0248-y.
38 Psaroulaki A, Chochlakis D, Ioannou I, et al. Presence of Coxiella burnetii in fleas in Cyprus. Vector Borne Zoonotic Dis 2014; 14: 685–687.
39 Duron O, Sidi-Boumedine K, Rousset E, et al. The importance of ticks in Q Fever transmission: what has (and has not) been demonstrated? Trends Parasitol 2015; 31: 536–552.
40 Willi B, Boretti FS, Tasker S, et al. From Haemobartonella to hemoplasma: molecular methods provide new insights. Vet Microbiol 2007; 125: 197–209.
41 Roura X, Peters IR, Altet L, et al. Prevalence of hemotropic mycoplasmas in healthy and unhealthy cats and dogs in Spain. J Vet Diagn Invest 2010; 22: 270–274.
42 Martfnez-Dfaz VL, Silvestre-Ferreira AC, Vilhena H, et al. Prevalence and co-infection of haemotropic mycoplasmas in Portuguese cats by real-time polymerase chain reaction. J Feline Med Surg 2013; 15: 879–885.
43 Weingart C, Tasker S and Kohn B. Infection with haemoplasma species in 22 cats with anaemia. J Feline Med Surg 2016; 18: 129–136.
44 Andre MR, Filgueira KD, Calchi AC, et al. Co-infection with arthropod-borne pathogens in domestic cats. Rev Bras Parasitol Vet 2017; 26: 525–531.
45 Ravagnan S, Carli E, Piseddu E, et al. Prevalence and molecular characterization of canine and feline hemotropic mycoplasmas (hemoplasmas) in northern Italy. Parasit Vectors 2017; 10: 132. DOI: 10.1186/s13071–017–2069–9.
46 Dfaz-Reganon D, Villaescusa A, Ayllon T, et al. Epidemiological study of hemotropic mycoplasmas (hemoplasmas) in cats from central Spain. Parasit Vectors 2018; 11: 140. DOI: 10.1186/s13071–018–2740–9.
47 Westfall DS, Jensen WA, Reagan W, et al. Inoculation of two genotypes of Haemobartonella felis (California and Ohio variants) to induce infection in cats and response to treat-ment with azithromycin. Am J Vet Res 2001; 62: 687–691.
48 Tasker S, Peters IR, Papasouliotis K, et al. Description of outcomes of experimental infection with feline haemoplasmas: copy numbers, haematology, Coombs’ testing and blood glucose concentrations. Vet Microbiol 2009; 139: 323–332.
49 Dean RS, Helps CR, Gruffydd Jones TJ, et al. Use of real-time PCR to detect Mycoplasma haemofelis and ‘Candidatus Mycoplasma haemominutum’ in the saliva and salivary glands of haemoplasma-infected cats. J Feline Med Surg 2008; 10: 413–417.
50 Museux, K, Boretti FS, Willi B, et al. In vivo transmission studies of ‘Candidatus Mycoplasma turicensis’ in the domestic cat. Vet Res 2009; 40: 45. DOI: 10.1051/ vetres/2009028.
51 Jensen WA, Lappin MR, Kamkar S, et al. Use of a polymerase chain reaction assay to detect and differentiate two strains of Haemobartonella felis infection in naturally infected cats. Am J Vet Res 2001; 62: 604–608.
52 Tasker S, Binns SH, Day MJ, et al. Use of a PCR assay to assess prevalence and risk factors for Mycoplasma haemofelis and ‘Candidatus Mycoplasma haemominutum’ in cats in the United Kingdom. Vet Rec 2003; 152: 193–198.
53 Ghazisaeedi F, Atyabi N, Zahrai Salehi T, et al. A molecular study of hemotropic mycoplasmas (hemoplasmas) in cats in Iran. Vet Clin Pathol 2014; 43: 381–386.
54 Peters IR, Helps CR, Willi B, et al. The prevalence of three species of feline haemoplasmas in samples submitted to a diagnostics service as determined by three novel real-time duplex PCR assays. Vet Microbiol 2008; 126: 142–150.
55 Willi B, Boretti FS, Baumgartner C, et al. Prevalence, risk fac-tor analysis, and follow-up of infections caused by three feline hemoplasma species in cats in Switzerland. J Clin Microbiol 2006; 44: 961–969.
56 Willi B, Boretti FS, Meli ML, et al. Real-time PCR investigation of potential vectors, reservoirs and shedding patterns of feline hemotropic mycoplasmas. Appl Environ Microbiol 2007; 73: 3798–3802.
57 Dowers KL, Olver CS, Radecki V, et al. Use of enrofloxacin for treatment of large-form Haemobartonella felis in experi-mentally infected cats. J Am Vet Med Assoc 2002; 221: 250–253.
58 Tasker S, Hofmann-Lehmann R, Belak S, et al. Haemo — plasmosis in cats: European guidelines from the ABCD on prevention and management. J Feline Med Surg 2018; 20: 256–261.
59 Tasker S, Caney SM, Day MJ, et al. Effect of chronic FIV infection, and efficacy of marbofloxacin treatment, on Mycoplasma haemofelis infection. Vet Microbiol 2006; 117: 169–179.
60 Dowers KL, Tasker S, Radecki SV, et al. Use of pradofloxacin to treat experimentally induced Mycoplasma hemofelis infection in cats. Am J Vet Res 2009; 70: 105–111.
61 Novacco, M, Sugiarto S, Willi B, et al. Consecutive antibiotic treatment with doxycycline and marbofloxacin clears bacteremia in Mycoplasma haemofelis-infected cats. Vet Microbiol 2018; 217: 112–120.
62 Steer JA, Tasker S, Barker EN, et al. A novel hemotropic Mycoplasma (hemoplasma) in a patient with hemolytic anemia and pyrexia. Clin Infect Dis 2011; 53: e147–151. DOI: 10.1093/cid/cir666.
63 Santos AP, Santos RP, Biondo AW, et al. Hemoplasma infection in HIV-positive patient, Brazil. Emerg Infect Dis 2008; 14: 1922–1924.
64 Taroura, S, Shimada Y, Sakata Y, et al. Detection of DNA of ‘Candidatus Mycoplasma haemominutum’ and Spiroplasma sp. in unfed ticks collected from vegetation in Japan. J Vet Med Sci 2005; 67: 1277–1279.
65 Lappin MR, Griffin B, Brunt J, et al. Prevalence of Bartonella species, haemoplasma species, Ehrlichia species, Anaplasma phagocytophilum, and Neorickettsia risticii DNA in the blood of cats and their fleas in the United States. J Feline Med Surg 2006; 8: 85–90.
66 Woods JE, Brewer MM, Hawley JR, et al. Evaluation of experimental transmission of ‘Candidatus Mycoplasma haemominutum’ and Mycoplasma haemofelis by Ctenocephalides felis to cats. Am J Vet Res 2005; 66: 1008–1012.
67 Sykes JE, Drazenovich NL, Ball LM, et al. Use of conventional and real-time polymerase chain reaction to determine the epidemiology of hemoplasma infections in anemic and nonanemic cats. J Vet Intern Med 2007; 21: 685–693.
68 Reagan KL, Clarke LL, Hawley JR, et al. Assessment of the ability of Aedes species mosquitoes to transmit feline Mycoplasma haemofelis and ‘Candidatus Mycoplasma haemominutum’. J Feline Med Surg 2017; 19: 798–802.
69 Nogueras MM, Pons I, Ortuno A, et al. Molecular detection of Rickettsia typhi in cats and fleas. PLoS One 2013; 8: e71386. DOI: 10.1371/journal.pone.0071386.
70 Teoh YT, Hii SF, Graves S, et al. The epidemiology of Rickettsia felis infecting fleas of companion animals in eastern Australia. Parasit Vectors 2018; 11: 138. DOI: 10.1186/s13071–018–2737–4.
71 Maina AN, Fogarty C, Krueger L, et al. Rickettsial infections among Ctenocephalides felis and host animals during a flea-borne rickettsioses outbreak in Orange County, California. PLoS One 2016; 11: e0160604. DOI: 10.1371/ journal.pone.0160604.
72 Noden BH, Davidson S, Smith JL, et al. First detection of Rickettsia typhi and Rickettsia felis in fleas collected from client-owned companion animals in the Southern Great Plains. J Med Entomol 2017; 54: 1093–1097.
73 Blanton LS, Vohra RF, Fistein L, et al. Rickettsiae within the fleas of feral cats in Galveston, Texas. Vector Borne Zoonotic Dis 2019; 19: 647–651.
74 Bayliss DB, Morris AK, Horta MC, et al. Prevalence of Rickettsia species antibodies and Rickettsia species DNA in the blood of cats with and without fever. J Feline Med Surg 2009; 11: 266–270.
75 Pennisi MG, Hofmann-Lehmann R, Radford AD, et al. Anaplasma, Ehrlichia and Rickettsia species infections in cats: European guidelines from the ABCD on prevention and management. J Feline Med Surg 2017; 19: 542–548.
76 Angelakis E, Mediannikov O, Parola P, et al. Rickettsia felis: the complex journey of an emergent human pathogen. Trends Parasitol 2016; 32: 554–564.
77 Eidson M, Thilsted JP and Rollag OJ. Clinical, clinicopatho- logic, and pathologic features of plague in cats: 119 cases (1977–1988). J Am Vet Med Assoc 1991; 199: 1191–1197.
78 Gasper PW, Barnes AM, Quan TJ, et al. Plague (Yersinia pestis) in cats: description of experimentally induced disease. J Med Entomol 1993; 30: 20–26.
79 Pennisi MG, Egberink H, Hartmann K, et al. Yersinia pestis infection in cats: ABCD guidelines on prevention and management. J Feline Med Surg 2013; 15: 582–584.
80 Kassem AM, Tengelsen L, Atkins B, et al. Notes from the field: plague in domestic cats — Idaho, 2016. MMWR Morb Mortal Wkly Rep 2016; 65: 1378–1379.
81 Bland DM and Hinnebusch BJ. Feeding behavior modulates biofilm-mediated transmission of Yersinia pestis by the cat flea, Ctenocephalides felis. PLoS Negl Trop Dis 2016; 10: e0004413. DOI: 10.1371/journal.pntd.0004413.
Источник: Journal of Feline Medicine and Surgery (2020) 22, 31–39. https://doi.org/10.1177/1098612X19895941. © The Author(s). 2020 Open Access
СВМ № 1/2022
Вам также могут быть интересна статья: