Вступление
В первой части мы разобрали два основных варианта повышения температуры тела (> 39,2 °C) у кошек — гипертермию и лихорадку (пирексию), а также возбудителей инфекционных заболеваний, которые доказанно или вероятно переносятся блохами. Во второй части статьи предметом рассмотрения станут лихорадка и возбудители, передаваемые клещами и возбудители, переносимые москитами. Особое внимание уделим общим клиническим и лабораторным данным, оптимальным диагностическим тестам, методам лечения и стратегиям профилактики.
Возбудители, передаваемые клещами
Анаплазмы, эрлихии и различные виды риккетсий
Anaplasma phagocytophilum
В США взрослые особи Ixodes scapularis, отловленные в дикой природе, обычно дают положительный результат на ДНК Anaplasma phagocytophilum, а экспериментально заражённые кошки восприимчивы к этой инфекции [2; 3]. У кошек постоянный иммунитет к A. phagocytophilum не вырабатывается — при экспериментальном заражении кошек были зарегистрированы повторные инфекции [4]. В большинстве стран, где обитают различные виды иксодовых клещей, кошки подвергаются их укусам в естественных условиях, и у этих кошек выделены ДНК A. phagocytophilum или антитела к патогену [5–13]. Иксодовые клещи также часто являются носителями Borrelia burgdorferi, а коинфекции с A. phagocytophilum повсеместно распространены.
В двух исследованиях у небольшого количества кошек, экспериментально инфицированных A. phagocytophilum после инвазии I. scapularis, клинические признаки болезни не развились [2; 4]. Кошки, живущие в эндемичных районах, обычно являются серопозитивными, однако у большинства нет клинических признаков заболевания. В случае развития болезни у естественно инфицированных кошек лихорадка, анорексия и летаргия являются наиболее частыми клиническими отклонениями; иногда к ним можно отнести и хромоту [4; 6; 9].
Кошкам с признаками лихорадки и тромбоцитопенией или без неё, проживающим в районах, эндемичных по иксодовым клещам, следует проводить цитологическое исследование мазков крови, чтобы попытаться найти морулы (илл. 1) [9]. Многие коммерческие лаборатории предлагают ПЦР-анализ для амплификации ДНК A. phagocytophilum из крови, и при остром заболевании скорее будет более показательным этот анализ, нежели серологические исследования (таблица 1) [2]. Было показано, что один и тот же коммерческий тест для обнаружения антител к A. phagocytophilum в сыворотке собак (SNAP 4DXPlus; IDEXX Laboratories) выявляет эти антитела и в сыворотке кошек [2]. 30 % кошек с подтверждёнными клиническими признаками, вызванными A. phagocytophilum, при первом серологическом исследовании дают отрицательные результаты, но в большинстве подтверждённых случаев, изученных на данный момент, в конечном итоге наблюдаются перекрёстные серологические реакции [5].
Естественно инфицированным кошкам с подозрением на анаплазмоз вводили несколько антибиотиков. В двух исследованиях у всех кошек симптомы болезни исчезли в течение 24–48 часов после начала приёма тетрациклина или доксициклина, и о рецидивах не сообщалось [5; 6; 9]. Две кошки, несмотря на отсутствие признаков заболевания, всё ещё оставались ПЦР-положительными через 17 и 90 дней после лечения (продолжавшегося 21–30 дней), что позволяет предположить, что у некоторых кошек лечение тетрациклинами в течение ≤30 дней может быть недостаточным для элиминации A. phagocytophilum [5].
Риск заражения кошек A. phagocytophilum следует снизить за счёт соответствующего применения акарицидов. Тем не менее, в одном исследовании использование топикального акарицида оказалось не связано со снижением риска наличия антител против A. phagocytophilum или B. burgdorferi [12]. В этом исследовании выяснилось, что владельцы пролеченных серопозитивных кошек не применяли акарицид круглый год. Также выяснилось, что наиболее склонными покупать средства против клещей являются владельцы тех кошек, которых до этого явно кусали клещи и, возможно, даже уже инфицировали.
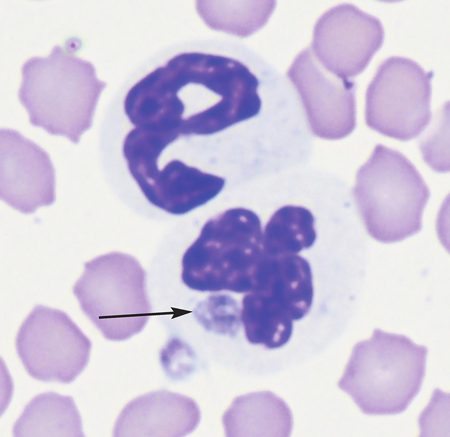 |
| Илл. 1. Морула Anaplasma phagocytophilum (стрелка) в нейтрофиле экспериментально инфицированной кошки |
Anaplasma platys
Было показано, что ряд кошек инфицирован Anaplasma platys [14–17]. Предполагается, что этот возбудитель передаётся клещами, возможно, Rhipicephalus sanguineus. Однако не установлено, вызывает ли этот патоген лихорадку у кошек только как моно- или же смешанную коинфекцию. Надёжность серологических исследований на Anaplasma platys у кошек не подтверждена. Таким образом, в настоящее время диагноз основан на обнаружении морул в тромбоцитах или амплификации специфической ДНК с помощью ПЦР-анализа. Оптимальные методы лечения кошек неизвестны, но доксициклин должен быть эффективным. Снизить риск заражения возможно применением акарицидов.
Эрлихии (несколько видов)
Несмотря на то, что у собак эрлихиоз хорошо изучен, о возбудителях, вызывающих заболевание у кошек, известно меньше. Вполне вероятно, что в любой стране, где наблюдается заражение собак Ehrlichia canis, также есть инфицированные E. canis кошки. Во многих странах у кошек, подвергшихся естественному заражению, при обследовании по разным поводам были обнаружены тельца или морулы в периферических лимфоцитах или моноцитах, похожие на Ehrlichia-подобные, а также ДНК, соответствующая E. canis, амплифицированная из крови или тканей, или антитела, реагирующие на морулы или пептиды E. canis [10; 13; 18–30]. Были зафиксированы полевые случаи, когда кошки были положительными на ДНК, идентичную E. canis в двух генах, и результаты никогда не показывали сероконверсии [21]. Другое исследование показало, что кошки с повышенным риском заражения R. sanguineus с большей вероятностью имели более высокие показатели распространённости (9,4 %) положительной ПЦР на ДНК E. canis [26]. На Сицилии ДНК E. canis амплифицировали от клещей, собранных с кошек [31].
Клинические нарушения у кошек с подозрением на эрлихиоз обычно наблюдаются в виде лихорадки, вялости и отсутствия аппетита, поэтому кошкам с этими признаками может быть показана необходимость исследования. Наиболее частыми клиническими лабораторными находками у естественно инфицированных кошек являются, по-видимому, тромбоцитопения, анемия и моноцитоз [19; 20; 25; 30]. Почти все отклонения, отмеченные у собак с клиническим эрлихиозом, были обнаружены и у кошек, включая моноклональную гаммапатию.
Достоверные серологические тесты в настоящее время не разработаны, так, некоторые кошки с наличием в крови ДНК, подобной E. canis, оказались серонегативными [21]. Положительные результаты серологических тестов наблюдаются как у здоровых, так и у клинически больных кошек, поэтому диагноз клинического эрлихиоза не должен основываться на серологическом исследовании. Только результаты ПЦР-тестов на виды эрлихий и секвенирование генов могут использоваться у кошек с подозрением на эрлихиоз для подтверждения наличия инфекции, и они должны рассматриваться в настоящее время в качестве тестов выбора. Однако не все кошки с положительным результатом ПЦР клинически больны.
Клиническое улучшение после лечения тетрациклином, доксициклином или имидокарба дипропионатом было зарегистрировано у большинства кошек с подозрением на эрлихиоз [19–21]. Текущая рекомендация Американского колледжа ветеринарной внутренней медицины по изучению инфекционных заболеваний — давать доксициклин (10 мг/кг перорально каждые 24 часа или 5 мг/кг перорально каждые 12 часов в течение 28 дней). Панцитопения у кошек с эрлихиозом может возникнуть [21]; у собак панцитопения может не поддаваться лечению.
Этот возбудитель является ещё одним примером того, почему следует использовать акарициды, применение которых помогает избежать заражения возбудителями трансмиссивных заболеваний. На собаках было показано, что E. canis может передаваться не позднее 3 часов после прикрепления клещей [32]. Это короткое время начала передачи указывает на важность использования таких акарицидов, которые либо быстро убивают прикрепившихся клещей, либо, предпочтительно, в первую очередь предотвращают их укусы.
Риккетсии (несколько видов)
В Испании и Италии из крови кошек были амплифицированы ДНК Rickettsia conorii и Rickettsia massiliae или антитела, реагирующие с R. conorii [13; 33]. В США в одном исследовании у кошек с лихорадкой уровень распространённости антител к Rickettsia rickettsii составлял 6,6%, но ДНК патогена не была амплифицирована из крови [34]. Подобные результаты были получены при исследовании кошек в Сент-Китсе, Вест-Индия, где 22 из 52 диких кошек имели сывороточные антитела к риккетсиям, но все были отрицательными по специфической ДНК в крови [18]. Эти результаты доказывают, что кошки иногда подвергаются воздействию микроорганизмов из группы клещевой пятнистой лихорадки, но для определения связи этого с такими симптомами, как лихорадка, необходимы дополнительные данные. Поскольку клиническое заболевание кошек не зарегистрировано, оптимальное лечение неизвестно. Однако, исходя из результатов у собак, доксициклин или фторхинолон были бы логичным выбором. Использование акарицидов должно снизить вероятность передачи риккетсий кошкам.
Другие патогены
Боррелии (несколько видов)
Многие кошки, контактировавшие с иксодовыми клещами в Северной Америке и некоторых частях Европы, вырабатывают антитела против B. burgdorferi. В ряде областей Ближнего Востока некоторые кошки также инфицированы Borrelia persica в результате инвазии Ornithodoros tholozani [35]. Лихорадка у кошек может быть связана с инфекциями B. burgdorferi или B. persica [12; 35; 36]. Однако, поскольку многие кошки подвержены нападению иксодовых клещей, бывает трудно определить, является ли клиническое заболевание результатом инфекции A. phagocytophilum, или B. burgdorferi, или обоих [12].
У кошек с лихорадкой и подозрением на инфекцию B. persica следует провести оценку мазков периферической крови на спирохеты, и наличие инфекции можно подтвердить с помощью ПЦР [35]. Сыворотка кошек с лихорадкой и подозрением на инфекцию B. burgdorferi может быть проверена с помощью коммерчески доступного набора (SNAP 4DXPlus; IDEXX Laboratories), титрованного для использования с сывороткой собаки [2; 4]. Однако выявление антител к B. burgdorferi доказывает только имевшееся воздействие, а не обязательно клинический боррелиоз.
Кошки с лихорадкой и подозрением на боррелиоз обычно отвечают на введение доксициклина в дозе 5 мг/кг перорально каждые 12 часов или 10 мг/кг перорально каждые 24 часа [12; 36]. Эффективность различных акарицидов для предотвращения передачи боррелий кошкам не сравнивалась, но, судя по опыту с собаками, потенциально все они могут быть полезны для предотвращения боррелиоза у кошек при правильном применении [37].
Francisella tularensis
По данным учёных из США, у кошек может развиться лихорадка после заражения Francisella tularensis [38]. Кошки часто заражаются F. tularensis, поедая добычу, но возможна и передача вируса клещами. Наличие инфекции можно подтвердить посевом, амплификацией специфической ДНК с помощью ПЦР или определением титра антител [39]. Клинически больные кошки должны реагировать на доксициклин или фторхинолоны. Кошкам в эндемичных районах следует обеспечивать контроль над клещами круглый год, а их охотничье поведение должно быть сведено к минимуму, если это возможно.
Таблица 1. Сопутствующие находки и рекомендации по диагностическому плану для выявления патогенов, переносимых клещами или москитами и связанных с лихорадкой у кошек
| Диагностика* | ||||
| Находки | Методы прямой идентификации |
Серологические методы | Комментарии | |
| Возбудители, передаваемые клещами | ||||
| Anaplasma phagocytophilum | Анорексия
Летаргия Хромота Тромбоцитопения |
Цитология мазка крови или синовиальной жидкостиПЦР-анализ крови |
Несколько методов доступно в некоторых лабораториях
Canine SNAP4DXPlus был использован в двух экспериментальных исследованиях [2; 4] |
Морулы в нейтрофилах |
| Anaplasma platys | Летаргия
Тромбоцитопения |
Цитология мазка крови
ПЦР-анализ крови |
Не применяются | Неизвестно, возможна ли при серологических исследованиях инфицированных собак и кошек перекрёстная реакция |
| Babesia виды | Гемолитическая анемия | Цитология мазка крови
ПЦР-анализ крови |
Не применяются | Результат цитологии часто бывает ложноотрицательным |
| Borrelia burgdorferi | Летаргия
Хромота |
ПЦР-анализ биоптата кожи с места укуса клеща
ПЦР-анализ синовиальной жидкости |
Несколько методов доступно в некоторых лабораториях
Canine SNAP4DXPlus был использован в двух |
ПЦР-анализ крови больных собак, как правило, отрицательный; у кошек — нет данных |
| Borrelia persica | Анемия
Тромбоцитопения |
Цитология мазка крови
ПЦР-анализ крови |
Не применяются | |
| Cytauxzoon виды | Анемия
Одышка Находки, соответствующие шоку |
Цитология мазка крови
ПЦР-анализ крови |
Не применяются | |
| Ehrlichia виды | Анемия
Тромбоцитопения Панцитопения Гиперглобулинемия Увеит Другое |
Цитология мазка крови
ПЦР-анализ крови |
В США доступны в некоторых лабораториях | Цитология обычно даёт ложноотрицательный результат
Морулы в мононуклеарных клетках Анализ на сывороточные антитела у некоторых кошек может дать ложноотрицательный результат Большинство клинических находок у собак были описаны и у кошек |
| Francisella tularensis | Лимфаденопатия | Цитология
Иммунофлуоресцентный анализ Посев ПЦР-анализ |
Доступны в некоторых лабораториях | В методах прямой идентификации используются ткани лимфатических узлов, содержимое абсцессов, смывы из дыхательных путей
Рост титра антител можно использовать для подтверждения недавнего инфицирования, если прямые методы дают отрицательный результат |
| Hepatozoon виды | На данный момент неизвестно |
Цитология мазка крови
ПЦР-анализ крови |
Не применяются | |
| Rickettsia rickettsii Rickettsia conorii Rickettsia massiliae | На данный момент неизвестно |
ПЦР-анализ крови | Не применяются | Rickettsia rickettsii является преобладающим видом в США, в Европе преобладают другие |
| Возбудители, передаваемые москитами | ||||
| Leishmania виды (преимущественно Leishmania infantum) | Поражения кожи
Гиперглобулинемия Лимфаденопатия Увеит Другое |
ПЦР-анализ аспирата или мазков-отпечатков
Цитология Гистология |
Доступны в некоторых лаборатория | В противоположность собакам, у кошек наличие даже низкого титра антител говорит о наличии инфекции |
* Результаты прямых тестов (цитология ± методы окрашивания, посев, ПЦР-анализ) подтверждают наличие инфекции, когда они положительны. Однако многих здоровых кошек существует фаза носительства таких возбудителей, как Ehrlichia и Hepatozoon, поэтому результаты анализов не всегда достоверны. Точно так же большинство положительных результатов теста на антитела просто указывает на перенесённую инфекцию, но не подтверждает текущую инфекцию или заболевание.
Простейшие
Бабезии (несколько видов)
В Южной Африке и некоторых частях Азии существует большое количество видов бабезий, к которым восприимчивы кошки. В Европе ДНК Babesia vogeli или Babesia vulpes была амплифицирована у клещей, собранных с кошек, а в крови обнаружены антитела к B. vulpes [13; 31; 37; 40]. В Северной и Южной Америке B. vogeli и Babesia gibsoni были обе описаны у кошек как одиночные и смешанные инвазии [18; 41]. B. vogeli и Babesia canis, вероятно, более распространены в районах с высокой степенью инвазии R. sanguineus. Однако не установлено, вызывают ли эти патогены лихорадку у кошек изолированно или при смешанном заражении.
Серологические тесты для кошек на эти патогены не обладают высокой чувствительностью. Таким образом, в настоящее время диагноз основан на обнаружении пироплазм в эритроцитах или амплификации специфической ДНК с помощью ПЦР-анализа. Оптимальные методы лечения кошек неизвестны, но были рассмотрены варианты, в основном экстраполированные на собачий бабезиоз [42]. Использование акарицидов должно снизить риск воздействия, за исключением B. gibsoni, которая может передаваться напрямую.
Cytauxzoon (несколько видов)
Кошки в США, Бразилии и Европе могут быть заражены разными видами Cytauxzoon [10; 43–49]. Очевидно, что Cytauxzoon felis в США (передаваемый Amblyomma americanum) может быть очень патогенным по сравнению с видами Cytauxzoon, встречающимися у кошек в других странах. В разных странах это могут быть разные виды [50]. В то время как смертельные инвазии C. felis распространены в некоторых регионах США, часто встречаются кошки, которые страдают от субклинических инвазий [51; 52]. Эти данные свидетельствуют о том, что у кошек может иметь место широкий спектр клинических проявлений, возможно, связанный с поствакцинальным иммунитетом, естественным иммунитетом, вариациями штаммов или другими не выясненными вариациями иммунного ответа кошки. Недавнее исследование показало, что C. felis может передаваться через 36–48 часов после прикрепления клещей и что поедание A. americanum не вызывает заражения [53].
В США клинические инвазии цитозооноза чаще всего выявляются весной, летом и осенью. Владельцы кошек с проявлениями болезни часто жалуются на неспецифические симптомы, такие как вялость и анорексия. У кошек в финальной острой фазе болезни, наблюдаются лихорадка или переохлаждение. Общие результаты клинической дифференциальной диагностики, которые могут привести к подозрению на наличие этого патогена, включают не поддающуюся коррекции лихорадку, бледность слизистых оболочек от шока или анемии, желтуху, спленомегалию и гепатомегалию [10; 45]. Дискомфорт, клинические признаки поражения центральной нервной системы включают конвульсии, учащённое дыхание с одышкой или без неё, вполне возможна внезапная смерть во время манипуляции. Недавно было описано поражение цитозоонозом глаз [34].
Cytauxzoon часто можно увидеть на эритроцитах, но на острых стадиях болезни цитология может дать ложноотрицательные результаты. Серьёзные симптомы заболевания связаны с развитием в тканях шизонтов. Синдром можно диагностировать путём цитологического исследования пироплазм на эритроцитах или шизонтов в образцах селезёнки, печени или костного мозга, а также амплификацией ДНК видов Cytauxzoon в крови или тканевых аспиратах с помощью ПЦР [45].
На сегодняшний день клинически больные кошки показали лучший ответ (60 %) на комбинацию азитромицина в дозе 10 мг/кг перорально каждые 24 часа и атоваквона в дозе 15 мг/кг перорально каждые 8 часов [55; 56]. Эта комбинация превосходит протоколы с диминазеном или имидокарбом [57]. Во время проведения поддерживающей терапии следует использовать минимальные методы фиксации, чтобы снизить вероятность внезапной смерти.
Плохая общая реакция на лечение в клинических случаях цитозооноза является прекрасным примером того, почему борьба с клещами так важна. Опять же, как упоминалось ранее в этой серии статей, всегда лучше предотвратить трансмиссивное заболевание, чем пытаться лечить его после того, как болезнь уже началась. Соответствующее использование акарацидов должно снизить риск передачи этого патогена [58]. Было показано, что один коммерчески доступный ошейник от блох и клещей, содержащий флуметрин, и продукт для местного применения, содержащий сароланер, блокируют передачу C. felis клещами A. Americanum [58; 59].
Hepatozoon (несколько видов)
Ряд исследователей амплифицировал ДНК видов Hepatozoon от кошек, также патоген был обнаружен у клещей, собранных с кошек [3; 28; 47; 60–62]. В недавнем отчёте сообщалось, что у кошек в Южной Италии были обнаружены три различных вида Hepatozoon [61]. У собак инвазия Hepatozoon americanum развивается после проглатывания клещей или таких видов добычи, как кролики [63]. Неизвестно, приводит ли поедание добычи к заражению гепатозоонозом кошек.
У кошек лихорадка, связанная с гепатозоонозом, широко не изучалась; однако в США у собак с инвазией H. americanum часто наблюдается лихорадка. В одном исследовании, проведённом в Израиле, сообщалось, что лихорадка является одним из потенциальных клинических проявлений гепатозооноза у кошек [60]. ПЦР-тесты могут использоваться для подтверждения диагноза, но оптимальные протоколы лечения кошек с гепатозоонозом неизвестны. Использование акарицидов должно снизить вероятность передачи этих возбудителей среди кошек.
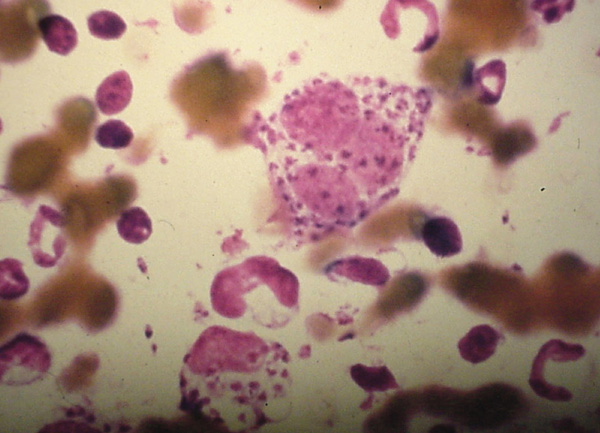 |
| Илл. 2. Цитологический препарат, показывающий амастиготы лейшманий в макрофагах |
Возбудители, передаваемые москитами
Лейшмании (несколько видов)
Сообщения о лейшманиозе кошек поступали со всего мира [62; 64–74]. Традиционно поражения кожи описывались как наиболее частое клиническое проявление и иногда были единственным клиническим признаком при обследовании. Однако совсем недавно были описаны кошки, у которых нет поражений кожи, а преобладают другие клинические признаки, и в целом такие случаи, по-видимому, имеют худший прогноз. Сообщалось о случаях лихорадки у кошек, которая могла быть связана с лейшманиозом [75].
Диагностика при подозрении на лейшманиоз у кошек может быть достигнута с использованием прямых методов, таких как цитология (илл. 2), гистология и ПЦР-тесты. В качестве альтернативы для косвенного подтверждения диагноза можно использовать серологические методы, такие как непрямой флуоресцентный анализ или ELISA, которые оценивают иммунный ответ кошки против лейшманий. В отличие от собак, у которых могут быть очень высокие титры антител даже при субклиническом носительстве, низкий положительный титр у кошек можно рассматривать как серьёзный довод в пользу диагноза лейшманиоза [76].
Информация о лучших методах лечения лейшманиоза кошек в основном основана на отчётах об отдельных случаях. Длительное введение аллопуринола (10–20 мг/кг каждые 12 или каждые 24 часа) обычно клинически эффективно, но меглумина антимонат также успешно применяли в некоторых случаях. Однако у большинства кошек инфекция не может быть полностью элиминирована, поэтому рекомендуется использовать адекватные меры профилактики, включая борьбу с москитами, чтобы уменьшить количество кошек, инвазированных лейшманиями, в эндемичных районах [77; 78].
Ключевые моменты
- Некоторые патогены, передаваемые клещами и москитами, могут вызывать лихорадку у кошек, а анамнез и сопутствующие клинические признаки должны инициировать диагностическое обследование и, в конечном итоге, назначение соответствующей терапии.
- В приоритете — профилактика трансмиссивных болезней. Появляется всё больше доказательств того, что желательно постоянное использование средств, которые либо быстро убивают переносчиков, либо, предпочтительно, вообще предотвращают укусы кошек переносчиками.
Благодарности
Авторы благодарят доктора Susanne Siebert и доктора Annette Boegel за их поддержку, а также за редакторские комментарии.
Конфликт интересов
Авторы заявили об отсутствии потенциальных конфликтов интересов в отношении исследования, авторства и/или публикации этой статьи.
Этическое одобрение и информированное согласие
В этой работе не использовались животные, и поэтому этическое одобрение и информированное согласие не требовались. В публикации невозможно идентифицировать животных или людей, поэтому дополнительное согласие на публикацию не требуется.
Финансирование
Авторы не получили финансовой поддержки для исследования, авторства и/или публикации этой статьи.
Литература
- Lappin MR, Tasker S and Roura X. Role of vector-borne pathogens in the development of fever in cats. 1. Flea- associated diseases. J Feline Med Surg 2020; 22: 31–39.
- Lappin MR, Chandrashekar R, Stillman B, et al. Evidence of infection of cats by Borrelia burgdorferi and Anaplasma phagocytophilum after exposure to wild-caught adult Ixodes scapularis. J Vet Diagn Invest 2015; 27: 522–525.
- Duplan F, Davies S, Filler S, et al. Anaplasma phagocytophilum, Bartonella spp., haemoplasma species and Hepatozoon spp. in ticks infesting cats: a large-scale survey. Parasit Vectors 2018; 11: 201. DOI: 10.1186/s13071–018–2789–5.
- Lappin M and Huesken R. Anaplasma phagocytophilum and Borrelia burgdorferi infections in cats exposed repeatedly to Ixodes scapularis [abstract]. J Vet Intern Med 2015; 29: 1201.
- Lappin MR, Breitschwerdt EB, Jensen WA, et al. Molecular and serologic evidence of Anaplasma phagocytophilum infection in cats in North America. J Am Vet Med Assoc 2004; 225: 893–896.
- Bjoersdorff A, Svendenius L, Owens JH, et al. Feline granulocytic ehrlichiosis — a report of a new clinical entity and characterization of the new infectious agent. J Small Anim Pract 1999; 40: 20–24.
- Adaszek t, Gorna M, Skrzypczak M, et al. Three clinical cases of Anaplasma phagocytophilum infection in cats in Poland. J Feline Med Surg 2013; 15: 333–337.
- Bergmann M, Englert T, Stuetzer B, et al. Prevalence of selected rickettsial infections in cats in Southern Germany. Comp Immunol Microbiol Infect Dis 2015; 42: 33–36.
- Savidge C, Ewing P, Andrews J, et al. Anaplasma phagocytophilum infection of domestic cats: 16 cases from the northeastern USA. J Feline Med Surg 2016; 18: 85–91.
- Andre MR, Filgueira KD, Calchi AC, et al. Co-infection with arthropod-borne pathogens in domestic cats. Rev Bras Parasitol Vet 2017; 26: 525–531.
- Galemore ER, Labato MA and O’Neil E. Prevalence of Anaplasma phagocytophilum infection in feral cats in Massachusetts. JFMS Open Rep 2018; 4. DOI: 10.1177/ 2055116917753804.
- Hoyt K, Chandrasheker R, Beall M, et al. Evidence for clinical borreliosis and anaplasmosis in cats in Maine. Top Companion Anim Med 2018; 33: 40–44.
- Persichetti MF, Pennisi MG, Vullo A, et al. Clinical evaluation of outdoor cats exposed to ectoparasites and associated risk for vector-borne infections in southern Italy. Parasit Vectors 2018; 11: 136. DOI: 10.1186/s13071–018–2725–8.
- Lima MLF, Soares PT, Ramos CAN, et al. Molecular detection of Anaplasma platys in a naturally-infected cat in Brazil. Braz J Microbiol 2010; 41: 381–385.
- Qurollo BAB, Balakrishnan N, Cannon CZ, et al. Co-infection with Anaplasma platys, Bartonella henselae, Bartonella koehlerae and Candidatus Mycoplasma haemominutum’ in a cat diagnosed with splenic plasmacytosis and multiple myeloma. J Feline Med Surg 2014; 16: 713–720.
- Attipa C, Papasouliotis K, Solano-Gallego L, et al. Prevalence study and risk factor analysis of selected bacterial, protozoal and viral, including vector-borne, pathogens in cats from Cyprus. Parasit Vectors 2017; 10: 130. DOI: 10.1186/s13071–017–2063–2.
- Zobba R, Anfossi AG, Visco S, et al. Cell tropism and molecular epidemiology of Anaplasma platys-like strains in cats. Ticks Tick Borne Dis 2015; 6: 272–280.
- Kelly PJ, Koster L, Li J, et al. Survey of vector-borne agents in feral cats and first report of Babesia gibsoni in cats on St Kitts, West Indies. BMC Vet Res 2017; 13: 331. DOI: 10.1186/s12917–017–1230–1.
- Beaufils JP, Marin-Granel J, Jumelle P, et al. Ehrlichiosis in cats. A retrospective study of 21 cases. Prat Med Chir Anim Cie 1999; 34: 587–596.
- Bouloy RP, Lappin MR, Holland CH, et al. Clinical ehrlichiosis in a cat. J Am Vet Med Assoc 1994; 204: 1475–1478.
- Breitschwerdt EB, Abrams-Ogg AC, Lappin MR, et al. Molecular evidence of Ehrlichia canis-like infection in cats. J Vet Intern Med 2002; 16: 642–649.
- Aguirre E, Tesouro MA, Amusategui I, et al. Assessment of feline ehrlichiosis in central Spain using serology and a polymerase chain reaction technique. Ann N Y Acad Sci 2004; 1026: 103–135.
- Solano-Gallego L, Hegarty B, Espada Y, et al. Serological and molecular evidence of exposure to arthropod-borne organisms in cats from northeastern Spain. Vet Microbiol 2006; 118: 274–277.
- Braga Mdo S, Andre MR, Freschi CR, et al. Molecular and serological detection of Ehrlichia spp. in cats on Sao Luis Island, Maranhao, Brazil. Rev Bras Parasitol Vet 2012; 21: 37–41.
- Braga IA, dos Santos LG, Melo AL, et al. Hematological values associated to the serological and molecular diagnostic in cats suspected of Ehrlichia canis infection. Rev Bras Parasitol Vet 2013; 22: 470–474.
- Braga IA, dos Santos L, de Souza Ramos D, et al. Detection of Ehrlichia canis in domestic cats in the central-western region of Brazil. Braz J Microbiol 2014; 45: 641–645.
- Maia C, Ramos C, Coimbra M, et al. Bacterial and protozoal agents of feline vector-borne diseases in domestic and stray cats from southern Portugal. Parasit Vectors 2014; 7: 115. DOI: 10.1186/1756–3305–7–115.
- Oliveira AC, Luz MF, Granada S, et al. Molecular detection of Anaplasma bovis, Ehrlichia canis and Hepatozoon felis in cats from Luanda, Angola. Parasit Vectors 2018; 11: 167. DOI: 10.1186/s13071–018–2767-y.
- Pennisi MG, Hofmann-Lehmann R, Radford AD, et al. Anaplasma, Ehrlichia and Rickettsia species infections in cats: European guidelines from the ABCD on prevention and management. J Feline Med Surg 2017; 19: 542–548.
- Peavy GM, Holland CJ, Dutta SK, et al. Suspected Ehrlichia infection in a household of cats. J Am Vet Med Assoc 1997; 210: 231–234.
- Pennisi MG, Persichetti MF, Serrano L, et al. Ticks and associated pathogens collected from cats in Sicily and Calabria (Italy). Parasit Vectors 2015; 8: 512. DOI: 10.1186/s13071–015–1128–3.
- Jongejan F, Crafford D, Erasmus H, et al. Comparative efficacy of oral administrated afoxolaner (NexGard™) and fluralaner (Bravecto™) with topically applied permethrin/ imidacloprid (Advantix®) against transmission of Ehrlichia canis by infected Rhipicephalus sanguineus ticks to dogs. Parasit Vectors 2016; 9: 348. DOI: 10.1186/s13071–016–1636–9.
- Segura F, Pons I, Miret J, et al. The role of cats in the eco- epidemiology of spotted fever group diseases. Parasit Vectors 2014; 7: 353. DOI: 10.1186/1756–3305–7–353.
- Bayliss DB, Morris AK, Horta MC, et al. Prevalence of Rickettsia species antibodies and Rickettsia species DNA in the blood of cats with and without fever. J Feline Med Surg 2009; 11: 266–270.
- Baneth G, Nachum-Biala Y, Halperin T, et al. Borrelia persica infection in dogs and cats: clinical manifestations, clinico- pathological findings and genetic characterization. Parasit Vectors 2016; 9: 244. DOI: 10.1186/s13071–016–1530–5.
- Pantchev N, Vrhovec MG, Pluta S, et al. Seropositivity of Borrelia burgdorferi in a cohort of symptomatic cats from Europe based on a C6-peptide assay with discussion of implications in disease aetiology. Berl Munch Tierarztl Wochenschr 2016; 129: 333–339.
- Davies S, Abdullah S, Helps C, et al. Prevalence of ticks and tick-borne pathogens: Babesia and Borrelia species in ticks infesting cats of Great Britain. Vet Parasitol 2017; 244: 129–135.
- Spagnoli ST, Kuroki K, Schommer SK, et al. Pathology in practice. Francisella tularensis. J Am Vet Med Assoc 2011; 238: 1271–1273.
- Magnarelli L, Levy S and Koski R. Detection of antibodies to Francisella tularensis in cats. Res Vet Sci 2007; 82: 22–26.
- Solano-Gallego L, Sainz A, Roura X, et al. A review of canine babesiosis: the European perspective. Parasit Vectors 2016; 9: 336. DOI: 10.1186/s13071–016–1596–0.
- Malheiros J, Costa MM, do Amaral RB, et al. Identification of vector-borne pathogens in dogs and cats from Southern Brazil. Ticks Tick Borne Dis 2016; 7: 893–900.
- Ashley L, Ayoob AL, Prittie J, et al. Feline babesiosis. J Vet Emerg Crit Care 2010; 20: 90–97.
- Haber MD, Tucker MD, Marr HS, et al. The detection of Cytauxzoon felis in apparently healthy free-roaming cats in the USA. Vet Parasitol 2007; 146: 316–320.
- Carli E, Trotta M, Chinelli R, et al. Cytauxzoon sp. infection in the first endemic focus described in domestic cats in Europe. Vet Parasitol 2012; 183: 343–352.
- Sherrill MK and Cohn LA. Cytauxzoonosis: diagnosis and treatment of an emerging disease. J Feline Med Surg 2015; 17: 940–948.
- Alho AM, Silva J, Fonseca MJ, et al. First report of Cytauxzoon sp. infection in a domestic cat from Portugal. Parasit Vectors 2016; 9: 220. DOI: 10.1186/s13071–016–1506–5.
- Dfaz-Reganon D, Villaescusa A, Ayllon T, et al. Molecular detection of Hepatozoon spp. and Cytauxzoon sp. in domestic and stray cats from Madrid, Spain. Parasit Vectors 2017; 10: 112. DOI: 10.1186/s13071–017–2056–1.
- Legroux JP, Halos L, Rene-Martellet M, et al. First clinical case report of Cytauxzoon sp. infection in a domestic cat in France. BMC Vet Res 2017; 13: 81. DOI: 10.1186/s12917–017–1009–4.
- Nentwig A, Meli ML, Schrack J, et al. First report of Cytauxzoon sp. infection in domestic cats in Switzerland: natural and transfusion-transmitted infections. Parasit Vectors 2018; 11: 292. DOI: 10.1186/s13071–018–2728–5.
- Gallusova M, Jirsova D, Mihalca AD, et al. Cytauxzoon infections in wild felids from Carpathian-Danubian-Pontic Space: further evidence for a different Cytauxzoon species in European felids. J Parasitol 2016; 102: 377–380.
- Meinkoth J, Kocan AA, Whitworth L, et al. Cats surviving natural infection with Cytauxzoon felis: 18 cases (1997–1998). J Vet Intern Med 2000; 14: 521–525.
- Rizzi TE, Reichard MV, Cohn LA, et al. Prevalence of Cytauxzoon felis infection in healthy cats from enzootic areas in Arkansas, Missouri, and Oklahoma. Parasit Vectors 2015; 8: 13. DOI: 10.1186/s13071–014–0618-z.
- Thomas JE, Ohmes CM, Payton ME, et al. Minimum transmission time of Cytauxzoon felis by Amblyomma americanum to domestic cats in relation to duration of infestation, and investigation of ingestion of infected ticks as a potential route of transmission. J Feline Med Surg 2018; 20: 67–72.
- Meekins J and Cino-Ozuna AG. Histologic identification of intraocular Cytauxzoon felis in three cats. JFMS Open Rep 2018; 4. DOI: 10.1177/2055116918813242.
- Cohn LA, Birkenheuer AJ, Brunker JD, et al. Efficacy of atovaquone and azithromycin or imidocarb dipropionate in cats with acute cytauxzoonosis. J Vet Intern Med 2011; 25: 55–60.
- Schreeg ME, Marr HS, Tarigo J, et al. Pharmacogenomics of Cytauxzoon felis cytochrome b: implications for atovaquone and azithromycin therapy in domestic cats with cytaux- zoonosis. J Clin Microbiol 2013; 51: 3066–3069.
- Lewis KM, Cohn LA, Marr HS, et al. Failure of efficacy and adverse events associated with dose-intense diminazene diaceturate treatment of chronic Cytauxzoon felis infection in five cats. J Feline Med Surg 2014; 16: 157–163.
- Reichard MV, Thomas JE, Arther RG, et al. Efficacy of an imidacloprid 10 % flumethrin 4.5 % collar (Seresto®, Bayer) for preventing the transmission of Cytauxzoon felis to domestic cats by Amblyomma americanum. Parasitol Res 2013; 112 Suppl 1: 11–20.
- Reichard MV, Rugg JJ, Thomas JE, et al. Efficacy of a topical formulation of selamectin plus sarolaner against induced infestations of Amblyomma americanum on cats and prevention of Cytauxzoon felis transmission. Vet Parasitol 2019; 270 Suppl 1: S31–S37. DOI: 10.1016/j.vetpar.2018.10.018.
- Baneth G, Aroch I, Tal N, et al. Hepatozoon species infection in domestic cats: a retrospective study. Vet Parasitol 1998; 79: 123–133.
- Giannelli A, Latrofa MS, Nachum-Biala Y, et al. Three different Hepatozoon species in domestic cats from southern Italy. Ticks Tick Borne Dis 2017; 8: 721–724.
- Attipa C, Neofytou K, Yiapanis C, et al. Follow-up monitoring in a cat with leishmaniosis and coinfections with Hepatozoon felis and ‘Candidatus Mycoplasma haemominutum. JFMS Open Rep 2017; 3. DOI: 10.1177/2055116917740454.
- Johnson EM, Panciera RJ, Allen KE, et al. Alternate pathway of infection with Hepatozoon americanum and the epidemiologic importance of predation. J Vet Intern Med 2009; 23: 1315–1318.
- Hervas J, Chacon-M De Lara F, Sanchez-Isarria MA, et al. Two cases of feline visceral and cutaneous leishmaniosis in Spain. J Feline Med Surg 1999; 1: 101–105.
- Poli A, Abramo F, Barsotti P, et al. Feline leishmaniosis due to Leishmania infantum in Italy. Vet Parasitol 2002; 106: 181–191.
- Pennisi MG, Venza M, Reale S, et al. Case report of leishmaniasis in four cats. Vet Res Commun 2004; 28 Suppl 1: 363–366.
- Leiva M, Lloret A, Pena T, et al. Therapy of ocular and visceral leishmaniasis in a cat. Vet Ophthalmol 2005; 8: 71–75.
- Rufenacht S, Sager H, Muller N, et al. Two cases of feline leishmaniosis in Switzerland. Vet Rec 2005; 156: 542–545.
- Navarro JA, Sanchez J, Penafiel-Verdu C, et al. Histopathological lesions in 15 cats with leishmaniosis. J Comp Pathol 2010; 143: 297–302.
- Rougeron V, Catzeflis F, Hide M, et al. First clinical case of cutaneous leishmaniasis due to Leishmania (Viannia) braziliensis in a domestic cat from French Guiana. Vet Parasitol 2011; 181: 325–328.
- Verneuil M. Ocular leishmaniasis in a cat: case report. J Fr Ophtalmol 2013; 36: 67–72.
- Richter M, Schaarschmidt-Kiener D and Krudewig C. Ocular signs, diagnosis and long-term treatment with allopurinol in a cat with leishmaniasis. Schweiz Arch Tierheilkd 2014; 156: 289–294.
- Pennisi MG and Persichetti MF. Feline leishmaniosis: is the cat a small dog? Vet Parasitol 2018; 251: 131–137.
- Rivas AK, Alcover M, Marti’nez-Orellana P, et al. Clinical and diagnostic aspects of feline cutaneous leishmaniosis in Venezuela. Parasit Vectors 2018; 11: 141. DOI: 10.1186/s13071–018–2747–2.
- Basso MA, Marques C, Santos M, et al. Successful treatment of feline leishmaniosis using a combination of allopurinol and N-methyl-glucamine antimoniate. JFMS Open Rep 2016; 2. DOI: 10.1177/2055116916630002.
- Persichetti MF, Solano-Gallego L, Vullo A, et al. Diagnostic performance of ELISA, IFAT and Western blot for the detection of anti-Leishmania infantum antibodies in cats using a Bayesian analysis without a gold standard. Parasit Vectors 2017; 10: 119. DOI: 10.1186/s13071–017–2046–3.
- Brianti E, Falsone L, Napoli E, et al. Prevention of feline leishmaniosis with an imidacloprid 10 % flumethrin 4.5 % polymer matrix collar. Parasit Vectors 2017; 10: 334. DOI: 10.1186/s13071–017–2258–6.
- Otranto D, Dantas-Torres F, Napoli E, et al. Season-long control of flea and tick infestations in a population of cats in the Aeolian archipelago using a collar containing 10 % imidacloprid and 4.5 % flumethrin. Vet Parasitol 2017; 248: 80–83.
Источник: Journal of Feline Medicine and Surgery (2020) 22, 41–48. DOI: 10.1177/1098612X19895942. © The Author(s). 2020. Open Access
СВМ № 2/2022
Первая часть статьи:
Лихорадка у кошек: роль патогенов, передаваемых трансмиссивным путём. Болезни, переносимые блохами




