Ключевые слова: морфология и морфометрия эритроцитов, световая микроскопия, сканирующая электронная микроскопия, взрослые собаки, пожилые собаки, гериатрические собаки.
Введение
Эритроциты — самые многочисленные клетки в организме, доставляющие кислород к тканям тела. Подсчёт этих жизненно важных клеток часто является первым шагом при оценке патологического состояния пациента [1; 2]. Эритроциты — безъядерные клетки, имеющие форму двояковогнутых дисков с бледной серединой, называемые дискоциты [3]. Пойкилоцитоз — это термин, используемый для обозначения нарушения формы эритроцитов в крови [4]. Оценка изменений в морфологии эритроцитов даёт важную информацию для постановки диагноза у людей и животных [5–8]. Помимо заболеваний, другие физиологические факторы, такие как возраст, могут вызывать изменения морфологии эритроцитов [9; 10].
Световой микроскоп ранее был самым распространённым инструментом для оценки морфологии эритроцитов, являющейся важным показателем для диагностики заболеваний у гериатрических пациентов, а также для контроля качества при использовании автоматических гематологических анализаторов и для быстрой оценки состояния пациентов в ветеринарных отделениях интенсивной терапии [11–13]. Однако развитие технологии позволяет использовать другие инструменты, которые могут стать альтернативой для оценки морфологии эритроцитов в области научных исследований, такие как сканирующая электронная микроскопия, которая широко используется для оценки морфологических свойств эритроцитов при различных физиологических состояниях у людей [8; 14–16].
Оценка морфологии эритроцитов методом сканирующей электронной микроскопии применялась в основном в медицине человека, у возрастных пациентов с диабетом, воспалительными сердечно-сосудистыми заболеваниями [17–19]. Некоторые из этих состояний также могут встречаться у собак, особенно у возрастных животных [7; 20–22]. Поэтому на протяжении многих лет собаки использовались как экспериментальная модель для изучения некоторых заболеваний, которые встречаются у людей [22–25].
По этой причине в области ветеринарных исследований важно использовать другие инструменты для микроскопии, которые могут помочь в постановке диагноза и мониторинге заболеваний животных и человека. Кроме того, насколько нам известно, до настоящего момента не были определены параметры эритроцитов для собак старшей возрастной группы. Поэтому это исследование имеет целью изучить морфологию эритроцитов методом световой и сканирующей электронной микроскопии у клинически здоровых взрослых (1–7,9 года), пожилых (8–11,9 года) и гериатрических собак (старше 12 лет). А также оценить влияние возраста, пола и веса тела и их связь с морфометрией эритроцита, оценивая параметры эритроцитов (диаметр, высоту и осевое отношение).
Материалы и методы
Выборка
Это исследование было проведено в соответствии с положениями, прописанными в Правилах этического использования животных в образовательных и научных целях в Независимом университете Агуаскальенеса (CEADI-UAA Код: DI-PL-NO-37) [26]. Был использован неэкспериментальный поперечный дизайн (дизайн среза) [27]. Мы отобрали 152 здоровые собаки различного пола и размера, распределённых по возрасту на группу I — 49 взрослых (1–7,9 года), группу II — 51 пожилые (8–11,9 года) и группу III — 52 гериатрические (старше 12 лет) [28]. Породы были сгруппированы по весу тела: мелкие (менее 9,5 кг), средние (9,5–22,7 кг) и крупные (22,7–54,5 кг) [29].
Животные были оценены как здоровые на основании данных анамнеза и полного физикального осмотра. Сбор анамнеза и физикальный осмотр были выполнены ветеринарным специалистом в области клинической медицины мелких животных в Лаборатории паразитологии центра сельскохозяйственных наук Независимого университета Агаускальентеса и частной клинике. Был проведён опрос о здоровье, условиях содержания, активности, изменениях поведения, кормлении, вакцинации, контроле над паразитами и анамнезе (Дополнительные материалы) [30; 31]. Анкета была проверена владельцем, при необходимости задавали дополнительные вопросы. В это время собаке позволяли свободно перемещаться в приёмной. Перед включением собаки в исследование была заполнена форма информации о животном в приложении 2 (содержащая дату рождения, пол, породу, вес, размер, диету, репродуктивный статус и показатели жизнедеятельности) [32; 33]. Более того, для каждой собаки была выполнена оценка упитанности в баллах по 9-балльной шкале [34].
Все собаки голодали по 8–12 часов перед забором крови, вода была доступна по желанию. Собаки без голодной диеты, получавшие лекарственные препараты в момент забора крови, или когда подозревалась тяжёлая патология на основании данных анамнеза и осмотра, были исключены из исследования. Собаки не получали препараты хотя бы 2 месяца перед включением в исследование. Профилактические препараты (дегельминтизация, вакцинация) допускались за 2 недели до консультации. Самки были не беременные, не кормящие и не в течке. Все собаки, включённые в это исследование, принадлежали владельцам [28–30]. Все владельцы подписали форму информированного согласия. При заборе образцов крови не применяли никакой анестезии или седации.
Сбор анализов крови
Для выполнения анализов мазков крови образцы объёмом 500 мкл крови были собраны с использованием пункции яремной вены в вакуумные пробирки BD Vacutainer® с EDTA K2, распылённой на стенки пробирки (BD Franklin Lakes NJ USA).
Световая микроскопия
Сразу после сбора крови мы исследовали мазки в Диагностической лаборатории патологии центра сельскохозяйственных наук Независимого университета Агаускальентеса. Мазки были зафиксированы метанолом и окрашены по Райту. Затем на них поместили покровное стекло с раствором Entellan (Merck®, Darmstadt, Germany) и ксилолом (JT Baker® Avantor, Matsonford Rd) и оставили для высыхания на 24 часа [35]. Все мазки были исследованы с помощью оптического микроскопа ZEISS (Oberkochen, Germany). Изображения были получены с помощью камеры AmScope™ и программного обеспечения (USA).
Оценка мазков крови
Оценка мазков крови была разделена на три части: клетки эритроцитарного ряда, белые клетки крови и тромбоциты. Для оценки морфологии эритроцитов, лейкоцитов и тромбоцитов использовали увеличение 100× [36]. При анализе клеток эритроцитарного ряда оценивали размер (анизоцитоз, макроцитоз, микроцитоз), цвет (полихроматофильные, гипохромные), форму (неспецифические или специфические морфологические изменения), распределение (эритроцитарные столбики, агглютинация) и тельца включений или эритроцитарных паразитов [5; 37]. Была оценена морфология лейкоцитов (белых клеток крови) и тромбоцитов [38].
Морфометрические параметры эритроцитов
Параметры эритроцитов были оценены по микрофоторафиям, полученным в ходе световой микроскопии по Loyola-Leyva et al. [14]. У каждой собаки в исследовании было изучено по 20 эритроцитов. У всех эритроцитов была измерена самая длинная ось, называемая большой осью или диаметром. Также для определения длины малой оси или высоты была проведена перпендикулярная линия в центре большой оси (илл. 1). Далее было рассчитано осевое отношение путём деления длины большой оси (диаметра) на длину малой оси (высоту). Результат, равный 1, соответствовал идеальному кругу [14]. Таким образом для оценки морфологических изменений было исследовано 2600 клеток. Все образцы были проанализированы с помощью инструмента Measurement scaler в главном меню программы AmScope™ (USA).
Сканирующая электронная микроскопия
В общей сложности в пробирки с K2ЭДТА BD Vacutainer®, содержащие оптимальное количество K2ЭДТА, нанесённой распылением для предотвращения коагуляции определённого объёма крови (BD Franklin Lakes NJ USA), было собрано 3 мл цельной крови из яремной вены. Сразу после забора крови образец был помещён в центрифугу при 2000 об/мин в течение 10 мин., чтобы отделить слой лейкоцитов, который затем был перенесён в пробирки «Эпендорфа» с добавлением глутаральдегида (JT Baker® Avantor, Matsonford Rd), чтобы сохранить для последующих анализов. Затем образец был отцентрифугирован при 6000 об/мин в течение 1 мин., чтобы получить осадок путём декантации образца. К осадку добавили физиологический раствор с фосфатным буфером 1Х (Merck®, Darmstadt Germany), перемешали и оставили на 5 мин. Этот процесс был повторён трижды, затем к осадку добавили 60% этиловый спирт и оставили на 10 мин. Образец снова поместили в центрифугу при 6000 об/мин на 1 мин., этот процесс был повторён с этиловым спиртом с концентрацией 70, 80, 90, 96 и 100%. В конце был добавлен 100% ацетон, и образец зафиксировали в алюминиевом цилиндре с тёмным дном, для последующего покрытия частицами золота в вакуумном оборудовании Desk II Denton (Lawrence, Kansas) и исследования в сканирующем электронном микроскопе JEOL JSM-5900LV (JEOL Solutions for innovation, Mexico City) [39; 40]. При сканирующей электронной микроскопии были получены микрофотографии. Некоторые изображения, полученные при электронной микроскопии, были обработаны с помощью фоторедактора, чтобы добавить цвета клеткам крови.
Статистический анализ
Статистический анализ был выполнен с использованием Minitab 17 (Minitab Statistical Software, State College, PA); p < 0,05 считалось значительным. Мы оценили распределение переменных, изучив гистограммы и используя критерий соответствия (Андерсона-Дарлинга) [41]. Чтобы определить, являются ли различия между двумя и более группами значимыми, мы использовали признаки равенства переменных с множественными сравнениями и критерий Левена. Эти методы подходят для ненормального распределения, при нормальном распределении использовали критерий Бартлетта. Во всех дисперсионных тестах использовали доверительный интервал 95% [42].
В статистическом анализе использовали дисперсионный анализ (ANOVA) с общей линейной моделью (GLM), которая позволяет сравнить несколько факторов на двух и более уровнях (p < 0,05). Морфометрические параметры эритроцитов: диаметр, высота и осевое отношение представляют зависимые переменные, а возраст, пол и размер тела — независимые переменные. Также оценивалась связь между независимыми переменными. Когда данные не соответствовали параметрам нормального распределения и однородной дисперсии, мы использовали преобразование Бокса-Кокса, используя оптимальный критерий λ в программе Minitab с уровнем достоверности 95%. Затем был применён метод множественного сравнения Тьюки с уровнем достоверности 95% [43].
Были рассчитаны референсные интервалы для каждого морфометрического показателя (диаметр, высота, осевое отношение) с использованием программного обеспечения Reference Value Advisor V.2.1 в соответствии с рекомендациями Международной федерации клинической химии (International Federation of Clinical Chemistry (IFCC)) и Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute (CLSI)) [44]. Это программное обеспечение определяет выпадающие значения по критериям Тьюки и Диксона, для визуальной оценки показывая распределение (точечные и столбчатые диаграммы) и качественно-количественные диаграммы [30; 44].
Таблица 1. Число образцов крови клинически здоровых собак, изученных методами световой и сканирующей электронной микроскопии
| Взрослые собаки | Пожилые собаки | Гериатрические собаки | Всего | |
| Световая микроскопия |
n = 44 | n = 41 | n = 44 | n = 129 |
| Сканирующая электронная микроскопия |
n = 2 | n = 1 | n = 1 | n = 4 |
| Исключённые образцы |
n = 3 | n = 9 | n = 7 | n = 19 |
| Всего | n = 49 | n = 51 | n = 52 | n = 152 |
Результаты
Всего было собрано 152 образца крови от собак разных возрастов: группа I — взрослые (1–7,9 года), группа II — пожилые (8–11,9 года) и группа III — гериатрические (старше 12 лет). 82 собаки были самки и 66 — самцы. Все собаки были сгруппированы по размеру: 81 мелкая, 25 средних и 42 крупных собаки. Мелкие, средние и крупные собаки были представлены во всех возрастных группах. 19 образцов крови были исключены из исследования: 5 образцов из-за присутствия сгустков, 4 образца из-за гемолиза, и 10 образцов были исключены из статистического анализа из-за выявленных субклинических заболеваний. Таким образом, только 129 образцов крови от клинически здоровых собак были исследованы методом световой микроскопии и 4 образца крови методом сканирующей электронной микроскопии, как показано в таблице 1.
Световая микроскопия
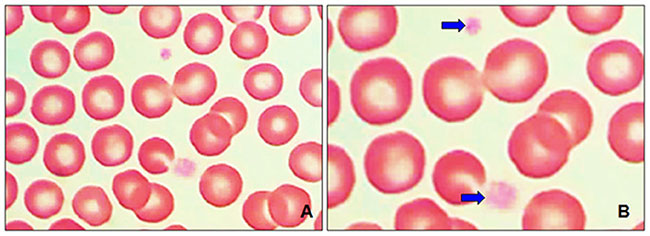
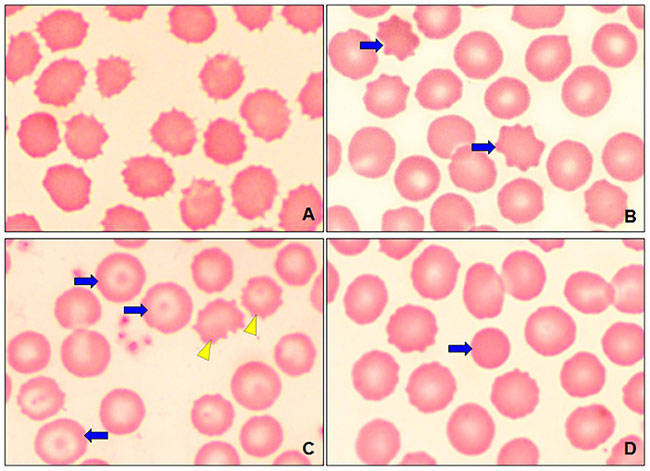
В этом исследовании при световой микроскопии были получены снимки мазков крови. На илл. 2А, В показана нормальная морфология эритроцитов и мелкие тромбоциты с бледно-серой или светло-голубой цитоплазмой с нормальным зернистым содержимым. При оценке морфологии эритроцитов в 88% образцов наблюдался анизоцитоз (вариабельность размеров) (илл. 3), полихромазия (полихроматофильные эритроциты) и пойкилоцитоз (нарушение формы). Ненормальные формы эритроцитов были специфически классифицированы.
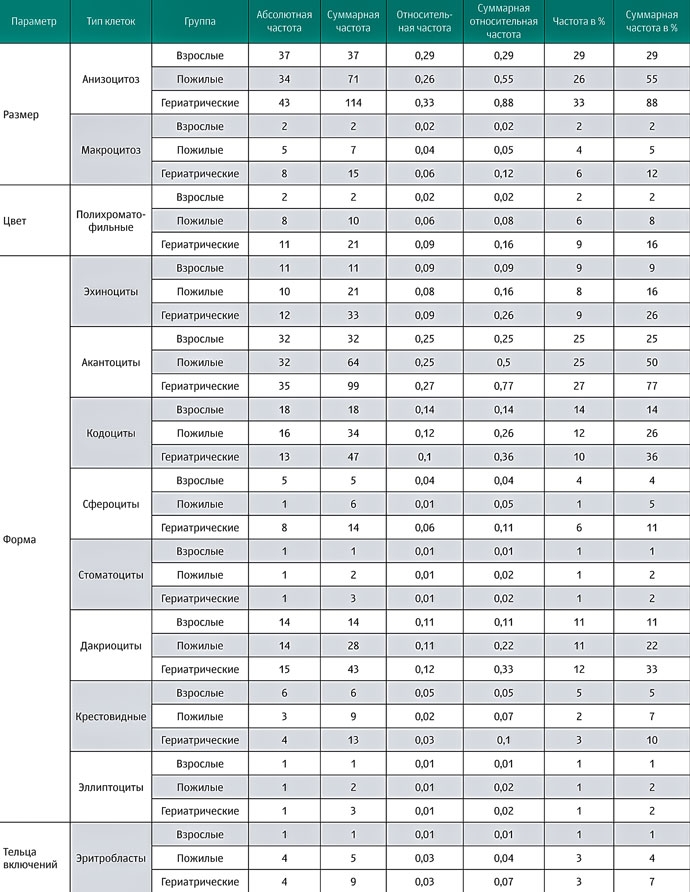
В таблице 2 показана частота каждого показателя: размера, цвета, формы и телец включений эритроцитов, которые наблюдались в мазках крови при световой микроскопии. В каждой группе собак (взрослых, пожилых и гериатрических) приведены: абсолютная частота, частота в процентах и суммарная частота в процентах.
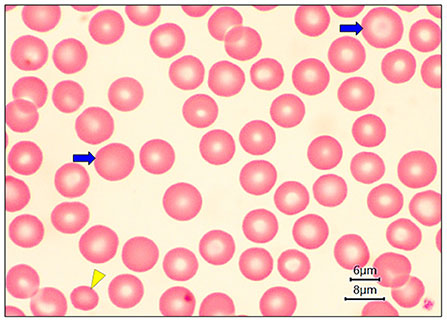
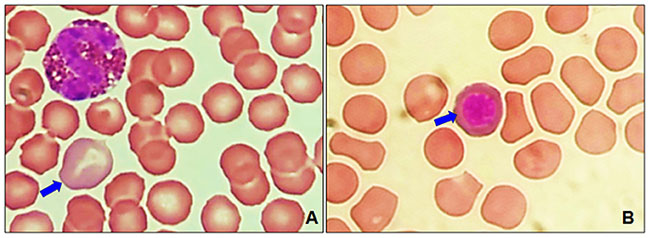
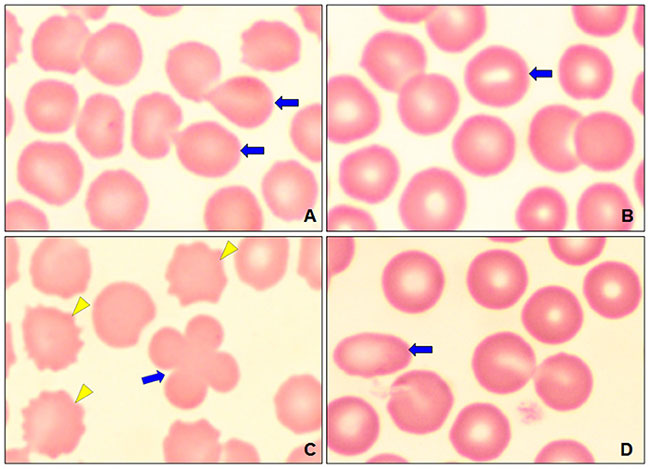
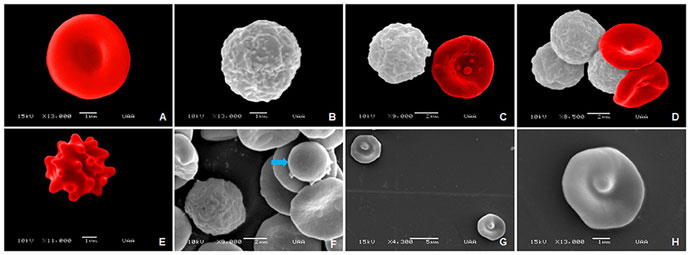
У гериатрических собак наблюдалась полихромазия (илл. 4А) в совокупности с макроцитами (илл. 3) и эритробластами (илл. 4В). При пойкилоцитозе распознавание аномальных форм эритроцитов было нечётким. Три аномальные формы эритроцитов встречались наиболее часто (таблица 1): акантоциты (77%), кодоциты (36%) и дакриоциты (34%). На илл. 5А показаны эхиноциты с маленькими иглами, равномерно расположенными на их поверхности, эта особенность отличает их от акантоцитов (илл. 5В, С). На илл. 5С также показаны мишеневидные эритроциты (клетки-мишени, или кодоциты). На илл. 5D показаны мелкие эритроциты, без зоны просветления в центре и ярко окрашенные (сфероциты). Каплевидные эритроциты, известные как дакриоциты, представлены на илл. 6А. На илл. 6В показаны эритроциты с овальной и продолговатой центральной бледной областью, названные стоматоцитами. Четырёхлепестковые клетки в форме креста (илл. 6С). Продолговатые или эллиптические красные клетки крови (эллиптоциты) показаны на илл. 6D. Тельца включений, характерные для клеток эритропоэза, таких как эритробласты, были выявлены в 7% проанализированных образцов (илл. 4В). Нарушений распределения (феномен монетных столбиков) и эритроцитарных паразитов обнаружено не было.
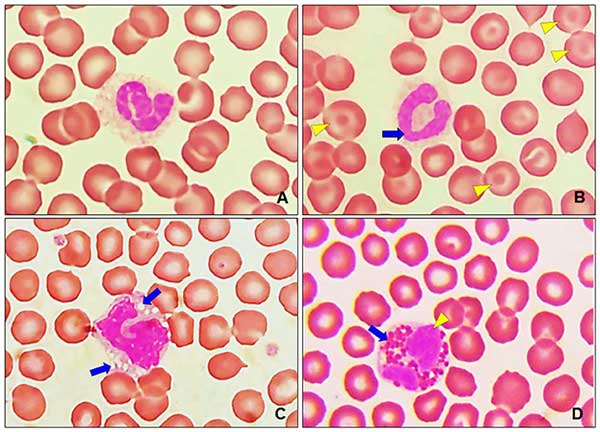
На илл. 7А можно рассмотреть морфологию сегментоядерного нейтрофила с разделённым ядром и цитоплазмой с лёгкой эозинофильной грануляцией, а на илл. 7В показан палочкоядерный нейтрофил с загнутым ядром с лёгкой перетяжкой, обратите внимание, что в цитоплазме есть лёгкая эозинофильная грануляция. Кроме того, на илл. 7С показана морфология моноцита с вакуолями и серо-голубой цитоплазмой с зубчатым ядром. Ядро моноцитов очень изменчиво и может быть круглым, зубчатым, монетообразным или почкообразным. Характерно присутствие вакуолей различного размера в цитоплазме. Также на илл. 7D представлены эозинофилы, с характерными красно-оранжевыми гранулами в бледно-голубой цитоплазме. В морфологии лейкоцитов и тробоцитов нарушений обнаружено не было.
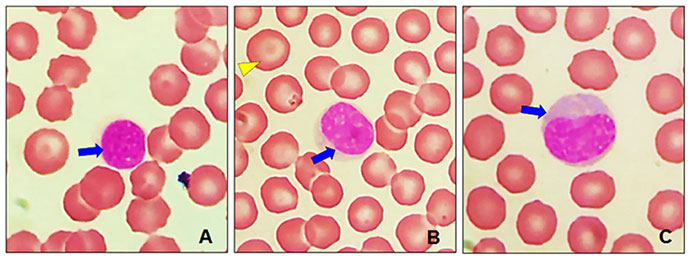
При световой микроскопии морфология лимфоцитов была оценена как нормальная. На илл. 8А показан малый лимфоцит, его ядро может быть круглым или овальным, иногда немного неровным и ярко окрашенным. Также на илл. 8В цитоплазма лимфоцита неплотная, светло-голубого цвета. На илл. 8С большой лимфоцит, его цитоплазма более плотная с базофилией, от лёгкой до умеренной.
Таблица 2. Частотный анализ параметров, оценённых в мазках крови собак (n = 129) разных возрастов: взрослые (n = 44), пожилые (n = 41) и гериатрические (n = 44)
Морфометрические параметры эритроцитов
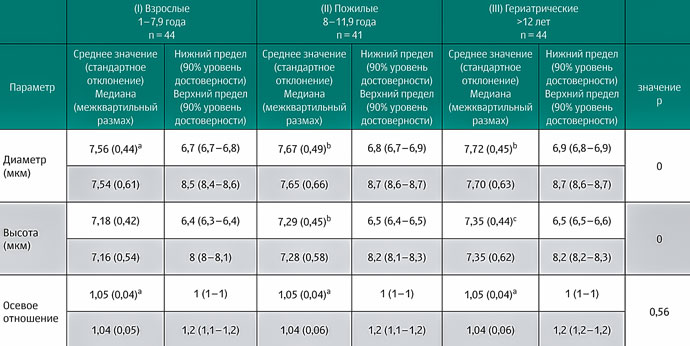
В таблице 3 показаны средние значения, стандартная девиация, медиана, интервал значений и достоверная разность с доверительным интервалом 95%; для каждого морфометрического параметра красных клеток крови нижний и верхний пределы были определены с доверительным интервалом 90%. Было оценено влияние возраста, пола, размера на параметры эритроцита (диаметр, высота и осевое отношение). Полученные статистические данные представлены в результатах: уровень достоверности (р), среднее значение (М) и стандартное отклонение (SD).
Таблица 3. Параметры красных клеток крови, измеренные с помощью световой микроскопии
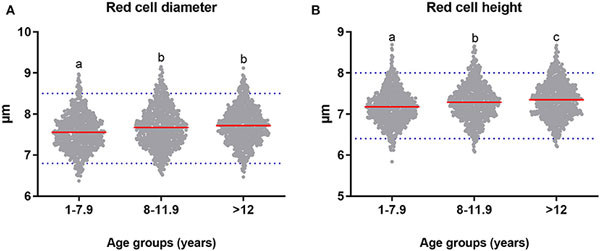
Возраст оказывал значительное влияние на диаметр (p = 0). Средний диаметр эритроцита у взрослых собак 1–7,9 года был 7,56 мкм (SD = 0,44), что было значительно меньше, чем диаметр эритроцита у пожилых (M = 7,67 мкм, SD = 0,49; p = 0,004) и гериатрических собак (M = 7,72 мкм, SD = 0,45; p = 0). Наше исследование показало, что диаметр эритроцита увеличивается с возрастом (илл. 9А). Значительного влияния пола (p = 0,069), размера (p = 0,512) и взаимосвязи между возрастом, полом и размером (p = 0,238) обнаружено не было.
Возраст значительно влиял на высоту эритроцита (p = 0). На илл. 9В показано, что высота эритроцита у взрослых собак (M = 7,18 мкм, SD = 0,42) была значительно меньше, чем у пожилых (M = 7,29 мкм, SD = 0,45; p = 0,002) и гериатрических собак (M = 7,35 мкм, SD = 0,44; p = 0). Более того, высота у пожилых собак была значительно меньше, чем у гериатрических собак (p = 0,027). Не было выявлено влияния пола (p = 0,867), размеров (p = 0,335) и взаимосвязи между возрастом, полом и размером (p = 0,414). Статистически значимого влияния возраста (p = 0,56), пола (p = 0,662), размера (p = 0,078) и взаимосвязи между возрастом, полом и размером на осевое отношение не выявлено.
Сканирующая электронная микроскопия
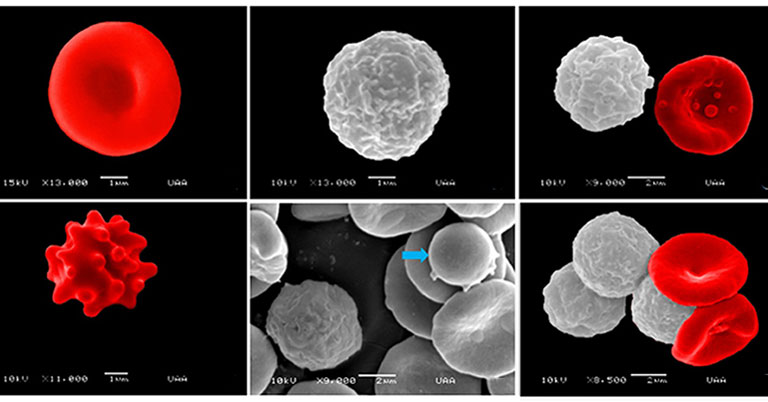
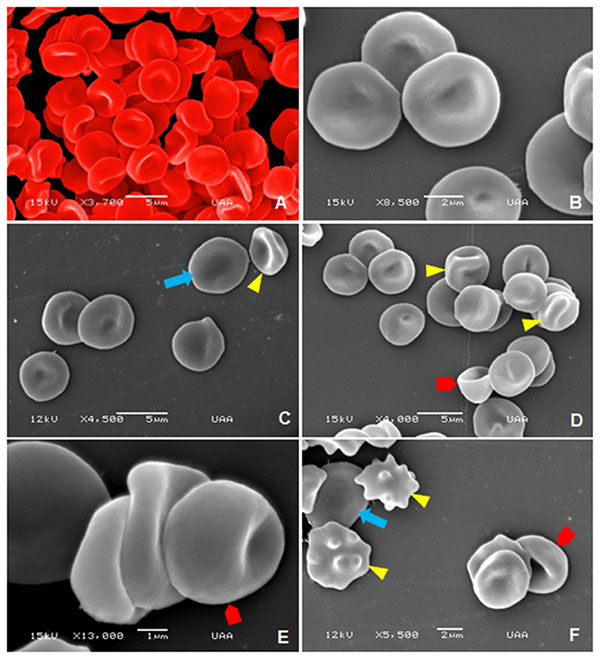
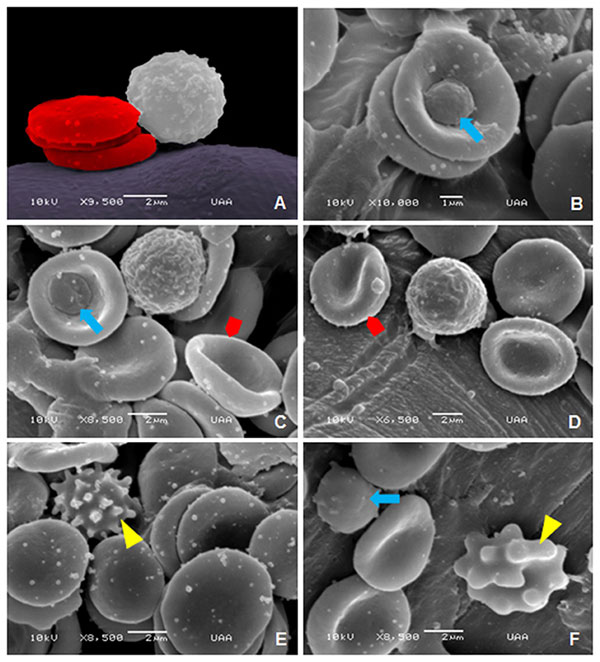
Представленные далее изображения были получены в результате сканирующей электронной микроскопии, они демонстрируют нормальную морфологию эритроцитов и лейкоцитов у взрослых, пожилых и гериатрических собак. Изображения клеток крови взрослых собак представлены на илл. 10. Наблюдается нормальная морфология эритроцитов с характерной гладкой вогнутой поверхностью (илл. 10А). На илл. 10В показана морфология гранулоцитов (нейтрофилов) с неровной поверхностью. Сравнить морфологию и размер лейкоцитов и эритроцитов можно на илл. 10С, D. Наблюдался пойкилоцитоз: были обнаружены эхиноциты, которые отличаются характерными выступами (илл. 10Е), более мелкие эритроциты, известные как сфероциты (илл. 10F), и кодоциты, красные клетки крови с плотным тёмным центром, окружённые бледным ореолом, вокруг которого лежит неровная тёмная полоса (илл. 10G, H).
Что касается пожилых собак, на илл. 11А, В представлена нормальная морфология эритроцитов. Отклонения в этой группе были представлены лептоцитами, это тонкие клетки, в основном большие в диаметре, обычно выглядят как гипо-хромные эритроциты с повышенным соотношением мембрана/объём (илл. 11C, F), книзоциты — зрелые эритроциты с тремя вогнутостями и двумя бледными областями, «клетки с защипами» (илл. 11С, D), стоматоциты — клетки с одной или двумя полостями — углублениями, похожими на рот (илл. 11D–F), и эхиноциты (илл. 11F).
Наконец, на илл. 12 показана нормальная морфология клеток крови гериатрических собак (илл. 12А, В). В дополнение показаны тромбоциты, прилепленные к эритроцитам (илл. 12В, С). В этой группе аномальные формы эритроцитов представлены стоматоцитами (илл. 12С, D), эхиноцитами (илл. 12Е) и сфероцитами (илл. 12F).
Обсуждение
При оценке методом световой микроскопии клеток эритроцитарного ряда по цвету и размеру наблюдались анизоцитоз и полихроматофилия. Это может быть вариантом нормы. В частности, полихроматофилия может быть в мазках, окрашенных по Райту, но количество должно быть < 1% [45]. Также полихромазия наблюдалась в основном у гериатрических собак в сочетании с макроцитами и эритробластами. При потере ядра красными клетками крови (эритробластами) образуются ретикулоциты, крупные клетки крови (макроциты) и полихроматофилы (голубое окрашивание) [46]. Полихроматофильные эритроциты — это ретикулоциты, которые окрашены синевато-красным цветом, так как содержат гемоглобин (красное окрашивание) и рибосомы (голубое окрашивание) [38]. Полихроматофилия умеренной степени является физиологичным явлением в ходе регенерации эритроцитов в костном мозге, которая обычно сопровождается большим количеством макроцитов. Они светло-пурпурные или фиолетовые из-за высокого содержания РНК, а когда концентрация РНК низкая, появляются пятнистые ретикулоциты [47].
На микрофотографиях, полученных при оптической и сканирующей электронной микроскопии, наблюдали пойкилоцитоз, представленный эхиноцитами, акантоцитами, кодоцитами, сфероцитами, стоматоцитами, дакриоцитами, четырёхлистными клетками, эллиптоцитами и лептоцитами. Наиболее часто встречаемые формы изменённых эритроцитов: акантоциты, кодоциты и дакриоциты. Это соответствует гематологическим данным для собак у других авторов [48]. Эхиноциты появляются при гломерулонефрите, уремии, лимфомах, алкалозе и после применения фуросемида и доксорубицина. Также они могут появляться как артефакты, если объём образца слишком мал в соотношении с количеством ЭДТА в пробирке [49; 50]. Акантоциты у собак появляются в основном при хронических заболеваниях печени, портосистемных шунтах, синдроме диссеминированного внутрисосудистого свёртывания (ДВС), новообразованиях и нефропатиях (гломерулонефрит) [51]. Кодоциты известны также как клетки-мишени. Они появляются в связи с повреждением печени, патологией почек, железодефицитной анемией, патологиями желчных протоков и селезёнки [37; 52; 53]. Сфероциты — мелкие клетки без зоны просветления в центре, характерны для врождённого сфероцитоза и аутоиммунной гемолитической анемии [54; 55]. Стоматоциты появляются в результате повреждения мембраны красных кровяных клеток при гемолитических и врождённых заболеваниях [56; 57]. Дакриоциты в основном появляются при миелопролиферативных нарушениях, гиперспленизме и гломерулонефрите. Они выглядят как каплевидные красные клетки крови из-за повреждения клеточной мембраны при прохождении через клетки плотного костного мозга или синусы селезёнки [46; 51]. Четырёхлистники — это клетки в форме креста, связанные с возрастом собак, как сообщалось в исследовании 2014 года [9]. Однако в этом исследовании наличие четырёхлистных эритроцитов не зависело от возраста.
Другое важное наблюдение — это присутствие эллиптоцитов и лептоцитов. Исследование, проведённое у людей с аутизмом и неаутистическими нарушениями формирования нервной системы и психических функций, в частности, выявило доминирование эллиптоцитов среди эритроцитов ненормальной формы. В то время как группа с неаутистическими расстройствами демонстрировала смешанные формы нарушения морфологи красных клеток крови, без доминирующих фенотипов форм эритроцитов, однако было отмечено небольшое преобладание лептоцитов [58]. Параллельно с недавними исследованиями в области поведения собак они также были предложены как модель для исследования нейропсихологических состояний у человека, включая заболевания аутистического спектра [24]. Эллиптоциты — это эритроциты эллиптической или овальной формы, они скорее плоские, чем двояковогнутые [38]. Врождённый эллиптоцитоз описан у собак как следствие мутации -спектрина [59]. Лептоциты — тонкие эритроциты с большим диаметром с повышенной площадью поверхности и нормальным объёмом клетки (например, клетки-мишени и крестовидные клетки), которые деформируются и дают розоватый оттенок жёлтой оболочке. Они обнаруживаются у хронически больных животных и при заболеваниях печени, обструктивной желтухе, регенеративной анемии и железодефицитной анемии. Лептоциты имеют тенденцию превращаться в книзоциты: эритроциты, вогнутые с трёх сторон (трёхгранные эритроциты), наблюдаемые при гемолитических анемиях у собак и людей [60].
В медицине человека морфологические изменения в клетках эритроцитарного ряда связаны с повышенным риском сердечно-сосудистых заболеваний [19]. Некоторые исследователи обнаружили, что при воспалительных состояниях в присутствии гидроксильных радикалов эритроциты теряют форму диска [61]. Некоторые недавние наблюдения, основанные на данных разных видов микроскопии, показали, что железо оказывает значительное влияние на морфологию и деформацию красных клеток крови [62]. Тем не менее, эти важные положения относятся к медицине человека, а информация об использовании сканирующей электронной микроскопии как диагностического инструмента в ветеринарной медицине ограничена из-за недоступности и стоимости метода.
Диаметр эритроцитов в этом исследовании оценивали по микрофотографиям, полученным при световой микроскопии. В результате средний диаметр эритроцита у взрослых собак составил 7,56 мкм и был меньше, чем диаметр эритроцита у возрастных (7,67 мкм) и гериатрических (7,72 мкм) собак. Эти результаты показали влияние возраста на диаметр эритроцита. Некоторые авторы сообщают, что диаметр эритроцитов собак варьируется от 6 до 8 мкм [45; 63]. Высота эритроцита также увеличивалась с возрастом (таблица 3). Эти результаты могут быть связаны с полихромазией, описанной в этом исследовании. Полихромазия, как было сказано выше, встречается примерно у 1% собак. Но более высокие значения могут быть признаком повышенного эритропоэза, кровопотери, гемолитической болезни или фазы ремиссии анемии [46]. Статистически значимых отличий в осевом отношении эритроцитов отмечено не было. Влияние пола, размера и их взаимосвязи (возраст, пол, размер) на диаметр, высоту и осевое отношение не выявлено. Другие авторы сообщали, что порода и возраст оказывают значительное влияние на морфометрию красных кровяных клеток [64; 65].
Заключение
Оценка морфологии и морфометрии эритроцитов имеет большое значение, особенно у возрастных собак, поскольку это, без сомнения, помогает постановке диагноза и прогнозу для пациентов во второй половине жизни. Световая микроскопия является хорошим методом исследования мазков крови, однако необходимо иметь в виду другие способы визуальных исследований. Некоторые заболевания человека могут встречаться у собак, поэтому последние могут быть использованы для дальнейших исследований морфологии и параметров красных клеток крови методами световой и сканирующей электронной микроскопии. Хорошо известно, что собака внесла свой вклад в некоторые достижения в прикладной медицине у людей. По этой причине данное исследование побуждает учёных как в области ветеринарии, так и в области медицины человека изучить другие диагностические инструменты, такие как сканирующая электронная микроскопия.
Несмотря на то, что в ветеринарной медицине метод не доступен в полной мере по экономическим причинам и из-за отсутствия навыка интерпретации результатов, сканирующая электронная микроскопия является полезным инструментом для определения морфологических отклонений в мембранах эритроцитов, которые могут быть признаками заболеваний, однако этот так как циркуляция крови происходит в трёхмерном пространстве, и именно так клетки выглядят при сканирующей электронной микроскопии, а при исследовании методом световой микроскопии клетки «расплющиваются» и меняют форму и размеры. Сканирующая электронная микроскопия показала своё значение для оценки морфологических изменений клеток у возрастных собак. Таким образом, это исследование положило основу для дальнейшего использования электронной микроскопии как диагностического метода в ветеринарной медицине, так как важно понимать влияние некоторых заболеваний и возраста на морфологию красных клеток крови. Это позволит специалистам объединять протоколы пациентов и вовремя выявлять заболевания, а также улучшать лечение.
Доступность данных
Оригинальные данные, полученные в этом исследовании, представлены в статье/дополнительном материале, остальную информацию можно запросить у ответственного автора: Alma Lilián Guerrero-Barrera, lilian.guerrero@edu.uaa.mx.
Этическое заключение
Для участия животных в исследовании от их владельцев было получено письменное информированное согласие. Исследование на животных было проверено и утверждено этическими правилами использования животных в научных и образовательных целях Независимого университета Агаускальентеса, код: DI-PL-NO-37.
Вклад авторов
AM-N и AG-B подали идею этого исследования, принимали участие в разработке дизайна, обеспечили координацию и помогли составить первичную рукопись. TQ-T, AV-F и MC-R внесли значительный вклад в концепцию, дизайн и анализ результатов. AM-N также выполнил лабораторные и статистический анализ. Все авторы участвовали в проверке рукописи и утвердили представленную версию.
Финансирование
Независимый университет Агаускальентеса утвердил и дал финансирование TQ-T (проект PIP/SA15–3) и AG-B (PIB19–3 и Especial Resource UAA Research), которое использовали для приобретения материалов и реагентов, необходимых для сбора и обработки образцов крови во время проведения этого исследования.
Благодарности
Благодарим биолога Araceli Adabache Ortíz, главу лаборатории сканирующей электронной микроскопии, за её личную помощь в получении микрофотографий эритроцитов с помощью электронной микроскопии. Благодарим также Sonia Sofía Cruz Muñoz из лаборатории гистологии и эмбриологии Независимого университета Агаускальентеса за её помощь в области техник окрашивания и презентации мазков крови. Также премного благодарим Juan Manuel Cruz Martinez, инженера, сертифицированного Lean Six Sigma Green Belt, за его большую помощь в статистическом анализе данных.
Конфликт интересов
Авторы заявляют, что исследование было проведено в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть расценены как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти по ссылке.
Литература
- Valenciano AC, Cowell RL, Rizzi TE. Introduction: blood smear preparation and examination. In: Valenciano AC, Cowell RL, Rizzi TE, Tyler R, editors. Atlas of Canine and Feline Peripheral Blood Smears. Mosby: St. Louis (2014). p. 2–21. doi: 10.1016/B978–0–323–04468–4.00001-X.
- Kulasekaran S, Sheeba F, Mammen JJ, Saivigneshu B. Morphology based detection of abnormal red blood cells in peripheral blood smear images. In: Goh J, editor. 7th WACBE World Congress on Bioengineering. Vol 52. Springer (2015). P. 57–60. doi: 10.1007/978–3–319–19452–3_16.
- Harvey JW. The erythrocyte: physiology, metabolism and biochemical disorders. In: Kaneko JJ, Harvey JW, editor. Clinical Biochemistry of Domestic Animals. 6th edition. San Diego, CA: Academic Press (2008). p. 173–240. doi: 10.1016/B978–0–12–370491–7.00007–6.
- Wahed A, Quesada A, Dasgupta A. Chapter 3 — red blood cell disorders. In: Wahed A, Quesada A, Dasgupta A, Second E, editors. Hematology and Coagulation. Amsterdam: Academic Press (2020). p. 31–50. doi: 10.1016/B978–0–12–814964–5.00003–6.
- Ford J. Red blood cell morphology. Int J Lab Hematol. (2013) 35:351–7. doi: 10.1111/ijlh.12082.
- Newman AW, Rishniw M, Behling-Kelly E. Reporting and interpreting red blood cell morphology: is there discordance between clinical pathologists and clinicians? Vet Clin Pathol. (2014) 43:487–95. doi: 10.1111/vcp.12202.
- Kumiega E, Michałek M, Kasztura M, Noszczyk-Nowak A. Analysis of red blood cell parameters in dogs with various stages of degenerative mitral valve disease. J Vet Res. (2020) 64:325–32. doi: 10.2478/jvetres-2020–0043.
- Maksimov GV, Mamaeva SN, Antonov SR, Munkhalova YA, Kononova IV, Sheikin IY. Measuring erythrocyte morphology by electron microscopy to diagnose hematuria. Meas Tech. (2016) 59:327–30. doi: 10.1007/s11018–016–0966–5.
- Gavazza A, Ricci M, Brettoni M, Gugliucci B, Pasquini A, Rispoli D, et al. Retrospective and prospective investigations about “quatrefoil” erythrocytes in canine blood smears. Vet Med Int. (2014) 2014:409573. doi: 10.1155/2014/409573.
- Strijkova-Kenderova V, Todinova S, Andreeva T, Bogdanova D, Langari A, Danailova A, et al. Morphometry and stiffness of red blood cells — signatures of neurodegenerative diseases and aging. Int J Mol Sci. (2022) 23:227. doi: 10.3390/ijms23010227.
- Metzger FL, Rebar AH. Clinical pathology interpretation in geriatric veterinary patients. Vet Clin North Am Small Anim Pract. (2012) 42:615. doi: 10.1016/j.cvsm.2012.04.004.
- Allison RW, Meinkoth JH. Hematology without the numbers: in-clinic blood film evaluation. Vet Clin North Am Small Anim Pract. (2007) 37:245. doi: 10.1016/j.cvsm.2006.10.002.
- Lanaux TM, Rozanski EA, Simoni RS, Price LL, Buckley GJ, Stockman C, et al. Interpretation of canine and feline blood smears by emergency room personnel. Vet Clin Pathol. (2011) 40:18–23. doi: 10.1111/j.1939–165X.2010.00280.x.
- Loyola-Leyva A, Loyola-Rodríguez JP, Terán Figueroa Y, González FJ, Atzori M, Barquera Cervera S. Altered erythrocyte morphology in Mexican adults with prediabetes and type 2 diabetes mellitus evaluated by scanning electron microscope. Microscopy. (2019) 68:261–70. doi: 10.1093/jmicro/dfz011.
- Loyola-Leyva A, Loyola-Rodríguez JP, Terán-Figueroa Y, González FJ, Atzori M, Camacho-Lopez S. Hypercholesterolemia associated with erythrocytes morphology assessed by scanning electron microscopy in metabolically unhealthy individuals with normal-weight and obesity. Obes Med. (2020) 20:100292. doi: 10.1016/j.obmed.2020.100292.
- Loyola-Leyva A, Alcántara-Quintana LE, Terán-Figueroa Y, González FJ. In vitro effect of high glucose concentrations on erythrocyte morphology assessed by scanning electron microscopy. Micron. (2022) 154:103179. doi: 10.1016/j.micron.2021.103179.
- Jin H, Xing X, Zhao H, Chen Y, Huang X, Ma S, et al. Detection of erythrocytes influenced by aging and type 2 diabetes using atomic force microscope. Biochem Biophys Res Commun. (2010) 391:1698–702. doi: 10.1016/j.bbrc.2009.12.133.
- Pretorius E, Bester J, Vermeulen N, Alummoottil S, Soma P, Buys AV, et al. Poorly controlled type 2 diabetes is accompanied by significant morphological and ultrastructural changes in both erythrocytes and in thrombin-generated fibrin: implications for diagnostics. Cardiovasc Diabetol. (2015) 14:30. doi: 10.1186/s12933–015–0192–5.
- Loyola-Leyva A, Loyola-Rodríguez JP, Atzori M, González FJ. Morphological changes in erythrocytes of people with type 2 diabetes mellitus evaluated with atomic force microscopy: a brief review. Micron. (2018) 105:11–7. doi: 10.1016/j.micron.2017.11.001.
- Greco DS. Chapter 37. Diabetes mellitus in animals: diagnosis and treatment of diabetes mellitus in dogs and cats. In: Bagchi D, Nair S, editors. Nutritional and Therapeutic Interventions for Diabetes and Metabolic Syndrome. London: Academic Press (2018). p. 507–17. doi: 10.1016/B978–0–12–812019–4.00037–4.
- Gates MC, Hinds HJ, Dale A. Preliminary description of aging cats and dogs presented to a New Zealand first-opinion veterinary clinic at end-of-life. N Z Vet J. (2017) 65:313–7. doi: 10.1080/00480169.2017.1360161.
- Mazzatenta A, Carluccio A, Robbe D, Giulio CD, Cellerino A. The companion dog as a unique translational model for aging. Semin Cell Dev Biol. (2017) 70:141–53. doi: 10.1016/j.semcdb.2017.08.024.
- Adin CA, Gilor C. The diabetic dog as a translational model for human islet transplantation. Yale J Biol Med. (2017) 90:509–15.
- Topál J, Román V, Turcsán B. The dog (Canis familiaris) as a translational model of autism: it is high time we move from promise to reality. Wiley Interdiscip Rev Cogn Sci. (2019) 10: e1495. doi: 10.1002/wcs.1495.
- Al-Anesi MA, Abu-Seida AM, El Ashry SH, Mahran AH, Abd-Elhamid ES. Influence of insulin on the healing of exposed dental pulp after pulp capping: an experimental study in a dog model. Spec Care Dentist. (2021) 41:49–59. doi: 10.1111/scd.12545.
- UAA. Regulations for the use of animals in teaching and research at the Autonomous University of Aguascalientes. Aguascalientes: University Legislation (2019) 1–11 p.
- Chew BH. Planning and conducting clinical research: the whole process. Cureus. (2019) 11: e4112. doi: 10.7759/cureus.4112.
- Radakovich LB, Pannone SC, Truelove MP, Olver CS, Santangelo KS. Hematology and biochemistry of aging-evidence of “anemia of the elderly” in old dogs. Vet Clin Pathol. (2017) 46:34–45. doi: 10.1111/vcp.12459.
- Willems A, Paepe D, Marynissen S, Smets P, Van de Maele I, Picavet P, et al. Results of screening of apparently healthy senior and geriatric dogs. J Vet Intern Med. (2017) 31:81–92. doi: 10.1111/jvim.14587.
- Friedrichs KR, Harr KE, Freeman KP, Szladovits B, Walton RM, Barnhart KF, et al. ASVCP reference interval guidelines: determination of de novo reference intervals in veterinary species and other related topics. Vet Clin Pathol. (2012) 41:441–53. doi: 10.1111/vcp.12006.
- Salvin HE, McGreevy PD, Sachdev PS, Valenzuela MJ. The canine cognitive dysfunction rating scale (CCDR): a data-driven and ecologically relevant assessment tool. Vet J. (2011) 188:331–6. doi: 10.1016/j.tvjl.2010.05.014.
- Bellows J, Colitz CM, Daristotle L, Ingram DK, Lepine A, Marks SL, et al. Defining healthy aging in older dogs and differentiating healthy aging from disease. J Am Vet Med Assoc. (2015) 246:77–89. doi: 10.2460/javma.246.1.77.
- Fortney WD. Implementing a successful senior/geriatric health care program for veterinarians, veterinary technicians, and office managers. Vet Clin North Am Small Anim Pract. (2012) 42:823. doi: 10.1016/j.cvsm.2012.04.011.
- Freeman L, Becvarova I, Cave N, MacKay C, Nguyen P, Rama B, et al. WSAVA nutritional assessment guidelines. J Small Anim Pract. (2011) 52:385–96. doi: 10.1111/j.1748–5827.2011.01079.x.
- Valenciano AC, Cowell RL. Diagnostic Cytology and Hematology of the Dog and Cat. Fifth edition. St. Louis, MO: Elsevier (2019) 438 p.
- Paltrinieri S, Bertazzolo W, Giordano A. Patologia Clinica Del Cane e Del Gatto. Milan: Elsevier-Masson (2010) 22–64 p.
- Thrall MA. Erythrocyte morphology. In: Thrall MA, Baker DC, Campbel TW,, editors. Veterinary Hematology and Clinical Chemistry. Ames, IA (2006). P. 69–82.
- Harvey JW. Veterinary Hematology: A Diagnostic Guide and Color Atlas. Vol. 54. St. Louis, MO: Elsevier (2012) 675 p.
- JEOL. Application Notes. Specimen Preparation Methods for Scanning Electron Microscopes. Mexico City: JEOL (2001) 1–22 p.
- Fischer ER, Hansen BT, Nair V, Hoyt FH, Dorward DW. Scanning electron microscopy. Curr Protoc Microbiol. (2012) 2:2B.2. doi: 10.1002/9780471729259.mc02b02s25.
- Khan, RM. Basic Statistics. In: Problem Solving and Data Analysis Using Minitab., Ed. Chichester: Wiley (2013). P. 50–70. doi: 10.1002/9781118307502.ch3.
- Lesik SA. Applied Statistical Inference With MINITAB®. Second edition. New York, NY: A Chapman and Hall/CRC Press (2018) p. 496. doi: 10.1201/9780429444951.
- Khan RM. Chapter 5 — analysis of variance. In: Problem Solving and Data Analysis Using Minitab. Chichester: John Wiley & Sons, Ltd (2013). p. 150–208. doi: 10.1002/9781118307502.ch5.
- Geffré A, Concordet D, Braun JP, Trumel C. Reference value advisor: a new freeware set of macroinstructions to calculate reference intervals with microsoft excel. Vet Clin Pathol. (2011) 40:107–12. doi: 10.1111/j.1939–165X.2011.00287.x.
- Rizzi TE, Meinkoth JH, Clinkenbeard KD. Normal hematology of the dog. In: Wardrop DJW, editor. Schalm’s Veterinary Hematology. Ames, IA: Wiley-Blackwell (2010). P. 799–810.
- Morales MJ. Veterinary Hemocytology Atlas. 2nd edition. Zaragoza: SERVET (2009) 4–94 p.
- Christian JA. Erythrokinetics and erythrocyte destruction. In: Weiss DJ,, editor. Schalm’s Veterinary Hematology. 6th edition. Ames, IA: Wiley-Blackwell. (2010). P. 136–43.
- Raiden GG, Robert FS, Joel PP, Jesús HA, Melanie CE, Willian AA, et al. Hallazgos hematológicos en perros y gatos en Lima, Perú. Rev Invest Vet. (2019) 30:1395–413. doi: 10.15381/rivep.v30i4.17154.
- Daleke DL. Regulation of transbilayer plasma membrane phospholipid asymmetry. J Lipid Res. (2003) 44:233–42. doi: 10.1194/jlr.R200019-JLR200.
- Stefanescu A, Vitalaru BA, Lippi I, Toader M. Alterations of echinocytes in dogs with acute renal injury undergoing hemodialysis. J Biotechnol. (2018) 280: S76. doi: 10.1016/j.jbiotec.2018.06.249.
- Barger AM. Erythrocyte morphology. In: Weiss DJ,, editor. Schalm’s Veterinary Hematology. 6th edition. Ames, IA: Wiley-Blackwell (2010). P. 144–51.
- Parachini-Winter C, Carioto LM, Gara-Boivin C. Retrospective evaluation of anemia and erythrocyte morphological anomalies in dogs with lymphoma or inflammatory bowel disease. J Am Vet Med Assoc. (2019) 254:487–95. doi: 10.2460/javma.254.4.487.
- Bexfield, N. Canine inflammatory liver disease. In: Bruyette DS, Bexfield N, Chretin JD, Kidd L, Kube S, Langston C, Owen TJ, Oyama MA, Peterson N, Reiter LV, Rozanski EA, Ruaux C, Wiley SM, editors. Clinical Small Animal Internal Medicine. Hoboken, NJ: Wiley Blackwell (2020). P. 695–704.
- Garden OA, Kidd L, Mexas AM, Chang YM, Jeffery U, Blois SL, et al. ACVIM consensus statement on the diagnosis of immune-mediated hemolytic anemia in dogs and cats. J Vet Intern Med. (2019) 33:313–34. doi: 10.1111/jvim.15441.
- Zoia A, Gerou-Ferriani M, Drigo M, Caldin M. Case-control study of plasma mean platelet component concentration and survival analysis for dogs with immune-mediated hemolytic anemia. J Am Vet Med Assoc. (2018) 252:1384–92. doi: 10.2460/javma.252.11.1384.
- Bonfanti U, Comazzi S, Paltrinieri S, Bertazzolo W. Stomatocytosis in 7 related standard schnauzers. Vet Clin Pathol. (2004) 33:234–9. doi: 10.1111/j.1939–165X.2004.tb00379.x.
- Kumar S. Short communication: trypanosomosis in dog — a case report. Explor Anim Med Res. (2017) 7:220–2. Available online at: https://www.animalmedicalresearch.org/Vol.7_Issue-2_December_2017/TRYPANOSOMOSIS%20IN%20DOG%20_%20A%20CASE%20REPORT.pdf.
- Ciccoli L, De Felice C, Paccagnini E, Leoncini S, Pecorelli A, Signorini C, et al. Erythrocyte shape abnormalities, membrane oxidative damage, and β-actin alterations: an unrecognized triad in classical autism. Mediators Inflamm. (2013) 2013:432616. doi: 10.1155/2013/432616.
- Di Terlizzi R, Gallagher PG, Mohandas N, Steiner LA, Dolce KS, Guo X, et al. Canine elliptocytosis due to a mutant β-spectrin. Vet Clin Pathol. (2009) 38:52–8. doi: 10.1111/j.1939–165X.2008.00092.x.
- Whalan JE. Hematology glossary. In: A Toxicologist’s Guide to Clinical Pathology in Animals. Heidelberg: Springer (2015). p. 109–43. doi: 10.1007/978–3–319–15853–2_8.
- Pretorius E. The adaptability of red blood cells. Cardiovasc Diabetol. (2013) 12:63. doi: 10.1186/1475–2840–12–63.
- Pretorius E, Kell DB. Diagnostic morphology: biophysical indicators for iron-driven inflammatory diseases. Integr Biol. (2014) 6:486–510. doi: 10.1039/C4IB00025K.
- Adili N, Melizi M, Belabbas H. Species determination using the red blood cells morphometry in domestic animals. Vet World. (2016) 9:960–3. doi: 10.14202/vetworld.2016.960–963.
- Brun-Hansen HC, Kampen AH, Lund A. Hematologic values in calves during the first 6 months of life. Vet Clin Pathol. (2006) 35:182–7. doi: 10.1111/j.1939–165X.2006.tb00111.x.
- Aniołek O, Barc A, Jarosińska A, Gajewski Z. Evaluation of frequency and intensity of asymptomatic anisocytosis in the Japanese dog breeds Shiba, Akita, and Hokkaido. Acta Vet Brno. (2017) 86:385–91. doi: 10.2754/avb201786040385.
Источник: Frontiers in Veterinary Science 9:998438. Copyright © 2022 Montoya-Navarrete, Guerrero-Barrera, Quezada-Tristán, Valdivia-Flores and Cano-Rábano. This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY).
СВМ № 3/2023
Вам также могут быть интересны статьи:
Мазок крови: возможности и ограничения при его анализе
Оксидативное повреждение эритроцитов: наиболее частые причины, патогенез, диагностика и терапия
Общеклинический анализ крови в ветеринарной дерматологии. Обзор