Elina Andersson1*, Anna Kendall1, Angelika Url2, Angelika Auer3 and Michael Leschnik4
1 Section of Pathology, Department of Biomedical Sciences and Veterinary Public Health, Faculty of Veterinary Medicine and Animal Science, Swedish University of Agricultural Sciences (SLU), Uppsala, Sweden.
2 Institute of Pathology, Department of Pathobiology, University of Veterinary Medicine, Vienna, Austria.
3 Institute of Virology, Department of Pathobiology, University of Veterinary Medicine, Vienna, Austria.
4 Small Animal Clinic, Department for Companion Animals, University of Veterinary Medicine, Vienna, Austria.
*Corresponding author: elina.andersson@slu.se
Аннотация
Введение. Клещевой энцефалит (КЭ) — это природно-очаговое инфекционное заболевание, вызываемое вирусом клещевого энцефалита (ВКЭ), который принадлежит к роду Flavivirus семейства Flaviviridae [1] и поражает нервную систему. Сероконверсия без клинических признаков заболевания — обычное явление у собак, и в большинстве ранее описанных случаев предварительный диагноз ставился при сочетании неврологических признаков с титрами сывороточных антител. Здесь сообщается о первом в Скандинавии клиническом случае КЭ у собаки, подтверждённом ОТ-ПЦР.
Разбор случая. У 4-летнего кастрированного самца породы лабрадор-пойнтер была диагностирована острая атаксия. Во время госпитализации у собаки развились судороги. Несмотря на агрессивное лечение стероидами, противомикробными препаратами и седацию/анестезию, в течение следующих 24 часов после госпитализации состояние продолжало ухудшаться, и собака была усыплена и отправлена на вскрытие. Патогистологические изменения в головном мозге соответствовали лимфоплазмоцитарному и гистиоцитарному менингоэнцефаломиелиту. Исследование головного мозга с помощью ОТ-КПЦР дало положительный результат на ВКЭ, что подтвердило наличие инфекции.
Выводы. Менингоэнцефаломиелит, вызванный вирусом клещевого энцефалита, должен рассматриваться при диагностике у собак с клиническими признаками заболевания центральной нервной системы, такими как атаксия с острым началом и судороги, в регионах, где клещи с положительным тестом на ВКЭ являются эндемическими. Клинически КЭ у собак может недооцениваться из-за отсутствия специальных тестов.
Сокращения: ОАК — общий/клинический анализ крови; ИПС — инфузия с постоянной скоростью; ЦРБ (англ. CRP) — С-реактивный белок; СМЖ (англ. CSF) — спинномозговая жидкость; ДАБ (англ. DAB) — 3’3-диаминобензидин; HRP — пероксидаза хрена; ИГХ (англ. IHC) — иммуногистохимия, иммуногистохимическое исследование; ПЦР — полимеразная цепная реакция; ОТ-ПЦР (англ. RT-PCR, reverse transcription polymerase chain reaction) — полимеразная цепная реакция с обратной транскрипцией; КЭ (англ. TBE) — клещевой энцефалит; ВКЭ (англ. TBEV) — вирус клещевого энцефалита.
Введение
Клещевой энцефалит (КЭ) — это природно-очаговое инфекционное заболевание с трансмиссивным механизмом передачи, вызываемое вирусом клещевого энцефалита (ВКЭ), который принадлежит к роду Flavivirus семейства Flaviviridae [1] и поражает центральную нервную систему. В Скандинавии природные очаги ВКЭ существуют в Швеции, Финляндии и некоторых частях Дании и Норвегии [1; 2], и он представляет серьёзную проблему для здоровья человека. В Европе с 2000 по 2010 год ежегодно регистрировалось около 3000 случаев заболевания людей КЭ [2]. В Швеции число случаев КЭ у людей увеличилось за последнее десятилетие [3], со 174 случаев в 2010 году до 358 в 2019 году, с соответствующей частотой 3,46 случаев на 100 000 жителей [3]. Самый высокий уровень заболеваемости отмечен в районе долины Меларен в лене Уппсала, в 2019 году он достиг частоты 9,12 на 100 000 жителей [3].
Европейский подтип ВКЭ передаётся главным образом клещом-переносчиком Ixodes ricinus, который активен с весны до осени [1; 4; 5; 6]. Это основной клещ-переносчик, ответственный за передачу болезни в Швеции [1; 7]. Ixodes persulcatus, переносчик дальневосточного и сибирского подтипа ВКЭ [1], был впервые обнаружен в Швеции в 2015 году [8]. Из 276 клещей Ixodes persulcatus, собранных в 2015–2016 годах, все были отрицательными на ВКЭ [9]. Распространённость ВКЭ в популяции шведского Ixodes ricinus варьируется в зависимости от исследования, стадии развития клеща и географического положения и составляет от 0,10 до 4,48 % [10].
У собак острое течение КЭ протекает монофазно с инкубационным периодом 5–9 дней [11; 12]. Клинические признаки включают лихорадку и неврологические нарушения, такие как изменение поведения и нарушение сознания, боль в шее, гиперестезию, проприоцептивную дисфункцию, парез, атаксию и судороги, а также поражение черепных и спинномозговых нервов [11; 12; 13]. При молниеносном и остром течении смерть наступает в течение недели [11]. Сообщается, что летальный исход наступает в 16–50 % клинических случаев КЭ у собак [12; 14; 15]. Основная патологоанатомическая находка включает лимфоплазмоцитарное и гистиоцитарное воспаление головного мозга, мозговых оболочек, ствола головного и спинного мозга [11; 13; 15; 16; 17]. У людей клинические симптомы и патологические изменения аналогичны таковым у собак, за исключением возможности двухфазного течения болезни [1; 18; 19; 20; 21].
Ранее сообщалось лишь о нескольких клинических случаях инфекции ВКЭ, наблюдавшихся у собак в Швейцарии, Австрии, Германии, Италии и Швеции [13; 22]. Первый задокументированный случай подозрения на КЭ у собаки в Швеции был зарегистрирован в 1960 году у 5-летней самки ирландского сеттера, у которой развились неврологические симптомы после укусов клещей на Стокгольмском архипелаге [23]. Ещё два случая были описаны в 2001 и 2007 годах соответственно [24; 25]. Все предыдущие случаи в Швеции были диагностированы лишь предварительно путём измерения титров антител в сыворотке [23; 24; 25]. Поскольку лихорадка и неврологические симптомы возникают у собак на ранних этапах течения болезни, реакция антител на инфекцию ВКЭ может не выявляться в сверхострых и острых случаях, когда смерть может наступить в течение недели [11; 12]. Кроме того, у собак часто встречается сероконверсия (появление в сыворотке крови больного или исчезновение из неё специфических антител) без клинических признаков [11; 13; 15; 26]. Поэтому повышение титра антител хотя и указывает в сочетании с неврологическими признаками на КЭ, не может служить для постановки окончательного диагноза.
Более надёжные методы диагностики КЭ in vivo включают исследование крови или спинномозговой жидкости (ЦСЖ) с помощью полимеразной цепной реакции (ПЦР) во время лихорадочной, виремической фазы [11; 27; 28]. Посмертно ПЦР может быть проведена на ткани мозга, а вирусный антиген может быть обнаружен с помощью иммуногистохимического исследования [11; 13; 16]. В нашем отчёте описан первый в Скандинавии подтверждённый полимеразной цепной реакцией с обратной транскрипцией (ОТ-ПЦР) случай клинического заболевания КЭ у собаки.
Разбор случая клещевого энцефалита
Четырёхлетний кастрированный самец собаки породы лабрадор-пойнтер весом 25 кг был госпитализирован в университетскую клинику для животных-компаньонов Шведского университета сельскохозяйственных наук в Уппсале в конце августа 2019 года из-за острой атаксии. За 24 часа до поступления у собаки была лёгкая заторможенность и ощущался лёгкий дискомфорт при пальпации грудного отдела позвоночника. Положительный ответ на лечение наблюдался после приёма одной дозы фирококсиба (4,5 мг/кг перорально.), а на следующее утро собака была бодрой и настороженной, но был отмечен одиночный эпизод лёгкой проприоцептивной недостаточности правой задней конечности. На протяжении дня состояние ухудшалось, а на следующий день проявилась атаксия всех четырёх конечностей, при этом сознание и аппетит остались в норме. Собака проживала в сельской местности в долине Меларен, где можно гулять по лесу, и в течение всего лета владелец обнаруживал и удалял отдельных присосавшихся клещей. Примерно за 3 месяца до поступления в клинику собаку обработали однократной дозой флураланера спот-он (Bravecto®, Intervet, Швеция).
При поступлении пациент находился в состоянии сильного стресса, у него была очевидная атаксия с лёгкой двусторонней гиперметрией передних конечностей. Функции черепных нервов в пределах нормы. Пальпация грудного отдела позвоночника вызвала умеренную болевую реакцию, при манипуляциях и пальпации шейного отдела позвоночника явной боли не было. Ректальная температура 39,1 °C. Аускультация сердца не могла быть проведена должным образом из-за тяжёлого дыхания. Слизистые оболочки были розовыми и влажными. Пальпация живота отклонений не выявила. Биохимия сыворотки показала нормальные уровни активности ферментов печени и креатинина. Общий анализ крови (ОАК) был в пределах нормы, но С-реактивный белок (СРБ) был слегка повышен и составлял 14,3 мг/л (референсный интервал 0–10 мг/л).
Собака была госпитализирована. Её состояние оставалось стабильным в течение ночи, мочеиспускание было нормальным, аппетит хорошим. Утром во время обычного забора крови (примерно через 15 часов после поступления) состояние пациента резко ухудшилось. Атаксия прогрессировала до такой степени, что стало ясно — собака не сможет лечиться в амбулаторных условиях. Дыхание превратилось в тяжёлую одышку, появились симптомы, указывающие на поражение лицевого нерва и ствола мозга (уродующая гримаса морды, оттянутые губы). Был отмечен опистотонус. Нормальные глазные рефлексы и зрачковый рефлекс на свет с обеих сторон всё ещё присутствовали. Болевая чувствительность и сгибательный рефлекс определялись на всех четырёх конечностях.
Седативный эффект достигался медетомидином (4 мкг/кг) и последующей инфузией медетомидина с постоянной скоростью (ИПС) в дозе 1 мкг/кг/ч. В связи с тем, что пациент был госпитализирован в выходные дни, когда доступ к лабораторным и другим диагностическим средствам был ограниченным, дополнительных обследований не проводилось. Поскольку имелось клиническое подозрение на менингоэнцефалит, было начато внутривенное введение преднизолона ацетата (2 мг/кг) и доктациллина (21 мг/кг). Несмотря на достаточно эффективный первоначальный ответ на седативную терапию, примерно через 2 часа после начала приёма медетомидина отмечена судорожная активность с лёгким движением передних конечностей. Мидазолам был добавлен к протоколу ИПС в дозе 0,17 мг/кг/ч, и доза ИПС медетомидина увеличена до
2 мкг/кг/ч. Несмотря на это, судороги не удалось купировать, и поэтому собаку перевели на ИПС пропофола в дозе 6 мг/кг/ч. В последующие часы дозу приходилось постепенно увеличивать. Несмотря на добавление ИПС мидазолама и увеличение ИПС пропофола до 30 мг/кг/ч, судороги не удалось контролировать. Ночью состояние собаки ухудшалось, характеризовалось плохой оксигенацией и периодическими эпизодами апноэ. Когда были предприняты попытки снизить ИПС пропофола, приступы повторились. Из-за продолжающегося ухудшения состояния собаку усыпили (примерно через 30 часов после поступления) и труп отправили на вскрытие.
На вскрытии: макроскопические результаты включали две двусторонние асимметричные области кровотечения в поверхностной коре лобной доли головного мозга, по одной в каждом полушарии, размером 0,5 см в диаметре. Мозг был диффузно перегружен и слегка отёчен. Других макроскопических находок не наблюдалось. Головной и спинной мозг фиксировали в 10% нейтральном забуференном формалине, по стандартной методике обрабатывали и окрашивали гематоксилин-эозином. Гистологически оценивали срезы лобного, теменного и височного конечного мозга, таламуса, гиппокампа, базальных ядер, среднего мозга, мозжечка и ствола мозга, а также шейного, грудного и поясничного отделов спинного мозга.
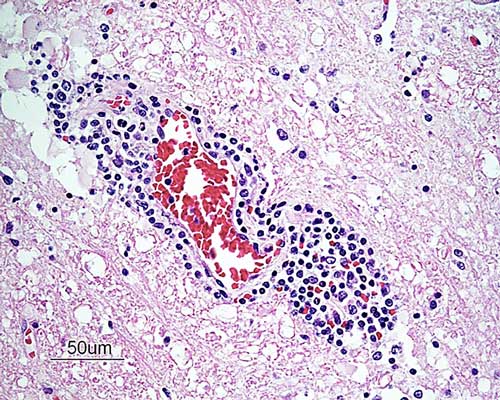 |
| Илл. 1. Периваскулярная манжета в стволе головного мозга, состоящая из лимфоцитов, плазматических клеток и гистиоцитов. Окраска гематоксилином и эозином. В отрезке: 50 мкм |
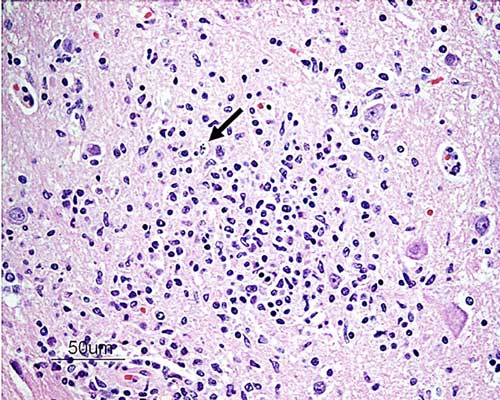 |
| Илл. 2. Область диффузного глиоза с некрозом единичных клеток (стрелка) в нейропаренхиме на уровне среднего мозга. Окраска гематоксилином и эозином. В отрезке: 50 мкм |
При микроскопическом исследовании все срезы головного и спинного мозга показали мультифокальные или сливающиеся воспалительные инфильтраты от умеренных до тяжёлых, состоящие из лимфоцитов, плазматических клеток и гистиоцитов, расположенных в нейропаренхиме и окружающих сосудах в виде периваскулярных манжет толщиной до 10 слоёв (илл. 1). В головном мозге воспаление наблюдалось как в белом, так и в сером веществе, в то время как в спинном мозге воспаление было более выражено в сером веществе как дорсальных, так и вентральных рогов. Наиболее серьёзные воспалительные изменения наблюдались в областях таламуса, среднего мозга, ствола головного мозга и всех сегментов спинного мозга. В нейропаренхиме головного и спинного мозга видны мультифокальные изменения от явно узловых до диффузного глиоза с некрозом одиночных клеток (илл. 2), а также дегенерация нейронов и микроглия, окружающая нейрональный дебрис (интерпретируется как нейронофагия) (илл. 3). Нейропаренхима разрежена от слабого до умеренного. Внутри лептоменингеального субарахноидального пространства и окружающих лептоменингеальных сосудов как в головном, так и в спинном мозге были мультифокальные сливающиеся инфильтраты от лёгкого до умеренного количества лимфоцитов, плазматических клеток и случайных гистиоцитов. Тела включений не обнаружены. Три среза головного мозга, представляющие средний мозг, мозжечок и ствол мозга, окрашенные по Гимзе, были без дополнительных находок. Патогистологические изменения соответствовали лимфоплазмоцитарному и гистиоцитарному менингоэнцефаломиелиту.
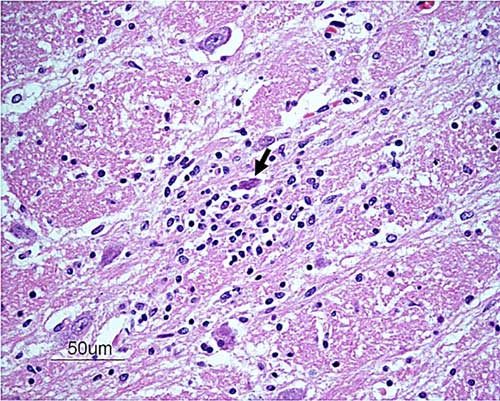 |
| Илл. 3. Омертвевший нейрон (стрелка), окружённый глиальными клетками (интерпретируется как нейронофагия), в таламусе. Окраска гематоксилином и эозином. В отрезке: 50 мкм |
Иммуногистохимическое исследование ткани головного мозга с использованием поликлональных кроличьих антител к ВКЭ (штамм Hochosterwitz, любезно предоставленный профессором K. Stiasny, Департамент вирусологии, MedUni, Вена, Австрия; разведение 1:500) проводилось в автостейнере (Lab Vision AS 360, Thermo Fisher Scientific, Waltham, MA, USA). Получение антигена проводили на депарафинизированных и регидратированных срезах путём переваривания проназой. Эндогенная пероксидазная активность блокировалась инкубацией в H2O2, в то время как уменьшение неспецифического фонового окрашивания достигалось применением УФ-протеинового блока (Thermo Scientific, Freemont, CA, USA). Для обнаружения первичных антител использовали вторичные поликлональные козьи антитела Anti-Rabbit IgG, конъюгированные с пероксидазой хрена (BrightVision Poly-HRP-Anti Rb, Immunologic, VB Duiven, NL) с последующей визуализацией с помощью ДАБ (DAB Quanto Substrate System, Thermo Scientific, Freemont, CA, USA). Впоследствии все срезы были контрастно окрашены гематоксилином, высушены и подготовлены для микроскопического исследования. Специфического окрашивания на КЭ на срезах не наблюдалось. Срезы мозга мыши с экспериментальным КЭ служили положительным контролем. Для отрицательного контроля первичное антитело было исключено.
Ткань мозга, залитая парафином, была отправлена на ОТ-ПЦР. Ткань депарафинизировали с использованием промывок ксилолом и этанолом, после чего переваривали с использованием буфера для лизиса ткани и протеиназы К (Qiagen, Hilden, Germany). Для экстракции нуклеиновой кислоты использовали 140 мкл лизата ткани с использованием набора QIAamp Viral RNA Mini QIAcube с использованием QIAcube (Qiagen) в соответствии с инструкциями производителя. ВКЭ-специфические последовательности были обнаружены с помощью ОТ-ПЦР, тест разработан Schwaiger et Cassinotti [27], с праймерами F-TBE 1: 5’-GGG CGG TTC TTG TTC TCC-3‘, R-TBE 1: 5’-ACA CAT CAC CTC CTT GTC AGA CT-3’ и КЭ-специфическим зондом TBE-Probe-WT: FAM-5’-TGA GCC ACC ATC ACC CAG ACA CA-3’-BHQ1 [27]. ОТ-ПЦР выполняли в реакционном объёме 20 мкл с использованием набора qScript One-Step RT-qPCR Kit (Quantabio, Beverly, MA, USA) в соответствии с рекомендациями производителя. Чтобы гарантировать достоверность анализов, были включены положительный и отрицательный контроли. ПЦР была положительной при пороговом числе циклов, равном 30, что подтвердило инфицирование ВКЭ.
Обсуждение и выводы
Исследование головного и спинного мозга в этом случае выявило лимфоплазмоцитарный и гистиоцитарный менингоэнцефаломиелит, вызванный инфекцией ВКЭ, что подтверждено ОТ-ПЦР. Альтернативный метод подтверждения клинической инфекции ВКЭ in vivo у собак включает ПЦР-исследование сыворотки или спинномозговой жидкости [11; 28]. Однако нуклеиновая кислота вируса клещевого энцефалита обнаруживается в сыворотке только во время начальной фазы виремии, которая может соответствовать периоду, когда клинические признаки ещё не проявились полностью [11; 28]. Кроме того, виремия не обязательно приводит к клиническому заболеванию, и в целом это может затруднить диагностику in vivo с помощью ПЦР образцов крови у собак.
В этом случае диагностическое исследование ткани головного мозга было выполнено посмертно, и положительный результат ОТ-ПЦР подтвердил инфицирование ВКЭ. Иммуногистохимическое исследование было отрицательным на ВКЭ, что, вероятно, связано с несколькими факторами. Этот метод обнаруживает антиген без размножения мишени и поэтому менее чувствителен, чем ПЦР, нацеленная на ДНК или РНК с последующей многократной амплификацией нуклеиновой кислоты. В свете порогового значения циклов ПЦР, равном 30, количество вирусного антигена также могло быть слишком низким для определения иммуногистохимическим методом. Кроме того, быстрый иммунологический клиренс вируса в головном мозге и спинномозговой жидкости мог вызвать ложноотрицательный иммуногистохимический результат [16; 29].
В этом случае тестирование на ВКЭ in vivo не проводилось из-за недостаточной осведомлённости о КЭ в качестве потенциального дифференциального диагноза. В свете увеличения заболеваемости ВКЭ у людей и расширения эндемичных территорий в течение последних десятилетий [2; 3] КЭ следует рассматривать как возможный дифференциальный диагноз для собак с неврологическими признаками.
Основной патологический признак в этом случае, включающий лимфоплазмоцитарное и гистиоцитарное воспаление головного и спинного мозга, отражает клинические признаки менингоэнцефаломиелита. Гистопатологическая картина неврального негнойного воспаления сама по себе неспецифична, но наводит на мысль о вирусной инфекции [17]. Многие из возможных гистопатологических дифференциальных диагнозов либо включают вирусные энцефалиты, которые в настоящее время не встречаются в Швеции, такие как лихорадка Западного Нила и бешенство, либо имеют признаки, которые не соответствуют клинической картине описанного случая. В дополнение к этому, гистопатологические данные соответствовали изменениям, наблюдаемым при ретроспективном патологоанатомическом исследовании ткани мозга восьми австрийских собак с клиническим КЭ, подтверждённым иммуногистохимическим анализом, за исключением отсутствия «глиального кустарника» в мозжечке (glial shrubbery — скопление клеток микроглии в молекулярном слое мозжечка в связи с дегенерацией клеток Пуркинье) [16]. Как в австрийском, так и в этом исследовании изменения включали лимфогистиоцитарный менингит, нейрональный некроз и нейронофагию, глиоз и негнойные периваскулярные манжеты в нейропаренхиме. В описанном случае наиболее серьёзные изменения наблюдались в таламусе, среднем мозге, стволе и спинном мозге, что хорошо согласуется с результатами, полученными в Австрии.
В заключение этот отчёт показывает, что менингоэнцефаломиелит, вызванный ВКЭ, должен рассматриваться как возможный дифференциальный диагноз у собак с клиническими признаками неврологического заболевания, такими как атаксия с острым началом и судороги, в районах, где клещи с положительным тестом на вирус клещевого энцефалита являются эндемичными [2; 3]. ПЦР-анализ крови или, предпочтительно, спинномозговой жидкости in vivo должен быть включён в работу с подозреваемыми случаями. Кроме того, следует повышать осведомлённость о том, что во время изменения климата и установления более тёплой погоды клещи могут быть активны в течение более длительных периодов [30; 31; 32], а в будущем в эндемичных по КЭ районах клинические случаи клещевого энцефалита у собак могут встречаться в течение большей части года.
Благодарности
Авторы выражают благодарность Vidar Andersson, Albin Norman и Peder Eriksson за отличную техническую поддержку.
Предыдущая публикация
Небольшая часть данной статьи была предоставлена для 2020–2021 Wednesday Slide Conference (WSC), организованной американской организацией Joint Pathology Center (JPC) Veterinary Pathology Services. Рукопись, представленная в Acta Veterinaria Scandinavica, значительно отличается от статьи, представленной в WSC.
Участие авторов
EA провела вскрытие трупа и оценила гистопатологию. AU и AA выполнили специальное диагностическое тестирование. EA, AK и ML подготовили рукопись. Все авторы прочитали и одобрили окончательный вариант статьи.
Финансирование
Финансовая поддержка Open access предоставлена Шведским университетом сельскохозяйственных наук.
Доступность данных и материалов
Подборки данных, использованные и/или проанализированные в ходе текущего исследования, доступны у ответственного за корреспонденцию автора по соответствующему запросу.
Одобрение этических норм и согласие на участие
Это исследование не требовало официального или институционального этического одобрения. С животными обращались в соответствии с высокими этическими стандартами и национальным законодательством.
Согласие на публикацию
Для публикации этого отчёта был получен контент от информированного владельца.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Литература
- Lindquist L, Vapalahti O. Tick-borne encephalitis. Lancet. 2008;371:1861-71.
- European Centre for Disease Prevention and Control: Epidemiological situation of tick-borne encephalitis in the European Union and European Free Trade Association countries. 2012 https://www.ecdc.europa.eu/sites/default/files/media/en/publications/Publications/TBE-in-EU-EFTA.pdf. Accessed 17 Mar 2020.
- Folkhälsomyndigheten: Tick-borne encephalitis. https://www.folkhalsomyndigheten.se/folkhalsorapportering-statistik/statistik-a-o/sjukdomsstatistik/tick-borne-encephalitis-tbe/?t=county. Accessed 22 Jul 2020.
- Nilsson A. Seasonal occurence of Ixodes ricius (Acari) in vegetation and on small mammals in Southern Sweden. Oikos. 1988;11:161-5.
- Mejlon HA, Jaenson TG. Seasonal prevalence of Borrelia burgdorferi in Ixodes ricinus in different vegetation types in Sweden. Scand J Infect Dis. 1993;25:449-56.
- Perret JL, Guigoz E, Rais O, Gern L. Influence of saturation deficit and temperature on Ixodes ricinus tick questing activity in a lyme borreliosis-endemic area (Switzerland). Parasitol Res. 2000;86:554–7.
- Jaenson TG, Tälleklint L, Lundqvist L, Olsen B, Chirico J, Mejlon H. Geographical distribution, host associations, and vector roles of ticks (Acari: Ixodidae, Argasidae) in Sweden. J Med Entomol. 1994;31:240–56.
- Jaenson TG, Värv K, Fröjdman I, Jääskeläinen A, Rundgren K, Versteirt V, et al. First evidence of established populations of the taiga tick Ixodes persulcatus (Acari: Ixodidae) in Sweden. Parasites Vectors. 2016;9:377.
- Jaenson TG, Wilhelmsson P. First records of tick-borne pathogens in populations of the taiga tick Ixodes persulcatus in Sweden. Parasites Vectors. 2019;12:559.
- Pettersson JH, Golovljova I, Vene S, Jaenson TG. Prevalence of tick-borne encephalitis virus in Ixodes ricinus ticks in northern Europe with particular reference to Southern Sweden. Parasites Vectors. 2014;7:102.
- Leschnik MW, Kirtz GC, Thalhammer JG. Tick-borne encephalitis (TBE) in dogs. Int J Med Microbiol. 2002;291:66–9.
- Leschnik MW, Benetka V, Url A, Pakozdy A, Thaller D, Bilek A, et al. Virale enzephalitiden beim hund in Österreich: diagnostische und epidemiologische aspekte. Wien Tierarztl Monatsschr. 2008;7–8:190–9.
- Pfeffer M, Dobler G. Tick-borne encephalitis virus in dogs — is this an issue? Parasites Vectors. 2011;4:59.
- Tipold A, Fatzer R, Holzmann H. Zentraleuropäische Zeckenenzephalitis beim Hund. Kleintierpraxis. 1993;38:619–28.
- Kirtz G. FSME-Infektion in einer Österreichischen Hunde-population. Wien: Diss Vet Med Univ; 1999.
- Weissenböck H, Suchy A, Holzmann H. Tick-borne encephalitis in dogs: neuropathological findings and distribution of antigen. Acta Neuropathol. 1998;95:361–6.
- Cantile C, Youssef S. Nervous System. In: Maxie MG, editor. Jubb, Kennedy and Palmer’s Pathology of Domestic Animals. Philadelphia: PA Saunders Elsevier; 2015. p. 250–406.
- Kaiser R. The clinical and epidemiological profile of tick-borne encephalitis in southern Germany 1994–98: a prospective study of 656 patients. Brain. 1999;122:2067–78.
- Kaiser R. Tick-borne encephalitis (TBE) in Germany and clinical course of the disease. Int J Med Microbiol. 2002;291:58–61.
- Günther G, Haglund M, Lindquist L, Forsgren M, Sköldenberg B. Tick-bone encephalitis in Sweden in relation to aseptic meningo-encephalitis of other etiology: a prospective study of clinical course and outcome. J Neurol. 1997;244:230–8.
- Gelpi E, Preusser M, Garzuly F, Holzmann H, Heinz FX, Budka H. Visualization of Central European tick-borne encephalitis infection in fatal human cases. J Neuropathol Exp Neurol. 2005;64:506–12.
- Weissenböck H, Holzmann H. Immunohistological diagnosis of tick-borne encephalitis in Austrian dogs. Wien Tierarztl Monatsschr. 1997;2:34–8.
- Lindblad G. Ett fall av fästingburen encephalit hos hund. Medlemsblad för Sveriges veterinärförbund. 1960;12:416–7.
- Ytterberg U, Bjöersdorff A. TBE hos hund — en fallbeskrivning. Svensk Vet Tidn. 2002;54:5–7.
- Åblad B. TBE hos en tvåårig hund i Västra Götaland. Svensk Vet Tidn. 2007;59:21–3.
- Leschnik M, Feiler A, Duscher GG, Joachim A. Effect of owner-controlled acaricidal treatment on tick infestation and immune response to tick-borne pathogens in naturally infested dogs from Eastern Austria. Parasites Vectors. 2013;6:62.
- Schwaiger M, Cassinotti P. Development of a quantitative real-time RT-PCR assay with internal control for the laboratory detection of tick borne encephalitis virus (TBEV) RNA. J Clin Virol. 2003;27:136–45.
- Hekrlová A, Kubíček O, Lány P, Rosenbergová K, Schánilec P. Tick-borne encephalitis in dogs: application of “nested real-time RT-PCR” for intravital virus detection. Berl Munch Tierarztl Wochenschr. 2015;128:397–401.
- Pfeffer M, Leschnik M. TBE in animals: disease, infection source, reservoir host, and sentinel for human infection risk. In: Dobler G, Erber W, Schmitt HJ, editors. Tick-borne encephalitis (TBE) — The book. Singapore: Global Health Press; 2018. p. 91–102.
- Lindgren E, Gustafson R. Tick-borne encephalitis in Sweden and climate change. Lancet. 2001;358:16–8.
- Gray JS. Ixodes ricinus seasonal activity: implications of global warming indicated by revisiting tick and weather data. Int J Med Microbiol. 2008;298:19–24.
- Daniel M, Danielová V, Fialová A, Malý M, Kříž B, Nuttall PA. Increased relative risk of tick-borne encephalitis in warmer weather. Front Cell Infect Microbiol. 2018;8:90.
Источник: Acta Veterinaria Scandinavica volume 62, Article number: 51 (2020). This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made.
СВМ № 4/2021
Вам также могут быть интересны публикации:
Менингит, вызванный Toxoplasma gondii