Аннотация. В статье описана успешная реконструкция обширного раневого дефекта лицевой части черепа с помощью лицевого аксиального лоскута. Также приведён разбор других возможных методик применения от иностранных авторов в ситуациях со схожими дефектами и их обсуждение.
Ключевые слова: пластическая хирургия, реконструкция, ветеринарная хирургия, лечение ран у животных, черепно-лицевая область, лицевой лоскут, собака, кошка.
Анамнез
Собака, нестерилизованная самка, 6 лет, вакцинированная, поступила в клинику с жалобой на хроническую незаживающую рану на дорсальной поверхности морды. Ранее собака попала на попечительство зооволонтёрам. Через месяц была проведена реконструктивно-восстановительная операция по закрытию данной раны аксиальным лоскутом на правой околоушной артерии в сторонней клинике. В течение недели развился некроз 2/3 лоскута. Был выполнен бактериологический посев содержимого раны, который выявил Escherichia coli 103 KOE/тамп. По результату бактериологического исследования пациенту был назначен амоксициллина клавуланат 25 мг/кг 2 р/день длительно.
Клинический осмотр и диагностика
В клинику «Биоконтроль» собака поступила спустя месяц после операции. Общее состояние пациента на момент осмотра было удовлетворительным. Аппетит, жажда и естественные отправления в норме. При осмотре головы визуализировался обширный раневой дефект на дорсолатеральной поверхности морды, неправильной формы, имеющий сообщение с ротовой полостью билатерально (илл. 1 и 2). Часть щёк и значительная часть носовых костей отсутствовали. Носовая полость открыта: визуализируются частично разрушенные дорсальный и средний носовые ходы, гиперплазированная и местами фиброзированная слизистая оболочка.
  |
| Илл. 1 и 2. Состояние после санации раны |
Частично рана была покрыта зрелой грануляционной тканью. Раневые карманы и экссудация отсутствовали. Донорская зона от предыдущей операции без особенностей.
Из сопутствующих заболеваний были выявлены опухоли молочных желёз.
Узнать, как именно возник такой дефект, достаточно сложно, и одной из причин мог быть онкологический процесс. Для его исключения была проведена компьютерная томография и взята инцизионная биопсия мягких тканей из нескольких мест раневого ложа. Отдельно была получена консультация онколога по вопросу опухолей молочных желёз и выполнены УЗИ брюшной полости и рентген грудной клетки для исключения метастазирования.
По результату цитологического исследования раневого ложа было выявлено нейтрофильное бактериальное воспаление, лимфоплазмоцитарное воспаление. В данном материале не было обнаружено достоверных данных за опухолевый рост, в том числе и трансмиссивную венерическую саркому, которая могла быть этиологическим фактором. Признаки атипии в эпителиальных клетках, выявленные во время исследования, были, более вероятно, вторичны на фоне длительного воспаления.
На гистологическое исследование было отправлено несколько образцов тканей: биоптат с кожно-слизистым переходом, из носовой полости и грануляционной ткани. Дополнительно была проведена окраска PAS (ШИК), с целью исключить грибковую микрофлору.
По результату гистологического исследования были получены следующие результаты:
— кожа с волосами: умеренный хронический лимфоплазмоцитарный и нейтрофильный дерматит с умеренным-тяжёлым фиброзом;
— более вероятно, слизистая: умеренное хроническое лимфоплазмоцитарное, нейтрофильное и эрозивное воспаление с умеренным фиброзом;
— носовая полость: тяжёлый хронический активный лимфоплазмоцитарный и нейтрофильный ринит с реактивной костью;
— ШИК-реакция не показала наличие грибковой флоры.
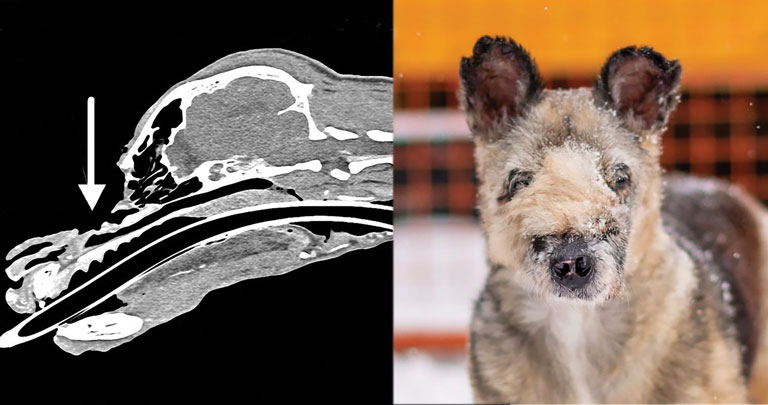
По КТ были оценены основные структуры головы: костные структуры, носовая полость, пазухи, среднее и внутреннее ухо, глазные яблоки, зубы, лимфатические узлы и др. По результатам исследования, помимо картины обширного дефекта мягких тканей и костных структур лицевой части головы, были выявлены признаки вторичного левостороннего ринита и нижнечелюстной лимфаденопатии справа. Одномоментно в анестезии были проведены первые замеры дефекта и намечены предполагаемые варианты закрытия раны (илл. 3, 4).
  |
| Илл. 3 и 4. КТ-картина раневого дефекта |
Лечение
В первую очередь пациент был прооперирован по поводу новообразований молочных желёз, послеоперационная гистология выявила смешанные аденомы молочных желёз. Также был назначен преднизолон 1 мг/кг внутрь один раз в день на 7 дней по поводу лимфоплазмоцитарного ринита, далее доза была снижена до 0,5 мг/кг в день, общая длительность курса составила 2 месяца. Реконструктивная операция была проведена через 2 месяца после первичного приёма и диагностики пациента.
В данном случае были возможны несколько вариантов закрытия дефекта. Выбрана была комбинация аксиального лоскута на лицевой артерии и остатков мягких тканей культи от лоскута на каудальной околоушной артерии (илл. 5). Возможность использовать два лицевых лоскута билатерально отсутствовала, из-за повреждения ветвей лицевой артерии со стороны предыдущей операции.
Культя и брыли были использованы для закрытия дефекта с правой стороны до границ спинки носа, а лицевой аксиальный лоскут для области спинки носа и левой стороны верхней челюсти.
 |
| Илл. 5. Фото разметки лоскута перед операцией |
Операция
Во время операции пациент находился в положении лёжа на животе с валиком под шеей. Первоочерёдно были установлены интраназальные трубки (илл. 6) в сохранившиеся носовые ходы. Операция с мягкими тканями началась с отделения слизистого края брылей от кожи и обновления края раны со стороны культи лоскута от предыдущей операции. Далее сшивались слизистая брылей с визуально здоровыми остатками слизистой оболочки ротовой полости со стороны верхней челюсти. Оставшийся дефект между брылями и дёснами был закрыт путём наложения костно-слизистых швов. Предварительно в носовых костях были просверлены каналы. Далее тканями культи лоскута от предыдущей операции был закрыт максимально возможный объём дефекта. Следующим этапом был выполнен окаймляющий разрез тканей аксиального лоскута и диссекция его от подлежащих тканей (илл. 7). После транспозиции лоскута в реципиентную зону края лоскута были фиксированы к краям раневого дефекта с полным покрытием оставшейся части раны.
 |
| Илл. 6. Установка назальных трубок |
 |
| Илл. 7. Выделение лоскута |
В итоге после ушивания в реципиентной зоне образовалось незначительное натяжение в ростральной части раны. Однако этот факт никак не повлиял на дальнейшее заживление. Перед закрытием донорской зоны был установлен вакуумный дренаж. Все покровные ткани были ушиты минимум в два слоя. Дополнительно была установлена эзофагостома.
Продолжительность операции составила 3,5 часа.
Анестезиологическое сопровождение
Предоперационное обследование не выявило у пациента серьёзных хронических заболеваний, но так как предполагалось, что оперативное вмешательство займёт более 1,5 часа, степень анестезиологического риска оценивалась по шкале ASA-VITAR–III.
В премедикацию были использованы следующие препараты: дексмедетомедин 70 мкг в/м, амоксиклав 15 мг/кг. Для индукции пациента были выбраны препараты: тилетамин/золазепам 1 мг/кг, пропофол 2 мг/кг. В качестве регионарной анестезии была выполнена блокада верхнечелюстного нерва препаратом ропивакаин 10 мг. В качестве поддерживающей анестезии использовалось: ИПС тилетамин/золазепам 1 мг/кг/ч, изофлюран 1,5–2%. Инфузионная терапия: раствор Рингера 4 мл/кг/час.
На протяжении всего анестезиологического сопровождения проводился мониторинг: ЭКГ, неинвазивная тонометрия, сатурация, капнография, термометрия. Течение анестезии гладкое, без осложнений, с сохранением спонтанного дыхания пациента.
В ранний послеоперационный период использовалась мультимодальная анальгезия: лидокаин 40 мкг/кг/мин, дексмедетомедин 0,5 мкг/кг/час, анальгин 20 мг/кг каждые 8 часов, трамадол 4 мг/кг каждые 8 часов.
НПВС не использовались в схеме анальгезии, так как пациент получал кортикостероиды по поводу лимфоплазмоцитарного ринита.
 |
| Илл. 8, 9. Фото после операции |
 |
Послеоперационный период
Пациент находился в отделении интенсивной терапии в течение ночи после операции, далее проводилось лечение в условиях стационара ещё 10 дней.
В послеоперационный период наблюдались следующие осложнения: умеренный отёк тканей лоскутов, серозные выделения по назальным трубкам, подкожная эмфизема с распространением в область лба и шеи. Для борьбы с подкожной эмфиземой использовалась повязка из сетчатого бинта, что не приводило к значительному улучшению. Проблема была решена после установки пассивного дренажа под область лоскута, что обеспечило отток воздуха, и эмфизема постепенно разрешилась в течение двух недель.
Назальные трубки и вакуумный дренаж были сняты на седьмые сутки после операции. Воздухопоток в обоих носовых ходах был сохранён. На седьмые сутки было проведено пробное кормление через рот и удаление эзофагостомической трубки. Через 10 дней после операции пациент был выписан в удовлетворительном состоянии.
 |
 |
| Илл. 10. Фото лоскута на следующий день после операции | Илл. 11. Фото через 3 месяца после операции |
Обсуждение
Для лечения таких сложных дефектов требуется достаточно точное планирование операции [1]. В данном случае на выбор метода реконструкции, помимо локализации и размеров дефекта, повлиял факт ранее проведённой попытки реконструкции раны лоскутом на каудальной околоушной артерии (caudal auricular axial pattern flap) [13–16].
Методом выбора у этого пациента был лицевой аксиальный лоскут (facial axial pattern flap) [2–6]. Это одноэтапный вариант реконструкции, наиболее близко расположенный к ране, не исключающий возможность проведения запасных методов (например, применение лоскута на каудальной околоушной артерии или лоскута на поверхностной височной артерии). Входящая в состав лоскута артерия угла рта обеспечивает отличное питание лоскуту, что даёт хорошие шансы на приживление. Эстетический и функциональный результат у данного пациента оценивался как хороший, а общий период наблюдения после операции составил 2 года.
Другим возможным методом закрытия данного дефекта был аксиальный лоскут на поверхностной височной артерии [11–12], но объём данного лоскута смог бы покрыть дефект лишь частично. Однако Ciou MJ и Yeh LS в своей публикации описали методику трубчатого лоскута на поверхностных височных артериях [9]. В этой статье авторы предложили при помощи многоэтапного метода увеличить длину аксиального лоскута. Первым этапом выполнялся трубчатый лоскут с двумя питающими ножками от правой и левой поверхностных височных артерий. Далее, через 7 и 14 дней, одно из оснований лоскута с питающей артерией пересекались (сначала половина основания, а вторая половина ещё через 7 дней) без перемещения лоскута, а ткани лоскута пришивались на то же место. Это позволило нарастить сосудистую сеть от противоположной поверхностной височной артерии. Последним этапом выполнялась реконструкция дефекта таким «удлинённым» лоскутом. Эстетический и функциональный результат был удовлетворительный. Но основным минусом данной методики является многоэтапность и длительность. Поэтому рассматривать такой вариант реконструкции стоит в случае невозможности выполнения одноэтапных методов.
Ещё одна альтернативная методика, которая могла бы успешно закрыть данный дефект — микроваскулярный лоскут [7; 8]. В качестве подходящего участка могут выступать любые участки кожи с крупным аксиальным сосудом. В одной из статей (Liu, Chi-Hsin et al., 2017) хирурги восстановили участок верхней губы после неудачной пластики щёчным лоскутом у собаки с помощью микрососудистого лоскута [10]. Лоскут включал в себя небольшой участок препуция со слизистой оболочкой и кожей, а питающим сосудом являлась каудальная поверхностная надчревная артерия и вена. Сосудистый анастомоз соединял эти сосуды с подъязычной артерией и веной. Хотя, по нашему мнению, дефект, представленный в статье, мог быть закрыт аксиальным лоскутом на лицевой артерии, описанный опыт весьма интересен с точки зрения альтернативы. Для успешного применения такого метода необходимы навыки выполнения сосудистых анастомозов и увеличительная оптика.
Несмотря на возможность выполнения альтернативных методик закрытия дефектов лицевой части черепа, следует быть максимально объективным при выборе варианта реконструкции. Если адекватного закрытия раны можно достичь простым, одноэтапным и минимально травматичным способом, то не стоит стремиться к выполнению более сложных реконструктивных техник.
Благодарности
Мы искренне благодарим всех врачей и ассистентов ветеринарной клиники «Биоконтроль», которые приняли участие в лечении данного пациента. А также А. В. Трубаченкову и А. А. Газина за консультацию по цитологическому и гистологическому исследованию, Е. С. Удалову за консультацию по КТ.
Отдельное спасибо Ксении Лавровой за консультацию при планировании операции.
Информация об авторах
И. А. Смирнов — ветеринарный врач, хирург ветеринарной клиники «Биоконтроль».
И. М. Борисовская — ветеринарный врач, хирург ветеринарной клиники «АлисаВет».
П. А. Анисимова — ветеринарный врач, анестезиолог-реаниматолог ветеринарной клиники «Биоконтроль».
Е. С. Стогова — ветеринарный врач, реабилитолог ветеринарной клиники «Биоконтроль».
Н. Ю. Зазвонова — ветеринарный врач, реабилитолог ветеринарной клиники «Биоконтроль».
Литература
- Guzu M, Rossetti D, Hennet PR. Locoregional Flap Reconstruction Following Oromaxillofacial Oncologic Surgery in Dogs and Cats: A Review and Decisional Algorithm. Front Vet Sci. 2021 May 21;8:685036. doi: 10.3389/fvets.2021.685036. PMID: 34095284; PMCID: PMC8175653.
- Frasson MT, Freitag FAV, Huppes RR, Pazzini JM, Nardi AB de, Castro JLC, et al. Use of the angularis oris axial pattern buccal flap for the correction of facial defects in six dogs. Acta Sci Vet. (2020) 48:1–6. doi: 10.22456/1679-9216.100541.
- Milgram J, Weiser M, Kelmer E, Benzioni H. Axial pattern flap based on a cutaneous branch of the facial artery in cats. Vet Surg. (2011) 40:347–51. doi: 10.1111/j.1532-950X.2011.00803.x.
- Bradford M, Degner D, Bhandal J. Use of the angularis oris cutaneous flap for repair of a rostral mandibular skin defect in a cat. Vet Comp Orthopaed Traumatol. (2011) 24:303–6. doi: 10.3415/VCOT-10-09-0129.
- Yates G, Landon B, Edwards G. Investigation and clinical application of a novel axial pattern flap for nasal and facial reconstruction in the dog. Aust Vet J. (2007) 85:113–8. doi: 10.1111/j.1751-0813.2007.00111.x.
- Losinski SL, Stanley BJ, Schallberger SP, Nelson LL, Towle Millard HA. Versatility of the angularis oris axial pattern flap for facial reconstruction. Vet Surg. (2015) 44:930–8. doi: 10.1111/vsu. 12408.
- Pavletic,M.M. DVM. Atlas of Small Animal Wound Management and Reconstructive Surgery, Third Edition, 2010.
- Jolle Kirpensteijn, Gert ter Haar, Reconstructive surgery and wound management of the dog and cat. Manson Publishing/The Veterinary Press; 2013.
- Ciou MJ, Yeh LS. «Reconstruction of a large nasal-facial defect using an augmented temporal myocutaneous tube flap in a dog». Vet Med Sci. 2021 Sep;7(5):1524–1529. doi: 10.1002/vms3.548. Epub 2021 Jun 15. PMID: 34132065; PMCID: PMC8464263.
- Liu, Chi-Hsin; Yeh, Lih-Seng (2017). A vascularized preputial free flap for labial reconstruction in a dog. Veterinary Surgery, Volume 46, Issue 8. P. 1116–1119. doi:10.1111/vsu.12694.
- Fahie MA, Smith BJ, Ballard JB, Moon ML, Smith MM. Regional peripheral vascular supply based on the superficial temporal artery in dogs and cats. Anatomia Histol Embryol. (1998) 27:205–8. doi: 10.1111/j.1439-0264.1998.tb00181.x.
- Fahie MA, Smith MM. Axial pattern flap based on the cutaneous branch of the superficial temporal artery in dogs: an experimental study and case report. Vet Surg. (1999) 28:141–7. doi: 10.1053/jvet.1999.0141.
- Proot JLJ, Jeffery N, Culp WTN, Buracco P, Puerta B de la, Williams JM, et al. Is the caudal auricular axial pattern flap robust? A multi-centre cohort study of 16 dogs and 12 cats. (2005 to 2016). J Small Anim Pract. (2019) 60:102–106. doi: 10.1111/jsap.12946.
- Smith M, Payne J, Moon M, Freeman L. Axial pattern flap based on the caudal auricular artery in dogs. Am J Vet Res. (1991) 52:922–5.
- Magno SD, Giuseppe P, Pisani G, Morello E, Piras LA, Buracco P, et al. Caudal auricular axial pattern flap for the reconstruction of the upper eyelid in three cats. J Am Anim Hosp Assoc. (2020) 56:236–41. doi: 10.5326/JAAHA-MS-6987.
- Stiles J, TownsendW,WillisM,Moore PA, Smith E. Use of a caudal auricular axial pattern flap in three cats and one dog following orbital exenteration. Vet Ophtalmol. (2003) 6:121–6. doi: 10.1046/j.1463-5224.2003.00275.x.
СВМ № 4/2023
Вас также могут заинтересовать статьи:
Реверсивный лоскут на артерии Сафена у 13 собак