У кошек опухоли тучных клеток, мастоцитомы, одно из наиболее часто встречающихся новообразований. В этом обзоре рассмотрены только тучноклеточные опухоли кожи.
Биология тучных клеток
Тучные клетки (ТК; англ. mast cells, MC) являются гемопоэтическими клетками и происходят из мультипотентных гемопоэтических стволовых клеток, предшественники которых мигрируют в кровь, попадают в соединительную ткань и слизистые, где уже дифференцируются в зрелые мастоциты. Тучные клетки находятся практически во всех тканях. Наибольшее их количество встречается в тканях, контактирующих с окружающей средой: коже, лёгких, желудочно-кишечном тракте, слизистых. У разных видов тучные клетки могут различаются по своему химическому составу и функциям. ТК участвуют во многих иммунных реакциях, включая немедленные и хронические аллергические реакции, реакции на паразитов, яды, вирусы, бактерии, участвуют в заживлении ран, ангиогенезе, онкологических процессах. Также тучные клетки представляют собой источник активных биологических веществ, факторов роста, цитокинов. При определённых стимулах тучные клетки дегранулируются, высвобождая различные медиаторы (гепарин, гистамин и серотонин, протеогликаны и протеазы). Тучные клетки подразделяют в зависимости от локализации на два типа: «тучные клетки слизистой оболочки» (ТКСО; англ. MMC) и «тучные клетки соединительной ткани» (ТКСТ; англ. CTMC). Тучные клетки кожи представляют собой тучные клетки соединительной ткани (ТКСТ; CTMC).
Тучноклеточные опухоли кошек
У кошек опухоли тучных клеток одно из наиболее часто встречающихся новообразований, которые возникают в коже, селезёнке, желудочно-кишечном тракте, слизистых оболочках, подкожных тканях, в зависимости от локализации клиническое течение, клеточная морфология и биологическое поведение будут варьировать. В этом обзоре мы рассмотрим только тучноклеточные опухоли кожи.
Мастоцитомы кожи одно из самых частых новообразований кожи у кошек и занимают второе место по частоте встречаемости [5]. На их долю приходится около 21% [4; 5]. В большинстве случаев данный тип новообразований имеет доброкачественное течение, процент развития метастатической болезни примерно в 22% (Carpenter et al., 1987) [27]. Но также существуют более агрессивные формы — плеоморфные, которые имеют высокий метастатический потенциал, более высокий риск местного рецидива и неблагоприятного прогноза.
Клиническая картина
Средний возраст возникновения тучноклеточных образований у кошек около 10 лет, самые частые локализации — голова и туловище. По нескольким ранним публикациям предполагается породная предрасположенность сиамских кошек. Половая предрасположенность отсутствует.
Морфологически тучноклеточные опухоли разделяют на мастоцитарный и атипичный, или гистиоцитарный типы.
Мастоцитарный тип — наиболее часто возникающий тип новообразований кожи у кошек. Средний возраст 8–9 лет (зарегистрированный диапазон 2–15 лет). Его в свою очередь разделяют на хорошо дифференцированные и плеоморфные (плохо дифференцированные / анапластические).
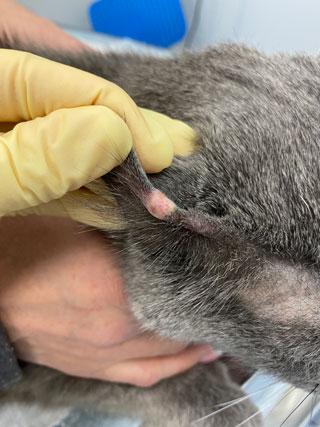
Хорошо дифференцированные мастоцитомы обычно ведут себя доброкачественно. Клинически выглядят как одиночные небольшие образования, часто безволосые, розового или белого цвета, которые могут изъязвляться (илл. 1, 2). Примерно в 12–20% случаев кожные мастоцитомы будут множественными.
 |
 |
| Илл. 1 | Илл. 2 |
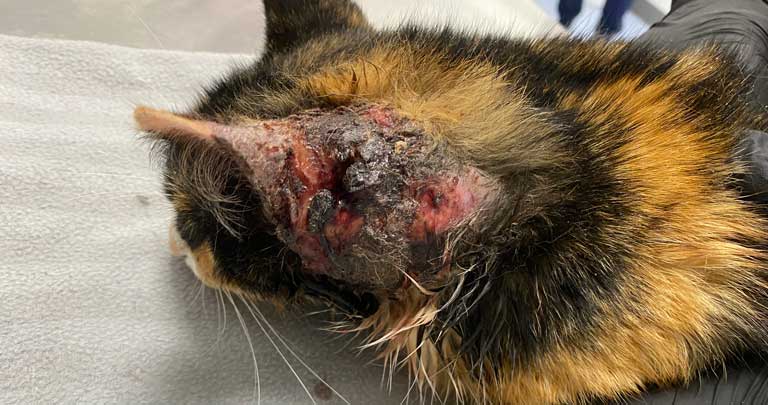
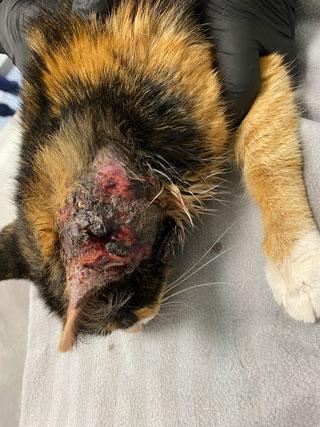
Плеоморфные (ранее плохо дифференцированные) типы тучноклеточных опухолей в большинстве случаев ведут себя доброкачественно, но могут иметь более агрессивное поведение, метастазировать в регионарные лимфатические узлы, селезёнку, костный мозг. Гистологически может наблюдаться низкий или высокий митотический индекс, инвазия в нижележащие ткани, выраженный клеточный и ядерный полиморфизм. Клинически они могут выглядеть так же, как хорошо дифференцированные мастоцитомы или как единичные или множественные эрозированные или язвенные поражения, часто не имеющие границ и покрытые корочками (илл. 3). Методический индекс является важным прогностическим индикатором поведения.
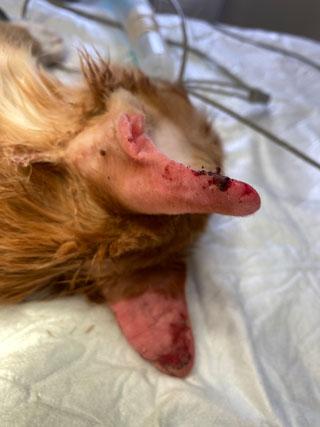
Один из самых частых симптомов, характерный для всех типов мастоцитом, — зуд, который может возникать из-за выброса медиаторов воспаления. Также выброс медиаторов воспаления, например гепарина, может вызывать нарушения свёртываемости крови и возникновение локальных гематом или кровоподтёков в области новообразования (илл. 4). Но гипергепаринемия редко приводит к неконтролируемому системному кровотечению или коагулопатии. В некоторых случаях может наблюдаться «симптом Дарье», который характеризуется как «гиперактивная кожа» и представляет собой присутствие диффузных отёков, зуда, гиперемии, возникающих после любых манипуляций (поглаживание, отбор биопсии, груминг, осмотр, пальпация и т. д.) с кожными образованиями.
 |
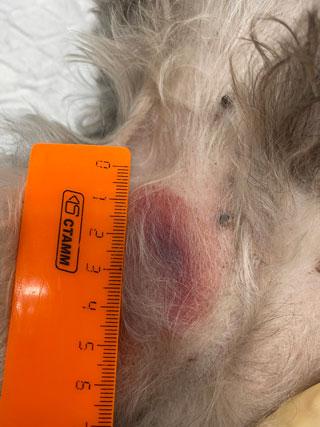 |
| Илл. 3 | Илл. 4 |
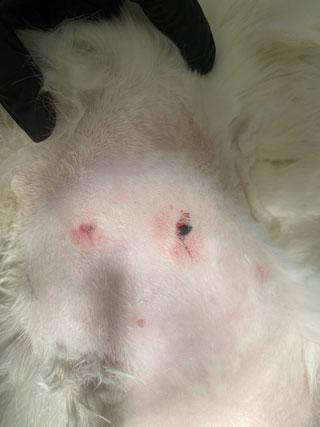
Атипичный (ранее гистиоцитарный) тип встречается чаще у животных младше 4 лет, представляет собой милиарные множественные твёрдые подкожные узелки 0,5–2 см, расположенные на границе дермы и подкожного слоя, опухоль состоит из смеси гистиоцитоподобных тучных клеток, эозинофилов и лимфоидных клеток. В большинстве случаев опухоли могут регрессировать в течение 4–24 месяцев (илл. 6, 7) [26]. В нескольких исследованиях сообщалось, что сиамские кошки имеют предрасположенность ко всем типам мастоцитом [26; 27].
 |
 |
| Илл. 5 | Илл. 6 |
 |
| Илл. 7 |
Паранеопластические синдромы (ПНС)
Тучноклеточные опухоли могут иметь несколько паранеопластических синдромов: анемия, эозинофилия, нарушения свёртывания крови, изъязвление желудочно-кишечного тракта и анафилактоидные реакции.
Анемия
Механизмы развития анемии у кошек с тучноклеточными опухолями могут быть различными и включают в себя несколько причин. Наиболее распространённые причины — анемия вследствие кровопотери, которая может возникать из-за хронических местных кровотечений или из-за эрозивно-язвенных поражений ЖКТ, которые связывают с высвобождением гистамина тучными клетками и стимуляцией секреции соляной кислоты, анемия хронического воспаления, а также вследствие миелофтиза из-за замещения костного мозга жировой тканью или метастатическим раком. Анемия при миелофтизе — нормоцитарная, нормохромная, которая возникает из-за уменьшения количества функциональной гемопоэтической ткани за счёт инфильтрации костного мозга негемопоэтическими или аномальными клетками. Ещё одна причина анемии у кошек с мастоцитомами — это эритрофагоцитоз. Злокачественные тучные клетки могут фагоцитировать эритроциты [25].
Нарушение свёртываемости крови
Нарушение коагуляции связано с высвобождением гепарина из гранул ТК. Чаще всего такие пациенты имеют нормальные параметры свёртываемости крови и коагулограмму, но во время биопсии, хирургии, самотравматизации и при любых других стимуляциях новообразования происходит локализованное чрезмерное кровотечение из-за дегрануляции ТК (илл. 7). Гипергепаринемия обычно тормозит все фазы свёртывания крови: увеличивает время свёртывания, уменьшает активность протромбина, уменьшает расход протромбина и тромбопластина, вызывая недолгосрочное кровотечение, которое имеет непродолжительный эффект (несколько часов). В некоторых случаях может дополнительно развиваться тромбоцитопения из-за агрегации тромбоцитов под воздействием гепарина.
Гастродуодениты
Считается, что гистамин, высвобождаемый из гранул MCT, действует на париетальные клетки через H2-рецепторы, что приводит к усилению секреции соляной кислоты, независимо от приёма корма, что в свою очередь может привести к эрозийным и язвенным поражениям слизистой желудка и ДПК. Также гистамин участвует в воспалительных реакциях и играет роль медиатора зуда, что объясняет местные воспалительные реакции и зуд в области ТКО.
Постановка диагноза
При обнаружении единичной мастоцитомы у кошки необходимо провести осмотр всего тела животного для исключения множественных поражений. Любые образования кожи должны исследоваться цитологически.
Для полной постановки диагноза требуется провести ряд исследований, направленных на установление окончательного морфологического диагноза и оценку стадии. Для установления типа опухоли проводят ТИАБ. Цитология в большинстве случаев будет полезна для установления предоперационного диагноза, точность данного метода исследования очень высокая, затруднение может вызвать гистиоцитарный тип, а также отбор материала из участков воспаления и гематом, которое происходит из-за дегрануляции тучных клеток и сопутствующей воспалительной реакции. Гистологическое исследование всегда требуется в послеоперационный период для оценки морфологии новообразования, классификация тучноклеточных опухолей собак не применима для кошек, на данный момент времени для кошек разработана своя классификация, которая может иметь прогностическое значение (таблица 1). Для постановки стадии оценивают: костный мозг, селезёнку, лимфатическую систему. Примерно в 4% случаев кроме кожи может быть поражена селезёнка. При этом визуальная оценка органа на таких исследованиях, как УЗИ и КТ, может не иметь значимых отклонений либо иметь неспецифические изменения, такие как неоднородная структура паренхимы и/или увеличение размера. Для оценки селезёнки требуется предоперационное цитологическое исследование органа. Оценка костного мозга проводится при наличии в периферической крови изменений неясной этиологии: анемия, тромбоцитопения, лейкопения. И также может входить в стандартный протокол стадирования опухолевого процесса.
Клинический анализ крови стандартно оценивается у всех кошек с подозрением на мастоцитому, дополнительно может оцениваться лейкоцитарная плёнка для обнаружения мастоцитов в периферической крови. Наличие мастоцитов в периферической крови у кошек всегда будет говорить о поражении костного мозга, в отличие от собак, у которых мастоциты в крови могут быть не связаны с тучноклеточными опухолями.
Для визуальной оценки внутренних органов, при подозрении на более агрессивные типы мастоцитом, мы используем компьютерную томографию с контрастированием. Но также возможна оценка брюшной полости и лимфатических узлов грудной полости при помощи УЗИ, а также рентгенограмм грудной полости.
Таблица 1
| Гистологический тип | % встречаемости | Клиническая картина | Медиана выживаемости | Средний возраст |
| Хорошо дифференцированный мастоцитарный тип | 60–70% | Единичные/множественные кожные образования | В большинстве случаев не приводят к гибели |
10 лет |
| Плеоморфный мастоцитарный тип | 20% | Единичные/множественные кожные образования. Одновременно могут присутствовать висцеральные формы или поражение КМ |
Прогноз зависит от биологического поведения | 10 лет |
| Атипичные (ранее гистиоцитарный тип) |
10% | Множественные внутрикожные/ кожные узлы розового цвета.Могут быть как узловые поражения, так и неограниченные |
Могут спонтанно регрессировать в течение 4–24 месяцев | 2,4 года (до 4 лет) |
Лечение
При лечении мастоцитом уделяется внимание лечению патологически повышенной активности тучных клеток (синдром высвобождения медиатора тучных клеток) и непосредственно лечению самого образования.
Так как во многих случаях происходит дегрануляция тучных клеток и высвобождение гистамина и других медиаторов, что может приводить к снижению качества жизни или увеличивать риски гибели животного после взятия биопсии или в послеоперационный период, требуется коррекция ПНС.
Блокада гистамина
Для снижения секреции желудочного сока используют ингибиторы протонной помпы и Н1- и Н2-блокаторы, для снижения уровня дегрануляции тучных клеток возможно применение преднизолона 1 мг/кг, а также возможно применение тирозинкиназ, которые зарекомендовали себя в гуманной медицине [28] (таблица 2).
Дополнительно не рекомендуется использовать ряд препаратов, которые могут активировать тучные клетки (таблица 3).
Основной тип лечения — хирургический. При этом, по данным нескольких исследований, прогноз и частота рецидива не коррелировали с частотой краёв резекции [24]. Частота рецидивов может варьировать от 0 до 24% вне зависимости от хирургического края. На данный момент нет установленных краёв резекции для н/о кожи кошек.
Для гистиоцитарных форм возможен вариант активного наблюдения, так как большинство новообразований данного типа самопроизвольно регрессируют [23; 26].
Химиотерапия остаётся спорной, возможно её применение при более агрессивных формах тучноклеточных образований, поражении лимфатических узлов, костного мозга.
Препараты для химиотерапии включают в себя: ломустин (CCNU), винбластин, хлорамбуцил, которые можно комбинировать с преднизолоном или дексаметазоном [12] (таблица 4). Также возможно использование ингибиторов тирозинкиназ, таких как масивет, палладия, иматиниб. Мишенью для данной группы препаратов является KIT, протоонкоген, кодирующий рецепторную тирозинкиназу c-Kit. У кошек частота встречаемости мутаций составляет 56–85%. И несмотря на то что ни один из перечисленных препаратов не зарегистрирован для кошек официально, по данным нескольких исследований, использование их будет эффективным и достаточно безопасным [11; 13; 14; 16; 17; 19; 21]. Самые частые побочные эффекты включают в себя: со стороны ЖКТ — анорексию, рвоту; со стороны гемопоэтической системы — тромбоцитопению, нейтропению, в некоторых случаях может развиваться тяжёлая гепатотоксичность.
Таблица 2. Препараты, подавляющие активацию тучных клеток
| Н1-антигистаминные препараты (предпочтительно второго и третьего поколения) | Блокируют взаимную активацию тучных клеток через H1-гистаминовые рецепторы; противодействуют симптомам, опосредованным H1-гистаминовыми рецепторами |
| Н2-антигистаминные препараты | Блокируют взаимную активацию тучных клеток через Н2-гистаминовые рецепторы; противодействуют симптомам, опосредованным H2-гистаминовыми рецепторами |
| Преднизолон/ дексаметазон |
Снижают уровень дегрануляции, подавляют пролиферацию ТК |
| Тирозинкиназы | Ингибируют рост ТК |
Таблица 3. Препараты, имеющие высокий риск активации тучных клеток
| Группа веществ | Препараты с доказанным или теоретическим высоким риском активации тучных клеток |
| Внутривенные наркотики | Метогекситал
Фенобарбитал Тиопентал |
| Миорелаксанты | Атракуриум
Мивакуриум Рокуроний |
| Антибиотики | Ингибиторы цефуроксим-гиразы
Ванкомицин |
| Селективные ингибиторы обратного захвата дофамина и норадреналина | Бупропион |
| Селективные ингибиторы обратного захвата серотонина | Все |
| Опиоидные анальгетики |
Меперидин, морфин, кодеин |
| Анальгетики периферического действия | Кислотные нестероидные противовоспалительные препараты, такие как АСС или ибупрофен |
| Местные анестетики |
Амидный тип: лидокаин, артикаин
Эфирный тип: тетракаин, прокаин |
| Сердечно-сосудистые препараты | Ингибиторы АПФ
Антагонисты ß-адренорецепторов |
Таблица 4. Основные протоколы химиотерапии для лечения мастоцитом кошек
| Химагент | Дозировка |
| Иматиниб (Gleevec)
+/– Преднизолон |
10 мг/кг, ежедневно
1–2 мг/кг в сутки |
| Тоцераниба фосфат (Palladia®)
+/– Преднизолон |
2,4–3,4 мг/кг, 3 раза в неделю
1–2 мг/кг в стуки |
| Маситиниба мезилат (Masivet)
+/– Преднизолон |
50 мг/кошку 1 раз в сутки или через день 1–2 мг/кг в сутки |
| Ломустин
+/– Преднизолон |
40–65 мг/м2 1 раз в 4 недели
1–2 мг/кг в сутки |
| Винбластин
+/– Преднизолон |
2–2,5 мг/м2 1 раз в 7–17 дней
1–2 мг/кг в сутки |
| Хлорамбуцил
+/– Преднизолон |
20 мг/м2 1 раз в 14 дней либо
4 мг/м2 1 раз в 2 дня 1–2 мг/кг в сутки |
Прогноз
Большинство кожных тучноклеточных опухолей ведут себя доброкачественно. Они имеют низкий MИ и не приводят к гибели животного независимо от гистологического типа.
Факторы, связанные с худшим прогнозом: высокий митотический индекс (> 5/10 в поле зрения), низкая или умеренная цитоплазматическая зернистость, высокий индекс Ki67, поражение лимфатических узлов. В отличие от собак, наличие экспрессии мутаций KIT или c-Kit не является предикатом прогноза у кошек с мастоцитомами [20; 13].
Хорошо дифференцированные мастоцитомы чаще всего ведут себя доброкачественно, и если опухоль единичная, то хирургическая резекция как единственный метод лечения приводит к излечению. В некоторых случаях возникает рецидив н/о или могут появляться новые образования в других локализациях. Данные образования также являются хорошо дифференцированными, не склонны метастазировать и не приводят к гибели животного. Также возможно одновременное поражение селезёнки. В данном случае спленэктомия улучшает прогноз.
Плеоморфные мастоцитомы: большая часть данных образований также будет вести себя доброкачественно. Однако высокий МИ и/или умеренная или низкая цитоплазматическая зернистость указывают на более агрессивное течение и худшие прогнозы. Данный тип требует обязательного стадирования, исследования регионарных лимфатических узлов, ТАБ селезёнки и печени, исследования лейкоцитарной плёнки и костного мозга.
Атипичные MCT: они также считаются доброкачественными, однако опубликовано лишь несколько случаев с данными последующего наблюдения. Высокий МИ и низкая цитоплазматическая гранулярность также являются неблагоприятными прогностическими маркерами.
Ключевые моменты
- Тучноклеточные опухоли кожи кошек занимают второе место по частоте встречаемости.
- Морфологически ТК новообразования подразделяют на мастоцитарный (хорошо дифференцированный и плеоморфный) тип и атипичный (гистиоцитарный) тип.
- Не существует однозначной гистологической классификации, коррелирующей с прогнозом.
- Большинство новообразований будут вести себя доброкачественно и не приведут к гибели.
- Основной тип лечения — хирургия. При этом окончательно не установлен объём хирургического иссечения новообразования.
Литература
- Elieh Ali Komi D., Wöhrl S., Bielory L. Mast cell biology at molecular level: a comprehensive review // Clinical reviews in allergy & immunology. — 2020. — Т. 58. — № 3. — P. 342–365.
- Johnson T. O. et al. Histopathology and biologic behavior of pleomorphic cutaneous mast cell tumors in fifteen cats // Veterinary pathology. — 2002. — Т. 39. — № 4. — P. 452–457.
- Lepri E. et al. Diagnostic and prognostic features of feline cutaneous mast cell tumours: a retrospective analysis of 40 cases // Veterinary research communications. — 2003. — Т. 27. — № 1. — P. 707–709.
- Macy, DW, Reynolds, HA: The incidence, characteristics and clinical management of skin tumors in cats. J Am Anim Hosp Assoc 17:1026–1034, 1981.
- Miller, MA, Nelson, SL, Turk, JR, Pace, LW, Brown, TP, Shaw, DP, Fischer, JR, Gosser, HS: Cutaneous neoplasia in 340 cats. Vet Pathol 28:389–395, 1991.
- Henry C., Herrera C. Mast cell tumors in cats: clinical update and possible new treatment avenues // Journal of Feline Medicine and Surgery. — 2013. — Т. 15. — № 1. — P. 41–47.
- Oliveira M. T. et al. Canine and feline cutaneous mast cell tumor: a comprehensive review of treatments and outcomes // Topics in Companion Animal Medicine. — 2020. — Т. 41. — P. 100472.
- Madewell B. R., Gunn C., Gribble D. H. Mast cell phagocytosis of red blood cells in a cat // Veterinary Pathology. — 1983. — Т. 20. — № 5. — P. 638–640.
- Berger E. P. et al. Retrospective evaluation of toceranib phosphate (Palladia) use in cats with mast cell neoplasia // Journal of feline medicine and surgery. — 2018. — Т. 20. — № 2. — P. 95–102.
- Musser M. L., Quinn H. T., Chretin J. D. Low apparent risk of CCNU (lomustine)-associated clinical hepatotoxicity in cats // Journal of feline medicine and surgery. — 2012. — Т. 14. — № 12. — P. 871–875.
- Berger E. P. et al. Retrospective evaluation of toceranib phosphate (Palladia) use in cats with mast cell neoplasia // Journal of feline medicine and surgery. — 2018. — Т. 20. — № 2. — P. 95–102.
- Rassnick K. M. et al. Lomustine for treatment of mast cell tumors in cats: 38 cases (1999–2005) // Journal of the American Veterinary Medical Association. — 2008. — Т. 232. — № 8. — P. 1200–1205.
- Sabattini S. et al. Prognostic significance of Kit receptor tyrosine kinase dysregulations in feline cutaneous mast cell tumors // Veterinary pathology. — 2013. — Т. 50. — № 5. — P. 797–805.
- Lachowicz J. L., Post G. S., Brodsky E. A phase I clinical trial evaluating imatinib mesylate (Gleevec) in tumorbearing cats // Journal of veterinary internal medicine. — 2005. — Т. 19. — № 6. — P. 860–864.
- Yancey M. F. et al. Distribution, metabolism, and excretion of toceranib phosphate (Palladia™, SU11654), a novel tyrosine kinase inhibitor, in dogs // Journal of veterinary pharmacology and therapeutics. — 2010. — Т. 33. — № 2. — P. 154–161.
- Harper A., Blackwood L. Toxicity and response in cats with neoplasia treated with toceranib phosphate // Journal of feline medicine and surgery. — 2017. — Т. 19. — № 6. — P. 619–623.
- Merrick C. H. et al. Retrospective evaluation of toceranib phosphate (Palladia®) toxicity in cats // Veterinary and Comparative Oncology. — 2017. — Т. 15. — № 3. — P. 710–717.
- Olmsted G. A. et al. Tolerability of toceranib phosphate (Palladia) when used in conjunction with other therapies in 35 cats with feline oral squamous cell carcinoma: 2009–2013 // Journal of feline medicine and surgery. — 2017. — Т. 19. — № 6. — P. 568–575.
- Daly M. et al. Safety of masitinib mesylate in healthy cats //Journal of veterinary internal medicine. — 2011. — Т. 25. — № 2. — P. 297–302.
- Melville K., Smith K. C., Dobromylskyj M. J. Feline cutaneous mast cell tumours: a UK-based study comparing signalment and histological features with long-term outcomes // Journal of feline medicine and surgery. — 2015. — Т. 17. — № 6. — P. 486–493.
- Harper A., Blackwood L. Toxicity and response in cats with neoplasia treated with toceranib phosphate // Journal of feline medicine and surgery. — 2017. — Т. 19. — № 6. — P. 619–623.
- Taylor F. et al. Chlorambucil and prednisolone chemotherapy for dogs with inoperable mast cell tumours: 21 cases // Journal of Small Animal Practice. — 2009. — Т. 50. — № 6. — P. 284–289.
- Chastain C. B., Turk M. A., O’brien D. Benign cutaneous mastocytomas in two litters of Siamese kittens // Journal of the American Veterinary Medical Association. — 1988. — Т. 193. — № 8. — P. 959–960.
- Molander-McCrary H. et al. Cutaneous mast cell tumors in cats: 32 cases (1991–1994) // Journal of the American Animal Hospital Association. — 1998. — Т. 34. — № 4. — P. 281–284.
- Madewell B. R., Gunn C., Gribble D. H. Mast cell phagocytosis of red blood cells in a cat // Veterinary Pathology. — 1983. — Т. 20. — № 5. — P. 638–640.
- Wilcock B. P., Yager J. A., Zink M. C. The morphology and behavior of feline cutaneous mastocytomas // Veterinary Pathology. — 1986. — Т. 23. — № 3. —P. 320–324.
- Sabattini S., Bettini G. Grading cutaneous mast cell tumors in cats // Veterinary pathology. — 2019. — Т. 56. — № 1. — P. 43–49.
- Molderings G. J. et al. Pharmacological treatment options for mast cell activation disease // Naunyn-Schmiedeberg’s Archives of Pharmacology. — 2016. — Т. 389. — № 7. — P. 671–694.
- Linde K. J. et al. The effect of prednisone on histologic and gross characteristics in canine mast cell tumors // The Canadian Veterinary Journal. — 2021. — Т. 62. — № 1. — P. 45.
СВМ № 6/2022
Вас могут также заинтересовать статьи: