Атопический дерматит и микробиом кишечника — как они связаны?
Кишечник и кожа — органы, имеющие много общих характеристик по своему строению и функциям. Оба органа хорошо иннервированы и васкуляризированы и несут как иммунные, так и нейроэндокринные функции. Внутренняя поверхность кишечника и наружная поверхность кожи покрыты эпителиальными клетками, которые имеют прямой контакт с внешней средой. В обоих органах представлена собственная иммунная система: кожная — skin immune system (SIS) и кишечно-ассоциированная лимфоидная ткань — gut-associated lymphoid tissue (GALT). За счёт них в органах возникают либо нормальные иммунные реакции, при которых развивается толерантность к антигенам окружающей среды при контакте с кожей, или к пероральным антигенам из рациона, или собственной микробиоте в кишечнике; или же неадекватный ответ к ним, приводящий к гиперчувствительности.
Механизм возникновения неблагоприятных пищевых реакций хорошо изучен у собак и кошек. Он включает в себя как пищевую непереносимость, так и пищевую гиперчувствительность, которые протекают как с симптомами зуда и кожных поражений, так и с ЖКТ-проявлениями в виде рвоты и диареи, а нередко и с комбинацией этих симптомов. Однако информация о том, как взаимосвязаны работа кишечника с патофизиологией развития атопического дерматита у людей и собак, имеет ограниченный характер. В данной обзорной статье будут рассмотрены предполагаемые механизмы атопического дерматита с точки зрения оси «кишечник — кожа».
В последние годы, благодаря появлению методов секвенирования нового поколения NGS (next-generation sequencing) гена 16S рРНК бактерий, в медицине человека и ветеринарной медицине стала доступна более обширная информация о микробиоме кожи и кишечника, в отличие от данных, которые можно было получить с помощью методов культивирования на питательных средах. Конечно, как и любой другой метод, он имеет ряд ограничений для интерпретации и пока рутинно только начинает внедряться в практическую медицину, например, было создано исследование индекса дисбиоза кишечника у собак и кошек, который разработала Texas A&M School of Veterinary Medicine & Biomedical Sciences.
Однако изучение микробиома дало толчок в развитии новых концепций влияния кишечной микробиоты далеко за пределами кишечника. На сегодняшний день определяют следующие оси взаимодействий: «кишечник — почки», «кишечник — мозг», «кишечник — лёгкие», «кишечник — кожа».
Тема оси «кишечник — почки» подробно изучается на примере хронической болезни почек у кошек и прямого влияния дисбиоза кишечника на прогрессирование заболевания. Так, накопление уремических токсинов в кишечнике связано со стимуляцией выработки свободных радикалов, активацией ренин-ангиотензин-альдостероновой системы (РААС), что в дальнейшем способствует развитию фиброза почек, воспалению с повреждением почечных канальцев и прогрессированию клубочкового склероза. Другие системные негативные воздействия описаны на илл. 1 [1].
 |
| Илл. 1. Многочисленные негативные системные эффекты уремических токсинов |
Относительно оси «кишечник — мозг» на сегодняшний день доступна следующая информация: микробиота кишечника связывается с мозгом и центральной нервной системой посредством нескольких различных каналов, в том числе:
— через энтеральную нервную систему, расположенную вдоль всего кишечного тракта, работа которой происходит через блуждающий нерв;
— симпатическая нервная система — через выработку адреналина и норадреналина;
— гипоталамо-гипофизарно-надпочечниковая ось — через секрецию кортизола;
— иммунные сигнальные пути — через цитокины, которые изменяют активность рецепторных нейронов ЦНС;
— метаболиты кишечных бактерий — через короткоцепочечные жирные кислоты (КЦЖК), а также гормоны и нейромедиаторы, включая дофамин, серотонин и GABA [2].
Схематично пути взаимодействий указаны на илл. 2.
 |
| Илл. 2. Молекулярные пути, участвующие в оси «кишечник — мозг» |
Данные об оси «кишечник — лёгкие» крайне ограниченны, и определение путей их взаимодействия — область новых исследований. Однако выдвигается теория о том, что возможно двунаправленное взаимодействие. Заболевания ЖКТ, которые увеличивают вероятность аспирации, например, гастроэзофагеальный рефлюкс, дисфагия, будут напрямую влиять на состав микробного сообщества дыхательных путей. Исследование кошек с индуцированной бронхиальной астмой выявило, что воспаление дыхательных путей может спровоцировать дисбиоз в дыхательных путях и привести к дисбиозу в отдалённых участках, таких как желудочно-кишечный тракт [3].
Рассмотрев тезисно все накопленные данные об осях взаимодействия кишечника с другими органами, вернёмся к взаимодействию с кожей. Не секрет, что атопический дерматит — это аллергическое заболевание, характеризующееся хроническим и рецидивирующим воспалительным поражением кожи, которое протекает с симптомами зуда и гиперемии кожи и имеет генетическую предрасположенность. Однако современное понимание патофизиологии АД всё ещё имеет ограничения и недомолвки. В исследованиях было доказано, что механизм запуска атопии несёт множество факторов, включая генетику, аберрантные иммунные реакции на аллергены окружающей среды и пищи, дисфункцию кожного барьера. В коже и кишечнике существует огромное количество микробных сообществ, и нарушение микробного баланса может вызвать дисбиоз и усиливать дисбаланс иммунного ответа. За последнее десятилетие исследования гуманных медиков показали, что помимо кожного барьера и дисфункции иммунных клеток как кожная, так и кишечная микробиота являются дополнительным стратегическим фактором, который влияет на патогенез АД [4].
Многие исследования выявили, что патогенез АД у собак очень похож на аналогичную болезнь у человека. Микробиота кожи людей, больных АД, характеризуется снижением разнообразия, что особенно проявляется в колонизации кожи S. aureus и снижением таксонов Streptococcus, Acinetobacter, Corynebacterium и Cutibacterium. У собак с атопией также наблюдается значительный дисбиоз на коже с преобладанием стафилококков, однако этот феномен скорее следствие, чем причина заболевания. Также известно, что люди с АД чаще испытывают желудочно-кишечные симптомы, а состав и доля микробиоты кишечника у пациентов с АД явно изменяются, о чём свидетельствует более низкое бактериальное разнообразие и уменьшение количества сахаролитических штаммов бактерий. Были обнаружены маркерные бактерии в микробиоте кишечника при АД у человека — Akkermanisia, Anaerofilum и Propionibacterium. У собак с АД в исследовании с группой контроля выявили, так же как у человека, признаки дисбиоза кишечника, который проявлялся в значительном снижении альфа-разнообразия микробиоты кишечника.
 |
| Илл. 3. Схематическое представление роли КЦЖК при воспалительных заболеваниях кожи у человека
Расшифровка: Treg — субпопуляция Т-клеток, регуляторные Т-лимфоциты; HaCaT — иммортализованные кератиноциты человека; FLG — филаггрин; HDAC — специфические мембранные рецепторы, ингибиторы гистондеацетилазы; GPCRs — рецепторы, связанные с G-белком; FOXP3 — скурфин, белок forkhead box; VLCFAs — жирные кислоты с очень длинной цепью; LCFAs — длинноцепочечные жирные кислоты; NHEKs — нормальные эпидермальные кератиноциты человека; TGM1 — трансглутаминаза-1; ICAM-1 — молекула межклеточной адгезии-1; IFN-γ — интерферон-γ; TLR-2 — toll-подобный рецептор-2; TNF-α — фактор некроза опухоли-α
|
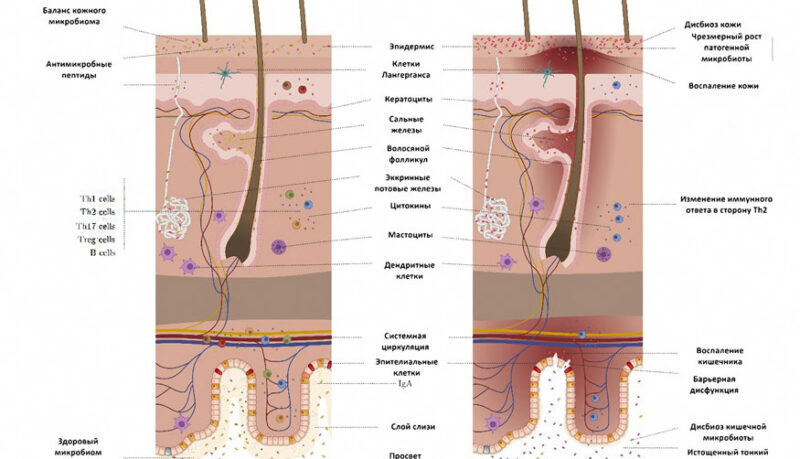
Было высказано предположение, что у людей кожные заболевания, протекающие параллельно с воспалительными заболеваниями кишечника, могут быть результатом иммунной дезрегуляции, приводящей к повреждающим процессам, опосредованным лимфоцитами. Так, Т-клетки, присутствующие в слизистой оболочке кишечника, могут мигрировать на кожу, подвергаться воздействию кожных антигенов и способствовать повреждению органа. Новые данные подтверждают существование оси «кишечник — кожа», на которую влияют нейроэндокринные молекулы, продуцируемые кишечным микробиомом. Выявлено по меньшей мере 30 гормоноподобных соединений, например, жирные кислоты с короткой цепью (КЦЖК); вторичные желчные кислоты, кортизол и нейротрансмиттеры, такие как гамма-аминомасляная кислота (ГАМК), серотонин, дофамин и триптофан. Гормоноподобные плейотропные соединения, вырабатываемые микробиомом кишечника, высвобождаются в кровоток и могут действовать на отдалённые органы и системы, такие как кожа. Эти молекулы несут ряд важных функций, однако нарушения их выработки и транспортировки могут приводить к дисфункции кожного барьера, нарушению регуляции иммунной системы. Было обнаружено, что гомеостаз и аллостаз кожи связаны со здоровьем желудочно-кишечного тракта, что указывает на двунаправленную связь между кишечником и кожей, и есть данные, позволяющие предположить, что метаболические и иммунологические эффекты членов микробиома кишечника могут влиять на состояние кожи. Дисбиотическое состояние характеризуется нарушением кишечного барьера (дисбаланс кишечного микробиома, уменьшение слоя слизи, снижение секреции IgA) и кожного барьера (дисбиоз, снижение выработки антимикробных пептидов). Дисбиоз кишечника и кожи связаны через иммунный дисбаланс посредством Th2 (илл. 4).
 |
| Илл. 4. Ось «кишечник — кожа» |
Нарушение этого механизма при дисбиозе кишечника связано с развитием аллергии у людей и собак. Именно поэтому восстановление дисбиоза кишечника может улучшить симптомы аллергических заболеваний кожи благодаря толерогенному влиянию положительной бактериальной флоры на иммунную систему. Эти данные подтверждаются в исследовании микробиома собак с АД и здоровых собак [8; 10].
В медицине человека предполагается, что вторичные желчные кислоты в толстом кишечнике могут оказывать влияние на физиологию кожи. Бактерии, участвующие в метаболизме вторичных желчных кислот, принадлежат к типам Bacteroidetes и Firmicutes, соотношение которых часто изменяется при дисбиозе кишечника [11]. Логично предположить, что и у собак происходят подобные изменения. Основной бактерией, которая метаболизирует у собак первичные желчные кислоты во вторичные, считается Clostridium hiranonis, популяция которой часто снижена у собак с дисбиозом.
У человека также было определено, что КЦЖК транспортируются из кишечника в отдалённые органы и ткани через периферическое кровообращение и связываются с рецепторами, связанными с G-белком, который экспрессируется на клетках кожи, лейкоцитах, нейтрофилах и других типах клеток, оказывая тем самым прямое влияние на метаболизм и функцию тканей. КЦЖК могут усиливать активность Treg, улучшать метаболизм митохондрий, способствовать дифференцировке кератоцитов, снижать экспрессию факторов воспаления в клетках и ингибировать воспалительную реакцию, что приводит к облегчению воспаления кожи и улучшению кожного барьера [12], илл. 3. При возникновении дисбиоза кишечника у собак снижается популяция бактерий, которые способны ферментировать клетчатку в толстом кишечнике, и, как следствие, снижается выработка КЦЖК, поэтому можно предположить, что это также будет негативно отражаться на состоянии кожи.
Согласно данным отчёта Яна Суходольских, основные типы бактерий, присутствующих в фекальной микробиоте здоровых собак, это Firmicutes (47,7%), за которыми следуют Proteobacteria (23,3%), Fusobacteria (16,6%) и Bacteroidetes (12,4%).
В одном из исследований, где сравнивали микробиом кишечника здоровых собак и собак с АД, было выявлено, что у здоровых собак в микробиоме кишечника обнаружена более высокая численность семейств Lachnospiraceae (р = 0,0006), (р = 0,006) и Oscillospiraceae (р = 0,021) и родов Lachnospira (р = 0,022), группа Ruminococcus torques group (p = 0,0001), Fusobacterium (p = 0,022) и Fecalibacterium по сравнению с собаками, страдающими аллергией. Численность Conchiformibius (p = 0,01), Catenibacterium spp. (р = 0,007), группы Ruminococcus gnavus (р = 0,0574) и Megamonas (р = 0,0102) была выше у собак с аллергией [4].
В настоящее время единственный способ дифференцировать атопический дерматит от пищевой аллергии — придерживаться строгой исключающей диеты в течение примерно 8 недель. Диагноз ставится на основании наблюдения за улучшением кожных симптомов после диеты и ухудшением кожных поражений и зуда после возобновления старой диеты, на которую у собаки аллергия (провокационный тест). В исследовании с использованием корма Farmina Ultra Hypo 60% собак значительно улучшили статус клинических проявлений аллергии благодаря диете, однако у 30% из них не возникло рецидива при провокационном тесте, что позволяет предположить положительное действие диеты, выходящее за рамки коррекции пищевой аллергии. Использование диетического рациона привело к снижению численности Bacteroidetes, бактерии, которая отражает наличие у собак дисбиоза, и Prevotella, обычно встречающейся при хронических кишечных заболеваниях [8].
Также стоит ознакомиться с публикацией, в которой оценивают воздействие оклацитиниба на микробиту кишечника у собак при атопическом дерматите в сравнении с группой здоровых собак.
У собак породы сиба-ину с АД в исследовании выявили, что преобладающие роды в кишечном микробиоме были Escherichia / Shigella (19,4%), Bacteroides (18,1%) и Clostridium sensu stricto (9,7%), а вот популяция полезных бактерий в низкой численности — Fusobacterium (0,06%), Megamonas (0,0003%). Для сравнения профиль здоровых собак: преобладали роды Fusobacterium (20,6%), Megamonas (18,4%) и неклассифицированный род, принадлежащий семейству Bacteroidaceae (16,2%). Через 14 дней терапии оклацитинибом у собак с АД увеличивалась популяция Fusobacterium, а численность Escherichia / Shigella значительно снизилась. Известно, что эти бактериальные таксоны имеют патофизиологическое значение у собак при ВЗК. Снижение численности Fusobacterium и Megamonas отрицательно коррелировало у собак с симптомами хронической энтеропатии. У собак обилие Fusobacterium положительно коррелирует с концентрацией бутирата и пропионата в фекалиях (КЦЖК), а некоторые виды Megamonas могут ферментировать глюкозу в ацетат и пропионат. У собак с АД, которые не проходили терапию оклацитинибом, наблюдалась тенденция к уменьшению видового разнообразия в микробиоме кишечника. В то же время собаки с АД, которые уже проходили долгосрочную терапию оклацитинибом (в среднем 13,24 мес.), состав таксонов кишечных бактерий был богаче, чем у собак с АД, которые получали только 2-недельное лечение: Fusobacterium сохранялись, обилие Escherichia / Shigella сократилось, и появился Megamonas, таким образом, видовое разнообразие стало ближе к таковому у здоровых собак, хотя и наблюдалось большее отклонение между отдельными особями собак [9].
Относительно новым методом микробиом-ориентированной терапии в контексте воспалительных заболеваний кишечника является терапия фекальной микробиотой — фекальная трансплантация. Некоторые практикующие врачи предположили, что такой метод будет актуален и для собак с АД, по причине доказанного дисбиоза у таких особей.
Рассмотрим несколько публикаций, где пациенты получали фекальную трансплантацию. На основании гипотезы о роли взаимодействия кишечного микробиома с дерматологическими заболеваниями авторы публикации доказали, что восстановление микробиоты кишечника облегчает течение атопического дерматита у собак.
Дизайн исследования: в открытой неконтролируемой серии случаев участие приняли 8 домашних собак с АД, в возрасте от 24 до 119 месяцев, которые ранее не получали лечения. Основная терапия была проведена запатентованным препаратом фекальной микробиоты в капсулах Animal Biome Gut Restoration System FMT capsules 2 раза в день в течение 4 недель.
Таблица 1. Динамика на терапии фекальной трансплантации по шкале CADESI-04
| Case no | Classification of CAD | CADESI-04 scores | |
| bt | aFMT | ||
| I | Severe | 99 | 12 |
| II | Severe | 128 | 14 |
| III | Severe | 76 | 7 |
| IV | Moderate | 50 | 21 |
| V | Severe | 90 | 10 |
| VI | Severe | 101 | 6 |
| VII | Severe | 88 | 8 |
| VIII | Severe | 79 | 4 |
Эффект терапии:
- По шкале CADESI-04 (индекс распространённости и тяжести атопического дерматита у собак) наблюдалось снижение баллов на 28-й день (4–21) по сравнению с исходными значениями в день 0 (50–128); см. таблицу 1.
- Расшифровка: 10 (mild — лёгкая степень), 35 (moderate — средняя степень), 60 (severe atopic dermatitis — тяжёлая форма атопического дерматита).
- По шкале Pruritus Visual Analog Scale (визуально-аналоговая шкала зуда у собак) было выявлено снижение баллов на 28-й день (0–2), в отличие от предыдущих значений (6–10).
- Расшифровка:
0–1 балла — без признаков зуда;
2–3 балла — очень лёгкий зуд (случайные эпизоды);
4–5 баллов — лёгкий зуд, собака не чешется во время кормления, игры, тренировки или когда её отвлекают;
6–7 баллов — умеренный зуд (частые эпизоды): собака периодически чешется в течение дня, но не во время кормления, игры, тренировки или когда её отвлекают. Зуд возникает также ночью.
- 8–9 баллов — сильный зуд (длительные эпизоды): зуд нарушает сон, отвлекает от кормления, игры и физических упражнений. Зуд не прекращается даже при попытке отвлечь собаку.
- 10 баллов — экстремальный зуд (сильный/непрерывный зуд): собака не перестаёт чесаться независимо от окружения или команд, и её нужно физически сдерживать от расчёсов.
Альфа-разнообразие микробиома кишечника продемонстрировало как богатство, так и разнообразие кишечной микробиоты и улучшилось во всех случаях на 28-й день. Кроме того, в конце исследования соотношение Firmicutes : Bacteroidetes составило меньше 8, что является эталоном, зарегистрированным у здоровых собак. Все собаки завершили исследование без каких-либо побочных эффектов, связанных с терапией. За собаками наблюдали в общей сложности 18 месяцев после завершения исследования: ни у одной из особей не было выявлено рецидива на момент написания публикации, что составило 1,5 года наблюдения [5].
Ещё одно клиническое испытание эффективности фекальной трансплантации у собаки с АД было проведено практикующими врачами. В данном случае было использовано однократное пероральное введение фекального раствора.
Дизайн исследования: 12 собак с АД и 20 здоровых собак в группе контроля для оценки микробиома кишеника. 12 собакам с АД в рамках открытого клинического исследования с одной группой без группы контроля провели фекальную трансплантацию и оценку эффекта в течение 56 дней.
Эффект терапии:
- CADESI-04 — снижение баллов с 0-го дня — средний балл 16,5 до 8 баллов к 56-му дню.
- Pruritus Visual Analog Scale — с 0-го дня — средний балл 3 до 1 балла к 56-му дню.
Также произошло изменение состава фекальной микробиоты у собак с АД на уровне типа и рода. Количество общих вариантов последовательностей ампликонов в фекальной микробиоте между собаками-донорами и собаками с АД положительно коррелировало с коэффициентами снижения CADESI-04 и PVAS через 56 дней после процедуры [6].
Эффект фекальной трансплантации оценивали в исследованиях на мышах, которых подвергли воздействию кальципотриола, чтобы создать модель АД. Результатами стало увеличение в микробиоте кишечника Firmicutes к Bacteroidetes и количества бактерий, продуцирующих масляную кислоту, включая Erysipelotrichaceae, Lactobacillaceae и Eubacteriacea. Со стороны кожи это ускорило процесс восстановления поражённого эпидермиса [7].
Новые знания в области взаимосвязей оси «кишечник — кожа» в перспективе могут позволить сделать уклон и в дерматологии на микробиом-ориентированную терапию. Подобный пересмотр постулатов терапии хронической энтеропатии сейчас происходит в области гастроэнтерологии собак и кошек. Поднимаются вопросы о том, что системные антибиотики больше не следует рутинно использовать при терапии хронической диареи, т. к. они приводят к развитию дисбиоза кишечника, а делать уклон на модификацию диеты, использование пребиотиков и пробиотиков или проводить фекальную трансплантацию.
Литература
- The feline gut-kidney axis: food for thought. Stacie C. Summers, Jessica M. Quimby. Veterinary Focus. Gastrointestinal topics, Issue number 33.1, 2023.
- The Gut-Brain Axis in Neurodegenerative Diseases and Relevance of the Canine Model: A Review. Yoko M. Ambrosini, Dana Borcherding, Anumantha Kanthasamy, Hyun Jung Kim, Auriel A. Willette, Albert Jergens, Karin Allenspach, Jonathan P. Mochel. Front. Aging Neurosci., Volume 11, 2019, doi.org/10.3389/fnagi.2019.00130.
- The respiratory microbiota and its impact on health and disease in dogs and cats: A One Health perspective. Aida I. Vientós-Plotts, Aaron C. Ericsson, Carol R. Reinero. Journal of Veterinary Internal Medicine, Volume 37, Issue 5, 2023, doi.org/10.1111/jvim.16824.
- Comparison of the Gut Microbiome between Atopic and Healthy Dogs — Preliminary Data. Ana Rostaher, Yasser Morsy, Claude Favrot, Stefan Unterer, Manuela Schnyder, Michael Scharl, Nina Maria Fischer. Animals 2022, 12, 2377, doi.org/10.3390/ani12182377.
- Fecal microbiota transplantation capsule therapy via oral route for combatting atopic dermatitis in dogs. Kerem URAL. Ankara Univ Vet Fak Derg, 69, 211–219, 2022 DOI: 10.33988/auvfd.822971.
- Pilot evaluation of a single oral fecal microbiota transplantation for canine atopic dermatitis. Koji Sugita, Ayaka Shima, Kaho Takahashi, Genki Ishihara, Koji Kawano, Keitaro Ohmori. Scientific Reports, volume 13, 8824, 2023, DOI: 10.1038/s41598–023–35565-y.
- Fecal microbiota transplantation affects the recovery of AD-skin lesions and enhances gut microbiota homeostasis. Xinyu Jiang, Zhifang Liu, Yizhao Ma, Linlin Miao, Keyu Zhao, Dianchen Wang, Mengmeng Wang, Hongyu Ruan, Feng Xu, Qiongyan Zhou, Suling Xu. International Immunopharmacology, 2023, Volume 118, doi.org/10.1016/j.intimp.2023.110005.
- Analysis of Intestinal Microbiota and Metabolic Pathways before and after a 2-Month-Long Hydrolyzed Fish and Rice Starch Hypoallergenic Diet Trial in Pruritic Dogs. Chiara Noli, Antonella Varina, Caterina Barbieri, Alessandra Pirola, Daniela Olivero. Vet. Sci. 2023, 10(7), 478; doi.org/10.3390/vetsci10070478.
- A comprehensive analysis of gut and skin microbiota in canine atopic dermatitis in Shiba Inu dogs. Mirja Thomsen, Axel Künstner, Inken Wohlers, Michael Olbrich, Tim Lenfers, Takafumi Osumi, Yotaro Shimazaki, Koji Nishifuji, Saleh M. Ibrahim, Adrian Watson, Hauke Busch, Misa Hirose. Microbiome, volume 11, 232 2023, DOI:10.1101/2022.07.11.497949.
- Gut–Skin Axis: Current Knowledge of the Interrelationship between Microbial Dysbiosis and Skin Conditions. Britta De Pessemier, Lynda Grine, Melanie Debaere, Aglaya Maes, Bernhard Paetzold, Chris Callewaert. Microorganisms 2021, 9(2), 353; doi.org/10.3390/microorganisms9020353.
- Targeting the gut-skin axis — Probiotics as new tools for skin disorder management? Magdolna Szántó, Anikó Dózsa, Dóra Antal, Kornélia Szabó, Lajos Kemény, Péter Bai. Experimental Dermatology, 2019, Volume 28, doi.org/10.1111/exd.14016.
- The role of short-chain fatty acids in inflammatory skin diseases. Xianjun Xiao, Xiaoshen Hu, Junpeng Yao, Wei Cao, Zihao Zou, Lu Wang, Haiyan Qin, Dongling Zhong, Yuxi Li, Peiwen Xue, Rongjiang Jin, Ying Li, Yunzhou Shi, Juan Li. Front Microbiol, 2023, DOI: 10.3389/fmicb.2022.1083432.
СВМ № 1/2024
Вас также могут заинтересовать статьи:
Одновременный контроль спонтанного центрального гиперадренокортицизма и пищевой аллергии у собаки