Tamara Grubb1, Heidi Lobprise2
1 Washington State University, Pullman, WA, USA
2 Main Street Veterinary Hospital, Flower Mound, TX, USA
Correspondence
Dr. Tamara Grubb, DVM, Ph.D., Diplomate ACVAA, 2002 Schultheis Rd, Uniontown, WA 99179 USA. Email: tamaragrubb@wsu.edu
Funding information: Aratana Therapeutics, Leewood, Kansas, USA
Анальгезия в ветеринарии, в том числе местная и регионарная анестезия, является ключевым компонентом квалифицированного ведения пациентов. В статье описываются отдельные техники местных и регионарных блокад, применяемые в ветеринарной медицине у кошек и собак. Она является продолжением статьи «Местная и регионарная анестезия у собак и кошек: обзор методов и препаратов», в которой была представлена детальная информация о препаратах, чаще всего применяемых для местной анестезии у мелких домашних животных (см. СВМ № 1/2021).
Резюме
Препараты, применяемые для местной и регионарной анестезии, способны полностью блокировать проведение ноцицептивных импульсов, снижая как интраоперационную ноцицепцию, так и постоперационную боль, одновременно уменьшая риск потенциальных побочных эффектов от применения системных анестетиков. Для большей эффективности и безопасности данный класс препаратов рекомендован как часть протоколов в анальгезии, применяемых при большинстве хирургических процедур и при лечении травматических повреждений. Множество местных и регионарных блокад имеют доказанную эффективность у кошек и собак, позволяя клиницистам применять эти блокады в своей практике. Данная статья сфокусирована на кратких описаниях отдельных часто применяемых техник местной/регионарной анестезии у кошек и собак, которые покрывают большое число болезненных хирургических манипуляций и травм и могут быть выполнены в любой клинике.
Ключевые слова: анальгезия, бупивакаин, липосомальный, местные анестетики, местная блокада.
Введение
Анальгезия в ветеринарии является ключевым компонентом квалифицированного ведения пациентов. В связи со способностью в значительной степени снижать интраоперационную ноцицепцию и послеоперационную боль препараты для местной анестезии рекомендованы для применения при выполнении большинства хирургических процедур и лечении травматических повреждений, что отражено в современных рекомендациях по контролю боли [23; 50]. Обратите внимание, что боль переходит в ноцицепцию у пациентов в анестезии, так как для ощущения боли требуется осознанная реакция, которая невозможна при анестезии. Понятие «боль» используется для характеристики чувствительности у пациентов в сознании. Несмотря на то что местная анестезия не так проста в выполнении, как в/м или в/в инъекция, по мнению авторов и по мнению некоторых экспертов [23], большинство местных/регионарных блокад легко осваивается и внедряется во всех типах ветеринарных клиник. Данный обзор написан в первую очередь для врачей общей практики для внедрения или расширения использования местной / регионарной анестезии без необходимости иметь или покупать специальное оборудование, которое может потребовать дополнительного обучения для наиболее эффективного использования. Все местные / регионарные блокады, описанные в этой статье, могут быть успешно выполнены с использованием знаний об анатомии кошек и собак, хорошими навыками пальпации и техники выполнения инъекций (например, аккуратное введение иглы, аспирационная проба перед инъекцией). Данная статья не является исчерпывающим описанием техники всех возможных блокад. Более сложные методы (например, с применением ультразвуковой навигации или нейростимулятора) упомянуты там, где это требуется, но полное описание таких методов находится за пределами области, освещённой в этой статье. Применение этих более сложных методов не является необходимым для таких техник местной анестезии, как инфильтрация операционного поля или раны, перитонеальный лаваж с местной анестезией, блокады семенников и т. д. Однако на основании данных исследований на кадаверном материале по точности введения препарата близко к нервам [63; 64; Portela, Verdier, & Otero, 2012] точность блокад, например, плечевого сплетения, лучевого/локтевого/срединного/мышечно-кожного нервов (RUMM) и седалищного/бедренного, может быть улучшена при использовании этих вспомогательных методов. Рекомендованные материалы по другим блокадам, с более углублённой информацией, иллюстрациями и более сложными техниками включают [12; 59; 63; 64; 47].
Местная и регионарная анестезия: препараты, оборудование и подготовка кошек/собак
Дозировки препаратов, используемые авторами, приведены в разделе «Часто используемые препараты» в части 1 этой статьи [30]. Однако объём препарата, который может быть введён в ткани, часто меньше, чем дозировка мг/кг. Рекомендованные объёмы препаратов, которые разработаны для большинства блокад, приведены ниже в соответствии с концентрацией препаратов: лидокаин — 2%, бупивакаин — 0,5%, ропивакаин — 0,5% и липосомальный бупивакаин, суспензия для инъекций — 1,33% (БЛСИ). При этом для всех блокад общая местная доза выбранного препарата для местной анестезии должна быть рассчитана с учётом вида пациента перед выполнением каждой блокады, и общее количество местного анестетика не должно превышать рассчитанной дозы, за исключением тех случаев, когда дополнительное количество препарата незначительно, как, например, небольшие дозы лидокаина, орошаемые на область гортани при интубации у кошек. В противоположность этому, как было отмечено рецензентом данной статьи, доза одного лекарства (не используемого авторами) составляет до 5 мг/кг для десенсибилизации гортани. Это является значительным ограничением для его использования и должно быть учтено при расчёте общей дозы. Дозировки препаратов приведены в части 1 этой статьи [30]. Объём препарата (если он отличается от общей дозы) и оборудование, необходимое для выполнения блокад, представлены в блоке 1 и блоке 2.
За исключением специфического использования при некоторых блокадах, все препараты для местной анестезии, представленные в части 1 [30], подходят для всех блокад, описанных в этой статье, однако бупивакаин в форме липосомальной суспензии для инъекций (обозначенный как БЛСИ в этой статье, NOCITA®) имеет несколько логичных противопоказаний. БЛСИ одобрен в США Комитетом по качеству пищевых продуктов и лекарств (FDA) (и мы надеемся, что будет распространён и в других странах) для инъекций в рассекаемые слои тканей при хирургическом лечении передней крестовидной связки у собак. БЛСИ часто применяется вне зарегистрированных показаний как у собак, так и у кошек для инфильтрации тканей при других хирургических процедурах, включая ампутации и иссечения опухолей, и используется для инфильтрации тканей при лечении ран. Для этих блокад БЛСИ вводят только перед закрытием операционного разреза или раны, но не заранее, так как липосомы могут быть разрушены при разрезе ткани или при удалении омертвевших тканей вокруг раны. Обычный бупивакаин можно вводить заранее, а БЛСИ перед закрытием разреза или раны. БЛСИ одобрен FDA для блокады периферических нервов (например, зубных/стоматологических блокад, ушно-височного и большого ушного нервов, плечевого сплетения (в зависимости от места операции), блокады лучевого/локтевого/срединного/мышечно-кожного нервов (RUMM), седалищного нерва и др.) как у собак, так и у кошек. БЛСИ может быть введён заранее для таких блокад, так как липосомы вводятся далеко от места операции, а не в область, которая будет повреждена при хирургическом разрезе или хирургической обработке раны. Из-за относительно крупного размера липосомы выделяют бупивакаин локально, диффузия в окружающие ткани не выражена, таким образом БЛСИ, скорее всего, не будет эффективна для блокад, требующих миграции местных анестетиков в достаточно удалённые ткани (например, блокада семенников, при которой препарат, введённый в семенник, должен распространиться на семенной канатик) или когда препараты омывают или орошают ткань (например, перитонеальный лаваж) вместо инъекционного местного введения, при котором липосомы могут выделить бупивакаин локально. Больше информации о технике введения БЛСИ см. в части 1 этой статьи [30] и на сайте продукта в интернете [55]. Из-за того, что БЛСИ достаточно новый препарат в ветеринарной медицине и выводы об использовании БЛСИ для всех видов блокад, описанных здесь, сделать нельзя, использование препарата будет описано для тех блокад, для которых он подходит. БЛСИ обычно используется авторами для всех блокад зубов и ротовой полости, но инструкций по применению для этих блокад не разработано.
Подготовка пациентов. Когда возможно, место инъекции должно быть выбрито и асептически обработано.
Предостережение. Аспирационная проба: для всех блокад следует сначала ОТТЯНУТЬ ПОРШЕНЬ (аспирировать) перед введением препарата (потенциальные особенности описаны в секции по люмбосакральной эпидуральной анестезии).
Блок 1. Оборудование и объём инфильтрации для зубных блокад и блокад ротовой полости
- Оборудование: шприцы подходящего размера, которые вмещают необходимый объём препарата, с иглами 25, 27 или 30G или больше (жёсткие, чтобы минимизировать сгибание иглы) и длиной от 1 до 1 3/8 дюймов [43]. БЛСИ вводят через иглы 25-го размера или более, чтобы избежать разрушения липосом.
- Объём инфильтрации [43]:
-
- Кошки — 0,2–0,25 мл в одно место;
- Собаки — 0,25, 0,5 или 1 мл в одно место для мелких, средних и крупных собак соответственно.
Блок 2. Оборудование и объём введения для всех других блокад, описанных в данной статье
- Оборудование: шприцы подходящего размера, которые вмещают рассчитанный объём препарата, и иглы от 25 до 22G и длиной от 1 до 1,5 дюймов. Иногда требуются более длинные иглы (2–3 дюйма) или специализированные (например, эпидуральные иглы Тоухи).
- Объёмы инфильтрации: если отличается от общего рассчитанного объёма препарата, объёмы указаны для каждой блокады.
Выбор местных и регионарных техник анестезии у собак и кошек
Каждая блокада, описанная в данной статье, применяется авторами, если нет других показаний. Техники некоторых блокад описаны в других источниках, часто с детальными иллюстрациями [20; 46; 66; 12; 59]. Специфические ссылки на техники выполнения блокад и/или их эффективность приведены в тех случаях, когда возможно.
Общая инфильтрация тканей
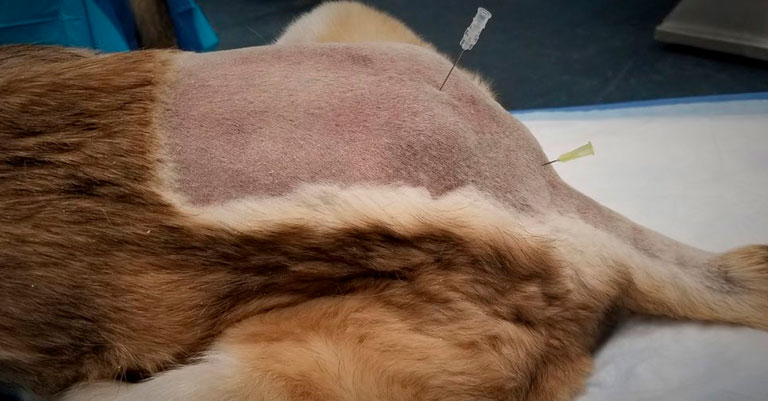
Поверхностная анестезия, также называемая инцизионной или линейной блокадой [84; 44; 90; 69]: илл. 1 и блок 3.
Ткани/области десенсибилизации: кожные и подкожные слои, мышечные слои в зависимости от глубины инъекции, в непосредственной близости от места инъекции. Используется перед разрезом тканей или закрытием ран.
 |
|
Илл. 1. Инцизионная блокада, или поверхностная анестезия. Данная блокада была выполнена после предварительной обработки поля, но перед стерильной обработкой. Если выполняется после стерильной обработки, специалист, выполняющий блокаду, должен быть в стерильных перчатках |
Блок 3. Техника общей инфильтрации тканей
- Техника: нервные окончания блокируются путём введения препарата вокруг или непосредственно в область разреза или раны. См. больше информации по введению БЛСИ в части 1 [30].
- Общий объём введения зависит от размера разреза/раны, следует быть внимательными, чтобы не превысить максимальную рекомендованную дозу для каждого препарата и вида животного. Если требуется большая доза, препараты, включая БЛСИ, могут быть разведены эквивалентным или меньшим объёмом стерильного физиологического раствора.
- Литература подтверждает, что местные анестетики, включая БЛСИ, введённые в место разреза или рану, не замедляют заживление тканей [1; 5; 14; 86].
Зубные блокады и блокады ротовой полости
ВАЖНАЯ ОСОБЕННОСТЬ БЛОКАД РОТОВОЙ ПОЛОСТИ. У кошек следует избегать чрезмерного открытия рта, так как это может ограничить кровоток по верхнечелюстной артерии, а у данного вида животных нет коллатерального кровотока для головного мозга и сетчатки глаза. Тяжёлый неврологический дефицит и слепота могут развиться вследствие нарушения кровотока и ишемии, в особенности при использовании пружинных роторасширителей для максимального открытия рта [4; 48; 70; 78]. Такие роторасширители нельзя применять у кошек. Использование роторасширителей для взрослых кошек с максимальным открытием на 42 мм между зубами для собак может привести к нарушению кровотока, однако допустимо раскрытие рта на 20–30 мм [48]. При этом можно использовать роторасширители, которые позволяют не полностью раскрывать рот.
Подглазничная блокада [29; 28]: блок 4.
Ткани/области десенсибилизации [38]: когда препарат удаётся ввести в канал или достигнуть области крылонёбной ямки в дистальной области канала, будут десенсибилизированы премоляры, клыки и резцы. Эта блокада не обеспечивает десенсибилизацию каудального альвеолярного нерва верхней челюсти, который отходит от верхнечелюстного нерва каудальнее подглазничного нерва и входит в подглазничный канал (иннервация 1-го и 2-го моляров у собак и 3-го и 4-го премоляров у кошек).
Блок 4. Техника инфраорбитальной блокады
- Техника:
-
- Потяните губу вверх и пальпируйте канал, открывающийся на слизистой над подглазничным отверстием дорсальнее 3-го премоляра.
- Введите иглу в канал и проведите иглу не далее уровня медиального угла глаза. Держите шприц и иглу параллельно нёбу и плотно прислонённым к верхней челюсти. Выполните аспирационную пробу, далее медленно и осторожно выполните инъекцию, чтобы ввести анестетик равномерно в канал.
-
-
- У кошек (не брахицефалических пород) длина подглазничного канала составляет примерно 4 мм, он заканчивается на уровне внутреннего угла глаза. Введение иглы в канал обычно не рекомендуется из-за близости к глазному яблоку.
-
Подглазничный доступ для блокады верхнечелюстного нерва [75]: блок 5.
Ткани/области десенсибилизации: инфильтрация местного анестетика в каудальую часть подглазничного канала может влиять на чувствительность каудального альвеолярного нерва верхней челюсти.
Блок 5. Техника подглазничного доступа к верхнечелюстному нерву
- Техника: глубокая подглазничная блокада с введением иглы до уровня 1-го моляра верхней челюсти описана [67], и использование внутривенного катетера для достижения этого уровня также было описано [85].
- Возможные осложнения включают повреждение нервно-сосудистого пучка в канале и введение препарата в сосуд. Во избежание повреждения глазного яблока этот доступ не используется у кошек, использование метода у брахицефалов неоднозначно. Вероятно, нет необходимости данного метода у таких пациентов из-за небольшого расстояния, на которое должен распространиться препарат — каудально от места инъекции в подглазничное отверстие до входа верхнечелюстного нерва в отверстие.
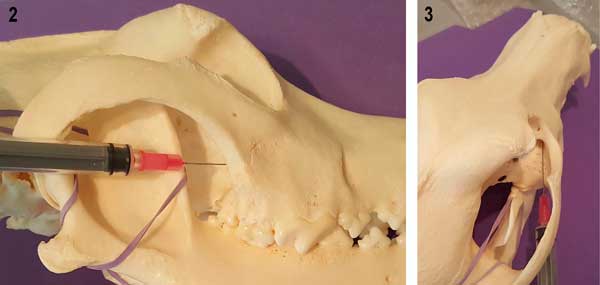
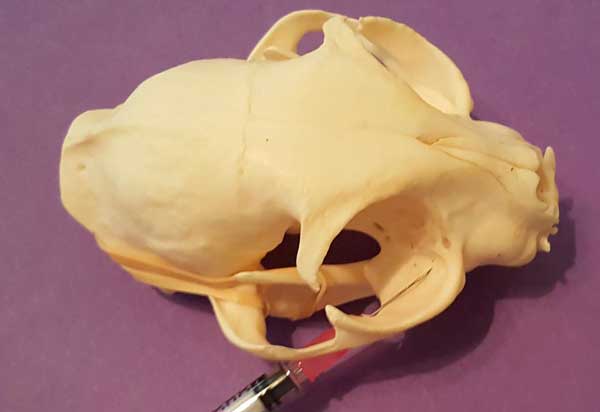
Каудальный доступ для блокады верхнечелюстного нерва [2], илл. 2–4 и блок 6.
Ткани/области десенсибилизации (38): верхняя челюсть и резцовая кость с прилегающими мягкими тканями, верхняя зубная арка, верхняя губа и ноздри, твёрдое и мягкое нёбо.
 |
|
Илл. 2 и 3. Каудальный доступ к нижнечелюстному нерву на черепе собаки |
 |
|
Илл. 4. Каудальный доступ для блокады нижнечелюстного нерва на черепе кошки |
Блок 6. Техника каудального доступа к верхнечелюстному нерву
- Техника:
-
- Чрезкожный доступ
-
-
- Введите иглу подкожно сразу под вентральной границей средней части скуловой дуги, перпендикулярно коже и направляйте медиально [85]. Для собак среднего размера место введения расположено на 0,5 см каудальнее линии, проведённой от медиального угла глаза.
- Продвиньте иглу до области крылонёбной ямки, направляя немного рострально к верхнечелюстному отверстию [18]. Введите иглу, пока она на всю длину не войдёт в ткани или пока не воткнётся в кость. Выполните аспирационную пробу, введите препарат.
-
-
- Доступ через ротовую полость
- Откройте рот и сдвиньте губы каудально.
- Введите иглу, направляя дорсально в слизистую, строго каудально к середине 2-го моляра верхней челюсти.
- Возможные осложнения: случайная перфорация глазного яблока была описана при использовании этого метода [62], при этом иглу не следует вводить дорсально более чем на 2–4 мм в зависимости от размера собаки/кошки, как рекомендовано Beckman и Legendre [7]. Также вероятна перфорация верхнечелюстной артерии.
- Доступ через ротовую полость
-
- Модифицированная блокада верхнечелюстного нерва — каудальный доступ. Автор предпочитает данный метод, так как потенциальное повреждение глаза менее вероятно.При достаточном расслаблении связок есть дополнительные плюсы, включая возможность непосредственной пальпации точки введения иглы, и нет необходимости проводить иглу через кожу.
-
-
- Каудально оттяните губы и пальпируйте вентральную поверхность скуловой дуги из ротовой полости или используйте модифицированный чрезкожный метод.
- Продвигайтесь в каудальном направлении и держите иглу и шприц в плоскости, параллельной нёбу.
- Введите иглу в слизистую (или кожу) вентрально или медиально к соединению скуловой дуги и нёбных костей, в рострально-медиальном направлении, нацелясь на потивоположную ноздрю. Продвиньте иглу строго дорсально к нёбной кости в направлении крылонёбной ямки.
- Вводите местный анестетик в ямку, а также по ходу выведения иглы с целью заблокировать каудальный альвеолярный нерв верхней челюсти.
-
Блокада большого нёбного нерва: блок 7.
Ткани/области десенсибилизации: десенсибилизирует ткани твёрдого нёба со стороны ротовой полости. Используется для анальгезии при хирургических манипуляциях на нёбе.
Блок 7. Техника большой блокады большого нёбного нерва
- Техника:
-
- Введите местный анестетик в середине между серединной линией нёба и рядом зубов на уровне среднего корня 1-го моляра верхней челюсти (в середину 4-го премоляра) у собак и нёбного корня 4-го премоляра у кошек [43].
Блокада подбородочного нерва: блок 8.
Ткани/области десенсибилизации: эффективная блокада подбородочного нерва в идеале достигает нижнечелюстного канала и ростральных ветвей альвеолярного нерва. Десенсибилизирует нижнюю губу и ростральную межчелюстную область [40], но в исследовании на собаках достаточно десенсибилизированы были только 2-й, 3-й и 4-й премоляры [40]. В этом исследовании только часть мягких тканей была заблокирована, возможно, из-за коллатеральной иннервации или, потенциально, из-за того, что использованная доза была ниже описанной в других источниках [45; 6]. Десенсибилизация зубов была более выраженной (влияние на волокна С-типа) [33].
Блок 8. Техника блокады подбородочного нерва
- Техника:
-
- Пальпируйте среднее подбородочное отверстие вентральнее средней (ростральной) области 2-го премоляра.
- У кошек среднее подбородочное отверстие немного каудальнее или на уровне верхушки клыка нижней челюсти [43].
- Пальпируйте среднее подбородочное отверстие вентральнее средней (ростральной) области 2-го премоляра.
-
- Введите иглу в мягкие ткани немного ростральнее этого места.
- У средних и крупных собак местный анестетик можно вводить непосредственно в канал нижней челюсти [43], это может обеспечить десенсибилизацию ростральной области, достаточную, чтобы не выполнять полную блокаду нижней челюсти. Направьте иглу в отверстие в краниально-каудальном направлении с небольшим медиальным углом. Введите иглу как можно глубже, примерно на 2–4 мм в зависимости от размеров собаки/кошки.
- У пациентов меньшего размера вводите местные анестетики непосредственно под десну чуть ростральнее отверстия.
Блокада альвеолярного нерва нижней челюсти (каудальная нижнечелюстная; [2]): блок 9.
Ткани/области десенсибилизации: верхняя челюсть, нижняя губа и нижняя зубная арка.
Блок 9. Техника блокады альвеолярного нерва нижней челюсти
- Техника: альвеолярный нерв нижней челюсти блокируется в месте вхождения в нижнечелюстное отверстие, которое расположено с медиальной (лингвальной) стороны нижней челюсти примерно в центре между 3-м моляром и угловатым отростком нижней челюсти у собак [73] и на середине линии к дистальной части 1-го моляра у кошек [43].
-
- Доступ через ротовую полость: собака/кошка находится в латеральном положении, а шприц направлен горизонтально, введите иглу через десну около отверстия, в описанном ранее месте [67]. Часто возможно пальпировать отверстие, особенно у средних и крупных собак.
- В соответствии с данными Goudie-DeAngelis, Snyder, Raffe, и David [27]: «Нижнечелюстное отверстие пальпируется, а скос иглы проходит вдоль ветви нижней челюсти, пока не достигнет отверстия. Шприц, расположенный вне рта, располагается по центру 1-го премоляра противоположной стороны ротовой полости. Выполните аспирационную пробу и введите препарат медленно, дольше 30 сек.».
- Доступ через ротовую полость: собака/кошка находится в латеральном положении, а шприц направлен горизонтально, введите иглу через десну около отверстия, в описанном ранее месте [67]. Часто возможно пальпировать отверстие, особенно у средних и крупных собак.
- Доступ снаружи ротовой полости: собака/кошка в латеральном положении, блокируйте свободную (верхнюю) сторону нижней челюсти. Пальпируйте нижнечелюстное отверстие одной рукой через ротовую полость. Другой рукой введите иглу в кожу близко к медиальной части нижней челюсти и продвиньте дорсально в десну в область отверстия. Выполните аспирационную пробу и введите анестетик [67].
-
- Отверстие может быть затруднительно пальпировать у мелких собак и кошек [27]. Однако пальпация отверстия не обязательна, а определить примерное место инъекции можно с помощью известных ориентиров. Эти ориентиры также описаны у [27]: «Воображаемая линия, проведённая от латерального угла глаза к центру вентрального жёлоба нижней челюсти. Введите иглу вдоль надкостницы нижней челюсти со стороны языка, скос иглы направлен к подъязычной кости. Продвиньте на 1/3 высоты нижней челюсти». Ориентиры одинаковы как для доступа через ротовую полость, так и для доступа снаружи ротовой полости.
- При этом пальпация отверстия может повысить эффективность блокады. По сравнению с доступом через ротовую полость данный метод становится менее точным без пальпации отверстия [27].
- Возможные осложнения включают: случайный укол пальца иглой. Контроль отверстия пальцем может улучшить место введения иглы, но увеличивает риск данного осложнения.
- Десенсибилизация языкового нерва и самоповреждение языка может возникнуть из-за некорректного введения или использования повышенных объёмов местного анестетика, как в одном описании клинического случая, в котором объём введённого препарата был в 3 раза больше объёма, рекомендуемого авторами этой статьи [16]. Авторы не сталкивались с таким осложнением и блокируют одновременно обе стороны на регулярной основе. При необходимости бупивакаин или ропивакаин можно вводить для блокады одной стороны на более длительное время, а для блокады другой стороны можно использовать лидокаин. Лидокаин будет выводиться достаточно быстро и снизит вероятность сохранения десенсибилизации языка дольше ранней постоперационной фазы.
- Распространённое повреждение нижнечелюстного нерва (язычный нерв) у людей связано с использованием артикаина, вероятно, связано с его токсичностью [32] и не было описано в ветеринарной практике.
-
Альтернативные местные инъекции препаратов для местной анестезии
В то время как публикаций по альтернативным методикам немного, применение техник из человеческой стоматологической практики может предоставить альтернативный выбор для десенсибилизации некоторых участков, когда выполнение регионарной анестезии невозможно. Инъекция местных анестетиков в ткани, окружающие операционное поле верхней челюсти, может обеспечить десенсибилизацию мягких тканей и потенциально проникнуть в костную ткань, так как кости верхней челюсти менее плотные, чем кости нижней челюсти [67]. Инъекция объёмом до 0,2 мл в перидонтальную щель зуба крупной собаки может быть использована при экстракции зуба, однако, возвращаясь к части 1 статьи [30], следует напомнить, что локальные анестетики менее эффективны в областях с инфицированными тканями [67].
Другие блокады в области головы
Ретробульбарная блокада [26; 3; 54; 71]: блок 10.
Ткани/области десенсибилизации: структуры глаза, включая конъюнктиву, роговицу и сосудистую оболочку. Используется прежде всего при энуклеации, но может быть использована при других хирургических процедурах на глазах. Доступны подробные рисунки [12].
Блок 10. Техника ретробульбарной блокады
- Техника: техника, описанная здесь (нижневисочная пальпебральная ретробульбарная блокада), использовалась автором и была признана наиболее эффективной и простой из пяти различных доступов ретробульбарной блокады [3; 26].
Другие техники описаны Shilo-Benjamini [71].
- Сделайте небольшой изгиб на игле 22-го размера длиной 1,5 дюйма.
- Введите иглу в костный край нижней орбиты (то есть с глазной стороны орбиты) на середине между латеральным углом глаза и центром нижнего века. Иглу можно вводить как через кожу, так и оттянув веко вентрально и введя иглу через конъюнктиву.
- Медленно продвиньте иглу вдоль дна орбиты (иногда возникает ощущение, будто игла царапает кость), а затем дорсально и немного медиально, чтобы игла достигла задней части глазного яблока. Прокол глазной связки может вызвать щелчок.
- Выполните аспирационную пробу и введите препарат медленно. Если есть значительное сопротивление, прекратите введение и немного оттяните иглу, попробуйте ввести препарат снова. Повторите выведение иглы и попытку введения препарата, пока препарат не будет входить легко.
- БЛСИ также может быть использована для инфильтрации тканей после энуклеации, однако её применение не было показано для ретробульбарной блокады.
- Потенциальные осложнения в месте введения включают прокол глазного яблока (описано как нечастое [26]), введение препарата в сосуд (помните про предварительную аспирацию!), инъекцию в нерв (не вводите препарат при сильном сопротивлении), ретробульбарное кровотечение и проптоз, который более часто встречается при введении большого объёма анестетика у брахицефальных пород [26].
Другие блокады в области головы
Блокада ушно-височного и большого ушного нервов (20; 49): блок 11.
Ткани/область десенсибилизации: ушная раковина и наружный слуховой проход. Публикаций об эффективности этой техники немного и некоторые из них сообщают об отсутствии преимуществ местной блокады по сравнению с системными опиоидами в монорежиме [10], однако клинический опыт автора показал, что эта блокада частично эффективна и должна быть включена в комплексный протокол анальгезии. Автор использует эту блокаду при хирургии в области слухового прохода (тотальной резекции наружного слухового прохода (ТРНСП), ТРНСП с остеотомией буллы, удалении инородных тел и новообразований и т. п.) и глубокой санации ушей. Недавно описанная техника [77], ещё не опробованная авторами, вероятно, может улучшить эффективность блокады. Рецензент статьи согласен с Buback et al. [10].
Блок 11. Техника блокады ушно-височного и большого ушного нервов
- Техника блока большого ушного нерва: введите иглу подкожно (нерв расположен поверхностно) в точке непосредственно вентрально от крыла атланта и каудально от барабанного пузыря. Вертикальный слуховой проход пальпируется немного ростральнее от этого места, и его можно использовать в качестве ориентира.
- Техника блока ушно-височного нерва: введите иглу подкожно и немного глубже (если игла упирается в кость, вернитесь на половину расстояния между кожей и костью) сразу над самой каудальной точкой скуловой дуги, немного ростральнее вертикального слухового прохода.
- Введите примерно 0,5–1,5 мл препарата в зависимости от размера собаки/кошки в каждую точку.
- Блокада длительнодействующими анестетиками крайне желательна, так как боль в области уха может быть глубокой и продолжительной.
Блокады в области грудной клетки и грудных конечностей
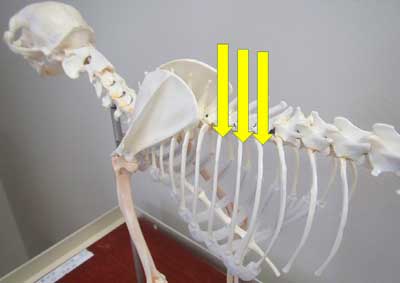
Межрёберная блокада [20; 24]: илл. 5 и блок 12.
Ткани/область десенсибилизации: мягкие ткани межрёберного пространства, расположенные дистальнее места инъекции. Используется для анальгезии ран или повреждений грудной клетки, мест установки/удаления торакальных дренажей, а также при хирургических операциях в грудной полости.
 |
|
Илл. 5. Ориентиры для межрёберной блокады на скелете собаки. Место инъекции обозначено стрелками |
Блок 12. Техника межрёберной блокады
- Техника: введите иглу в кожу и мышечные слои каудальнее проксимальной части (то есть ближайшей к позвоночному столбу) рёбер на 2–3 межрёберных промежутка краниальнее и 2–3 межрёберных промежутка каудальнее от области, которую требуется десенсибилизировать.
-
- Введите от 0,5 до 2 мл в каждую точку в зависимости от размера собаки/кошки.
- Потенциальные осложнения в месте инъекции включают перфорацию сосуда и пневмоторакс. Как и при других блокадах, внутрисосудистое введение местного анестетика может иметь потенциальные осложнения, поэтому перед введением препарата необходимо оттянуть поршень шприца, чтобы убедиться, что игла не находится в межрёберной артерии или вене. Пневмоторакс как осложнение был описан в медицине человека. Для снижения риска развития пневмоторакса авторы рекомендуют использовать иглы маленького размера (22G) и обходить иглой каудальный край ребра, то есть менять направление иглы за счёт изменения угла введения (острее или тупее) во время прохождения иглы около заднего края ребра. Оттяните поршень шприца, чтобы убедиться, что игла не находится в грудной клетке.
- Если при оттягивании поршня в шприц не попадает кровь или воздух, введите препарат в это место и продолжайте вводить в слои мышц и кожу, пока вынимаете иглу. Если в шприц при оттягивании поршня попадает кровь или воздух, немного вытяните иглу и оттяните поршень снова. Вводите препарат, только когда кровь или воздух не будут набираться в шприц при оттягивании поршня.
- Липосомальный бупивакаин применялся для этой блокады в медицине человека [37]. Это позволило снизить объём послеоперационного использования опиоидов в течение 24 часов и быстрее выписывать пациентов из госпиталя по сравнению с пациентами, для которых использовали обычный бупивакаин. Авторы используют такую блокаду как у кошек, так и у собак.
Блокады для десенсибилизации грудных конечностей (пясти): блок 13.
Ткани/область десенсибилизации: все мягкие ткани пясти. Используется у кошек и собак при болезненных хирургических процедурах или ранах конечностей, таких как повреждения подушечек, отрыв когтя, и при удалении инородных тел.
Блок 13. Техники блокад пясти
- Техники
-
- Трёхточечная блокада
-
-
- В области запястья и добавочной подушечки запястья.
- Введите 0,1–0,3 мл (в зависимости от размера собаки/кошки) подкожно в три точки:
-
-
-
-
- Медиальнее от добавочной подушечки запястья, блокируя срединный нерв и пальмарную ветвь локтевого нерва.
- Латерально и проксимально от добавочной подушечки запястья, блокируя дорсальную ветвь локтевого нерва.
- В дорсо-медиальную часть запястья, блокируя поверхностные ветви лучевого нерва.
-
-
-
- Четырёхточечная техника блокады запястья Эномото
-
-
- Местные анестетики вводят в четыре точки для десенсибилизации поверхностных ветвей лучевого нерва, дорсальных ветвей локтевого нерва, срединного нерва и поверхностной и глубокой ветви пальмарного ответвления локтевого нерва.
- Описание этой блокады выходит за рамки данной публикации. Описание и подробные иллюстрации опубликованы у [21].
- Есть опыт периневрального использования липосомального бупивакиана для подобных блокад в медицине человека [76]. Четырёхточечная блокада Эномото была использована для оценки степени анальгезии при использовании БЛСИ (NOCITA®) и опубликована на сайте продукта во вкладке для кошек [56].
-
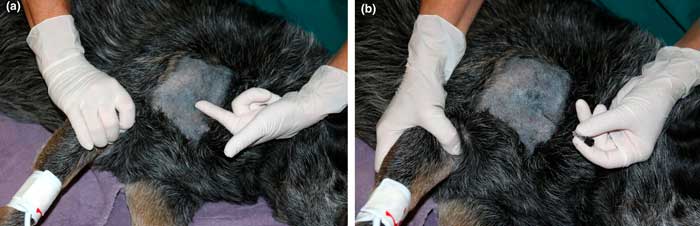
Блокады плечевого сплетения [20; 53; 87; 19; 57]: илл. 6 (а) и (b) и блок 14. Существует две техники: (1) чрезкожная «слепая» инъекция и (2) периневральная инъекция с прямой визуализацией, которая выполняется только во время межлопаточно-грудного вычленения.
Ткани/область десенсибилизации: мягкие ткани от дистальной части плечевой кости до кончиков пальцев, иннервируемые кожно-мышечным, лучевым, срединным и локтевым нервами. Эта блокада не обеспечивает достаточной десенсибилизации локтя, но может быть использована как часть комплексного протокола.
 |
|
Илл. 6. Ориентир для блокады плечевого сплетения, показаны плечо (а) и место введения иглы (b) |
Блок 14. Техники блокады плечевого сплетения
- Техника подкожной слепой инъекции: определите расположение акромиона лопатки, первого ребра и яремной вены.
-
- Введите иглу нейростимулятора или обычную иглу длиной 2–4 дюйма (подойдёт спинальная игла) в аксиальную сторону акромиона. Направляйте иглу строго каудально или немного каудо-вентрально (параллельно яремной вене). Держите иглу в сагиттальной плоскости грудной клетки — конец иглы может воткнуться в аксиальную строну лопатки. Это нормально. Немного вытяните иглу и поменяйте направление. Остановитесь, когда кончик иглы окажется на одном уровне с первым ребром или каудальным краем лопатки (это примерно одно и то же место).
- Оттяните поршень шприца, затем введите 1/3 объёма местного анестетика. Оттяните иглу до середины лопатки, затем в точку перед выходом иглы из кожи и снова оттяните поршень шприца. Введите 1/3 анестетика в этих двух положениях.
- Потенциальное осложнение в месте инъекции — риск перфорации плечевой артерии.
- Использование нейростимулятора или ультразвукового контроля повышает точность выполнения блокады при использовании этого метода [64].
- Была описана техника, позволяющая обеспечить анальгезию всей передней конечности (шейная паравертебральная блокада)[46]. Использование нейростимулятора или ультразвука повышает точность этой блокады. Существуют другие техники, включая описанные [72; 34].
Блокада лучевого/локтевого/срединного/кожно-мышечного нервов (RUMM) [81]: блок 15.
Ткани/область десенсибилизации: структуры дистальной части грудной конечности, включая запястье, пясть и пальцы. Опубликованы подробные иллюстрации [81]. Применяется для болезненных хирургических процедур и при повреждениях дистальнее локтя, включая пясть. В качестве примера можно привести остеосинтез перелома лучевой и локтевой кости и ампутацию пальца.
Блок 15. Техника блокады лучевого/локтевого/серединного и кожно-мышечного нерва
- Техника: при согнутом локте с помощью пальпации определите места инъекций.
-
- Лучевой нерв расположен на латеральной стороне грудной конечности: пациент должен находиться в латеральном положении, лёжа на конечности, на которой НЕ будет выполняться блокада. Место инъекции расположено на задней части плечевой кости в точке на 2/3 длины плечевой кости от проксимального её конца и 1/3 длины плечевой кости от дистального конца (то есть 2/3 длины дистальнее большого бугорка или 1/3 длины проксимальнее надмыщелка). Иглу вводят в каудальную область плечевой кости, перпендикулярно ей. Игла будет проходить через длинную головку трёхглавой мышцы [81] или между длинной и латеральной головками трицепса. Как только игла упрётся в плечевую кость, немного вернитесь назад и после аспирационной пробы введите 0,1 мл местного анестетика.
- Локтевой, серединный и мышечно-кожный нервы расположены на внутренней стороне передней конечности: пациент должен находиться в латеральном положении, лёжа на конечности, которую блокируют. Вытяните конечность каудально таким образом, чтобы она лежала перед противоположной конечностью, которая находится над ней, и пальпируйте плечевую артерию на середине плечевой кости. Введите иглу каудальнее плечевой артерии и двуглавой мышцы плеча — в некоторых случаях их нужно осторожно сдвинуть краниально. Иглу введите в каудальную область плечевой кости, перпендикулярно ей. Игла пройдёт через [81] или вдоль длинной головки трицепса. Как только игла упрётся в плечевую кость, вернитесь немного назад и после аспирационной пробы введите 0,075 мл/кг местного анестетика и введите ещё 0,075 мл/кг во время выведения иглы.
- Возможные осложнения в месте инъекции отсутствуют. Как и при других блокадах, которые выполняются рядом с сосудами, пункция вероятна, но встречается нечасто [81].
Блокада семенников
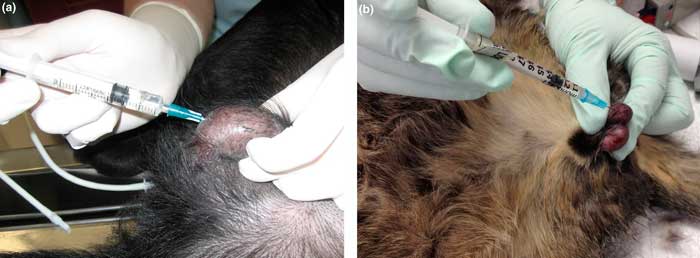
Блокада семенников [61; 41; 35; 52]: илл. 7 (а) и (b) и блок 16.
Ткани/область десенсибилизации: семенной канатик и связанные с ним структуры. Используется для анальгезии при кастрации.
Внутрибрюшной лаваж: ткани и область десенсибилизации — серозные поверхности брюшной полости, включая ткани яичников и матки, задействованные при овариогистерэктомии. В связи с более простым введением препаратов и учитывая данные множества публикаций, подтверждающих эффективность этой блокады, автор предпочитает эту технику технике инъекции в связку яичника.
Блокада связки яичника: десенсибилизируемые ткани — связка яичника и связанные с ней структуры.
 |
|
Илл. 7. Блокада яичника у собак (а) и кошек (b) |
Блок 16. Техника блокады семенников
- Техника: введите иглу непосредственно в тело семенника, направляя конец иглы к семенному канатику.
-
- Оттяните поршень шприца, введите половину общей рекомендованной для данного вида животных дозы бупивакаина, ропивакаина или лидокаина, или объёма, приводящего к повышению давления в тканях (что наступит ранее), в каждый семенник. Повышение тканевого давления проявляется как выраженное увеличение объёма семенника.
- ОБРАТИТЕ ВНИМАНИЕ: некоторые специалисты используют для этой блокады только лидокаин, так как семенники пронизаны множеством кровеносных сосудов и существует потенциальный риск попадания препарата в системный кровоток. Автор применяет бупивакаин или ропивакаин из-за более длительного действия, при этом перед введением обязательно оттягивая поршень шприца. Не существует доказанных данных о том, что один препарат лучше/безопаснее другого, поэтому для принятия решения о том, какой препарат использовать для этой блокады, врач должен основываться на опыте и удобстве использования препарата.
- Препарат проникает в семенной канатик [65] и подавляет интраоперационно ноцицепцию и постоперационно боль от хирургического повреждения канатика и сосудов.
- У кошек разрез в большинстве случаев выполняют непосредственно над семенником, и инфильтрация препарата должна продолжаться во время выведения иглы из семенника для блокады кожи и подкожных тканей.
- У собак разрез обычно выполняют в прескротальной области, и местный анестетик должен быть введён в кожу и подкожные ткани в месте разреза.
- Будьте готовы ввести 0,2–2 мл в каждый семенник, в зависимости от размера собаки/кошки.
- Липосомальный бупивакаин может быть введён непосредственно в семенной канатик, профилактируя его попадание в васкуляризированные места. Он не будет распространяться на семенной канатик из семенника.
- Специфических осложнений в месте инъекции нет, но семенник часто будет выглядеть повреждённым. Это не имеет значения, так как семенник в большинстве случаев должен быть удалён.
Местная / регионарная анальгезия при овариогистерэктомии
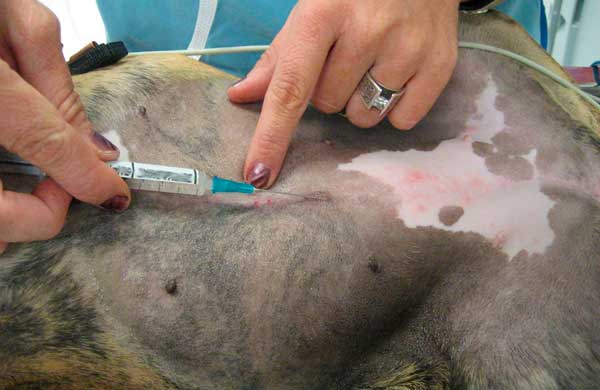
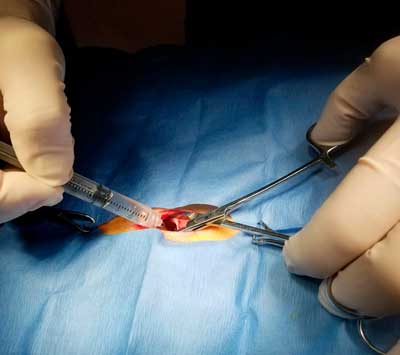
Могут быть использованы две техники: лаваж брюшной полости с местными анестетиками [15; 89; 8; 42]: илл. 8 и блоки 17 и 18; или прямая инфильтрация связки яичника: блок 16. Для той и другой техники кожа и подкожные ткани в месте разреза также должны быть обезболены.
 |
|
Илл. 8. Инстилляция местных анестетиков через разрез для овариогистерэктомии для лаважа брюшной полости |
Блок 17. Техника лаважа брюшной полости местными анестетиками
- Техника: наберите в шприц 2–4 мг/кг (кошкам) или 4–6 мг/кг (собакам) лидокаина ИЛИ 1–2 мг/кг (кошкам) или 2–4 мг/кг (собакам) бупивакаина или ропивакаина. При необходимости разведите стерильным физиологическим раствором, чтобы довести общий объём до 0,4–0,6 мл/кг.
-
- Эти дозы не максимальные. При введении собакам 8,8 мг/кг лидокаина ИЛИ 4,4 мг/кг бупивакаина (внутрибрюшное введение) и 2 мл этого же препарата в место инъекции не развивается побочных эффектов [15]. В этом исследовании препарат для местной анестезии был разбавлен до общего объёма 0,88 мл/кг. Концентрация лидокаина в плазме не достигала токсического уровня при введении 8 мг/кг интраперитонеально и 2 мг/кг в место разреза [89].
- Для лаважа брюшной полости введите смесь физиологического раствора и местного анестетика в брюшную полость сразу после рассечения брюшной стенки или непосредственно перед закрытием брюшной полости. Закройте разрез в соответствии с рутинным хирургическим протоколом, оставив препарат в брюшной полости.
- В медицине человека лаваж брюшной полости используется для контроля интраоперационной ноцицепции и послеоперационной боли и при других хирургических операциях на брюшной полости [9; 68], например, при кесаревом сечении [60]. Лаваж брюшной полости в редких случаях используется для таких операций и в ветеринарной медицине, но публикаций на сегодняшний день нет.
- БЛСИ вводят непосредственно в ткани, и поэтому маловероятно, что она будет эффективна для интраперитонеальной техники, но может быть использована для десенсибилизации места разреза.
Блок 18. Техника прямой инфильтрации связки яичника
- Техника: откройте брюшную полость, поднимите один из яичников, найдите и инфильтрируйте связку, поднимите другой яичник, определите и инфильтрируйте связку, удалите первый яичник, удалите второй яичник, завершите процедуру овариогистерэктомии.
- Так как местные анестетики абсорбируются через слизистые оболочки, орошение яичника лидокаином обеспечивает анальгезию у кошек без необходимости выделения связки яичника [91]. В этом исследовании 2-процентный раствор лидокаина 1 мг/кг был введён в кожу и 2 мг/кг применяли местно на каждый яичник, 1 мг/кг был введён в мышечные слои брюшной стенки. Исследование показало, что использование местных анестетиков во все три области привело к снижению потребности в кетамине для группы, получавшей местную анальгезию лидокаином.
- Объём, введённый или распылённый в каждую область, составил примерно 0,5 мл для мелких собак или кошек и до 3 мл на каждую область для крупных собак. Можно использовать объёмы, не превышающие максимальную рекомендованную дозу. Введение БЛСИ непосредственно в ткани будет затруднено из-за недостаточной визуализации места инъекции.
Эпидуральная анальгезия
Крестцово-копчиковая или межкопчиковая эпидуральная блокада: илл. 9 и 10, блок 19.
Ткани/область десенсибилизации: мягкие ткани промежности, хвост и крестцовый отдел позвоночника, иннервируемые срамным, тазовым и хвостовым нервами. Обеспечивает анальгезию для катетеризации мочевого пузыря (например, для лечения обструкции мочевого пузыря; [58]), ампутации хвоста, удаления параанальных желёз, лечения констипации, вагинальном родовспоможении у кошек и собак, промежностной уретростомии и других хирургических операциях в области промежности.
Блок 19. Техника выполнения крестцово-копчиковой или межкопчиковой эпидуральной блокады
- Техника: определите место инъекции, двигая хвост вверх и вниз (дорсо-вентрально) качающими движениями, при этом пальпируя крестцово-копчиковую область. Первая подвижная зона на каудальном конце крестца — это крестцово-копчиковое или межкопчиковое пространство. И то, и другое подходит для блокады, не нужно уточнять, какое именно место определено.
-
- Введите иглу 22-го или 25-го размера через кожу ПО СРЕДНЕЙ ЛИНИИ под углом 60–90 градусов к поверхности кожи, при этом более острый угол (45–30 градусов) может также быть использован для первоначального доступа.
- Продвигайтесь медленно, пока игла не войдёт в эпидуральное пространство. В большинстве случаев игла упрётся в кость позвонка, но может обойти кость, что происходит из-за смещения иглы при небольшом изменении угла в месте введения (более острый или тупой) до входа в эпидуральное пространство. Можно почувствовать «щелчок» при прокалывании иглой жёлтой связки, но отсутствие «щелчка» не должно быть расценено как неверное введение иглы, особенно при использовании обычной подкожной иглы. Эти иглы острее, чем эпидуральные или спинальные иглы, и могут проходить через связки без «щелчка».
- Введите 0,1 мл/кг в зависимости от размеров собаки/кошки. Не должно быть сопротивления при введении препарата, или оно должно быть минимальным.
- Избегайте введения воздуха. Гипотетически в таком небольшом пространстве пузырёк воздуха может стать причиной неполной блокады [58].
- Для этой блокады подходят лидокаин, бупивакаин и ропивакаин. Касательно использования БЛСИ информация отсутствует, и авторы не использовали БЛСИ для этой блокады.
- Специфических осложнений в месте инъекции нет. Спинной мозг заканчивается у краниальной границы позвонка L7 у крупных собак и в области пояснично-крестцового сочленения у мелких собак и кошек [88], поэтому повреждения спинного мозга исключены. Увеличение объёма вводимого препарата может привести к более высокому краниальному распространению препарата, с вероятной блокадой двигательных нервов таза. При этом у кошек не происходит нарушений функций тазовых конечностей при введении 0,1–0,2 мл/кг местного анестетика [58].
- Авторы выполняют блокаду так же, как описано в этой публикации, а в некоторых случаях используют стимуляцию нервов [59].
 |
|
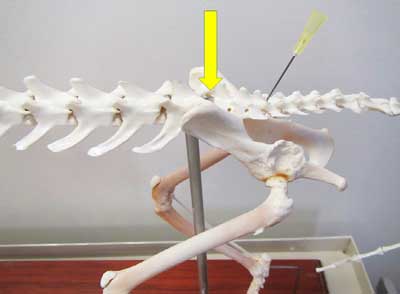
Илл. 9. Пояснично-крестцовая и крестцово-копчиковая эпидуральные блокады — точки на скелете собаки: стрелкой показано место для выполнения пояснично-крестцовой эпидуральной блокады, которое находится между последним поясничным позвонком и краниальной границей крестца. Игла показывает место для выполнения крестцово-копчиковой эпидуральной блокады, которое расположено между каудальным краем крестца и первым копчиковым позвонком |
 |
|
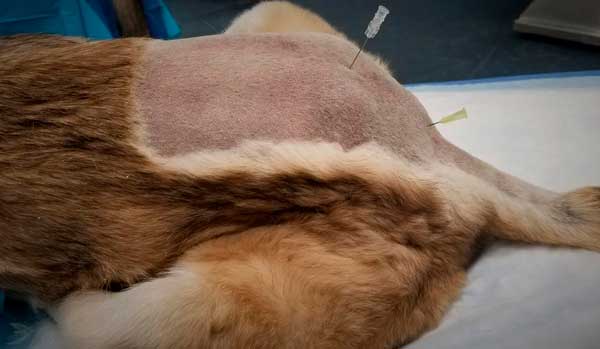
Илл. 10. Пояснично-крестцовая и крестцово-копчиковая эпидуральная блокада кошки: игла слева находится в точке для пояснично-крестцовой эпидуральной блокады, которая расположена между последним поясничным позвонком и краниальным краем крестца. Игла справа в точке для крестцово-копчиковой эпидуральной блокады, которая расположена между каудальным краем крестца и первым хвостовым позвонком |
Пояснично-крестцовая эпидуральная блокада [25; 82; 83]: илл. 9 и 10, блок 20.
Ткани/область десенсибилизации: все структуры, расположенные каудальнее места инъекции, включая структуры задних конечностей, промежности и хвоста. Краниально десенсибилизация распространяется обычно до уровня Т13 при использовании объёма введения 0,2 мл/кг. При введении бóльших объёмов или использовании эпидурального катетера область десенсибилизации может распространиться краниальнее. Используется для анальгезии при хирургических операциях в брюшной полости, операциях на тазовой конечности, включая ортопедические, и может быть использована для тех же процедур в области промежности / урогенитальной области, как и крестцово-копчиковая эпидуральная блокада.
Блок 20. Техника пояснично-крестцовой эпидуральной блокады
- Техника: определите место инъекции путём пальпации пояснично-крестцового сочленения, оно пальпируется как достаточно большое пространство на средней линии почти на одном уровне с крыльями подвздошной кости. Пациент может быть в стернальном или латеральном положении, и задние конечности можно вытянуть вперёд (чтобы увеличить расстояние между поясничным позвонком и крестцом, что делает это пространство больше) или назад (часто упрощает пальпацию места инъекции у крупных собак с избыточным весом).
-
- Побрейте и асептически обработайте эту область. Наденьте перчатки. Рекомендуется использовать небольшое оперполе или стерильную перчатку в качестве поля.
- Введите эпидуральную или спинальную иглу (например, иглу Тоухи) в каудальной части пояснично-крестцового пространства, под углом 45 градусов от вертикальной оси.
- Медленно продвиньте иглу до входа в эпидуральное пространство.
-
-
- Часто работает метод висячей капли (капля жидкости попадает в павильон иглы при входе в эпидуральное пространство).
- Можно почувствовать несколько «щелчков», которые используют для контроля глубины проникновения иглы.
- Если игла упирается в кость, вытяните иглу на несколько миллиметров, немного перенаправьте (поменяйте угол введения на более острый или тупой) и продолжите продвижение иглы (обходя кость). Повторите это действие, пока игла не попадёт в пространство между позвонками.
- ОСТАНОВИТЕСЬ, как только войдёте в пространство, и введите препарат.
-
-
-
- Некоторые специалисты, как и авторы статьи, рекомендуют оттягивать поршень шприца перед введением препарата, чтобы убедиться, что игла не находится в сосуде (тогда в шприц попадёт кровь) или не проткнула твёрдую мозговую оболочку (тогда в шприц попадёт цереброспинальная жидкость). При этом другие убеждены, что отрицательное давление, создаваемое оттягиванием поршня шприца, может повредить нежные ткани оболочки.
- Если в шприц попадает кровь, иглу можно немного вытянуть и снова оттянуть поршень шприца, пока кровь не перестанет набираться в шприц, затем введите препарат. Некоторые эксперты рекомендуют полностью вынуть иглу и начать процедуру заново. Авторы придерживаются первого метода. Если в шприц попадает цереброспинальная жидкость, рекомендуется вводить только половину препарата, чтобы избежать высокого распространения препарата с сопутствующим угнетением центральной нервной системы. Несмотря на частое использование, эта рекомендация не имеет доказательств.
- Пробное введение физиологического раствора можно использовать, чтобы убедиться, что игла находится в эпидуральном пространстве.
- Если игла в эпидуральном пространстве, то препарат будет вводиться легко.
- Для точного определения, что игла находится в пояснично-крестцовом эпидуральном пространстве, нужно остановить введение и убрать большой палец с поршня шприца. Препарат продолжит вводиться, если игла находится в эпидуральном пространстве.
-
-
- Если введение препарата затруднено, вероятнее всего, игла была введена немного глубже в момент присоединения шприца. Вытяните иглу на 1–2 мм и попробуйте снова.
- После того как препарат введён, выньте иглу и приступайте к хирургии.
- При использовании местных анестетиков можно оставить пациента лежать областью оперативного вмешательства вниз примерно 5 мин., чтобы препарат мог омыть нервы конечности, на которой он лежит. При использовании опиоидов в монорежиме данный метод не усилит анальгезию, так как местом действия являются опиоидные рецепторы в спинном мозге, а не локальные нервы. Эффективность такого позиционирования пациентов находится под вопросом.
- Чаще всего используют опиоиды, но также возможно применение местных анестетиков в монорежиме или в комплексе с опиоидами.
-
- 0,1 мг/кг морфина (золотым стандартом является морфин без консервантов, но с консервантами также может быть использован). Другие опиоиды обладают более коротким действием, чем морфин, но в большинстве случаев их применение также допустимо [82].
- Доведите общий объём до 1 мл/4,5 кг или 0,2 мл/кг лидокаином, бупивакаином или ропивакаином, стерильным физиологическим раствором или водой для инъекций общим объёмом до 6 мл, если используете местные анестетики (см. объяснение в пункте «Осложнения»).
- Морфин почти не растворяется в жирах и поэтому остаётся в эпидуральном пространстве и обеспечивает до 24 часов анальгезии с минимальным попаданием в системный кровоток. Время начала анальгезии составляет 30–60 мин. Опиоиды вызывают сенсорную блокаду, развитие двигательной блокады маловероятно.
- Местные анестетики имеют время начала и продолжительность действия, сходные с таковыми при блокаде в любом другом месте. Местные анестетики усиливают обезболивающий эффект блокады [39]. Они могут вызывать двигательную блокаду, однако нарушение двигательных функций обычно минимально или проходит к моменту пробуждения пациента от анестезии и моменту выписки в амбулаторию.
- Специфические осложнения включают неэффективную или неполную блокаду (наиболее распространённое осложнение), эпидуральную гематому или абсцесс или гипералгезию (очень редко). Чрезмерный объём местного анестетика может распространяться краниально от места блокады к нервам, контролирующим диафрагму, с сопутствующими нарушениями вентиляции. Рекомендация не превышать 6 мл общего вводимого объёма местных анестетиков существует для профилактики этого осложнения. Задержка мочи может развиться, но бывает редко, и мочевой пузырь можно легко опорожнить [36; 80]. Замедленное отрастание шерсти также может наблюдаться на месте блокады [36; 80]. С этим ничего не поделать при эпидуральном введении препаратов, сбритая шерсть отрастает в пояснично-крестцовой области медленнее, чем в любом другом месте [17]. Противопоказания включают нарушения системы свёртываемости крови (для профилактики гематом) и кожные заболевания в пояснично-крестцовой области (во избежание абсцессов). Ненормальное анатомическое строение таза (врождённые аномалии или травма) может затруднить выполнение эпидуральной блокады.
- Эпидуральные катетеры можно ставмит у крупных собак на несколько дней для постоянного или периодического введения обезболивающих препаратов [79].
Другие блокады тазовых конечностей
Блокады для десенсибилизации тазовых конечностей (плюсны): блок 21.
Ткани/область десенсибилизации: все мягкотканные структуры плюсны. Применяется у кошек и собак для болезненных операций и лечения ран на конечностях, таких как разрыв подушечек, отрыв когтя и удаление инородных тел.
Блок 21. Техника блокады плюсны
- Кольцевая блокада: введите местный анестетик подкожно по всей дорсальной и всей вентральной стороне стопы в месте примерно в средней (от проксимального до дистального) части стопы. Две подкожные инъекции образуют кольцо местной блокады.
- Техника Эномото для плюсны
-
- Две инъекции рекомендованы, чтобы избежать накопления препарата около специфических нервов. Дистальная блокада голени включает большеберцовый нерв, общий малоберцовый (перонеальный) нерв и нерв Сафена. Дистальная блокада лапы включает две ветви общего малоберцового (перонеального) нерва (поверхностный малоберцовый (перонеальный) нерв и глубокий малоберцовый (пронеальный) нерв), большеберцовый нерв и нерв Сафена.
- Описание блокады находится за пределами компетенции этой статьи, но описание и соответствующие подробные иллюстрации доступны у [22].
Седалищная/бедренная блокада [51; 13; 11; 31]: илл. 11, блок 22.
Ткани/область десенсибилизации: используемые вместе, эти блокады будут десенсибилизировать структуры тазовых конечностей от дистальной части бедра до пальцев.
 |
|
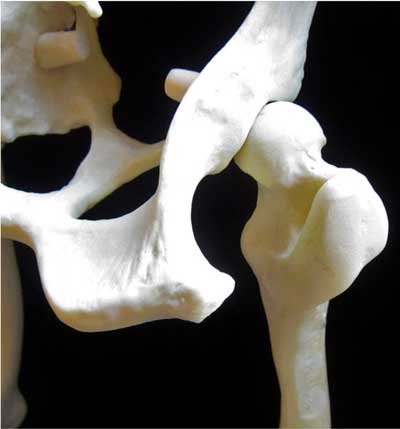
Илл. 11. Ориентиры для блокады седалищного нерва на модели таза/бедра собаки. Слева расположен седалищный бугор, а справа большой вертел бедренной кости. Инъекцию выполняют на 1/3 расстояния от большого вертела на линии, которая соединяет большой вертел и седалищный бугор. Используется для ортопедических операций и операций на мягких тканях тазовой конечности |
Блок 22. Техника блокады седалищного и бедренного нерва
- Несмотря на то что сравнительные данные не были опубликованы, можно утверждать, что нейростимулятор или ультразвуковой контроль позволяют улучшить точность блокады, особенно бедренного нерва [12; 59; 63].
- Техника, описанная здесь, используется автором. Обзор этой и других техник опубликован у [31, 12 и 59].
-
- Седалищный нерв (илл. 11)
-
-
- Расположение нерва легко определить, так как он лежит во впадине, образованной большим вертелом бедренной кости и подвздошным бугром.
- Введите примерно 0,1 мл/кг местного анестетика на 1/3 расстояния от большого вертела на линии, ведущей к подвздошному бугру.
- Бедренный нерв (подробная иллюстрация доступна у [12])
- Нерв лежит в бедренном «треугольнике» на медиальной поверхности бедра, ограниченный дорсально прямой мышцей бедра, а краниально каудальной частью портняжной мышцы и снизу подвздошно-поясничной мышцей.
- Определите бедренную артерию и держите палец на артерии, чтобы избежать её случайного прокола. Направляйте иглу дорсо-медиально к артерии в глубину, эквивалентную размеру артерии.
- Потенциальным осложнением является перфорация бедренной артерии, поэтому, как и при других блокадах, перед введением препарата оттяните поршень шприца. Введите примерно 0,2 мл/кг местного анестетика.
- Исследование по безопасности Комитета по безопасности продуктов питания и лекарственных средств США (FDA) одобрило использование БЛСИ у кошек при супраингвинальном доступе к бедренному нерву в повышенных дозах (сайт продукта NOCITA®). Липосомальный бупивакаин использовался для блокады бедренного нерва у людей [74].
-
Заключение
Местные и регионарные блокады безопасны и эффективны у собак и кошек при правильной технике выполнения и использовании адекватных доз препаратов, описанных в этом обзоре. Местные анестетики можно вводить непосредственно в ткани, чтобы обеспечить анальгезию при хирургических операциях и лечении ран, или периневрально для обезболивания при различных болезненных состояниях. В связи со способностью обеспечивать глубокую анальгезию и профиль безопасности (при корректном использовании) местные анестетики рекомендованы как часть протокола анальгезии для большинства пациентов при хирургических вмешательствах или травматических повреждениях. Существует множество местных и регионарных блокад, описанных для использования у собак и кошек, позволяющих практикующему врачу контролировать ноцицепцию и передачу болевых импульсов и обеспечивать более глубокое обезболивание, чем при использовании системных препаратов в монорежиме.
Конфликт интересов
Несмотря на то что подготовка статьи была поддержана Aratana Therapeutics — производителем липосомального бупивакаина (NOCITA®), по мнению авторов, информация, приведённая в статье, является сбалансированным мнением об использовании всех местных анестетиков с подробной информацией по липосомальному бупивакаину (ввиду того, что это новый препарат). Других конфликтов интересов у авторов нет.
Вам также могут быть интересны статьи:
«Эпидуральная анестезия и её осложнения»
«Особенности анестезии кошек при гипертиреоидозе и собак при гипотиреоидозе»
Литература
-
Abrao, J., Fernandes, C. R., White, P. F., Shimano, A. C., Okubo, R., Lima, G. B.,Garcia, S. B. (2014). Effect of local anaesthetic infiltration with bupivacaine and ropivacaine on wound healing: A placebo-controlled study. International Wound Journal, 11(4), 379-385. https :// doi.org/10.1111/j.1742-481X.2012.01101.x
-
Aguiar, J., Chebroux, A., Martinez-Taboada, F., & Leece, E. A. (2015). Analgesic effects of maxillary and inferior alveolar nerve blocks in cats undergoing dental extractions. Journal of Feline Medicine & Surgery, 17(2), 110-116. https://doi.org/10.1177/1098612X14 533551
-
Accola, P. J., Bentley, E., Smith, L. J., Forrest, L. J., Baumel, C. A., & Murphy, C. J. (2006). Development of a retrobulbar injection technique for ocular surgery and analgesia in dogs. Journal of the American Veterinary Medical Association, 229(2), 220-225. https :// doi.org/10.2460/javma.229.2.220
-
Barton-Lamb, A. L., Martin-Flores, M., Scrivani, P. V., Bezuidenhout, A. J., Loew, E., Erb, H. N., & Ludders, J. W. (2013). Evaluation of maxillary arterial blood flow in anesthetize cats with the mouth closed and open. The Veterinary Journal, 196(3), 325-331.
-
Baxter, R., Bramlett, K., One, E., & Daniels, S. (2013). Impact of local administration of liposome bupivacaine for postsurgical analgesia on wound healing: A review of data from ten prospective, controlled clinical studies. Clinical Therapeutics, 35(3), 312-320. https://doi. org/10.1016/j.clinthera.2013.02.005
-
Beckman, B. W. (2006). Pathophysiology and management of surgical and chronic oral pain in dogs and cats. Journal of Veterinary Dentistry, 23, 50-60. https://doi.org/10.1177/089875640602300110
-
Beckman, B. W., & Legendre, L. (2002). Regional nerve blocks for oral surgery in companion animals. Compendium for Continuing Education for the Practicing Veterinarian, 24(6), 439-444.
-
Benito, J., Monterrey, B., Lavoie, A. M., Beauchamp, G., Lascelles, B. D. X., & Steagall, P. V. (2016). Analgesic efficacy of intraperitoneal administration of bupivacaine in cats. Journal of Feline Medicine & Surgery, 18(11), 906-912.
-
Boerboom, S. L., de Haes, A., Vd, W. L., Aarts, E. O., Janssen, I. M. C., Geurts, J. W., & Kamphuis, E. T. (2018). Preperitoneal bupivacaine infiltration reduces postoperative opioid consumption, acute pain, and chronic postsurgical pain after bariatric surgery: a randomized controlled trial. Obesity Surgery, 28(10), 3102-3110. https://doi. org/10.1007/s11695-018-3341-6
-
Buback, J. L., Boothe, H. W., Carroll, G. L., & Green, R. W. (1996). Comparison of three methods for relief of pain after ear canal ablation in dogs. Veterinary Surgery, 25(5), 380-385. https://doi. org/10.1111/j.1532-950X.1996.tb01431.x
-
Campoy, L., Martin-Flores, M., Ludders, J. W., Erb, H. N., & Gleed, R. D. (2012). Comparison of bupivacaine femoral and sciatic nerve block versus bupivacaine and morphine epidural for stifle surgery in dogs. Veterinary Anaesthesia and Analgesia, 39(1), 91-98. https://doi. org/10.1111/j.1467-2995.2011.00673.x
-
Campoy, L., & Read, M. (2013). Small Animal Regional Anesthesia and Analgesia. Hoboken, NJ: John Wiley & Sons, Inc.
-
Caniglia, A. M., Driessen, B., Puerto, D. A., Bretz, B., Boston, R. C., & Larenza, M. P. (2012). Intraoperative antinociception and postoperative analgesia following epidural anesthesia versus femoral and sciatic nerve blockade in dogs undergoing stifle joint surgery. Journal of the American Veterinary Medical Association, 241(12), 1605-1612. https://doi.org/10.2460/javma.241.12.1605
-
Cantatore, M., Ferrari, R., Boracchi, P., Gobbetti, M., Travetti, O., Ravasio, G Stefanello, D. (2014). Factors influencing wound healing complications after wide excision of injection site sarcomas of the trunk of cats. Veterinary Surgery, 43(7), 783-790. https : //doi. org/10.1111/j.1532-950X.2014.12217.x
-
Carpenter, R. E., Wilson, D. V., & Evans, A. T. (2004). Evaluation of intraperitoneal and incisional lidocaine or bupivacaine for analgesia following ovariohysterectomy in the dog. Veterinary Anaesthesia and Analgesia, 31(1), 46-52. https://doi.org/10.1111/j.1467-2995.2004.00137.x
-
Chau, A. Y. K. (2017). Tongue lacerations in a geriatric dog after bilateral inferior alveolar nerve blocks with bupivacaine. Veterinary Record Case Reports, 5, e000433. https://doi.org/10.1136/vetre ccr-2017-000433
-
Diaz,S. F., Torres, S. M.,Nogueira, S. A., Gilbert, S.,&Jessen, C. R. (2006).The impact of body site, topical melatonin and brushing on hair regrowth after clipping normal Siberian Husky dogs. Veterinary Dermatology, 17(1), 45-50. https://doi.org/10.1111/j.1365-3164.2005.00497.x
-
Dugdale, A. (2010). Local anaesthetic techniques for the head: Small animals. In A. Dugdale (Ed.), Veterinary Anaesthesia: Principles to Practice (pp. 118-122). Oxford, UK: Wiley-Blackwell.
-
Duke, T., Cullen, C. L., & Fowler, J. D. (1998). Anesthesia case of the month, analgesia for fractures until surgery can take place. Journal of the American Veterinary Medical Association, 212, 649-650.
-
Duke-Novakovski, T. (2016). Pain management II: Local and regional anaesthetic techniques. In T. Duke-Novakovski, M. deVries & C. Seymore (Eds.), Manual of Canine and Feline Anaesthesia and Analgesia, 3rd ed. (pp. 143-158). Gloucester, UK: BSAVA.
-
Enomoto, M., Lascelles, B. D., & Gerard, M. P. (2016). Defining the local nerve blocks for feline distal thoracic limb surgery: A cadaveric study. Journal of Feline Medicine and Surgery, 18(10), 838-845. https ://doi.org/10.1177/1098612X15597967
-
Enomoto, M., Lascelles, B. D. X., & Gerard, M. P. (2017). (2017) Defining local nerve blocks for feline distal pelvic limb surgery: A cadaveric study. Journal of Feline Medicine and Surgery, 19(12), 1215-1223. https://doi.org/10.1177/1098612X17690652
-
Epstein, M. E. (2015). 2015-2015 AAHA/AAFP pain management guidelines for dogs and cats*. Journal of the American Animal Hospital Association, 51, 67-84. https://doi.org/10.5326/JAAHA-MS-7331).
-
Flecknell, P. A., Kirk, A. J., Liles, J. H., Hayes, P. H., & Dark, J. H. (1991). Post-operative analgesia following thoracotomy in the dog: an evaluation of the effects of bupivacaine intercostal nerve block and nalbuphine on respiratory function. Laboratory Animals, 25(4), 319-324. https://doi.org/10.1258/002367791780810029
-
Garcia-Pereira, F. (2018). Epidural anesthesia and analgesia in small animal practice: An update. The Veterinary Journal, 242, 24-32. https:// doi.org/10.1016/j.tvjl.2018.09.007
-
Giuliano, E. A., Walsh, K. P. (2013). The eye. In: L. Campoy, & M. Read (Eds.), Small Animal Regional Anesthesia and Analgesia (pp. 103-117). Ames, IA: Wiley-Blackwell.
-
Goudie-DeAngelis, E. M., Snyder, C. J., Raffe, M. R., & David, F. H. (2016). A pilot study comparing the accuracy of two approaches to the inferior alveolar nerve block in canine cadavers. International Journal of Applied Research in Veterinary Medicine, 14(1), 49-58.
-
Gross, M. E., Pope, E. R., O’Brien, D. P., & Dodam, J. R., Polkow-Haight, J. (1997). Regional anesthesia of the infraorbital and inferior alveolar nerves during noninvasive tooth pulp stimulation in halothane-anesthetized dogs. Journal of the American Veterinary Medical Association, 211(11), 1403-1405.
-
Gross, M. E., Pope, E. R., Jarboe, J. M., O’Brien, D. P., Dodam, J. R., & Polkow-Haight, J. (2000). Regional anesthesia of the infraorbital and inferior alveolar nerves during noninvasive tooth pulp stimulation in halothane-anesthetized cats. American Journal of Veterinary Research, 61(10), 1245-1247. https://doi.org/10.2460/ ajvr.2000.61.1245
-
Grubb, T., Lobprise, H. (2020). Local and regional anaesthesia in dogs and cats: Overview of concepts and drugs (Part 1). Veterinary Medicine and Science, in press, https://doi.org/10.1002/vms3.219
-
Gurney, M. A., & Leece, E. A. (2014). Analgesia for pelvic limb surgery. A review of peripheral nerve blocks and the extradural technique. Veterinary Anaesthesia and Analgesia, 41(5), 445-458.
-
Hillerup, S., & Jensen, R. (2006). Nerve injury caused by mandibular block analgesia. International Journal of Oral & Maxillofacial Surgery, 35, 437-443. https://doi.org/10.1016/jj.ijom.2005.10.004
-
Ho, J., & DeLuca, K. G. (1999). Neurologic assessment of the pain patient. In H. T. Benzon, S. N. Raja, D. Borsook, R. E. Malloy & G. Strichartz (Eds.), Essentials of pain medicine and regional anesthesia (pp. 14-19). New York: Churchill Livingstone.
-
Hofmeister, E. H., Kent, M., & Read, M. R. (2007). Paravertebral block for forelimb anesthesia in the dog-an anatomic study. Veterinary Anaesthesia and Analgesia, 34(2), 139-142. https://doi. org/10.1111/j.1467-2995.2006.00313.x
-
Huuskonen, V., Hughes, J. M., Estaca, B. E., & West, E. (2013). Intratesticular lidocaine reduces the response to surgical castration in dogs. Veterinary Anaesthesia and Analgesia, 40(1), 74-82. https : // doi.org/10.1111/j.1467-2995.2012.00775.x
-
Kalchofner Guerrero, K. S., Guerrero, T. G., Schweizer-Kolliker, M., Ringer, S. K., Hassig, M., & Bettschart-Wolfensberger, R. (2014). Incidence of delayed hair re-growth, pruritus, and urinary retention after epidural anaesthesia in dogs. Tierarztl Prax Ausg K Kleintiere Heimtiere, 16;42(2), 94-100.
-
Kelley, T. M., Bailey, D. W., Sparks, P., Rice, R., Caddell, E., Currier, H., & Gallo, D. (2018). Intercostal nerve blockade with exparel® results in lower opioid usage during the first 24 hours after video-assisted thorascopic surgery. American Surgeon, 84(9), 1433-1438.
-
Kitchell, R. L. (1993). Introduction to the Nervous System. In H. E. Evans, M. E. Miller, Anatomy of the Dog, 3rd ed. (pp. 758-775). Philadelphia, Pa:W.B.Saunders.
-
Kona-Boun, J. J., Cuvelliez, S., & Troncy, E. (2006). Evaluation of epidural administration of morphine or morphine and bupivacaine for postoperative analgesia after premedication with an opioid analgesic and orthopedic surgery in dogs. Journal of the American Veterinary Medical Association, 229(7), 1103-1112. https://doi.org/10.2460/ javma.229.7.1103
-
Krug, W., & Losey, J. (2011). Area of desensitization following mental nerve block in dogs. Journal of Veterinary Dentistry, 28(3), 146-150. https://doi.org/10.1177/089875641102800301
-
Kushnir, Y., Toledano, N., Cohen, L., Bdolah-Abram, T., & Shilo-Benjamini, Y. (2017). Intratesticular and incisional line infiltration with ropiva- caine for castration in medetomidine-butorphanol-midazolam sedated dogs. Veterinary Anaesthesia and Analgesia, 44(2), 346-355. https://doi.org/10.1016/j.vaa.2016.03.007
-
Lambertini, C., Kluge, K., Lanza-Perea, M., Bruhl-Day, R., & Kalchofner Guerrero, K. S. (2018). Comparison of intraperitoneal ropivacaine and bupivacaine for postoperative analgesia in dogs undergoing ovariohysterectomy. Veterinary Anaesthesia and Analgesia, 45(6), 865-870. https://doi.org/10.1016/jj.vaa.2018.06.012.
-
Lantz, G. C. (2003). Regional anesthesia for dentistry and oral surgery. Journal of Veterinary Dentistry, 20(3), 181-186. https://doi.org/10.1177/089875640302000306
-
Lascelles, B. D. X., Rausch-Derra, L. C., Wofford, J. A., & Huebner, M. (2016). Pilot, randomized, placebo-controlled clinical field study to evaluate the effectiveness of bupivacaine liposome injectable suspension for the provision of post-surgical analgesia in dogs undergoing stifle surgery. BMC Vet Res 12(1), 168.
-
Lemke, K. (2007). Pain management II: local and regional anaesthetic techniques. Manual of canine and feline anaesthesia and analgesia 2nd. ed. (pp. 104-114). Gloucester, UK: BSAVA.
-
Lemke, K. A., & Creighton, C. M. (2008). Paravertebral blockade of the brachial plexus in dogs. The Veterinary Clinics of North America. Small Animal Practice, 38(6), 1231-1241. https ://doi.org/10.1016/j. cvsm.2008.06.003
-
Lerche, P., Aarnes, T. K., Covey-Crump, G., & Martinez, T. F. (2016). Handbook of Small Animal Regional Anaesthesia and Analgesia Technique. Hoboken, N.J: Wiley Blackwell.
-
Martin-Flores, M., Scrivani, P. V., Loew, E., Gleed, C. A., & Ludders, J. W. (2014). Maximal and submaximal mouth opening with mouth gags in cats; implications for maxillary artery blood flow. The Veterinary Journal, 200(1), 60-64. https://doi.org/10.1016/jj.tvjl.2014.02.001
-
Martinez Taboada, F.(2016). Blocks of the head. In: P. Lerche, T. K. Aarnes, G. Covey-Crump, & F. Martinez Taboada. Handbook of Small Animal Regional Anaesthesia and Analgesia Technique (pp. 48-51).
-
Hoboken, N.J.: Wiley Blackwell. Mathews, K., Kronen, P. W., Lascelles, D., Nolan,, A., Robertson, S., Steagall, P. V., Wright, B…. Yamashita, K. (2014). Guidelines for recognition, assessment and treatment of pain: WSAVA Global Pain Council. Journal of Small Animal Practice, 55(6), E10-E68. https://doi.org/10.1111/jsap.12200
-
McCally, R. E., Bukoski, A., Branson, K. R., Fox, D. B., & Cook, J. L. (2015). Comparison of short-term postoperative analgesia by epidural, femoral nerve block, or combination femoral and sciatic nerve block in dogs undergoing Tibial Plateau leveling osteotomy. Veterinary Surgery, 44(8), 983-987. https://doi.org/10.1111/vsu.12406
-
McMillan, M. W., Seymour, C. J., & Brearley, J. C. (2012). Effect of intra- testicular lidocaine on isoflurane requirements in dogs undergoing routine castration. Journal of Small Animal Practice, 53(7), 393-397. https://doi.org/10.1111/j.1748-5827.2012.01233.x
-
Mosing, M., Reich, H., & Moens, Y. (2010). Clinical evaluation of the anaesthetic sparing effect of brachial plexus block in cats. Veterinary Anaesthesia and Analgesia, 37(2), 154-161. https://doi.org/10.1111/j.1467-2995.2009.00509.x
-
Myrna, K. E., Bentley, E., & Smith, L. J. (2010). Effectiveness of injection of local anesthetic into the retrobulbar space for postoperative analgesia nfollowing eye enucleation in dogs. Journal of the American Veterinary Medical Association, 237(2), 174-177.
-
NOCITA® (bupivacaine liposome injectable suspension) (2018) Injection technique. Leawood, KS. Aratana Therapeutics. https://nocita.aratana.com/dosingandadministration-2.
-
NOCITA® (bupivacaine liposome injectable suspension) (2018) Package Insert. Leawood, KS. Aratana Therapeutics. https://www.aratana.com/wp-content/uploads/2018/08/NOCITA-Package-Insert.pdf.
-
Nutt, P. (1962). Brachial plexus analgesia in the dog. The Veterinary Record, 74,874-876.
-
O’Hearn, A. K., & Wright, B. D. (2011). Coccygeal epidural with local anesthetic for catheterization and pain management in the treatment of feline urethral obstruction. Journal of Veterinary Emergency & Critical Care, 21(1), 50-52. https://doi.org/10.1111/j.1476-4431.2010.00609.x
-
Otero, P., & Portela, D. A. (2018). Manual of small animal regional anesthesia: Illustrated anatomy for nerve stimulation and ultrasound-guided nerve blocks. https://www.researchgate.net/publi cation/327663189_Manual_of_small_animal_regional_anest hesia_Illustrated_anatomy_for_nerve_stimu lation_and_ultra sound-guided_nerve_blocks.
-
Patel, R., Carvalho, J. C., Downey, K., Kanczuk, M., Bernstein, P., & Siddiqui, N. (2017). Intraperitoneal instillation of lidocaine improves postoperative analgesia at cesarean delivery: A randomized, double-blind, Placebo-Controlled Trial. Anesthesia and Analgesia, 124(2), 554-559.
-
Perez, T. E., Grubb, T. L., Greene, S. A., Meyer, S., Valdez, N., Bingman, J., & Farnsworth, R. (2013). Effects of intratesticular injection of bupivacaine and epidural administration of morphine in dogs undergoing castration. Journal of the American Veterinary Medical Association, 242(5), 631-642. https://doi.org/10.2460/javma.242.5.631
-
Perry, R., Moore, D., & Scurrell, E. (2015). Globe penetration in a cat following maxillary nerve block for dental surgery. Journal of Feline Medicine & Surgery, 17, 66-72. https://doi.org/10.1177/1098612X14 560101
-
Portela, D. A., Verdier, N., & Otero, P. E. (2018a). Regional anesthetic techniques for the pelvic limb and abdominal wall in small animals: A review of the literature and technique description. The Veterinary Journal, 238, 27-40. https://doi.org/10.1016/jj.tvjl.2018.07.003
-
Portela, D. A., Verdier, N., & Otero, P. E. (2018b). Regional anesthetic techniques for the thoracic limb and thorax in small animals: A review of the literature and technique description. The Veterinary Journal, 241, 8-19. https://doi.org/10.1016/jj.tvjl.2018.09.006
-
Ranheim, B., Haga, H. A., & Ingebrigtsen, K. (2005). Distribution of radioactive lidocaine injected into the testes in piglets. Journal of Veterinary Pharmacology and Therapeutics, 28(5), 481-483. https :// doi.org/10.1111/j.1365-2885.2005.00675.x
-
Rioja Garcia, E. (2015). Local anesthetics. In K. A. Grimm, L. A. Lamont, W. J. Tranquilli, S. A. Greene, & S. A. Robertson (Eds.), Veterinary Anesthesia and Analgesia: The Fifth Edition of Lumb and Jones (pp. 332-354).
-
Ames, IA: John Wiley & Sons. Rochette, J. (2005). Regional anesthesia and analgesia for oral and dental procedures. In S. E. Holmstrom (Ed.), Small Animal Practice (Dentistry) (pp. 1041-1058) Philadelphia, Pa: Veterinary Clinics of North America.
-
Ruiz-Tovar, J., Gonzalez, J., Garcia, A., Cruz, C., Rivas, S., Jimenez, M., Duran, M. (2016). Intraperitoneal ropivacaine irrigation in patients undergoing bariatric surgery: A prospective randomized clinical trial. Obesity Surgery, 26(11), 2616-2621. https://doi.org/10.1007/s11695-016-2142-z
-
Savvas, I., Papazoglou, L. G., Kazakos, G., Anagnostou, T., Tsioli, V., & Raptopoulos, D. (2008). Incisional block with bupivacaine for analgesia after celiotomy in dogs. Journal of the American Animal Hospital Association, 44(2), 60-66. https://doi.org/10.5326/0440060
-
Scrivani, P. V., Martin-Flores, M., van Hatten, R., & Bezuidenhout, A. J. (2013). Structural and functional changes relevant to maxillary arterial flow observed during computed tomography and nonselective digital subtraction angiography in cats with the mouth closed and opened. Veterinary Radiology & Ultrasound, 55(3), 263-271.
-
Shilo-Benjamini, Y. (2019). A review of ophthalmic local and regional anesthesia in dogs and cats. Veterinary Anaesthesia and Analgesia, 46(1), 14-27. https://doi.org/10.1016/jj.vaa.2018.10.004
-
Skelding, A., Valverde, A., Sinclair, M., Thomason, J., & Moens, N. (2018). Anatomical characterization of the brachial plexus in dog cadavers and comparison of three blind techniques for blockade. Veterinary Anaesthesia and Analgesia, 45(2), 203-211. https://doi.org/10.1016/j. vaa.2017.11.002
-
Snyder, L., Snyder, C. S., & Beebe, D. (2019). Anesthesia and Pain Management. In H. B. Lobprise, J. R. Dodd (Eds.), Wigg’s Veterinary Dentistry: Principles and Practice (pp. 177-192). Ames: Wiley.
-
Snyder, M. A., Scheuerman, C. M., Gregg, J. L., Ruhnke, C. J., & Eten, K. (2016). Improving total knee arthroplasty perioperative pain management using a periarticular injection with bupivacaine liposomal suspension. Arthroplasty Today, 2(1), 37-42. https ://doi.org/10.1016/j. artd.2015.05.005
-
Snyder, C. J., & Snyder, L. B. (2013). Effect of mepivacaine in an infraorbital nerve block on minimum alveolar concentration of isoflurane in clinically normal anesthetized dogs undergoing a modified form of dental dolorimetry. Journal of the American Veterinary Medical Association, 242(2), 199-204. https://doi.org/10.2460/javma.242.2.199
-
Soberon, J. R. Jr, Ericson-Neilsen, W., Sisco-Wise, L. E., Gastanoduv, M., & Beck, D. E. (2016). Perineural liposomal bupivacaine for postoperative pain control in patients undergoing upper extremity orthopedic surgery: A prospective and randomized pilot study. Ochsner Journal, 16(4), 436-442.
-
Stathopoulou, T. R., Pinelas, R., Haar, G. T., Cornelis, I., & Viscasillas, J. (2018). Description of a new approach for great auricular and auriculotemporal nerve blocks: A cadaveric study in foxes and dogs. Veterinary Medicine and Science, 4(2), 91-97. https://doi.org/10.1002/vms3.90
-
Stiles, J., Weil, A. B., Packer, R. A., & Lantz, G. C. (2012). Post-anesthetic cortical blindness in cats: Twenty cases. The Veterinary Journal, 193(2), 367-373. https://doi.org/10.1016/jj.tvjl.2012.01.028
-
Swalander, D. B., Crowe, D. T. Jr, Hittenmiller, D. H., & Jahn, P. J. (2000). Complications associated with the use of indwelling epidural catheters in dogs: 81 cases (1996-1999). Journal of the American Veterinary Medical Association, 216(3), 368-370. https://doi.org/10.2460/ javma.2000.216.368
-
Troncy, E., Junot, S., Keroack, S., Sammut, V., Pibarot, P., Genevois, J. P., & Cuvelliez, S. (2002). Results of preemptive epidural administration of morphine with or without bupivacaine in dogs and cats undergoing surgery: 265 cases (1997-1999). Journal of the American Veterinary Medical Association, 221(5), 666-672. https://doi.org/10.2460/javma.2002.221.666
-
Trumpatori, B. J., Carter, J. E., Hash, J., Davidson, G. S., Mathews, K. G., Roe, S. C., & Lascelles, B. D. (2010). Evaluation of a midhumeral block of the radial, ulnar, musculocutaneous and median (RUMM block) nerves for analgesia of the distal aspect of the thoracic limb in dogs. Veterinary Surgery, 39(7), 785-796. https ://doi. org/10.1111/j.1532-950X.2010.00712.x
-
Valverde, A. (2008). Epidural analgesia and anesthesia in dogs and cats. The Veterinary Clinics of North America. Small Animal Practice, 38(6), 1205-1230. https://doi.org/10.1016/j.cvsm.2008.06.004
-
Valverde, A. (2018) Local Anesthetic Techniques. In: Mathews, K. A., Sinclair, M., Steele, A. M., Grubb, T. Analgesia and Anesthesia for the Ill or Injured Dog and Cat (pp. 171-203). Hoboken, N.J: Wiley Blackwell.
-
Vicente, D., & Bergstrom, A. (2018). Evaluation of interoperative analgesia provided by incisional lidocaine and bupivacaine in cats undergoing ovariohysterectomy. Journal of Feline Medicine & Surgery, 20(10), 922-927.
-
Viscasillas, J., Seymour, C. J., & Brodbelt, D. C. (2013). A cadaver study comparing two approaches for performing maxillary nerve blocks in dogs. Veterinary Anaesthesia & Analgesia, 40, 212-219.
-
Waite, A., Gilliver, S. C., Masterson, G. R., Hardman, M. J., & Ashcroft, G. S. (2010). Clinically relevant doses of lidocaine and bupivacaine do not impair cutaneous wound healing in mice. British Journal of Anaesthesiology, 104(6), 768-773.
-
Wenger, S., Moens, Y., Jaggin, N., & Schatzmann, U. (2005). Evaluation of the analgesic effect of lidocaine and bupivacaine used to provide a brachial plexus block for forelimb surgery in 10 dogs. The Veterinary Record, 156(20), 639-642. https://doi.org/10.1136/ vr.156.20.639
-
Wetmore, L. A., & Glowaski, M. M. (2000). Epidural analgesia in veterinary critical care. Clinical Techniques in Small Animal Practice, 15(3), 177-188. https://doi.org/10.1053/svms.2000.16545
-
Wilson, D. V., Barnes, K. S., & Hauptman, J. G. (2004). Pharmacokinetics of combined intraperitoneal and incisional lidocaine in the dog following ovariohysterectomy. Journal of Veterinary Pharmacology & Therapeutics, 27(2), 105-109. https://doi.org/10.1111/j.1365-2885.2004.00552.x
-
Yilmaz, O. T., Toydemir, T. S., Kirsan, I., Dokuzeylul, B., Gunay, Z., & Karacam, E. (2014). Effects of surgical wound infiltration with bupivacaine on postoperative analgesia in cats undergoing bilateral mastectomy. Journal of Veterinary Medical Science, 76(12), 1595-1601. https://doi.org/10.1292/jvms.14-0112
-
Zilberstein, L. F., Moens, Y. P., & Leterrier, E. (2008). The effect of local anaesthesia on anaesthetic requirements for feline ovariectomy. The Veterinary Journal, 178(2), 214-218. https ://doi.org/10.1016/j. tvjl.2007.10.011
Источник: Veterinary Medicine and Science 2020;6:218–234. Doi: 10.1002/vms3.218. This is an open access article under the terms of the Creative Commons Attribution License, which permits use, distribution and reproduction in any medium, provided the original work is properly cited.
СВМ № 2&3/2021