Врождённые портосистемные шунты, к которым относится и портокавальный шунт — это дополнительные сосуды, соединяющие венозный бассейн портальной вены и общий венозный бассейн. Благодаря наличию шунтов происходит частичный сброс крови, поступающей от желудка и кишечника, в общий кровоток, минуя печёночные ацинусы.
Общий венозный бассейн объединяет систему каудальной и краниальной полых вен. Каудальная полая вена (КПВ) формируется из бедренных вен и, направляясь краниально, собирает кровь из левой и правой почечных вен, правой гонадной вены, левой гонадной вены (впадает в КПВ через левую почечную вену) и печёночных вен. В краниальную полую вену впадает непарная вена (v. azygus), являющаяся продолжением поясничной вены. Портальная венозная система объединяет следующие сосуды: краниальную и каудальную мезентериальные вены, формирующие портальную вену и впадающие в неё вены — селезёночную, гастродуоденальную, левую желудочную (впадает в портальную вену через селезёночную вену) и правую желудочную (впадает в портальную вену самостоятельно или через гастродуоденальную вену).
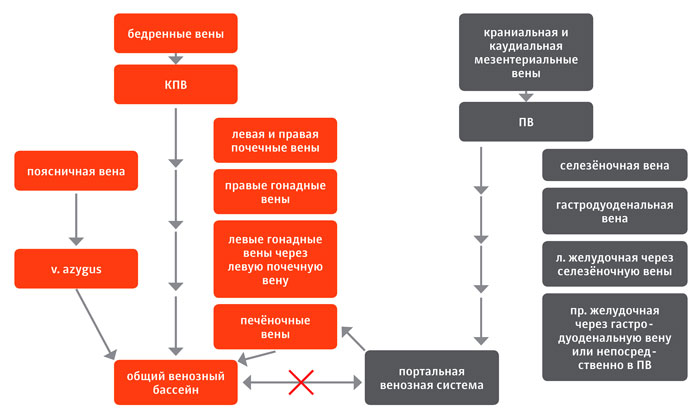 |
| Илл. 1. Схематичное изображение сосудов общего и портального венозных бассейнов |
Портальная вена (ПВ) сразу после вхождения в печень делится на левую и правую ветви, которые, в свою очередь, делятся на более мелкие ветви, несущие кровь к печёночным ацинусам. Из последних кровь собирается в ветви печёночных вен, впадающих в КПВ. Таким образом, в норме кровь из портальной венозной системы не смешивается с кровью из общего венозного бассейна, не пройдя печёночные ацинусы [5] (илл. 1).
Согласно принятой Всемирной ассоциацией ветеринарии мелких животных (WSAVA) в 2006 г. классификации болезней печени у кошек и собак, портосистемные шунты делятся на врождённые портосистемные шунты, ВПСШ (портокавальные, соединяющие портальный кровоток и каудальную полую вену, и портоазигальные, соединяющие портальный кровоток и непарную вену) (илл. 2) и приобретённые портосистемные коллатерали (ППКК).
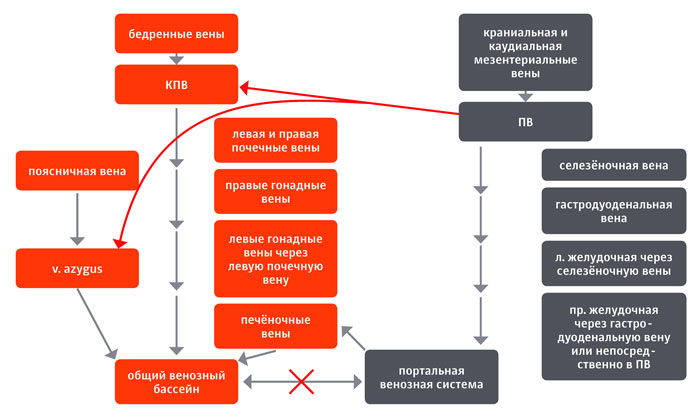 |
| Илл. 2. Схематичное изображение расположения врождённых портосистемных шунтов |
ВПСШ — это патологические сосуды, функционирование которых вторично приводит к снижению портального кровотока в печени, нарушению питания гепатоцитов, атрофии и последующему фиброзу печени. ВПСШ делятся на внепечёночные, начинающиеся до бифуркации ПВ, и внутрипечёночные, отходящие от внутрипечёночных ветвей ВП.
ППКК, напротив, развиваются на фоне фиброза печени, в результате которого нарушается печёночный кровоток и развивается портальная гипертензия (ПГ). При этом повышается давление крови во всех сосудах, несущих кровь в ПВ, в том числе и в селезёночной вене. Последняя с левой гонадной веной имеет врождённый анастомоз, который не функционирует в обычных условиях. При повышении давления в селезёночной вене анастомоз раскрывается и происходит частичный сброс портальной крови через левую гонадную и левую почечную вены в КПВ. Таким образом, развитие ППКК является компенсаторным механизмом, позволяющим снижать давление в ПВ при паренхиматозных заболеваниях печени [5] (илл. 3).
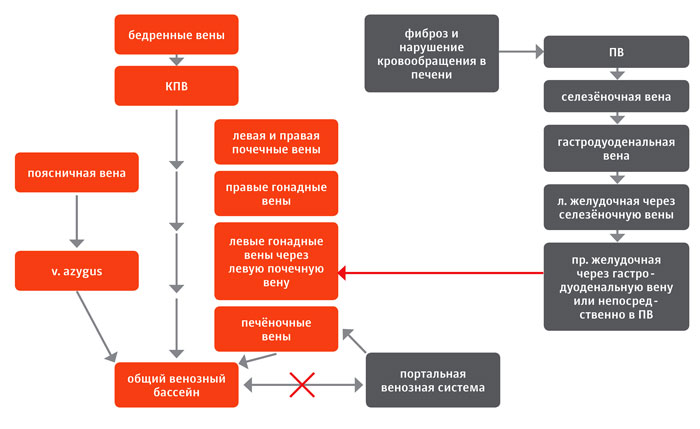 |
| Илл. 3. Схематичное изображение расположения приобретённых портокавальных коллатералей |
Все виды портосистемных шунтов сопровождаются идентичными клиническими симптомами: неврологическими расстройствами вследствие накопления в крови сильнейшего нейротоксина аммиака, нарушением белкового и других видов обмена вследствие снижения портального кровотока в печени и развития первичного или вторичного фиброза, нарушением минерального обмена и развитием минерализации почек и мочекаменной болезни.
Методы диагностики можно разделить на инструментальные и лабораторные.
К инструментальным методам в первую очередь относится УЗИ. Ультрасонография позволяет выявить как непосредственно шунт, так и косвенные признаки данной патологии: уменьшение диаметра ПВ, уменьшение размера печени и структурные изменения паренхимы, отсутствие визуализации ветвей v. porta [2, 4]. Рентгенография наиболее информативна при проведении портографи — исследовании портального кровотока при введении в брыжеечные вены контрастного вещества [1]. Это исследование проводится под общей анестезией, как правило, перед плановым оперативным вмешательством для окончательного подтверждения наличия ПСШ, а также уточнения их количества и расположения. Сцинтиграфия — недоступный сегодня в России метод исследования, позволяющий проследить пути распределения портальной крови в организме.
К специфическим лабораторным методам относятся определение уровня желчных кислот и аммиака в сыворотке крови, а также скрининговые исследования, позволяющие выявить гипоальбуминемию, уратный уролитиаз и другие изменения, характеризующие нарушения функции печени. При интерпретации результатов исследований необходимо учитывать, что гипераммониемия может развиваться при недостаточности ферментов цикла мочевины, голодании и липидозе печени у кошек, недостаточности аргинина у кошек, абсорбции мочевины через брюшину при разрыве мочевого пузыря. Кроме того, у щенков ирландского волкодава это является физиологической нормой [5].
Биопсия печени позволяет выявить специфические изменения, характерные для гипоперфузии ПВ: гепатоцеллюлярную атрофию печени с липогрануломатозом, увеличение количества интралобулярных артерий, редко — дилятацию синусов и фиброз. Данное исследование является важным тестом при постановке диагноза.
Следует отметить, что окончательный диагноз на наличие ПСШ ставится на основании комплексной оценки клинических симптомов, результатов лабораторных тестов и инструментальных методов диагностики.
Способы лечения животных с ПСШ зависят от наличия врождённой или приобретённой патологии. В первом случае лечение хирургическое, обеспечивающее постепенное закрытие просвета портокавального или портоазигального шунта. При наличии приобретённой коллатерали лечение только консервативное, направленное на компенсацию избыточного давления в ПВ [3].
Портокавальный шунт. Описание клинического случая
В ветеринарную клинику «Центр» поступила собака породы шелти в возрасте 3,5 месяца с жалобами владельца на наличие у собаки неврологических расстройств в виде беспокойства, тонико-клонических судорог, атаксии. Симптомы развивались через 3–10 часов после кормления. Также отмечались отсутствие роста и снижение упитанности. Собака была доставлена в клинику голодной.
При клиническом осмотре выявлено: сознание ясное, реакция на внешние раздражители адекватная, координация движений сохранена, походка естественная, рефлексы угрозы и поверхностные рефлексы сохранены, постуральные реакции не нарушены, кахексия. Температура тела 38,1°С, частота сердечных сокращений 144 уд./мин., частота дыхательных движений — 26 в минуту, тургор кожи сохранён, слизистые оболочки розового цвета, влажные, выделений из носовых ходов и субконъюнктивальных мешков не выявлено. Живот не увеличен, безболезненный, симметричный. Отклонений со стороны сердечно-сосудистой и дыхательной систем не выявлено.
Общий клинический анализ крови не выявил значимых отклонений от физиологических норм. В биохимическом анализе крови отмечались гипоальбуминемия (общий белок 29,2 г/л, альбумины 19,3 г/л), гипогликемия (уровень глюкозы 2,2 ммоль/л), повышение уровня желчных кислот до 121,4 мкмоль/л на голодный желудок и до 326,4 мкмоль/л через три часа после кормления.
В клиническом анализе мочи выявлена кристаллурия (мочекислый аммоний).
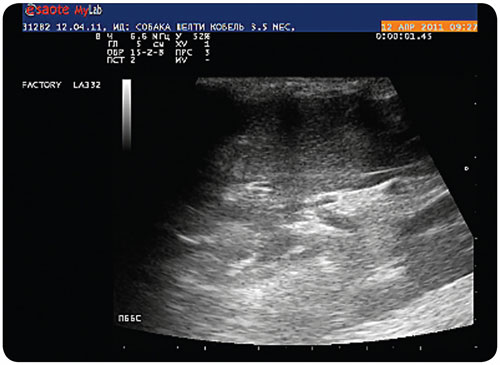
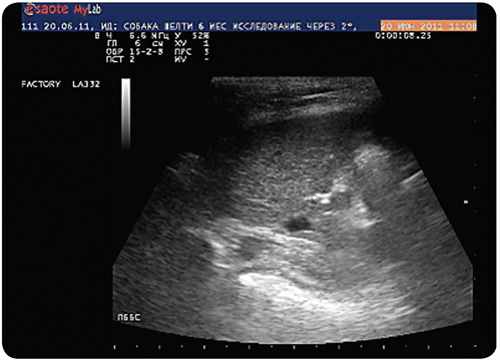
При ультрасонографии печени в режиме серошкального сканирования выявлено незначительное уменьшение линейного размера органа, эхогенность паренхимы незначительно повышена, структура характеризуется выявлением умеренной мелкоочаговой неоднородности за счёт очагов повышенной эхогенности (илл. 4).
При поперечном исследовании КПВ и ПВ, выполненном при установке датчика через межрёберные промежутки справа, выявлено, что диаметр ПВ сопоставим с диаметром КПВ (илл. 5).
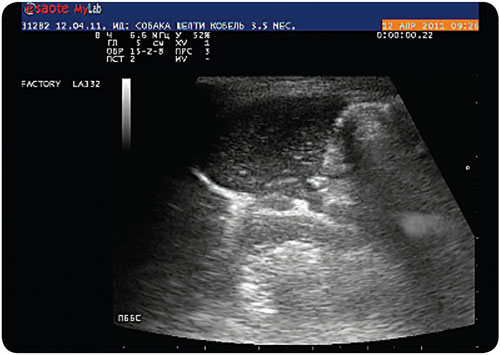 |
| Илл. 4. Ультрасканограмма печени, В-режим, повышение эхогенности и неоднородность паренхимы |
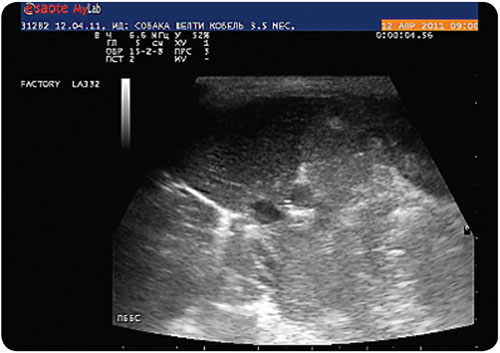 |
| Илл. 5. Ультрасканограмма печени, В-режим. Поперечное сканирование КПВ и ПВ |
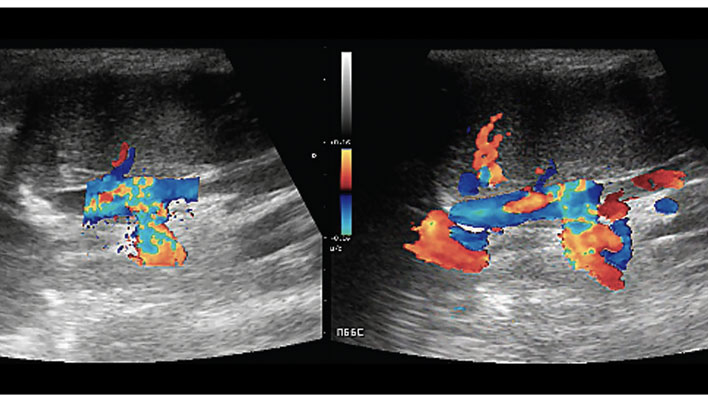
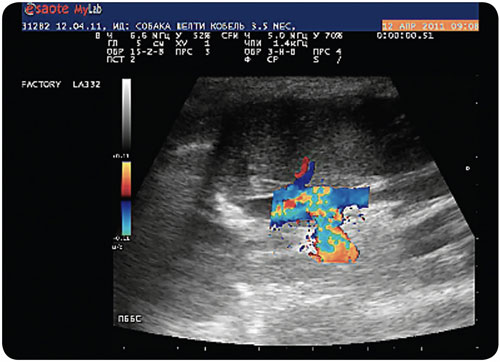
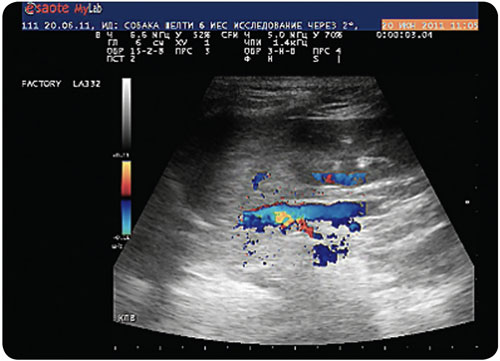
При продольном сканировании ПВ также не выявлено изменения диаметра, внутрипечёночные ветви ПВ визуализируются хорошо, отхождения дополнительных сосудов от ПВ или её ветвей не выявлено. На уровне впадения гастродуоденальной вены в портальную визуализируются неоднородные гипоэхогенные массы. При исследовании в режиме ЦДК установлено, что данное образование представлено конгломератом сплетённых сосудов с разнонаправленным низкоскоростным кровотоком (илл. 6).
При продольном сканировании КПВ краниально от места впадения левой почечной вены выявлена гипоэхогенная тубулярная структура (илл. 7).
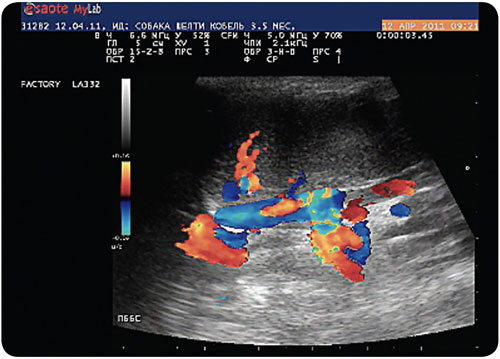
При исследовании в режиме ЦДК в обнаруженной структуре выявляется турбулентный низкоскоростной кровоток, направленный в КПВ (илл. 8).
Также при исследовании в режиме ЦДК отмечается усиление артериального кровотока в виде выраженных артериальных сосудов (илл. 9).
С учётом характерной клинической картины, результатов лабораторных тестов и ультразвукового обследования был поставлен диагноз: портокавальный шунт.
Проведено лапароскопическое исследование, идентифицирован шунт (илл. 10).
Была произведена конверсия на лапаротомию по белой линии живота. При ревизии брюшной полости выявлена свободная жидкость объёмом около 20 мл серозного типа. При эмпирической оценке печень уменьшена в размере. Идентифицирован патологический сосуд (шунт), соединяющий левую желудочную вену и КПВ, впадающий в КПВ краниальнее правой почечной вены. Другой патологии не выявлено. В ходе дальнейшего оперативного вмешательства были проведены препаровка и выделение проксимальной части шунта и наложение амероидного констриктора (илл. 11).
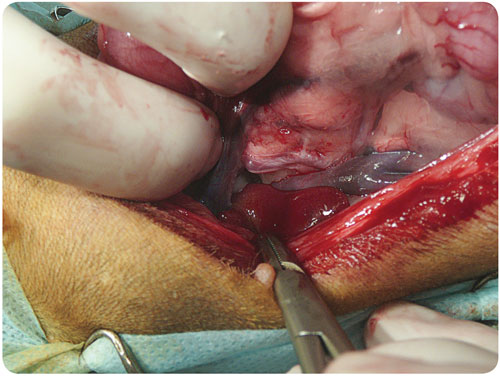 |
| Илл. 10. Макропрепарат. Портокавальный шунт |
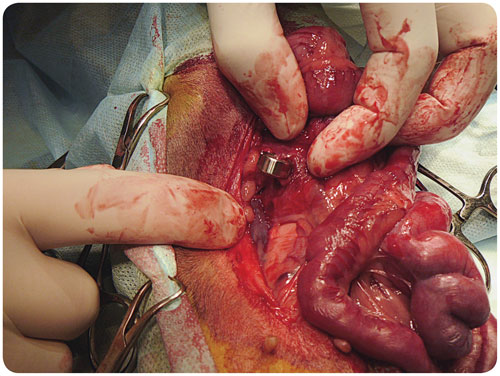 |
| Илл. 11. Макропрепарат. Амероидный констриктор наложен на портокавальный шунт. Операционная рана закрыта послойно, наглухо |
В течение восьми дней после оперативного лечения при ультразвуковом сканировании выявлялось незначительное скопление свободной жидкости в брюшной полости. В реабилитационный период были назначены безбелковая диета и приём энтеросорбентов. Ретроспективное исследование проводилось через шесть недель: гипоальбуминемия выражена в меньшей степени: общий белок 50,2 г/л, альбумины 26,6 г/л, уровень желчных кислот в сыворотке крови составил: на голодный желудок 46,6 мкмоль/л, после кормления 55,2 мкмоль/л. Ультразвуковое исследование показало значительное уменьшение диаметра шунта, отсутствие визуализации патологических сосудов в области левой желудочной и селезёночной вены, незначительное повышение эхогенности и неоднородность паренхимы печени по сравнению с предоперационным периодом (илл. 12, 13).
Через два месяца собака признана клинически здоровой и вакцинирована в плановом порядке.
Выводы
Врождённые портокавальные шунты и приобретённые портокавальные коллатерали обусловливают частичный сброс крови из портального в общий венозный бассейн, минуя печёночные синусы. Это обусловливает: 1) развитие неврологической симптоматики, связанной с накоплением аммиака в крови животного; 2) развитие атрофии печени в связи с нарушением почечной портальной перфузии; 3) нарушение белкового и других видов обмена в связи с нарушением функции печени.
ВПКШ могут отходить от различных сосудов портального венозного бассейна, в частности в представленном клиническом случае – от левой желудочной вены.
Диагностика ПСШ основана на комплексной оценке данных анамнеза и клинических симптомов, результатов лабораторных тестов (уровень аммиака и желчных кислот в сыворотке крови) и ультразвукового исследования. В качестве дополнительных тестов могут быть рекомендованы портография, лапароскопия, сцинтиграфия.
Информативность и достоверность ультрасонографии повышается при проведении исследования в двух режимах: серошкального сканирования и цветного допплеровского картирования.
При исследовании в режиме серошкального сканирования признаками наличия ВПСШ могут являться: уменьшение диаметра ВП или её внутрипечёночных ветвей, визуализация тубулярной структуры, отходящей от ПВ или её внутрипечёночных ветвей, визуализация дополнительного сосуда в виде тубулярной гипоэхогенной структуры, впадающей в КПВ (при наличии ПКШ), визуализация конгломератов сосудов в области портального венозного бассейна.
Исследование в режиме ЦДК позволяет окончательно интерпретировать выявленные в серошкальном режиме тубулярные структуры как сосуды, определить характер, направление и приблизительную скорость кровотока в них.
Дополнительными ультразвуковыми критериями при наличии ВПСШ являются: уменьшение размера печени, диффузные изменения паренхимы в виде неоднородности и повышения эхогенности. Также возможно усиление артериального кровотока.
Основной способ лечения ВПСШ — хирургический, обеспечивающий постепенное закрытие просвета шунта и нормализацию печёночного кровообращения.
Сокращения
ПСШ — портосистемные шунты, ВПСШ — врождённые портосистемные шунты, ППКК — приобретённые портокавальные коллатерали, КПВ — каудальная полая вена, ПВ — портальная вена, ПГ — портальная гипертензия.
Список литературы
- Arlene Coulson, Noreen Lewis, An Atlas of interpretative Radiographic anatomy of the Dog and Cat, 2002.
- Dominique Penninck, Marc-Andre d’Ahjuo, Atlas of Small Animal Ultrasonography, 2008.
- M. Joseph Bojrab, Gary W. Ellison, Barclay Slocum, Current Techniques in Small Animal Surgery, 4-s adition, 1998.
- Nyland T.G., Mattoon J.S., Small Animal Diagnostic Ultrasound, 2002.
- Standarts for Clinical and Histological Diagnosis of Canine and Feline Liver Diseasis, 2006.
СВМ № 2/2012
Вам будут также интересны статьи: