Аннотация
Введение. Шиншиллы (Chinchilla laniger) — популярные домашние питомцы и широко используемые для множества исследований лабораторные животные. Синегнойная палочка (Pseudomonas aeruginosa) — важный инфекционный патоген, вызывающий средний отит, пневмонию, септицемию, энтерит и внезапную смерть у шиншилл. Эта бактерия также вызывает нозокомиальные инфекции у человека. Для предотвращения распространения синегнойной палочки среди людей и животных необходимо детальное изучение изолятов P. aeruginosa, включающее генетическую характеристику и определение антибиотикочувствительности. В настоящем исследовании мы изучили распространённость P. aeruginosa среди домашних и лабораторных шиншилл, а также описали антибиотикочувствительность и генетические параметры бактериальных изолятов от этих шиншилл.
Результаты. P. aeruginosa была выделена у 41,8% из 67 шиншилл, включённых в исследование. С помощью реакции агглютинации на предметном стекле (слайд-агглютинации) и гель-электрофореза в пульсирующем поле (пульс-электрофореза) были выявлены 5 серотипов и 7 уникальных паттернов соответственно. При определении антибиотикочувствительности 40,9% изолятов оказались чувствительны к гентамицину, 77,3% — к ципрофлоксацину, 77,3% — к имипенему и 72,7% — к цефтазидиму. Анализ ДНК подтвердил, что ни в одном изоляте не содержался ген, кодирующий бета-лактамазы расширенного спектра, однако в 2 из 23 изолятов обнаружился ген, похожий на ген pilL, идентифицированный в острове патогенности клинического изолята P. aeruginosa.
Выводы. P. aeruginosa широко распространена у шиншилл, включая штаммы с низкой чувствительностью к антибиотикам и высоковирулентные штаммы. Необходимо проводить периодический мониторинг с целью предотвращения распространения этого патогена и снижения риска передачи инфекции от шиншилл человеку.
Введение
Шиншиллы (Chinchilla laniger) относятся к семейству шиншилловых подотряда дикобразовых отряда грызунов. Они очень популярны в качестве домашних питомцев из-за небольшого размера и простоты разведения. У шиншилл большая барабанная перепонка и слуховой проход, которые похожи на человеческие, поэтому этих грызунов часто используют как лабораторных животных для отоларингологических исследований [1–4].
Синегнойная палочка (Pseudomonas aeruginosa) — грамположительная палочковидная условно-патогенная бактерия, которая вызывает ряд тяжёлых заболеваний у человека и животных. С недавних пор этот патоген приобрёл резистентность ко многим антибиотикам, а штаммы, продуцирующие бета-лактамазы расширенного спектра (БЛРС), стали особенно серьёзной проблемой во многих лабораториях и клиниках [5–8]. Следовательно, для обеспечения защиты здоровья людей и животных важно не только исследовать частоту возникновения инфекций, вызванных синегнойной палочкой, но также оценить количество антибиотикорезистентных штаммов P. aeruginosa. Известно, что шиншилла подвержена инфицированию синегнойной палочкой, и поэтому часто используется для моделирования заболеваний, вызываемых P. aeruginosa, включая средний и внутренний отиты, пневмонию, септицемию, энтерит и внезапную смерть [9–12]. В экспериментах на шиншиллах были открыты и исследованы различные методы лечения инфекций, вызванных P. aeruginosa [11, 13].
Клинические симптомы синегнойной инфекции, возникающей естественным путём у лабораторных шиншилл, хорошо известны. Doerning с соавт. [10] сообщили, что предполагаемый путь передачи синегнойной инфекции в лабораторных условиях — через воду и оборудование, в том числе поилки. Известно, что к клиническим признакам синегнойной инфекции относятся средний отит и внутренний отит с неврологическими проявлениями, а также несовместимые с жизнью симптомы у некоторых животных [14]. Хотя экспериментальные модели синегнойной инфекции у шиншилл в последние годы хорошо описаны, имеется лишь несколько сообщений о распространённости естественно передающейся инфекции среди лабораторных или домашних шиншилл, и даже в этих сообщениях эпидемиологические данные весьма скудны.
Типирование штаммов P. aeruginosa и определение антибиотикочувствительности очень полезно с эпидемиологической точки зрения для учёта эффективности контроля за инфекциями у шиншилл. Большую помощь при выборе антибиотика и при оценке эффективности предыдущей антибактериальной терапии оказывает определение минимальных подавляющих концентраций (МПК). Зоонозы давно считаются одной из главных угроз общественному здоровью [15]. Для предотвращения распространения синегнойной инфекции среди людей и животных может понадобиться детальная характеристика изолятов, включая антибиотикочувствительность и генетические параметры. Исследование этих эпидемиологических показателей необходимо не только для ветеринарного, но и для гуманитарного здравоохранения.
В настоящем исследовании мы изучали частоту возникновения синегнойной инфекции у лабораторных и домашних шиншилл. Мы определили эпидемиологические характеристики изолятов P. aeruginosa, включающие серологический и молекулярный типы, а также с помощью анализа ДНК проверили их на наличие БЛРС.
Методы
Выделение и идентификация P. aeruginosa у шиншилл
Выделение синегнойной палочки было произведено у 67 шиншилл, в том числе у 23 домашних и 44 лабораторных, выращенных в 2 питомниках для лабораторных животных. Все они были здоровы и не имели симптомов инфекции, 1 шиншилла со средним отитом были исключена из исследования. В дальнейшем 2 лабораторных шиншиллы получали лечение энрофлоксацином в течение 6 дней и гентамицином в течение 2 дней в связи со средним отитом. Они полностью вылечились от отита перед забором образцов. У каждой шиншиллы из ротовой полости, с морды и из индивидуальных поилок брались соскобы, которые затем растворяли в стерильном солевом растворе. Образцы посеяли на агар с цетримидом и налидиксовой кислотой (Nissui, Токио, Япония) и культивировали в течение 48 часов при 37°C. Изоляты идентифицировали по пигментированию колоний, окрашиванию по Граму и каталазной активности. После этого идентичность P. aeruginosa подтверждалась с помощью набора Quick ID GN «Nissui» (Nissui). Серотип изолятов P. aeruginosa устанавливался с помощью набора для слайд-агглютинации (Denka Seiken, Токио, Япония). Изоляты, которые не реагировали ни с одной антисывороткой, признавались нетипируемыми штаммами. Изоляты сохранялись в глицерине при –80°C до проведения анализа. После этого 6 изолятов оказались невосстановимы и, следовательно, для анализа использовались 22 изолята. Для достоверности идентификации сравнительный анализ проводился с двумя образцовыми штаммами P. aeruginosa: ATCC 27853 (Американская коллекция типовых культур, Манассас, США) и IID 1130 (Институт медицины, Университет Токио, Япония). Содержание шиншилл обеспечивалось средствами из фонда по защите прав животных Японского университета ветеринарии и медико-биологических наук (бывший Японский университет ветеринарии и зоотехнии) в соответствии с Руководством по экспериментам над животными Японской ассоциации по лабораторным животным.
Пульс-электрофорез
Пульс-электрофорез проводился по описанной ранее методике [32, 33]. Краткое описание: все изоляты, выращенные в течение ночи в питательном бульоне при 37°C, были отцентрифугированы при 10000 g в течение 2 минут. Затем осадок был перерастворён и смешан с 1%-ной агарозой, после чего лизировался в течение 1 часа при 37°C и ферментировался протеиназой К в течение 16 часов при 50°C. После четырёхкратного промывания все образцы были разрезаны с помощью рестриктазы SpeI в течение 16 часов при 25°C. Затем фрагменты были разделены с помощью электрофореза в геле с 1%-ной агарозой на аппарате CHEF-DR (Bio-Rad, Калифорния, США) в течение 18 часов с временем переключения от 5,3 с до 34,9 с и силой поля 6 В/см2. В качестве маркеров молекулярного веса использовались рестрикционные фрагменты ДНК фага лямбда (Bio-Rad). Затем гели протравливались в течение 20 минут бромидом этидия, а потом в течение 20 минут обесцвечивались. После получения фотоснимков в ультрафиолете паттерны фрагментов сравнивались визуально и с помощью невзвешенного попарно-группового метода со средними арифметическими с помощью программы NTSYSpc (Exeter Software, США) по описанной ранее методике [34].
Определение антибиотикочувствительности
МПК определялись как минимальная концентрация антибиотика, при которой не наблюдается видимого роста после инкубации при 35°C в течение 24 часов. МПК антибиотиков во всех изолятах измерялась методом микроразведений в бульоне, описанным Институтом клинических и лабораторных стандартов [16]. Применялись следующие антибиотики: гентамицин (ICN Biomedicals, США), амикацин (Bristol Laboratories, Бельвиль, Канада), имипенем (Merck, США), цефтазидим (LKT Laboratories, США), цефепим (Bristol-Myers Squibb, США), энрофлоксацин (MP Biomedicals, США) и ципрофлоксацин (LKT Laboratories). Все антибиотики перед определением чувствительности были приведены к желаемым концентрациям в бульоне Мюллера-Хинтона II со стандартным содержанием катионов (BD, США). Каждый эксперимент был повторен не менее 3 раз. Все изоляты исследовались на предмет продукции МБЛ с помощью металло-бета-лактамазы SMA «Eiken» (Eiken, Токио, Япония). Для верификации антибиотикочувствительности изолятов значения МПК аминогликозидов, ципрофлоксацина, имипенема и цефтазидима сравнивались со стандартами НККЛС [16].
Манипуляции с ДНК
Мы использовали ПЦР для выявления генов, кодирующих разные типы БЛРС, встречающиеся у синегнойной палочки, с помощью методик Jiang с соавт. [17] и Weldhagen [8]. Краткое описание метода: ПЦР использовалась для выявления генов, кодирующих бета-лактамазы: OXA-10, TEM, SHV, PER-1, CTX группы 1, CTX группы 2, CTX группы 9, VEB-1 и GES. Ампликоны были подтверждены с помощью электрофореза в агарозном геле, и визуализированные бэнды были впоследствии очищены Suprec PCR (Takara bio, Сига, Япония). Очищенные продукты ПЦР были лигированы с Т-вектором, pTAC-1, с помощью набора для клонирования TA PCR (Biodynamics laboratory, Токио, Япония), и получившиеся плазмиды, трансформированные в DH5a E. coli, помещали на среду Луриа-Бертани с добавлением ампициллина в концентрации 100 мг/мл. Колонии случайным образом отбирали и проверяли на ДНК-вставки методом колониальной ПЦР с праймерами M13-f и M13-r. Продукты ПЦР очищались, после чего проводилось циклическое секвенирование с помощью набора BigDye (Applied Biosystems). Продукты реакции анализировались на ДНК-секвенсоре ABI 310 (Applied Biosystems). Наиболее подходящие последовательности идентифицировались с помощью поиска BlastX. Наличие плазмид в некоторых изолятах было подтверждено с целью изоляции плазмидной ДНК с помощью набора для очищения ДНК Miniprep (Takara). Результаты были подтверждены на агарозном геле под УФ.
Номера образцов нуклеиновых кислот
Нуклеотидные последовательности частично опознанных генов, кодирующих АТФ-связывающие кассеты транспортеров-пермеаз (G-1) и белок pilL (C-1), были размещены в GenBank через Банк данных ДНК Японии (DDBJ) и им присвоены номера AB591379 и AB591380 соответственно.
Результаты
Обнаружение P. aeruginosa у шиншилл
В исследование были включены 67 здоровых домашних и лабораторных шиншилл. У 7 из 23 домашних шиншилл и у 21 из 44 лабораторных шиншилл была выделена синегнойная палочка. В целом 41,8% в остальном здоровых шиншилл оказались носителями P. aeruginosa. Соскобы и смывы для посева на синегнойную палочку были собраны из полости рта, с морды и с поилок в клетках шиншилл. Синегнойная палочка была обнаружена в 7, 9 и 20% случаев соответственно. Процент высевания в смывах с поилок оказался очень высоким. У 2 шиншилл синегнойная палочка высеялась и из ротовой полости, и с морды, и из поилок, у одной шиншиллы — и из ротовой полости, и с морды.
Типирование изолятов P. aeruginosa
На рис. 1 показана дендрограмма, структурирующая результаты серотипирования и пульс-электрофореза. Серотипы всех изолятов P. aeruginosa определялись с помощью наборов для слайд-агглютинации. 28 изолятов были разделены на 4 серотипа (в скобках — количество изолятов): тип G (9), тип B (11), тип I (1), тип F (2) и нетипирующиеся изоляты (5). Среди изолятов от домашних шиншилл было 2 типа G и 5 нетипирующихся штаммов. От лабораторных шиншилл было получено 11 изолятов типа B и 7 — типа G.
Методом пульс-электрофореза исследовали 22 изолята, потому что остальные 6 оказались невосстановимы после консервации. Из результатов паттернов бэндов, полученных после пульс-электрофореза, была составлена дендрограмма (рис. 1). Наблюдались 7 уникальных паттернов (ПЭ-типов) изолятов синегнойной палочки, полученных от шиншилл, и в дендрограмме они соотнесены с серотипами. ПЭ-типы изолятов считались идентичными, если они совпадали на 100%. Изоляты, полученные от шиншилл из одного питомника, имели схожие характеристики, что говорит об эпидемиологической ценности типирования с помощью пульс-электрофореза и серологических реакций.
Определение антибиотикочувствительности
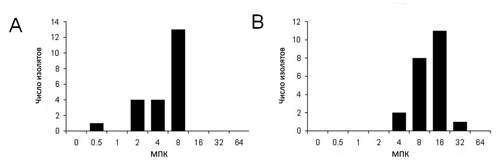
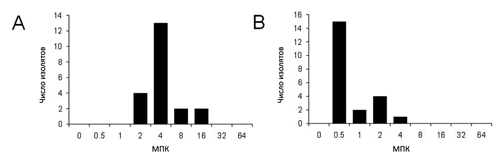
На рисунках 2–4 показаны МПК аминогликозидов, фторхинолонов и некоторых бета-лактамов. Для определения чувствительности к аминогликозидам мы выбрали гентамицин и амикацин (рис. 2). Приблизительно в 60% изолятов значения МПК гентамицина превысили 8 мкг/мл (рис. 2а). Интерпретируя значения МПК согласно стандартам для синегнойной палочки, опубликованным Национальным комитетом по клиническим и лабораторным стандартам (НККЛС) [16], 9 и 13 изолятов были признаны умеренно чувствительными и чувствительными к гентамицину соответственно. Только 1 изолят был умеренно чувствителен к амикацину, и ни один изолят не оказался резистентным к обоим аминогликозидам (рис. 2б). Что касается фторхинолонов, только в одном изоляте МПК ципрофлоксацина была на уровне 4 мкг/мл, тогда как приблизительно в 80% изолятов МПК энрофлоксацина была выше 4 мкг/мл (рис. 3а и 3б). Один изолят оказался резистентен к ципрофлоксацину. Перед забором образцов две лабораторные шиншиллы получали лечение байтрилом (энрофлоксацин, Bayer, Леверкузен, Германия) в течение 6 дней и гентацином (гентамицин, Schering-Plough Animal Health, Боксмеер, Нидерланды) в течение 2 дней в связи со средним отитом. МПК энрофлоксацина и гентамицина в этих двух изолятах составили 2–4 мкг/мл и 4–8 мкг/мл соответственно. Такие показатели говорят о том, что предшествующее лечение привело к снижению чувствительности к указанным антибиотикам. Кроме этих двух шиншилл ни одно животное не получало антибиотиков.
Затем мы протестировали бета-лактамные антибиотики, наиболее часто применяющиеся в лечении людей, а именно имипенем и цефалоспорины III и IV поколений (рис. 4). В пяти изолятах МПК имипенема составила 8 мкг/мл, что по стандартам НККЛС означает умеренную чувствительность, а в 16 изолятах МПК была менее 4 мкг/мл, т. е. они были чувствительны к имипенему. Что касается цефалоспоринов, то 80% изолятов оказались чувствительны и к цефтазидиму, и к цефепиму. МПК цефтазидима и цефепима была выше 16 мкг/мл в 6 и 1 изоляте соответственно. 6 изолятов показали умеренную чувствительность к цефтазидиму. Эти результаты говорят о том, что изоляты, полученные от шиншилл, чувствительны к антибиотикам, применяемым у животных, но недостаточно чувствительны к антибиотикам, применяемым в настоящее время у людей.
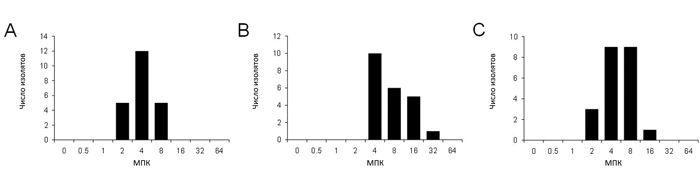 |
| Рис. 4. Минимальные подавляющие концентрации (МПК) бета-лактамов в 22 штаммах P. aeruginosa, выделенных у шиншилл (а — имипенем, б — цефтазидим, в — цефепим). |
Полимеразная цепная реакция (ПЦР) и секвенирование
Все изоляты были исследованы методом ПЦР для выявления генов, кодирующих разные типы БЛРС у диких штаммов P. aeruginosa [3, 17]. При исследовании с праймерами OXA, TEM, SHV, PER, CTX группы 2, CTX группы 9 и типа VEB ни в одном изоляте не обнаружены БЛРС. При использовании праймеров GES и CTX группы 1 в 9 и 2 изолятах соответственно визуализировались бэнды в ожидаемой локализации (данные не представлены). Для исследования точности секвенирования было выполнено ТА-клонирование. Все обнаруженные при использовании праймера GES ДНК-вставки были идентифицированы как АТФ-связывающие кассеты транспортеров-пермеаз, которые обнаруживаются у различных штаммов P. aeruginosa, и ни одна не содержала ген, кодирующий бета-лактамазу типа GES. Ни одна из вставок, выявленных с помощью праймера CTX группы 1, не содержала ген, кодирующий бета-лактамазу типа CTX. Однако все вставки из 2 ПЦР-ампликонов были очень похожи на ген, кодирующий предполагаемый белок PilL, обнаруживаемый у P. aeruginosa (образец ABR13432), с покрытием 82% и максимальным соответствием 97%. Помимо этого все вставки были также похожи на ген, кодирующий белок типа IVB, содержащийся в фимбриях синегнойной палочки (образец YP_792920), с покрытием 81% и максимальным соответствием 95%. Оба этих белка были идентифицированы в новом островке патогенности (ОП) у высоковирулентных клинических изолятов, включая штаммы PSE9 и PA14 [18–20]. Хотя праймер CTX группы 1 может комплементарно соединяться с похожей на искомый ген последовательностью нуклеотидов, было подтверждено, что в двух изолятах содержится ген pilL. Хотя мы пытались изолировать плазмиду из двух этих штаммов, ни у одного плазмиды не было обнаружено. Такие результаты говорят о том, что 2 изолята, содержащие ген, похожий на pilL, вероятно, также содержат ОП в своих геномах. Обе шиншиллы, инфицированные сингенойной палочкой, содержащей ген, похожий на pilL, были лабораторными, и эти изоляты были чувствительны ко всем испытанным антибиотикам.
Мы также провели тесты на определение продукции металло-бета-лактамаз (МБЛ) во всех изолятах, но результаты были отрицательными. Не было выявлено никакой корреляции между ПЭ-типами, серотипами и антибиотикочувствительностью. И хотя при проведении ПЦР и секвенировании не было выявлено генов, кодирующих БЛРС, 2 изолята, содержащие ген pilL, вероятно, являются высоковирулентными штаммами P. aeruginosa.
Обсуждение
В настоящем исследовании изоляты P. aeruginosa выделялись от шиншилл, не имевших признаков синегнойной или другой бактериальной инфекции, кроме двух лабораторных особей со средним отитом. P. aeruginosa была выделена у 30,4% домашних шиншилл и у 47,7% лабораторных шиншилл. В целом синегнойная палочка была выделена у 41,8% клинически здоровых особей. Хотя синегнойный средний отит и его клинические признаки были многократно описаны в предыдущих исследованиях [9–12], в нашем исследовании отсутствие симптомов у инфицированных животных может быть связано с течением латентного периода. В дальнейшем клинические признаки синегнойной инфекции могли развиться при снижении иммунитета. Многие случаи заражения шиншилл синегнойной палочкой связывают с загрязнением окружающей среды: еды, воды, материалов клетки. Помимо этого транзиторные инфекции могут приводить к бессимптомным хроническим процессам у шиншилл вследствие копрофагии [21].
Хотя не было никаких свидетельств, что изоляты от шиншилл были гетерогенными, серотипирование и пульс-электрофорез позволили разделить изоляты на 5 серотипов и 7 ПЭ-типов соответственно. Таким образом, несмотря на небольшое количество, отмечается большое разнообразие изолятов. Мы использовали слайд-агглютинацию для определения серотипа немного модифицированным методом Хоммы [22]. В более ранних эпидемиологических исследованиях среди изолятов P. aeruginosa от людей и лабораторных грызунов преобладал серотип G, что было установлено методом слайд-агглютинации [23, 24]. Хотя серотип G был вторым по распространённости в нашем исследовании, изоляты этого типа были в последующем разделены на 3 независимых ПЭ-типа. Серотип и ПЭ-тип, по имеющимся данным, дают перекрёстную реакцию слайд-агглютинации; однако серотип G, определённый по методу Хоммы, разделяется на 2–4 серотипа при других методах агглютинации [23]. Таким образом, при рестрикционном картировании ДНК эти серотипы могут оказаться негомогенными.
В настоящем исследовании мы определяли МПК трех разных групп антибиотиков: аминогликозидов, фторхинолонов и бета-лактамов. Перед исследованием мы удостоверились, что ни домашние, ни лабораторные шиншиллы, за исключением двух лабораторных особей, не получали антибиотиков. Оставшиеся две шиншиллы получали энрофлоксацин и гентамицин. Оба изолята от этих шиншилл оказались чувствительными к энрофлоксацину, в то время как один из них был умеренно чувствителен к гентамицину. По-видимому, снижение чувствительности связано с предшествующим антибактериальным лечением. Гентамицин и энрофлоксацин часто используются для лечения при подозрении на синегнойную или другую грамотрицательную инфекцию у лабораторных грызунов [10, 25, 26], тогда как фторхинолоны, карбапенемы и цефалоспорины (в частности, ципрофлоксацин, имипенем и цефепим) строго запрещено использовать для лечения лабораторных грызунов в Японии, так как они являются резервными антибиотиками в гуманитарной медицине. У домашних шиншилл в нашем исследовании анамнез был не отягощён и антибиотики они не получали. Таким образом, синегнойная палочка со сниженной чувствительностью к ципрофлоксацину, имипенему или цефалоспоринам была получена от человека или из окружающей среды.
По сообщениям, вспышки полирезистентной синегнойной инфекции в последнее время участились. Среди этих инфекций особое место занимает полирезистентная синегнойная палочка (MDRP), продуцирующая БЛРС и МБЛ и вызывающая нозокомиальные инфекции [27–30]. В связи с этим следующим этапом стало определение чувствительности изолятов к антибиотикам, к которым резистентна MDRP. При определении антибиотикочувствительности ни в одном изоляте не выявлено высоких МПК аминогликозидов, фторхинолонов или бета-лактамов. В частности, МПК имипенема нигде не была выше 16 мкг/мл и ни в одном изоляте не выявлена продукция МБЛ. Это позволяет утверждать, что синегнойная палочка в изолятах не относилась к MDRP или МБЛ-продуцирующим штаммам. В одном изоляте, однако, МПК цефтазидима составила более 32 мкг/мл, что позволяет предположить его принадлежность к БЛРС-продуцирующему штамму.
В настоящем исследовании при использовании известных праймеров в изолятах не удалось обнаружить генов, кодирующих БЛРС. Однако изоляты, в которых были выявлены высокие МПК цефалоспоринов III и IV поколений, рассматривались как имеющие генетически обусловленное снижение чувствительности к этим антибиотикам. Эти генетические признаки ещё предстоит изучить в будущих исследованиях. Хотя гены, кодирующие БЛРС, не были выявлены с помощью праймера CTX группы 1, ТА-клонирование позволило идентифицировать один из генов, ответственных за биогенез пилина (антигена фимбрий). Этот частично идентифицированный ген был похож на ген pilL, который, как известно, локализуется в ОП вирулентного штамма P. aeruginosa [20]. Обнаруженный нами ОП был также гомологичен уже известному ОП синегнойной палочки (PAPI-1), который выявлялся только в штамме PA14, высоковирулентном для животных и растений [18, 19]. Гены, кодирующие pilL и белок фимбрий IVB типа, не обнаруживались в менее вирулентных штаммах P. aeruginosa, таких как PAO1, а выявлялись только в высоковирулентных штаммах, например, PSE9 и PA14. Описана связь обоих белков с пилином IV типа во вновь открытых ОП [19, 20]. Было показано, что пилин IV типа является одним из наиболее важных факторов адгезии и проникновения в клетки макроорганизма во время инфекции [31]. Наличие у синегнойной палочки ОП, такого как PAPI-1, тесно связано с вирулентностью и патогенностью. Таким образом, генетическое исследование P. aeruginosa, включающее выявление ОП и антибиотикорезистентности, может способствовать борьбе с распространением инфекции.
Выводы
В настоящем исследовании синегнойная палочка была выделена у значительной доли лабораторных и домашних шиншилл. С помощью типирования установлено большое разнообразие изолятов, а при определении антибиотикочувствительности в некоторых изолятах выявлена низкая чувствительность. Мы не смогли обнаружить гены, кодирующие БЛРС, однако мы обнаружили ген pilL, который прежде наблюдался только в высоковирулентных штаммах P. aeruginosa. Таким образом, необходимо принимать в расчёт риск инфицирования людей от домашних и лабораторных шиншилл. Поскольку болезнь у шиншилл быстро прогрессирует и часто приводит к летальному исходу [10], с целью предотвращения инфицирования синегнойной палочкой необходима тщательная обработка места содержания шиншилл и мониторинг их здоровья.
Благодарности
Мы хотим поблагодарить владельцев шиншилл и лаборатории за предоставленные образцы.
Вклад авторов
N. A. исследовал P. aeruginosa у шиншилл в 2002–2004 годах. Y. H. расширил исследование, добавив ПЭ и определение антибиотикочувствительности. H. S. проводил ПЦР и секвенирование, а также координировал исследование. I. H. и T. M. проводили определение антибиотикочувствительности. E. K., H. K. и H. A. поддерживали и курировали исследование. Все авторы прочитали и одобрили финальную рукопись.
Литература
- Hamernik R. P., Patterson J. H., Salvi R. J. The effect of impulse intensity and the number of impulses on hearing and cochlear pathology in the chinchilla. J Acoust Soc Am 1987, 81:1118–1129.
- Snyder D. L., Salvi R. J. A novel chinchilla restraint device. Lab Anim 1994, 23:42–44.
- McFadden S. L., Kasper C., Ostrowski J., Ding D. L., Salvi R. J. Effects of inner hair cell loss on inferior colliculus evoked potential thresholds, amplitudes and forward masking functions in chinchilla. Hear Res 1998, 120:121–132.
- Zheng X. Y., McFadden S. L., Ding D. L., Henderson D. Cochlear de-efferentation and impulse noise-induced acoustic trauma in the chinchilla. Hear Res 2000, 144:187–195.
- Bradford P. A. Extended-spectrum beta-lactamases in the 21st century: characterization, epidemiology, and detection of this important resistance threat. Clin Microbiol Rev 2001, 14:933–951.
- Mavroidi A., Tzelepi E., Tsakris A., Miriagou V., Sofianou D., Tzouvelekis L. S. An integron-associated beta-lactamase (IBC-2) from Pseudomonas aeruginosa is a variant of the extended-spectrum beta-lactamase IBC-1. J Antimicrob Chemother 2001, 48:627–630.
- Poirel L., Weldhagen G. F., Naas T., de Champs C., Dove M. G., Nordmann P. GES-2, a class A beta-lactamase from Pseudomonas aeruginosa with increased hydrolysis of imipenem. Antimicrob Agents Chemother 2001, 45:2598–2603.
- Weldhagen G. F. Sequence-selective recognition of extended-spectrum beta–lactamase GES-2 by a competitive, peptide nucleic acid-based multiplex PCR assay. Antimicrob Agents Chemother 2004, 48:3402–3405.
- Doyle W. J. Animal models of otitis media: other pathogens. Pediatr Infect Dis J 1989, 8:S45–S47.
- Doerning B. J., Brammer D. W., Rush H. G. Pseudomonas aeruginosa infection in a Chinchilla lanigera. Lab Anim 1993, 27:131–133.
- Cotter C. S., Avidano M.A., Stringer S. P., Schultz G. S. Inhibition of proteases in Pseudomonas otitis media in chinchillas. Otolaryngol Head Neck Surg 1996, 115:342–351.
- Ehrlich G. D., Veeh R., Wang X., Costerton J. W., Hayes J. D., Hu F. Z., Daigle B. J., Ehrlich M. D., Post J. C. Mucosal biofilm formation on middle-ear mucosa in the chinchilla model of otitis media. JAMA 2002, 287:1710–1715.
- Lusis P. I., Soltys M. A. Immunization of mice and chinchillas against Pseudomonas aeruginosa. Can J Comp Med 1971, 35:60–66.
- Wideman W. L. Pseudomonas aeruginosa otitis media and interna in a chinchilla ranch. Can J Vet Res 2006, 47:799–800.
- Rosen T., Jablon J. Infectious threats from exotic pets: dermatological implications. Dermatol Clin 2003, 21:229–236.
- National Committee for Clinical Laboratory Standards: Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. National Committee for Clinical Laboratory Standards, Wayne, Pa; 8, 2009, approved standard.
- Jiang X., Zhang Z., Li M., Zhou D., Ruan F., Lu Y. Detection of extended- spectrum beta-lactamases in clinical isolates of Pseudomonas aeruginosa. Antimicrob Agents Chemother 2006, 50:2990–2995.
- He J., Baldini R. L., Déziel E., Saucier M., Zhang Q., Liberati N. T., Lee D., Urbach J., Goodman H. M., Rahme L. G. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proc Natl Acad Sci USA 2004, 101:2530–2535.
- Lee D. G., Urbach J. M., Wu G., Liberati N. T., Feinbaum R. L., Miyata S., Diggins L. T., He J., Saucier M., Deziel E., Friedman L., Li L., Grills G., Montgomery K., Kucherlapati R., Rahme L. G., Ausubel F. M. Genomic analysis reveals that Pseudomonas aeruginosa virulence is combinatorial. Genome Biol 2006, 7: R90.
- Battle S. E., Meyer F., Rello J., Kung V. L., Hauser A. R. Hybrid pathogenicity island PAGI-5 contributes to the highly virulent phenotype of a Pseudomonas aeruginosa isolate in mammals. J Bacteriol 2008, 190:7130–7140.
- Kruckenberg S. M., Cook J. E., Feldman B. F. Clinical toxicities of pet and caged rodents and rabbits. Vet Clin North Am 1975, 5:675–684.
- Homma J. Y. Designation of the thirteen O-group antigens of Pseudomonas aeruginosa; an amendment for the tentative proposal in 1976. Jpn J Exp Med 1982, 52:317–320.
- Zierdt C. H., Williams R. L. Serotyping of Pseudomonas aeruginosa isolates from patients with cystic fibrosis of the pancreas. J Clin Microbiol 1975, 1:521–526.
- Nakamura N., Noguchi K., Urano T. Elimination of Pseudomonas aeruginosa from an experimental nude mouse colony. Jikken Dobutsu 1994, 43:191–197, (In Japanese with English abstract).
- Urano T., Maejima K., Okada O., Takashina S., Syumiya S., Tamura H. Control of Pseudomonas aeruginosa infection in laboratory mice with gentamicin. Jikken Dobutsu 1977, 26:259–262, (In Japanese with English abstract).
- Sasaki H., Kawamoto E., Kunita S., Yagami K. Comparison of the in vitro susceptibility of rodent isolates of Pseudomonas aeruginosa and Pasteurella pneumotropica to enrofloxacin. J Vet Diagn Invest 2007, 19:557–560.
- Goossens H. Susceptibility of multi-drug-resistant Pseudomonas aeruginosa in intensive care units: results from the European MYSTIC study group. Clin Microbiol Infect 2003, 9:980–983.
- Paterson D. L., Bonomo R. A. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Rev 2005, 18:657–686.
- El Solh A. A., Alhajhusain A. Update on the treatment of Pseudomonas aeruginosa pneumonia. J Antimicrob Chemother 2009, 64:229–238.
- Miriagou V., Cornaglia G., Edelstein M., Galani I., Giske C. G., Gniadkowski M., Malamou-Lada E., Martinez-Martinez L., Navarro F., Nordmann P., Peixe L., Pournaras S., Rossolini G. M., Tsakris A., Vatopoulos A., Cantón R. Acquired carbapenemases in Gram-negative bacterial pathogens: detection and surveillance issues. Clin Microbiol Infect 2010, 16:112–122.
- Mattick J. S. Type IV pili and twitching motility. Annu Rev Microbiol 2002, 56:28–314.
- Spencker F. B., Haupt S., Claros M. C., Walter S., Lietz T., Schille R., Rodloff A. C. Epidemiologic characterization of Pseudomonas aeruginosa in patients with cystic fibrosis. Clin Microbiol Infect 2000, 6:600–607.
- Sasaki H., Kawamoto E., Tanaka Y., Sawada T., Kunita S., Yagami K. Comparative analysis of Pasteurella pneumotropica isolates from laboratory mice and rats. Antonie van Leeuwenhoek 2009, 95:311–317.
- Sasaki H., Kawamoto E., Okiyama E., Ueshiba H., Amao H., Sawada T. Molecular typing of Pasteurella pneumotropica isolated from rodents by amplified ribosomal DNA restriction analysis and pulsed-field gel electrophoresis. Microbiol Immunol 2006, 50:265–272.
Источник: BMC Veterinary Research 2010, 6:52. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
СВМ № 3/2011
Вам также могут быть интересны статьи:
Болезни кожи грызунов и кроликов
Расстройства пищеварения у кроликов, вызванные клостридиями