Вирусная лейкемия кошек: в этом обзоре представлены последние знания о патогенезе ВЛК, ключевых признаках, которые необходимо выявить, и часто используемых методах обнаружения ВЛК, а также их характеристиках и интерпретации результатов. В статью включён алгоритм диагностики ВЛК у отдельно взятой кошки, разработанный Европейским консультативным советом по болезням кошек (European Advisory Board on Cat Diseases), и рассматривается тестирование на ВЛК в различных ситуациях. Главная цель — внести вклад в диагностическую экспертизу, чтобы практикующие ветеринарные врачи улучшили диагностику ВЛК и могли ещё больше снизить его распространённость.
 |
| Regina Hofmann-Lehmann, Prof, Dr med vet, FVH Professor of Laboratory Medicine, Director of Department of Clinical Diagnostics and Services, Head of Clinical Laboratory and Centre for Clinical Studies, Vetsuisse Faculty, University of Zurich, Switzerland |
Katrin Hartmann, Prof, Dr med vet, Dr habil, Dip ECVIM-CA (Internal Medicine) Professor of Internal Medicine, Head of Clinic of Small Animal Medicine, Centre for Clinical Veterinary Medicine, LMU Munich, Germany |
Ключевые слова: ВЛК, FeLV, ретровирус, диагностические тесты, патогенез, исход инфекции, антиген, антитело, ИФА, ПЦР, ОТ-ПЦР, выделение вируса, серология.
Носители провируса
Носители провируса играют эпидемиологическую роль — если они используются в качестве доноров крови, может произойти непреднамеренная передача ВЛК. Если шире рассматривать эту проблему, то возможно ослабление иммунной системы, что при сохранённой способности провирусной ДНК к репликации приведёт к тому, что вирус начнёт вновь размножаться, и кошки станут жертвами ВЛК.
Провирус ВЛК выявляют с помощью ДНК-ПЦР в реальном времени, которая является высокочувствительной и специфичной. Было установлено, что для доказательства наличия инфекции ВЛК у кошки выявление провируса ВЛК в периферической крови с использованием ДНК-ПЦР в реальном времени обладает большей чувствительностью, чем обнаружение свободного антигена ВЛК p27 [52]. ДНК-ПЦР в цельной крови выявляет всех носителей провируса ВЛК, включая кошек как с прогрессирующей, так и регрессирующей инфекцией (илл. 1) [иллюстрации 1, 2, 3 и таблицы 1 и 2 см. в «Вирусная лейкемия кошек: практический подход к диагностике. Часть 1»]. Однако не все носители провируса являются антиген-положительными к ВЛК по p27; кошки с регрессирующей инфекцией обычно являются ВЛК-провирус-положительными и антиген-отрицательными — исключения бывают во время любой начальной фазы антигенемии или в случае реактивации (илл. 1). В раннем исследовании, проведённом в Швейцарии, было обнаружено, что 10% домашних кошек подверглись регрессивной инфекции, что было установлено по провирус-положительному и антиген-отрицательному статусу ВЛК [20]. В дальнейшем несколько исследований подтвердили существование кошек с регрессирующей инфекцией ВЛК (т. е. провирус-положительных, но к свободному антигену p27 — отрицательных) в разных популяциях кошек по всему миру [16; 38; 62; 75]. ПЦР на наличие провируса в крови даёт положительные результаты теста в более короткий срок после воздействия ВЛК, чем выявление антигена p27 (таблица 2). В экспериментальных исследованиях кошки становились позитивными к провирусу через 1–2 недели после воздействия ВЛК (против 3–6 недель для антигена p27) [20; 39].
Методы диагностики ВЛК
Далее рассмотрим наиболее часто используемые методы определения свободного антигена ВЛК p27, вирусной РНК и провирусной ДНК. Обнаружение антител к ВЛК также обсуждается, поскольку совсем недавно в Европе стал доступен экспресс-тест на антитела к ВЛК (англ. POC-тест). В специализированных лабораториях доступны дополнительные методы, такие как выделение вируса или ИФА (таблица 2), но они больше не используются и поэтому рассматриваться не будут.
Обнаружение свободного антигена ВЛК p27 в крови
Когда проводить тестирование
Необходимо определить статус по ВЛК каждой кошки, и тест на наличие антигена p27 является в данном случае наиболее распространённым методом. В частности, требуется тестирование таких кошек или при следующих ситуациях:
- кошки, подозреваемые в заражении ВЛК по любому признаку;
- больные кошки, представленные для ветеринарного обследования;
- здоровые кошки до вакцинации против ВЛК;
- кошки с неизвестным анамнезом по ВЛК;
- для выявления очагов ВЛК, например, на территории, занимаемой несколькими кошками;
- до введения новой кошки в группу сородичей.
Как интерпретировать единственный положительный результат
Любой положительный или сомнительный результат теста на антиген p27 (например, слабо положительный или положительный только после истечения времени считывания теста, указанного производителем) должен быть подтверждён немедленно, особенно если распространённость ВЛК низкая или ожидаемый риск заражения ВЛК у тестируемой кошки небольшой. С уменьшением распространённости прогностическая ценность положительного результата становится ниже, а это означает, что даже при самых точных тестах на антигены увеличивается частота ложноположительных результатов. Подтверждение может быть выполнено путём проведения второго и, предпочтительно, другого теста на антиген p27 (т. е. теста POC от другого производителя или количественного ИФА в лаборатории). В качестве альтернативы проба слюны может быть отправлена на ОТ-ПЦР для выявления вирусной РНК в слюне, или проба крови с EDTA может быть отправлена для ПЦР-тестирования на провирус. Как обсуждалось выше, антиген-положительные кошки, как правило, также являются провирусно-положительными (за редкими исключениями).
На всякий случай, поскольку антигенемия ВЛК связана с выделением ВЛК, кошек с положительным результатом на свободный антиген p27 (даже если результат сомнительный или ещё не подтверждённый положительный) следует содержать отдельно от ВЛК-негативных компаньонов до подтверждения отсутствия инфекции.
Как интерпретировать подтверждённый антиген-положительный результат
Если положительный результат на свободный антиген p27 подтверждается, у кошки есть антигенемия и выделение ВЛК на момент тестирования. Животное следует повторно протестировать через 6 недель, а затем, если результат всё ещё положительный, повторно протестировать ещё через 6 недель, чтобы определить, прогрессирует ли инфекция со стойкой антигенемией/виремией или регрессирует с транзиторной антигенемией/виремией. Кошки с антигенемией представляют риск как источники инфекции, и их всегда следует содержать отдельно от ВЛК-негативных компаньонов, независимо от состояния их здоровья и до тех пор, пока повторное тестирование не даст отрицательный результат в более поздний момент времени.
Подтверждённый положительный результат теста на антиген ВЛК (будь то единичный или многократный положительный результат с течением времени) никогда не должен быть смертным приговором для кошки, если обстоятельства позволяют держать её отдельно от других кошек.
Как интерпретировать отрицательный результат
Отрицательный результат теста на свободный антиген ВЛК p27 является высоконадёжным, поскольку прогностическая ценность отрицательного результата теста намного выше, чем положительного из-за низкой распространённости ВЛК в большинстве стран. Это означает, что у кошки нет антигенемии на момент тестирования. Таким образом, кошка не подвергалась разному воздействию ВЛК (не инфицирована), обладает иммунитетом к ВЛК (например, была вакцинирована), преодолела антигенемию (регрессивно инфицирована), имеет абортивное течение ВЛК или просто ещё не положительна, потому что всё ещё находится на очень ранней стадии инфекции ВЛК. Обычно после воздействия ВЛК проходит не менее 3–6 недель (иногда даже дольше), прежде чем антиген ВЛК может быть обнаружен в периферической крови инфицированной кошки. Если недавнее заражение ВЛК нельзя полностью исключить, кошку следует повторно протестировать примерно через 6 недель. До момента повторного тестирования кошку следует содержать отдельно от других кошек (например, на карантине в приюте для животных; домашним кошкам запрещено выходить на улицу). Это делается для того, чтобы не представлять опасности для других, а также для того, чтобы не подвергаться риску заражения в течение 6 недель; последнее приведёт к необходимости дальнейшего повторного тестирования из-за неизвестного воздействия ВЛК.
Обнаружение вирусной РНК методом ОТ-ПЦР в слюне (одной или нескольких кошек)
Когда проводить тестирование
Антиген-положительные кошки с p27 также обычно положительны на РНК вируса ВЛК в слюне [23; 24; 27]. Таким образом, обнаружение РНК ВЛК с помощью ОТ-ПЦР в слюне может быть использовано в качестве маркера антигенемии, и показания для проведения ОТ-ПЦР такие же, как и для тестирования на свободный антиген ВЛК p27. Однако ввиду относительно высокой стоимости ОТ-ПЦР и времени выполнения теста (обычно 1–3 дня) этот тест нечасто используется у отдельных кошек. Одним из исключений может быть случай, когда сбор слюны позволяет обойти проблемы, связанные с забором крови (например, у капризных кошек или в приютах без ветеринарной поддержки на месте). Другим исключением могут быть случаи, когда ОТ-ПЦР используется в качестве подтверждающего теста после положительного или сомнительного результата анализа крови на антиген ВЛК p27. Кроме того, ОТ-ПЦР на слюне может быть полезна на самой ранней стадии ВЛК-инфекции, поскольку вирусная РНК в слюне (и тем более в крови) обнаруживается примерно на 2 недели раньше, чем антиген p27 обнаруживается в крови.
Другим применением ОТ-ПЦР в режиме реального времени является тестирование объединённых проб слюны на наличие РНК вируса ВЛК из-за его чрезвычайно высокой чувствительности и очень высокой вирусной нагрузки ВЛК в слюне. ОТ-ПЦР в реальном времени объединённых проб слюны — это экономичный и эффективный скрининг-анализ для подтверждения отсутствия выделений ВЛК в среде с несколькими кошками, которые, вероятно, не заражены ВЛК.
Как интерпретировать положительный результат ОТ-ПЦР
Если результат ВЛК ОТ-ПЦР из слюны у одной кошки положительный, у кошки есть антигенемия и выделение ВЛК на момент тестирования. Таким образом, интерпретация такая же, как и для кошки, у которой положительный результат теста на свободный антиген ВЛК p27. Кошку следует повторно протестировать через 6 недель, а затем, если результат всё ещё положительный, повторно протестировать ещё через 6 недель, чтобы определить, прогрессирующая или регрессирующая у неё инфекция. Кошек, выделяющих ВЛК, всегда следует содержать отдельно от ВЛК-негативных компаньонов, независимо от состояния их здоровья и до тех пор, пока повторное тестирование не даст отрицательный результат.
В случае положительного результата объединённой пробы слюны (популяционный анализ) необходимо последующее тестирование отдельных кошек для выявления в группе тех, кто выделяет ВЛК, либо с помощью ОТ-ПЦР на отдельных мазках слюны, либо с помощью анализа крови отдельных кошек на антиген ВЛК p27.
Ложноположительные результаты ОТ-ПЦР могут быть вызваны лабораторным загрязнением. Важно использовать только референтные лаборатории, в которых чувствительность и специфичность анализа ОТ-ПЦР подтверждены, а также проводится контроль вирусовыделения и контрольные анализы при отрицательном и положительном результате ПЦР.
Как интерпретировать отрицательный результат
Если результат ВЛК ОТ-ПЦР из слюны у одной кошки отрицательный, у кошки нет антигенемии на момент тестирования. Таким образом, существует вероятность того, что кошка не подвергалась воздействию ВЛК (не инфицирована), обладает иммунитетом к ВЛК (например, была вакцинирована), преодолела антигенемию (регрессивная инфекция), перенесла абортивную форму ВЛК или ещё не является положительной, потому что она всё ещё находится на очень ранней стадии инфицирования ВЛК. Отрицательная фаза после воздействия значительно короче для ОТ-ПЦР в слюне (а также короче для ОТ-ПЦР в крови), чем для тестов на антиген р27 в крови [27; 39]. Обычно проходит не менее 3–6 недель (иногда даже дольше) после воздействия ВЛК, прежде чем антиген ВЛК может быть обнаружен в периферической крови инфицированной кошки, в то время как вирусная РНК в слюне (и крови) может быть обнаружена уже через 1 неделю после заражения ВЛК [47].
Обнаружение провируса ВЛК в крови
Когда проводить тестирование
ПЦР ДНК провируса ВЛК может быть использована у следующих кошек и в следующих ситуациях:
- в качестве подтверждающего теста для положительных или сомнительных результатов теста на свободный антиген p27;
- для выявления носителей провируса / кошек с регрессирующей инфекцией;
- для тестирования в ранние сроки после потенциального воздействия (ПЦР на провирус даёт положительный результат раньше, чем тесты на антиген p27);
- подтвердить отсутствие носителей провируса ВЛК в популяциях с несколькими кошками;
- прояснить неясные клинические случаи при подозрении на инфекцию ВЛК, но при отсутствии антигенемии ВЛК;
- для тестирования доноров крови и продуктов крови перед переливанием.
Как интерпретировать положительный результат
Если результат ПЦР на провирус ВЛК положительный, кошка подверглась воздействию ВЛК и у неё развилась либо прогрессирующая, либо регрессирующая инфекция (илл. 1). Некоторые лаборатории также предоставляют сведения о провирусной нагрузке. Если провирусная нагрузка высока (пороговое значение низкого цикла), существует большая вероятность того, что у кошки в крови во время тестирования наличествуют антигены; если провирусная нагрузка остаётся постоянно высокой, инфекция, вероятно, станет прогрессировать [20].
Если результат ПЦР на провирус ВЛК положительный, следует провести тест на выявление антигенемии, чтобы отличить прогрессирующую инфекцию от регрессирующей. Через несколько недель после заражения провирусная нагрузка в крови также может быть использована для дифференциации кошек с прогрессирующей и регрессирующей инфекцией. Однако у естественно инфицированных кошек момент заражения обычно неизвестен, и во время ранней инфекции провирусные нагрузки в крови кошек с регрессирующей или прогрессирующей инфекцией не различаются [6].
Ложноположительные результаты ПЦР могут быть вызваны лабораторной контаминацией. Важно использовать только референтные лаборатории, в которых чувствительность и специфичность ПЦР-тестов подтверждены, а также проводятся повторные взятия проб и контрольные анализы при отрицательном и положительном результате ПЦР.
Как интерпретировать отрицательный результат
Если результат ПЦР на провирус ВЛК отрицательный, провирус не интегрирован в геном кошки, и у неё не развилось ни прогрессирующей, ни регрессирующей инфекции. Таким образом, кошка не подвергалась заражению ВЛК, или у неё инфекция в очаговой либо абортивной форме, или же кошка находится на самой ранней стадии инфекции. Однако обычно требуется всего 1–2 недели после заражения ВЛК, чтобы кошка стала ВЛК-положительной, и поэтому маловероятно, что инфекция будет пропущена в течение этого короткого промежутка времени.
Обнаружение антител к ВЛК
Когда проводить тестирование
У кошек, заражённых ВЛК, может развиться разная степень иммунного ответа на вирус (илл. 2). Хотя определение клеточного иммунного ответа очень сложно даже в специализированных лабораториях [43; 76], существует несколько методов определения антител к ВЛК, включая реакцию нейтрализации и новый экспресс-тест. Для определения истинного гуморального иммунитета к ВЛК потребуется количественное определение биологически активных вируснейтрализующих антител. Однако реакция вируснейтрализации ставится только в специализированных лабораториях и требует длительной работы с культурой клеток.
У кошек с абортивной инфекцией ВЛК наличие антител является единственным доказательством воздействия вируса на организм (илл. 1 и 2). Таким образом, тестирование на наличие антител к ВЛК является единственным методом выявления кошек с абортивной инфекцией. Однако поскольку такие кошки не распространяют вирус, и у них не развиваются клинические признаки и не происходит реактивации инфекции, их клиническая и эпидемиологическая значимость очень низка.
Тестирование на антитела к ВЛК может быть использовано для определения исхода заболевания (т. е. прогрессирующей или регрессирующей инфекции) [6; 20; 54]. Большинство кошек с регрессирующей инфекцией демонстрируют сильный гуморальный иммунный ответ с высоким уровнем нейтрализующих антител, в то время как у кошек с прогрессирующей инфекцией обычно низкий уровень нейтрализующих антител к ВЛК или они вообще отсутствуют (илл. 2) [36]. Ни одна из существующих вакцин против ВЛК не вызывает реакции, проявляющейся выработкой нейтрализующих антител; эти вакцины защищают от заражения предположительно потому, что они стимулируют клеточный иммунитет [6; 36; 77; 78].
Исследование различных антигенов ВЛК с целью оценки их диагностической полезности для разработки экспресс-теста, который обнаруживает антитела к ВЛК, выявило, что рекомбинантный препарат ВЛК p15E (трансмембранный белок оболочки) является наиболее перспективным антигеном [79]. У естественно инфицированных кошек ИФА p15E показал диагностическую чувствительность 77,1% и специфичность 85,6% по сравнению с результатами ПЦР на провирус [79]. Использование этого антигена в тесте на антитела к ВЛК (в сочетании с тестированием на антиген ВЛК p27) может дать наибольшие перспективы для распознавания всех кошек, подвергшихся заражению ВЛК. Ожидается, что тест на антитела будет положительным у кошек с регрессирующей или абортивной инфекцией, а тест на антиген распознает всех кошек с прогрессирующей инфекцией.
Неизвестно, насколько хорошо наличие антител к p15E коррелирует с защитой от ВЛК и сохраняются ли антитела у кошек с абортивной инфекцией на протяжении всей жизни. Это важные вопросы, на которые ещё предстоит ответить, чтобы определить, может ли кошка с абортивной инфекцией быть невосприимчивой к новому заражению и, следовательно, не требовать вакцинации. У кошек, вакцинированных против ВЛК, результаты тестирования на антитела к антигену p15E зависят от используемой вакцины. Если у кошек, вакцинированных цельновирионной вакциной, могут вырабатываться сильные антитела против p15E, то при использовании вакцины на основе рекомбинантного белка или оспы канареек это может быть совсем не так [79].
Как интерпретировать положительный результат
Тестирование на антитела к ВЛК в настоящее время не используется регулярно (таблица 2). Недавно на европейском рынке был представлен экспресс-тест, обнаруживающий антитела к антигену ВЛК p15E [79]. Однако в настоящее время недостаточно данных для оценки ценности этого теста для диагностики инфекции ВЛК в полевых условиях. Потребуются контролируемые исследования, чтобы определить, может ли этот тест надёжно показать инфекцию ВЛК или иммунитет к ВЛК, и можно ли его использовать, например, в качестве теста перед вакцинацией.
Как интерпретировать отрицательный результат
Большинство кошек, не имеющих антитела к ВЛК p15E, вероятно, ранее не подвергались заражению ВЛК [79]; но поскольку не у всех кошек, подвергшихся воздействию ВЛК, сохраняются антитела к ВЛК, отрицательный результат теста на антитела при отсутствии антигена ВЛК не исключает предшествующего воздействия ВЛК на организм.
Тестирование на ВЛК в конкретной ситуации
Тестирование единственной (отдельно содержащейся) кошки
Европейский консультативный совет по болезням кошек (ABCD) создал диагностический алгоритм («Диагностический инструмент ABCD ВЛК»), который предназначен для того, чтобы провести ветеринарных врачей через этапы определения вероятности того, подвергалась ли кошка воздействию ВЛК и имеет ли место прогрессирующая или регрессирующая инфекция (этапы диагностики показаны на илл. 4). Этот диагностический инструмент, основанный на оценке риска, а также клинической картине, учитывает различные характеристики теста, промежуток времени, в течение которого тест может дать положительные результаты, а также положительную и отрицательную прогностическую ценность тестов. В нём также освещаются шаги для подтверждения результатов, а также для повторного тестирования с целью выявления различных путей заражения ВЛК. Дополнительную информацию об использовании диагностического инструмента ABCD ВЛК можно найти по адресу abcdcatsvets.org.
Тестирование доноров крови
Было продемонстрировано, что кошки с регрессирующей инфекцией могут передавать ВЛК неинфицированным реципиентам при переливании крови [80]. У некоторых кошек, получавших кровь от кошек с регрессирующей инфекцией, впоследствии развивалась прогрессирующая ВЛК-инфекция и ВЛК-ассоциированное заболевание (нерегенеративная анемия и лимфома). Перелитая кровь дала отрицательный результат на свободный антиген ВЛК p27 и была отрицательной при выделении вируса, но положительной на провирусную ДНК ВЛК. Таким образом, методов выявления свободного антигена ВЛК p27 недостаточно для предотвращения непреднамеренной передачи инфекции. Чувствительная ПЦР в реальном времени рекомендуется для выявления провируса ВЛК у каждой кошки, выступающей в качестве донора крови для того, чтобы исключить случайную передачу ВЛК реципиентам, а также в более общем плане для дальнейшего снижения распространённости инфекции ВЛК в популяции кошек.
Тестирование для предотвращения занесения вируса в популяцию кошек, не заражённых ВЛК
Кошка из неизвестной среды (например, подобранная спасателями) или с неизвестной историей заражения ВЛК (например, кошка, имеющая выход на улицу или кошка из учреждения, где не все кошки были протестированы или некоторые из них имеют доступ на улицу) попадает в популяцию кошек, не инфицированных FeLV. Например, в помещении питомника или в доме с кошками-компаньонами вновь прибывшая кошка должна быть проверена на антигенемию ВЛК и/или выделение вируса перед заселением. Для этой цели можно использовать диагностический алгоритм ABCD ВЛК (илл. 4).
Важно, чтобы в течение всего периода тестирования, включая возможное повторное тестирование, вновь прибывшая кошка находилась на карантине без каких-либо контактов с другими кошками, проживающими в учреждении / домашнем хозяйстве, пока не будет подтверждено, что она не выделяет ВЛК. Наиболее частая ошибка — когда получают отрицательный результат теста и не учитывают, что кошка может быть инфицирована совсем недавно и прошло слишком мало времени для того, чтобы тест мог дать положительный результат. Если внимательно следовать алгоритму диагностики ВЛК (илл. 4) и в течение этого времени кошек держать по отдельности, этой ловушки можно избежать.
Тестирование при совместном проживании нескольких кошек на отсутствие инфекции ВЛК
Выбор наилучшей стратегии в этом случае зависит от цели. В идеале в помещении, где содержатся несколько кошек, не должно быть носителей ВЛК. Для подтверждения того, что эта цель достигнута, всех кошек необходимо будет протестировать на наличие провируса ВЛК с использованием ДНК-ПЦР, чтобы также выявить кошек, которые являются только носителями провируса ВЛК (регрессирующая инфекция). Поскольку ПЦР-тесты на ВЛК-провирус могут дать положительную реакцию примерно через 2 недели после воздействия ВЛК (таблица 2), кошек необходимо изолировать от любого потенциального риска заражения ВЛК не менее 2–3 недель.
В качестве альтернативы для того, чтобы кошки, свободные от ВЛК, не смогли заразиться, среди проживающих в учреждении кошек не должно быть особей, активно выделяющих ВЛК. Отсутствие активной циркуляции ВЛК может быть подтверждено анализом крови на антиген ВЛК у всех животных (антиген-положительные кошки — выделяют вирус) или, что более экономично, с помощью ОТ-ПЦР тестирования образцов слюны всех кошек на вирусную РНК. Для последнего анализа сбор проб является простым, и эти пробы могут быть объединены для тестирования в специализированной лаборатории. Как уже обсуждалось, рекомендуется объединять не более 10 проб слюны для каждого теста (предварительно проконсультируйтесь с лабораторией). ОТ-ПЦР также имеет то преимущество, что инфицированных кошек можно выявить уже примерно через 1 неделю после заражения. Если используется тестирование на антигены и нельзя исключить недавнее заражение ВЛК, кошек необходимо повторно протестировать через 6 недель. В течение этого периода положительно реагирующие на ВЛК кошки должны содержаться отдельно. Более подробная информация об организации менеджмента по ВЛК в среде обитания нескольких кошек доступна в ABCD [81; 82].
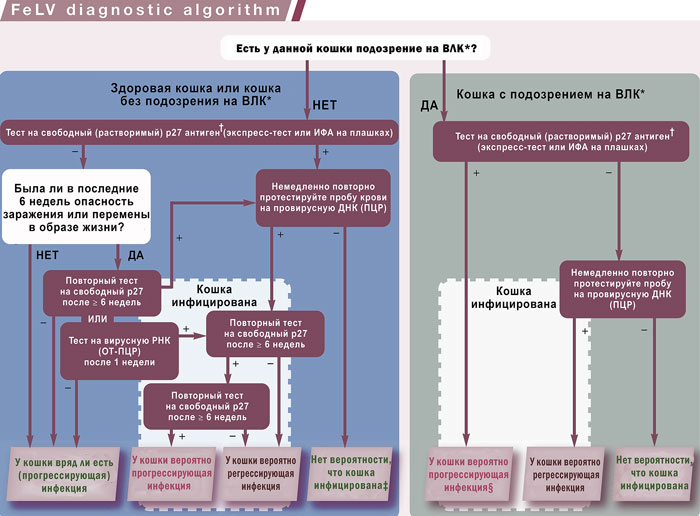 |
| Илл. 4. Алгоритм диагностики вируса лейкемии кошек (ВЛК) Европейского консультативного совета по болезням кошек (ABCD). Этому диагностическому алгоритму необходимо следовать для определения вероятности того, заражена кошка ВЛК или нет, и какой исход инфекции наиболее вероятен. [Данный диагностический алгоритм основан на «Диагностическом инструменте ABCD ВЛК», который доступен по адресу abcdcatsvets.org]
* О факторах риска или клинических признаках, связанных с ВЛК, см. вставку ниже. |
Факторы риска и клинические проблемы, которые у кошек ассоциируются с заражением ВЛК
- Метисы, свободно гуляющие или одичавшие кошки, кошки из домов, где уже есть ВЛК-позитивные кошки
- Кошки из местности с высоким распространением ВЛК
- Наличие новообразований (лимфома, лейкемия или подобные)
- Супрессия костного мозга (нерегенеративная анемия, тромбоцитопения, нейтропения, панцитопения)
- Хронические или рецидивирующие инфекции, вызывающие подавление иммунитета
- Хронический гингивостоматит
- Иммуноопосредованная гемолитическая анемия
- Неврологическая симптоматика (периферическая >> центральная нервная система)
- Репродуктивные нарушения
- Синдром увядания котят
- Изредка другие расстройства, такие как иммуноопосредованный увеит или эрозивный полиартрит
Влияние материнских антител и вакцинации на результаты тестирования
Материнские антитела не мешают тестированию на свободный антиген p27, поэтому котят можно тестировать на антигенемию в любом возрасте. Подтверждённый положительный результат теста на антиген p27 свидетельствует о продолжающейся антигенемии у котёнка, и у большинства этих котят впоследствии развивается прогрессирующая инфекция. Отрицательный результат теста на антиген ВЛК p27 не всегда является доказательством отсутствия заражения, поскольку у некоторых котят тест даёт положительный результат только через несколько недель или месяцев после рождения, даже если они были инфицированы в процессе рождения или вскоре после него. Каждый котёнок должен тестироваться индивидуально; не все котята из одного помёта обязательно должны быть инфицированы, и у отдельных котят могут быть разные исходы ВЛК.
Вакцинация против ВЛК обычно не даёт положительного результата теста. Исключением является редко используемый тест на антитела p15E, который может дать положительный результат после использования некоторых вакцин против ВЛК (например, цельновирионных, но не вакцин на основе оспы канареек или рекомбинантного белка) [6; 39; 78]. Однако в одном отчёте указано, что кровь, собранная сразу после вакцинации, может содержать обнаруживаемые антигены вакцины против ВЛК [7], и, таким образом, представляется целесообразным брать кровь для тестирования на антиген p27 до вакцинации от ВЛК.
Ключевые моменты
- Тестирование кошек на инфицирование ВЛК является важной задачей для ветеринаров в клинической практике. Интерпретация тестов ВЛК не является тривиальной и требует фундаментальных знаний о патогенезе заболевания, взаимодействии вируса с хозяином, а также различных тестах ВЛК и их характеристиках.
- Статус ВЛК каждой кошки должен быть известен; это влияет на терапевтические и эпидемиологические решения, которые необходимо обсуждать с владельцем кошки.
- Для снижения распространённости инфекции ВЛК и даже потенциального её искоренения в определённых географических районах необходимо дальнейшее повышение осведомлённости об этой смертельной инфекционной болезни кошек и её правильной диагностике.
Благодарность
Диагностический алгоритм, на котором основана илл. 4, любезно предоставлен Европейским консультативным советом по болезням кошек (ABCD).
Конфликт интересов
Авторы заявили об отсутствии потенциальных конфликтов интересов в отношении исследования, авторства и/или публикации этой статьи.
Финансирование
Авторы не получали финансовой поддержки за исследование, авторство и/или публикацию этой статьи.
Этическое одобрение
Эта работа не предполагала использования животных, и поэтому этическое одобрение не требовалось.
Информированное согласие
Эта работа не предполагала использования животных, и поэтому информированное согласие не требовалось. В этой публикации не идентифицируются животные или люди, и поэтому дополнительного информированного согласия на публикацию не требовалось.
Литература
- Willett BJ and Hosie MJ. Feline leukaemia virus: half a century since its discovery. Vet J 2013; 195: 16–23.
- Lutz H, Addie D, Belak S, et al. Feline leukaemia. ABCD guidelines on prevention and management. J Feline Med Surg 2009; 11: 565–574.
- Jarrett WF, Crawford EM, Martin WB, et al. A viruslike particle associated with leukemia (lympho- sarcoma). Nature 1964; 202: 567–569.
- Helfer-Hungerbuehler AK, Widmer S, Kessler Y, et al. Long-term follow up of feline leukemia virus infection and characterization of viral RNA loads using molecular methods in tissues of cats with different infection outcomes. Virus Res 2015; 197: 137–150.
- Hofmann-Lehmann R, Holznagel E, Ossent P, et al. Parameters of disease progression in long-term experimental feline retrovirus (feline immunodeficiency virus and feline leukemia virus) infections: hematology, clinical chemistry, and lymphocyte subsets. Clin Diagn Lab Immunol 1997; 4: 33–42.
- Hofmann-Lehmann R, Cattori V, Tandon R, et al. Vaccination against the feline leukaemia virus: outcome and response categories and long-term follow-up. Vaccine 2007; 25: 5531–5539.
- Little S, Levy J, Hartmann K, et al. 2020 AAFP feline retrovirus testing and management guidelines. J Feline Med Surg 2020; 22: 5–30.
- McClelland AJ, Hardy WD and Zuckerman EE. Prognosis of healthy feline leukemia virus infected cats. In: Hardy WD, Essex M and McClelland AJ (eds). Developments in cancer research. Amsterdam: Elsevier, 1980, pp. 121–126.
- Hartmann K. Clinical aspects of feline retro-viruses: a review. Viruses 2012; 4: 2684–2710.
- Hartmann K. Clinical aspects of feline immunodeficiency and feline leukemia virus infection. Vet Immunol Immunopathol 2011; 143: 190–201.
- Levy JK, Scott HM, Lachtara JL, et al. Seroprevalence of feline leukemia virus and feline immunodeficiency virus infection among cats in North America and risk factors for sero-positivity. J Am Vet Med Assoc 2006; 228: 371–376.
- Weijer K, UijtdeHaag F and Osterhaus A. Control of feline leukaemia virus infection by a removal programme. Vet Rec 1986; 119: 555–556.
- Cotter SM. Changing epidemiology of FeLV. 15th Annual ACVIM Forum. Lake Buena Vista, Florida: USA, 1997, pp. 22–25.
- Burling AN, Levy JK, Scott HM, et al. Seroprevalences of feline leukemia virus and feline immunodeficiency virus infection in cats in the United States and Canada and risk factors for seropositivity. J Am Vet Med Assoc 2017; 251: 187–194.
- Gleich SE, Krieger S and Hartmann K. Prevalence of feline immunodeficiency virus and feline leukaemia virus among client-owned cats and risk factors for infection in Germany. J Feline Med Surg 2009; 11: 985–992.
- Hofmann-Lehmann R, Gonczi E, Riond B, et al. Feline leukemia virus infection: importance and current situation in Switzerland [article in German]. Schweiz Arch Tierheilkd 2018; 160: 95–105.
- Cattori V, Tandon R, Pepin A, et al. Rapid detection of feline leukemia virus provirus integration into feline genomic DNA. Mol Cell Probes 2006; 20: 172–181.
- Polani S, Roca AL, Rosensteel BB, et al. Evolutionary dynamics of endogenous feline leukemia virus proliferation among species of the domestic cat lineage. Virology 2010; 405: 397–407.
- Anai Y, Ochi H, Watanabe S, et al. Infectious endogenous retroviruses in cats and emergence of recombinant viruses. J Virol 2012; 86: 8634–8644.
- Hofmann-Lehmann R, Huder JB, Gruber S, et al. Feline leukaemia provirus load during the course of experimental infection and in naturally infected cats. J Gen Virol 2001; 82: 1589–1596.
- Rohn JL and Overbaugh J. In vivo selection of long terminal repeat alterations in feline leukemia virus-induced thymic lymphomas. Virology 1995; 206: 661–665.
- Jackson ML, Haines DM, Meric SM, et al. Feline leukemia virus detection by immunohistochemistry and polymerase chain reaction in formalin-fixed, paraffin-embedded tumor tissue from cats with lymphosarcoma. Can J Vet Res 1993; 57: 269–276.
- Gomes-Keller MA, Gonczi E, Tandon R, et al. Detection of feline leukemia virus RNA in saliva from naturally infected cats and correlation of PCR results with those of current diagnostic methods. J Clin Microbiol 2006; 44: 916–922.
- Gomes-Keller MA, Tandon R, Gonczi E, et al. Shedding of feline leukemia virus RNA in saliva is a consistent feature in viremic cats. Vet Microbiol 2006; 112: 11–21.
- Francis DP, Essex M and Hardy WD, Jr. Excretion of feline leukaemia virus by naturally infected pet cats. Nature 1977; 269: 252–254.
- Pacitti AM, Jarrett O and Hay D. Transmission of feline leukaemia virus in the milk of a non-viraemic cat. Vet Rec 1986; 118: 381–384.
- Cattori V, Tandon R, Riond B, et al. The kinetics of feline leukaemia virus shedding in experimentally infected cats are associated with infection outcome. Vet Microbiol 2009; 133: 292–296.
- Gomes-Keller MA, Gonczi E, Grenacher B, et al. Fecal shedding of infectious feline leukemia virus and its nucleic acids: a transmission potential. Vet Microbiol 2009; 134: 208–217.
- Francis DP, Essex M and Gayzagian D. Feline leukemia virus: survival under home and laboratory conditions. J Clin Microbiol 1979; 9: 154–156.
- Major A, Cattori V, Boenzli E, et al. Exposure of cats to low doses of FeLV: seroconversion as the sole parameter of infection. Vet Res 2010; 41: 17.
- Rojko JL, Hoover EA, Mathes LE, et al. Pathogenesis of experimental feline leukemia virus infection. J Natl Cancer Inst 1979; 63: 759–768.
- Rojko JL and Kociba GJ. Pathogenesis of infection by the feline leukemia virus. J Am Vet Med Assoc 1991; 199: 1305–1310.
- Cattori V, Pepin AC, Tandon R, et al. Real-time PCR investigation of feline leukemia virus proviral and viral RNA loads in leukocyte subsets. Vet Immunol Immunopathol 2008; 123: 124–128.
- Hoover EA, Olsen RG, Hardy WD, Jr, et al. Feline leukemia virus infection: age-related variation in response of cats to experimental infection. J Natl Cancer Inst 1976; 57: 365–369.
- Grant CK, Essex M, Gardner MB, et al. Natural feline leukemia virus infection and the immune response of cats of different ages. Cancer Res 1980; 40: 823–829.
- Lehmann R, Franchini M, Aubert A, et al. Vaccination of cats experimentally infected with feline immunodeficiency virus, using a recombinant feline leukemia virus vaccine. J Am Vet Med Assoc 1991; 199: 1446–1452.
- Pepin AC, Tandon R, Cattori V, et al. Cellular segregation of feline leukemia provirus and viral RNA in leukocyte subsets of long-term experimentally infected cats. Virus Res 2007; 127: 9–16.
- Torres AN, Mathiason CK and Hoover EA. Re-examination of feline leukemia virus: host relationships using real-time PCR. Virology 2005; 332: 272–283.
- Hofmann-Lehmann R, Tandon R, Boretti FS, et al. Reassessment of feline leukaemia virus (FeLV) vaccines with novel sensitive molecular assays. Vaccine 2006; 24: 1087–1094.
- Hofmann-Lehmann R, Holznagel E, Aubert A, et al. Recombinant FeLV vaccine: long-term protection and effect on course and outcome of FIV infection. Vet Immunol Immunopathol 1995; 46: 127–137.
- McCaw DL, Boon GD, Jergens AE, et al. Immuno-modulation therapy for feline leukemia virus infection. J Am Anim Hosp Assoc 2001; 37: 356–363.
- Hoover EA, Olsen RG, Hardy WD, Jr, et al. Biologic and immunologic response of cats to experimental infection with feline leukemia virus. Bibl Haematol 1975: 180–183.
- Flynn JN, Hanlon L and Jarrett O. Feline leukaemia virus: protective immunity is mediated by virus-specific cytotoxic T lymphocytes. Immunology 2000; 101: 120–125.
- Stutzer B, Muller F, Majzoub M, et al. Role of latent feline leukemia virus infection in nonregenerative cytopenias of cats. J Vet Intern Med 2010; 24: 192–197.
- Stutzer B, Simon K, Lutz H, et al. Incidence of persistent viraemia and latent feline leukaemia virus infection in cats with lymphoma. J Feline Med Surg 2011; 13: 81–87.
- Torres AN, O’Halloran KP, Larson LJ, et al. Development and application of a quantitative real-time PCR assay to detect feline leukemia virus RNA. Vet Immunol Immunopathol 2008; 123: 81–89.
- Tandon R, Cattori V, Gomes-Keller MA, et al. Quantitation of feline leukaemia virus viral and proviral loads by TaqMan real-time polymerase chain reaction. J Virol Methods 2005; 130: 124–132.
- Pacitti AM. Latent feline leukemia-virus infection — a review. J Small Anim Pract 1987; 28: 1153–1159.
- Pacitti AM and Jarrett O. Duration of the latent state in feline leukemia-virus infections. Vet Record 1985; 117: 472–474.
- Pedersen NC, Meric SM, Johnson L, et al. The clinical significance of latent feline leukemia virus infection in cats. Feline Pract 1984; 14: 32–48.
- Rojko JL, Hoover EA, Quackenbush SL, et al. Reactivation of latent feline leukaemia virus infection. Nature 1982; 298: 385–388.
- Hofmann-Lehmann R, Cattori V, Tandon R, et al. How molecular methods change our views of FeLV infection and vaccination. Vet Immunol Immunopathol 2008; 123: 119–123.
- Helfer-Hungerbuehler AK, Cattori V, Boretti FS, et al. Dominance of highly divergent feline leukemia virus A progeny variants in a cat with recurrent viremia and fatal lymphoma. Retrovirology 2010; 7: 14. DOI: 10.1186/1742–4690–7–14.
54 Lutz H, Pedersen NC and Theilen GH. Course of feline leukemia virus infection and its detection by enzyme-linked immunosorbent assay and monoclonal antibodies. Am J Vet Res 1983; 44: 2054–2059.
55 Jarrett O, Golder MC and Weijer K. A comparison of three methods of feline leukaemia virus diagnosis. Vet Rec 1982; 110: 325–328.
56 Jarrett O, Pacitti AM, Hosie MJ, et al. Comparison of diagnostic methods for feline leukemia virus and feline immunodeficiency virus. J Am Vet Med Assoc 1991; 199: 1362–1364.
57 Miyazawa T and Jarrett O. Feline leukaemia virus proviral DNA detected by polymerase chain reaction in antigenaemic but non-viraemic (‘discordant’) cats. Arch Virol 1997; 142: 323–332.
58 Hayes KA, Rojko JL and Mathes LE. Incidence of localized feline leukemia virus infection in cats. Am J Vet Res 1992; 53: 604–607.
59 Jarrett O. Feline leukaemia virus. In Pract 1985; 7: 125–126.
60 Jarrett O, Golder MC and Stewart MF. Detection of transient and persistent feline leukaemia virus infections. Vet Rec 1982; 110: 225–228.
61 Hayes KA, Rojko JL, Tarr MJ, et al. Atypical localised viral expression in a cat with feline leukaemia. Vet Rec 1989; 124: 344–346.
62 Westman M, Norris J, Malik R, et al. The diagnosis of feline leukaemia virus (FeLV) infection in owned and group-housed rescue cats in Australia. Viruses 2019; 11. DOI: 10.3390/v11060503.
63 Lutz H, Pedersen NC, Durbin R, et al. Monoclonal antibodies to three epitopic regions of feline leukemia virus p27 and their use in enzyme-linked immunosorbent assay of p27. J Immunol Methods 1983; 56: 209–220.
64 Hartmann K, Griessmayr P, Schulz B, et al. Quality of different in-clinic test systems for feline immunodeficiency virus and feline leukaemia virus infection. J Feline Med Surg 2007; 9: 439–445.
65 Pinches MD, Diesel G, Helps CR, et al. An update on FIV and FeLV test performance using a Bayesian statistical approach. Vet Clin Pathol 2007; 36: 141–147.
66 Sand C, Englert T, Egberink H, et al. Evaluation of a new in-clinic test system to detect feline immunodeficiency virus and feline leukemia virus infection. Vet Clin Pathol 2010; 39: 210–214.
67 Kim WS, Chong CK, Kim HY, et al. Development and clinical evaluation of a rapid diagnostic kit for feline leukemia virus infection. J Vet Sci 2014; 15: 91–97.
68 Levy JK, Crawford PC and Tucker SJ. Performance of 4 point-of-care screening tests for feline leukemia virus and feline immunodeficiency virus. J Vet Intern Med 2017; 31: 521–526.
69 Westman ME, Malik R, Hall E, et al. Comparison of three feline leukaemia virus (FeLV) point-of-care antigen test kits using blood and saliva. Comp Immunol Microbiol Infect Dis 2017; 50: 88–96.
70 Hartmann K, Werner RM, Egberink H, et al. Comparison of six in-house tests for the rapid diagnosis of feline immunodeficiency and feline leukaemia virus infections. Vet Rec 2001; 149: 317–320.
71 Barr MC. FIV, FeLV, and FIPV: interpretation and misinterpretation of serological test results. Semin Vet Med Surg (Small Anim) 1996; 11: 144–153.
72 Buch JS, Clark GH, Cahill R, et al. Analytical validation of a reference laboratory ELISA for the detection of feline leukemia virus p27 antigen. J Vet Diagn Invest 2017; 29: 654–659.
73 Lutz H and Jarrett O. Detection of feline leukemia virus infection in saliva. J Clin Microbiol 1987; 25: 827–831.
74 Westman ME, Malik R and Norris JM. Diagnosing feline immunodeficiency virus (FIV) and feline leukaemia virus (FeLV) infection: an update for clinicians. Aust Vet J 2019; 97: 47–55.
75 Englert T, Lutz H, Sauter-Louis C, et al. Survey of the feline leukemia virus infection status of cats in Southern Germany. J Feline Med Surg 2012; 14: 392–398.
76 Flynn JN, Dunham SP, Watson V, et al. Longitudinal analysis of feline leukemia virus-specific cytotoxic T lymphocytes: correlation with recovery from infection. J Virol 2002; 76: 2306–2315.
77 Torres AN, O’Halloran KP, Larson LJ, et al. Feline leukemia virus immunity induced by whole inactivated virus vaccination. Vet Immunol Immunopathol 2010; 134: 122–131.
78 Poulet H, Brunet S, Boularand C, et al. Efficacy of a canarypox virus-vectored vaccine against feline leukaemia. Vet Rec 2003; 153: 141–145.
79 Boenzli E, Hadorn M, Hartnack S, et al. Detection of antibodies to the feline leukemia virus (FeLV) transmembrane protein p15E: an alternative approach for serological FeLV detection based on antibodies to p15E. J Clin Microbiol 2014; 52: 2046–2052.
80 Nesina S, Helfer-Hungerbuehler AK, Riond B, et al. Retroviral DNA — the silent winner: blood transfusion containing latent feline leukaemia provirus causes of infection and disease in naive recipient cats. Retrovirology 2015; 12: 105. DOI: 10.1186/s12977–015–0231-z.
81 Mostl K, Egberink H, Addie D, et al. Prevention of infectious diseases in cat shelters: ABCD guidelines. J Feline Med Surg 2013; 15: 546–554.
82 ABCD. Infectious diseases in shelter situations and their management. http://www.abcdcatsvets.org/infectious-diseases-in-shelter-situations-and-their-management/ (2017, accessed September 2, 2019)
СВМ № 6/2022
Вам также могут быть интересными статьи:




