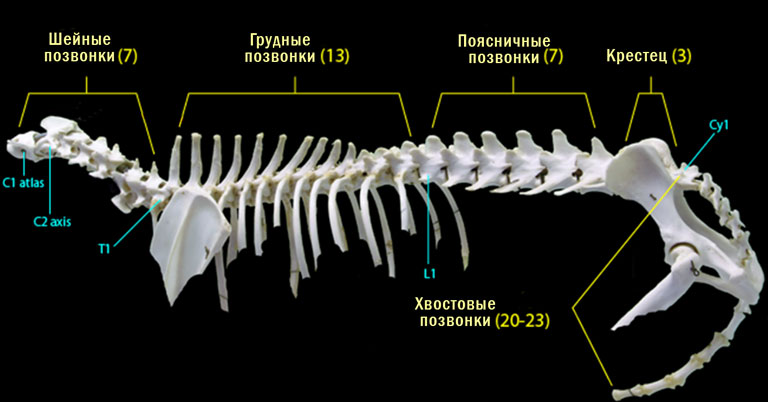
Болезнь межпозвоночных дисков, или дископатия, часто встречается у собак разных пород и возрастов. Во втором реферате статей из проекта Canine Intervertebral Disc Disease — The Current State of Knowledge («Болезнь межпозвоночных дисков у собак: современное состояние знаний») мы поговорим о генетических причинах возникновения болезни межпозвоночных дисков и рассмотрим патогенез травмы спинного мозга, которая вызывается грыжей МПД.
Болезнь межпозвоночных дисков у собак: текущее понимание генетики дегенерации межпозвоночных дисков
Породная предрасположенность, исследования, в которых высказывались предположения о наследовании преждевременной дегенерации межпозвоночных дисков (МПД), и связь локуса в 12-й хромосоме (CFA 12) у собак с кальцификацией МПД поддерживают гипотезу о том, что в развитии дегенерации МПД есть генетический компонент. Недавние исследования подтверждают связь дегенерации МПД с чрезмерной экспрессией ретрогена FGF4 в CFA 12 и открыли новые области для дальнейшего исследования патофизиологии преждевременной дегенерации МПД.
Только у собак известно более 120 генетических вариантов (мутаций), связанных с неврологическими заболеваниями. Многие из этих заболеваний связаны с породоспецифичными синдромами и имеют относительно «ограниченный» эффект на здоровье всей популяции собак в целом. Огромное фенотипическое разнообразие у одомашненных собак — это результат селекции генетических вариантов, которые обуславливают ключевые характеристики породы. Кроме «желаемых» морфологических признаков, нежелательные синдромы также могут быть связаны с этими локусами либо из-за многочисленных фенотипических последовательностей конкретных генетических вариантов, либо из-за того, что генетические варианты, связанные с этими синдромами, находятся в неравновесных областях сцепления. Больше всего проблем возникает в случае, когда гены, вызывающие заболевание, определяют и ключевые породные черты. Это приводит к тому, что генетический вариант специально фиксируется (связанный с ним аллель становится гомозиготным) у большинства, если не у всех животных в пределах конкретной породы. Преждевременная дегенерация МПД у хондродистрофичных пород собак — это яркий пример такой дилеммы.
Собаки с короткими лапами и БМПД
Связь между конкретными «коротколапыми» породами и прежде-временной дегенерацией МПД регистрируют с начала XX века. Скелетная дисплазия — это общий термин, описывающий аномалии роста и развития хрящей и/или костей, которые приводят к изменениям в росте. Несколько скелетных дисплазий у конкретных пород собак связаны с мутациями в членах семейства генов коллагена или связывающих белков, белков, связанных с фибриллином, а также в изменённом белке-переносчике сульфата. При этом чрезмерная экспрессия FGF4, связанная с инсерцией ретрогенов FGF4 в CFA12 и CFA18, по всей видимости, шире всего влияет на длину конечностей у разных пород собак. И в исследованиях, проведённых с участием разных пород собак, показано, что это единственные гены, которые влияют на размер тела.
Терминология, касающаяся подгрупп скелетных дисплазий, может сбивать с толку. Термин «хондродисплазия» у людей описывает большую группу нарушений, связанных с дисплазией скелета, с аномальным развитием эндохордальных компонентов скелета (которые присутствуют при рождении), а также используется для описания выраженной разницы в длине конечностей у некоторых пород собак, например, у бассет-хаунда, такс и пекинеса. Исторически термин «хондродистрофия» использовался более широко и включал в себя понятие «хондродисплазия». В ветеринарной литературе его традиционно используют для описания «коротколапых» пород собак со скелетной дисплазией, у которых дополнительно происходит прогрессирующая дегенерация МПД после рождения (именно на этот процесс указывает термин «дистрофия»). С преждевременной дегенерацией МПД связана только чрезмерная экспрессия FGF4, которая возникает вторично к инсерции ретрогена в CFA12, но не другие мутации, перечисленные выше.
Ген FGF4
FGF4 — это один из генов семейства из 18 секретируемых канонических FGF белков, которые взаимодействуют с 4 сигнальными рецепторами к тирозинкиназе FGF (FGFR1–4). Подсемейство FGF4 (FGF4, 5, 6) связывается с рецепторами, которые экспрессируются преимущественно в мезенхимальных тканях (FGFR1c, 2c, 3c, 4). Как и большинство генов FGF, они играют важную роль на ранних стадиях эмбрионального развития и органогенеза. FGF4 (фактор роста фибробластов, Fibroblast Growth Factor) больше всего экспрессируется в эмбриональной эктодерме, аксиальной, параксиальной и латеральной пластинках мезодермы и в хвостовой почке. На поздних стадиях развития FGF4 больше всего экспрессируется в апикальном эктодермальном гребне развивающихся почек конечностей, а также в сомитах, из которых затем формируются позвоночный столб и неядерные компоненты межпозвоночных дисков. Сигналинг FGF необходим для правильного аксиального роста эмбриона и сегментации. Для нормального развития конечностей необходимо, чтобы во время эмбрионального развития уровень FGF белков строго контролировался. Сигналинг FGF важен и для развития уха, FGF4 и FGF8 экспрессируются в эмбриональных структурах, из которых затем формируется ушная раковина. Не задокументирована экспрессия FGF4 непосредственно в студенистом ядре во время развития, но при этом сигналинг FGF участвует в дифференциации нотохордальных клеток, присутствует в развивающейся концевой пластинке и в фиброзном кольце. А взаимодействие между нотохордой и телами позвонков способствует правильному формированию МПД.
Ретрогены FGF4
У собак описаны два отдельных ретрогена, получившихся из родительского гена FGF4 в CFA18, которые приводят к разной степени скелетной дисплазии и диспропорциональной карликовости. Ретроген FGF4 в CFA18 связан с явным изменением длины конечностей, а ретроген FGF4 в CFA12 связан с хондродистрофией, которая характеризуется умеренным изменением длины конечностей и с вероятностью 51,23 — развитием БМПД типа I по Хансену.
Ретропозиция — это механизм дупликации гена, который использует РНК-интермедиаты, чтобы рандомно вставлять безинтронные ретрокопии генов в геном с последующей обратной транскрипцией. Активность обратной транскриптазы можно получить из разных источников, но у млекопитающих чаще всего она связана с длинными диспергированными ядерными элементами (LINEs — long interspersed nuclear elements).
Исторически ретрокопии в большинстве случаев рассматривали как неактивные элементы генома, поскольку у них нет правильных регуляторных элементов, а также генетических изменений, которые могут убирать открытую рамку считывания. Редко выявляли связь между ретрогенами и наследственными заболеваниями. При этом считается, что ретротранспозиция играет важную роль в эволюции генома. На данный момент у собак только CFA12 и CFA18 ретрогены FGF4 связаны с клиническими фенотипами.
CFA12 ретроген FGF4 транскрипционно активен и приводит к 20-кратному повышению экспрессии FGF в неонатальном МПД у собак, гомозиготных по инсерции CFA12 ретрогена FGF4, по сравнению с собаками, у которых есть только один родительский ген FGF4.
БМПД и ретрогены FGF4
Нам известно, что описания собак с короткими лапами появились ещё 4 тысячи лет назад. И хотя генетический портрет этих собак неизвестен, вероятно, что один или оба ретрогена FGF4 были задействованы в создании этих древних «коротколапых» фенотипов. Ретротранспозиция гена FGF4 происходила как минимум дважды в недавней истории, хотя отсутствие накопленных мутаций в обеих ретрокопиях говорит о том, что эти события происходили относительно недавно с точки зрения эволюционной геномики.
Разная экспрессия CFA12 и CFA18 ретрогенов FGF4 в общем отражает морфологический фенотип и подверженность БМПД, которые мы видим в клинической практике. Породы, у которых есть одна копия ретрогена FGF4 (CFA12 или CFA18), склонны к скелетной дисплазии с умеренно короткими конечностями, а те, у которых есть обе копии, например, таксы, корги и бассет-хаунды, проявляют самую сильную форму диспропорциональной карликовости. Породы с самой высокой частотой встречаемости инсерции CFA12 FGF4 — это те же породы, которые последние 50 лет считаются предрасположенными к БМПД. И хотя CFA18 ретроген FGF4 часто находят у тех же пород, у которых также есть CFA12 ретроген FGF4 и БМПД (таксы, корги, бассет-хаунды), есть данные о том, что он напрямую не связан с развитием БМПД. Несколько пород собак с короткими конечностями, которые подвержены БМПД — бигль, французский бульдог, кокер-спаниель — несут CFA12 ретроген FGF4, но при этом у них нет CFA18 ретрогена FGF4. И наоборот, у ряда «коротколапых» пород собак — керн-терьера, вест-хайленд-уайт-терьера — редко выявляют БМПД, при этом они несут только CFA18 ретроген FGF4.
Количество гена FGF4
В то время как есть понятная связь между CFA12 ретрогеном FGF4 и преждевременной хондроидной метаплазией и дегенерацией МПД, сложно точно оценить влияние CFA ретрогена FGF4 на весь процесс, поскольку многие предрасположенные породы несут также CFA18 ретроген FGF4. А многие породы, подверженные БМПД, гомозиготны по обоим ретрогенам FGF4, поэтому сложно оценить относительный риск по каждому из ретрогенов. Вероятно, что есть и другие модифицирующие или казуальные генетические локусы, а также морфологические факторы и факторы среды, которые вносят вклад в клиническое проявление БМПД у разных пород. Мы знаем, что наличия только CFA12 ретрогена FGF4 достаточно, чтобы произошла потеря нормальных вакуолизированных нотохордальных клеток и началось замещение студенистого ядра хрящевым веществом у щенков в возрасте от 10 недель. Влияние CFA12 ретрогена FGF4 на дегенерацию МПД, вероятнее всего, доминантное, поскольку БМПД возникает у собак и гомозиготных, и гетерозиготных по CFA12 инсерции.
Частота аллелей
Генотипирование более 3 тысяч собак 75 пород показало, что CFA12 ретроген FGF4 есть у 40 пород, CFA18 ретроген FGF4 — у 32 пород, а оба ретрогена — у 23 пород. У CFA12 ретрогена FGF4 экстремально высокая частота аллелей (> 90 %) наблюдается у биглей, такс, французских бульдогов и у большинства спаниелей, и неудивительно, что эта частота повышается в популяции собак с клиническим проявлением БМПД. Эти данные согласуются с обычной нагрузкой на неврологическое отделение клиники, в которое в 75 % случаев поступают собаки с поражениями грудопоясничных межпозвоночных дисков, при этом у пациентов часто есть 1 или 2 копии CFA12 ретрогена FGF4 (частота аллелей 0,636). В соответствии с фенотипом скелетной дисплазии, общей для обоих ретрогенов, наличие 1 или 2 копий или CFA12, или CFA18 ретрогена FGF4 также было связано с меньшим размером собак (по весу).
Факторы, связанные с возрастом
Наличие 1 или 2 копий CFA12 ретрогена FGF4 связано с более ранним возрастом поступления пациента для проведения декомпрессионной операции (в среднем 6,1 против 8,5 лет). У французских бульдогов средний возраст проведения операции наступает значительно раньше (в среднем в 3,7 года) по сравнению с другими породами, гомозиготными по CFA12 ретрогену FGF4, например, с таксами (в среднем в 6,5 лет). Количество копий CFA12 ретрогена FGF4 не влияет на возраст, в котором собаки поступают на операцию декомпрессии. Роль CFA18 ретрогена FGF4 менее ясна; есть данные, что 1 копия связана с более ранним возрастом проведения операции, но при этом не выявлено разницы, если сравнивать 2 ко-пии с отсутствием копий этого ретрогена, 1 или 2 копиями.
Кальцификация: I тип по сравнению со II типом
Кальцификация/минерализация межпозвоночных дисков, выявленная интраоперационно или рентгенографически, обычно используется для классификации БМПД по Хансену на I или II тип, поскольку при II типе минерализация обычно не происходит. В исследованиях, в которых изучали кальцификации МПД и частоты CFA12 ретрогена FGF4, выявили, что собаки с кальцифицированным МПД (I тип) были значительно меньше (в среднем 8,1 против 25 кг) и им в более раннем возрасте требовалось проводить операцию (5,5 против 9 лет) по сравнению с собаками, у которых МПД не были кальцифицированы (II тип). CFA12 ретрогены FGF4 чаще встречаются у собак, которые прошли через хирургическое лечение и у которых есть признаки кальцификации МПД (частота аллелей 0,77) по сравнению с собаками, которые получали хирургическое лечение, но у них были фиброзные/некальцифицированные грыжи/протрузии дисков (частота аллелей 0,149).
Рентгенографический скрининг
Исследования показали, что у такс степень кальцификации МПД наследуется и связана с риском клинической БМПД, так же как и у пекинесов. Рентгенографический скрининг, основанный на оценке степени кальцификации МПД, исторически использовался как возможный инструмент для селективного размножения, особенно для такс. Есть много переменных, которые влияют на кальцификацию МПД, видимую на рентгене, а также временные факторы, которые могут играть ведущую роль в появлении и рассасывании кальцификатов в МПД с течением времени. Проспективный скрининг с определёнными промежутками времени, которые могут быть специфичны для конкретной породы, очень важен для оптимальной оценки собак группы риска. Ретроспективный анализ наличия или отсутствия кальцификатов в МПД (не контролируемый по возрасту собак, включённых в исследование, на момент оценки) показал, что обнаружение кальцифицированных дисков значительно более вероятно у собак с 2 копиями CFA12 ретрогена FGF4 (84,8 %) по сравнению с собаками с 1 копией CFA12 ретрогена FGF4 (63,8 %) и по сравнению с 0 копий (18,5 %). С помощью многомерной логистической регрессии удалось выявить, что наличие CFA12 ретрогена FGF4 является основной причиной кальцификации дисков, поскольку 2 копии CFA12 ретрогена FGF4 повышают вероятность возникновения кальцификатов в 2,5 раза по сравнению с 1 копией. Наличие или отсутствие CFA18 ретрогена FGF4 не оказывает значимого эффекта на вероятность обнаружения кальцификации МПД.
К сожалению, уменьшение вероятности появления кальцификатов в дисках при помощи селективного размножения такс на основании результатов рентгенографического скрининга ограничивается тем, что на этот процесс влияет большое количество переменных, которые на данный момент нельзя оценить. Скрининговые стратегии, основанные на определении количества копий CFA12 ретрогена FGF4, а не на оценке фенотипов, пока выглядят более перспективными для получения данных, которые можно использовать в селекции.
Относительный риск БМПД
Всё ещё необходимо собирать данные, которые помогут определить риск возникновения БМПД, связанной с наличием CFA12 ретрогена FGF4. Провели оценку небольшой группы собак-метисов пород с сегрегацией ретрогена FGF4, которым проводили хирургическое лечение, по сравнению с контрольной группой возрастных собак без симптомов БМПД, для которых были доступны данные из историй болезни. Если учитывать количество копий CFA12 и CFA18 ретрогенов FGF4, вес тела и пол, то только наличие CFA12 ретрогена FGF4 оказалось значимо связанным с необходимостью проведения декомпрессионной операции при БМПД, при этом не было различий между 1 и 2 копиями ретрогена. Относительный риск развития БМПД (поступление в клинику для проведения хирургического лечения), связанный с CFA12 ретрогеном FGF4, колеблется от 5,5 у чихуахуа до 15,1 у собак-метисов.
Что мы не знаем
Несколько аспектов клинического проявления БМПД не объясняются просто наличием или отсутствием CFA12 ретрогена FGF4. Более цельная и понятная картина позволит заводчикам и владельцам более уверенно выстраивать стратегии селекции и снижать частоту аллелей этого ретрогена в популяции. Вероятно, в результате произойдёт пересмотр стандарта некоторых пород, у которых особенно высокая частота аллелей CFA12 ретрогена FGF4.
Доза CFA12 ретрогена FGF4
Риск развития клинического развития болезни, основанный на определении гетерозиготного или гомозиготного статуса ретрогена, может служить важной информацией для планирования стратегий селекции для заводчиков. По косвенным данным можно предположить, что на уровень кальцификации МПД может влиять доза ретрогена, поскольку у такс и пекинесов степень кальцификации дисков коррелирует с частотой аллелей CFA12 ретрогена FGF4. Но в последнем исследовании не удалось показать прямой эффект дозы гена на возраст поступления на операцию или относительный риск необходимости операции (у метисов), но при этом оценивали только факт необходимости проведения операции, без учёта других важных факторов, например, возраста или времени проведения визуальной диагностики, на основании которой направляли на операцию.
Переменные, связанные с породой и окружающей средой
Изменчивость внутри одной породы и между породами позволяет предположить, что есть дополнительные генетические, морфологические и метаболические факторы, а также факторы окружающей среды, которые влияют на патофизиологию БМПД у собак. Наличие CFA12 ретрогена FGF4 связано с переменным риском необходимости операции при БМПД от 5,5 до 15,1 раза у разных пород собак. И даже в такой однородной группе пород, как таксы, замечена разница в распространённости БМПД у разных типов.
Больше всего исследований, связанных с риском развития БМПД, проводилось с участием такс. Результаты, о которых мы будем говорить далее, приводятся именно для этой группы пород. Факторы риска включают в себя репродуктивный статус, физическую форму, длину осевого мышечного пучка, температуру окружающей среды, тип шерсти и физическую активность. Однако их влияние строго не доказано, в разных исследованиях не все результаты согласуются между собой.
В одном из исследований более короткий отдел T1-S1 позвоночника и меньшая длина лап (от пятки до надколенника) были связаны с повышенным риском развития БМПД, при этом в другом исследовании повышенный риск связывали с более высоким отношением длины тела к росту. CFA12 ретроген FGF4, скорее всего, приводит к уменьшению длины позвонка, а во втором исследовании, вероятно, смогли пронаблюдать доминирующее влияние CFA12 ретрогена FGF4 на длину конечностей (а не на длину позвонка), и именно этот признак взяли в качестве определяющего для изменений в соотношении длины тела и роста. Но при этом вероятно, что на строение тела влияют разные генетические факторы, в том числе CFA12 и CFA18 ретрогены FGF4. В одном исследовании сообщается, что у такс с клиническим проявлением БМПД эпаксиальный мышечный пучок был длиннее, что может быть вторичным эффектом от БМПД; но при этом важно отметить, что FGF4 — это ключевая сигнальная молекула в развитии мышечных волокон и связок эпаксиальных мышц, которые развиваются из соматической мезодермы.
В самом крупном исследовании, в котором участвовало более 2 тысяч такс, обнаружили, что у стандартных жесткошёрстных такс БМПД меньше распространена по сравнению с другими стандартными и миниатюрными типами. Эти данные могут отражать гетерозиготный статус по CFA12 ретрогену FGF4 среди популяции стандартных жесткошёрстных такс, которого удалось достигнуть с помощью картирования генома с использованием полногеномного поиска ассоциаций (GWAS), которое проводилось на этом типе такс. Эти данные поддерживаются и первым пилотным проектом по генотипированию в Дании, который показал, что примерно 30 % жесткошёрстных такс (но не гладкошёрстных и не короткошёрстных) гетерозиготны по CFA12 ретрогену FGF4. Типы длинношёрстных такс (стандартная и миниатюрная) — это следующая группа по степени распространённости БМПД. Длинношёрстный фенотип получается в результате мутации в FGF5 гене (вероятно, происходит потеря его функции, основанной на рецессивном наследовании). Хотя экспрессию FGF5 гена обычно связывают с развитием волосяных фолликулов, филогенетически он очень близок к FGF4, и показано, что он сходно с FGF4 экспрессируется в развивающихся конечностях. Избыточность среди путей сигналинга FGF встречается часто, и интересно размышлять на тему того, может ли быть биологическое значение у БМПД, связанное с чрезмерной или недостаточной экспрессией этих 2 близкородственных FGF генов. Генетическая мутация, которая приводит к жесткошёрстному фенотипу, также может быть потенциально связана с МПД, поскольку этот процесс включает в себя активацию мутации, которая влияет на экспрессию RSPO2 гена. RSPO2 синергирует с WNT–катениновым путём, который влияет на развитие МПД, и было показано, что подавление сигналинга WNT присутствует при ранней дегенерации МПД.
Кальцификация, связанная с породой
Известно, что среди разных пород есть значимая вариабельность в обнаружении кальцификатов дисков на рентгене (из-за наличия CFA12 ретрогена FGF4 или других факторов). У собак, которые поступают на оперативное лечение, связанное с БМПД, у 90,5 % такс, 70,6 % французских бульдогов, 60,2 % метисов и 40,8 % других чистокровных пород собак есть как минимум 1 кальцифицированный диск, обнаруженный на рентгене, на момент проведения операции. Несомненно, что есть очевидная разница, связанная с породой, которую нельзя объяснить только наличием CFA12 ретрогена FGF4.
Возрастные изменения, связанные с породой
В то время как в группе собак с CFA12 ретрогеном FGF4 значимо ниже возраст поступления для проведения операции, связанной с БМПД, различия между хондродистрофичными породами позволяют предположить, что есть дополнительные факторы в патогенезе БМПД. Таксы и потенциально другие породы с высокой частотой аллелей CFA12 ретрогенов FGF4 поступают на операции в более старшем возрасте по сравнению с метисами. Этот факт, вероятно, отражает, что у этих пород с высокой частотой аллелей происходит дополнительная селекция по модифицирующим факторам, которая приводит к выводу из пула размножения собак с ранним началом дегенерации МПД. На другом конце спектра есть французские бульдоги, у которых возраст клинического проявления БМПД значительно ниже. В отличие от возможной активации путей WNT с помощью RSPO2 гена у жесткошёрстных такс, у французских бульдогов есть подавление сигналинга WNT из-за мутации рамки считывания в DVL2 гене, который связан с закрученным хвостом и брахицефалией. Ещё необходимо определить, есть ли клиническая связь между этими изменениями в путях WNT, которые происходят у хондродистрофичных пород (в контексте чрезмерной экспрессии FGF4), и сообщениями о подавлении регуляции сигналинга WNT, которое связано с МПД. Но при этом известно, что пути сигналинга WNT и FGF пересекаются во многих внутриклеточных процессах.
Модифицирующие эффекты других ретрогенов
Коэкспрессия CFA12 и CFA18 ретрогенов FGF4 часто встречается у хондродистрофичных пород, из-за этого сложно исключить влияние CFA18 ретрогена FGF4 из ретроспективных данных. При этом эффект CFA18 ретрогена FGF4, вероятнее всего, очень умеренный, потенциально он может влиять на возраст начала проявления симптомов, но не на относительный риск или распространённость кальцификации дисков, которая выявляется рентгенографически. Одного CFA12 ретрогена FGF4 достаточно, чтобы вызвать преждевременную дегенерацию МПД. Но гистопатологические исследования МПД у молодых собак пород, гомозиготных по CFA18 ретрогена FGF4 — керн-терьеров, вест-хайленд-уайт-терьеров (для которых типична редкая встречаемость БМПД) — дадут дополнительные данные.
Наличие участка, богатого цитозином и гуанином (CG-site), в обоих FGF4 ретрогенах может усиливать его экспрессию и в других хромосомных локациях.
БМПД у собак без CFA12 ретрогена FGF4
В предыдущих исследованиях описывали БМПД I типа по Хансену у нехондродистрофичных пород. У 12 % (46/378) собак, которые поступили на операции, связанные с лечением БМПД, и у которых задокументировано наличие кальцифицированных МПД, не было копий CFA12 ретрогена FGF4. Эти породы: лабрадор-ретривер, доберман-пинчер, немецкая овчарка, питбультерьер, ротвейлер и померанский шпиц, у них возраст проведения операции на 1,5–2 года больше по сравнению с собаками — носителями CFA12 ретрогена FGF4. Дегенерация МПД II типа обычно наблюдается у возрастных нехондродистрофичных пород и редко связана с кальцификацией МПД, при этом с точки зрения гистологических изменений у дегенерации дисков как у хондродистрофичных, так и у нехондродистрофичных пород есть много сходных черт. Популяция собак с кальцифицированными МПД, негативных по CFA12 ретрогену FGF4, может отражать альтернативные генетические причины БМПД, которые характеризуются кальцификацией, но в более позднем возрасте.
Выводы
Самый важный неотвеченный вопрос, который касается CFA12 ретрогена FGF4 — каким будет влияние этого открытия на частоту встречаемости БМПД через 10–20 лет. Несмотря на то что, вероятно, есть дополнительные модифицирующие факторы, как генетические, так и связанные с окружающей средой, полученные данные говорят о том, что CFA12 ретроген FGF4 — это главный фактор в развитии БМПД у хондродистрофичных пород собак. В то время как определяется всё больше причин болезней, которые связаны с породными морфологическими чертами, ветеринарные врачи сталкиваются с этическими решениями, когда главная миссия профессии («предотвращение и облегчение страданий животных») может порой конфликтовать с целями фенотипической селекции собак.
Некоторая степень сегрегации CFA12 ретрогена FGF4 наблюдается почти у всех пород собак, подверженных БМПД, даже у пород с высокой частотой аллелей. У пород с высокой степенью сегрегаций может быть возможно уменьшить или устранить этот ретроген из популяции.
Даже у пород с высокой частотой аллелей, таких как таксы, эти частоты различаются между популяциями, что говорит о том, что некоторые популяции могут быть менее гомозиготными, чем другие. Многие морфологические черты по природе своей полигенны, и селекция на коротколапый фенотип, вероятно, стала управляемым отбором собак с FGF4 ретрогенами. Для пород собак с высоким риском БМПД — такс, бассет-хаундов, корги и пекинесов — которые несут и CFA12, и CFA18 ретрогены FGF4, возможна тактика селекции, которая позволит уменьшить распространённость CFA12 ретрогена FGF4 в популяции, но при этом поддерживать желаемый фенотип с короткими конечностями, который будет обусловлен CFA18 ретрогеном FGF4.
Доминантное влияние CFA12 ретрогена FGF4 на БМПД и высокая частота аллелей у некоторых пород означают, что искоренение этого ретрогена из популяции может быть достаточно сложным. Долгосрочная стратегия может потребовать сочетать тестирование и селекцию гетерозиготных собак, аутбридинг, кроссбридинг и изменения в стандартах пород, возможность дополнительно включать в породный стандарт фенотипы, отрицательные по CFA12 ретрогену FGF4. С ветеринарной точки зрения текущие данные говорят о том, что у заводчиков в приоритете должны быть собаки с меньшим количеством копий CFA12 ретрогена FGF4, чтобы уменьшать частоту аллелей.
Болезнь межпозвоночных дисков у собак: текущее понимание патофизиологии травмы спинного мозга, вызванной экструзией межпозвоночного диска у собак
У собак травма спинного мозга часто происходит из-за экструзии МПД (IVDE). В этом обзоре мы обобщим все данные, которые получены на сегодняшний день о патофизиологических процессах, связанных с травмой спинного мозга (SCI — spinal cord injury) из-за IVDE. Патологические изменения в спинном мозге у собак, происходящие из-за SCI, вызванной IVDE, включают в себя раннее и персистирующее повреждение аксонов и глиальный ответ, в котором преобладают фагоцитарная микроглия или макрофаги. Эти процессы сопровождаются провоспалительным микроокружением, происходит нарушение регуляции цитокинов и матриксных металлопротеиназ в пределах спинного мозга. Ещё предстоит выяснить роль поляризации микроглии или макрофагов в развитии SCI, вызванной IVDE.
Патогенез миеломаляции, серьёзного осложнения SCI у собак, детально не изучен. Вероятно, в развитии этого уникального нейропатологического процесса участвует молниеносный и излишне сильный вторичный ответ на травму с образованием большого количества активных форм кислорода.
SCI у собак может быть вызвана внешними или внутренними причинами. IVDE — это самая частая причина SCI у собак. SCI, вызванная IVDE, составляет 2 % от всех болезней собак.
Прогноз при SCI, вызванной IVDE, лёгкой или средней степени тяжести обычно хороший. Но у 40–50 % собак с тяжёлой SCI, развившейся вторично к IVDE (с параплегией и отсутствием ноцицепции), не восстанавливается способность к самостоятельному хождению, и из-за этого их могут эвтаназировать.
SCI, вызванная IVDE, у собак очень схожа с травматической SCI у людей. Она возникает из-за сочетания компрессионного и контузионного воздействия структур, которые анатомически расположены вентрально к спинному мозгу.
В этом обзоре в основном представлены данные, полученные в (гисто)патологических исследованиях естественно возникшей SCI, вызванной IVDE, у собак. Но есть данные и из нескольких экспериментальных исследований SCI, поскольку некоторые аспекты естественно возникающей SCI пока не изучены. Основная цель этого обзора — дать представление о патологических процессах, которые происходят в травмированном спинном мозге у собак, с отсылкой к возможному терапевтическому применению этих данных.
Основные патологические механизмы дегенерации межпозвоночных дисков у собак
Дегенерация МПД часто предшествует SCI, вызванной IVDE, то есть дегенерация МПД — это важный предрасполагающий фактор для развития грыжи диска в спинномозговой канал. Про анатомию и основные моменты дегенерации МПД мы говорили в первой части обзора.
Недавний независимый полногеномный поиск ассоциаций для скелетной дисплазии и IVDE показал, что высокая степень экспрессии FGF4 ретрогена на CFA12 связана как с IVDE, так и с хондродистрофией. Об этом мы подробно говорили в первой части обзора. Студенистое ядро замещается гиалиновым хрящом, в котором происходит постепенная дегенерация, а на поздних стадиях — кальцификация.
У такс с острой грыжей МПД на гистопатологическом исследовании видно, что основная часть грыжевого вещества кальцифицирована, даже в тех случаях, когда на рентгене кальцификация не видна. В недавних гистопатологических исследованиях предлагается шкала оценки дегенерации МПД, основанная на следующих параметрах: морфология фиброзного кольца, метаплазия хондроцитов фиброзного кольца, образование разрывов и трещин, пролиферация хондроцитов в пределах студенистого ядра, наличие нотохордальных клеток в студенистом ядре, окрашивание матрикса студенистого ядра альцианским синим/ пикросириусом красным, морфология концевой пластинки, образование новых костей и склероз субхондральной кости. В этих исследованиях гликозаминогликанов содержимое и общая гистопатологическая оценка коррелируют между собой.
Традиционная концепция — у хондродистрофичных пород происходит хрящевая метаплазия студенистого ядра, а у нехондродистрофичных пород — фиброзная — в последнее время подвергается сомнению, поскольку проведены исследования, в результате которых показано, что процессы, которые происходят у этих двух типов пород, больше похожи друг на друга, чем считалось ранее. Хрящевая метаплазия по факту наблюдается и у тех, и у других, а фиброциты в студенистом ядре не были обнаружены ни в одном образце МПД.
Клиническое проявление травмы спинного мозга, вызванной грыжей межпозвоночного диска
Клинически IVDE у собак проявляется целым спектром симптомов — от боли в шее или спине до тяжёлой травмы спинного мозга с потерей сенсорной и моторной функции каудальнее места поражения. Самая распространённая шкала для клинической оценки пациента — это модифицированная шкала Франкеля. Диапазон этой шкалы — от параплегии с потерей поверхностной и глубокой болевой чувствительности до нормы. Тяжесть травмы, измеренная по этой шкале, хорошо коррелирует с прогнозом на выздоровление после хирургической декомпрессии: собаки с 0 баллов возвращаются к самостоятельному передвижению и управлению мочеиспусканием и дефекацией в 50–60 % случаев.
Быстрая экструзия студенистого ядра приводит к компрессионной и контузионной травме спинного мозга. Хотя IVDE вызывает смешанное контузионное/компрессионное воздействие на соответствующий сегмент спинного мозга, степень каждого компонента этого воздействия различается у разных пациентов и при разных типах грыжи. Поскольку экструзия диска I типа по Хансену обычно происходит остро и с существенной силой, она чаще вызывает более тяжёлую травму соответствующего сегмента спинного мозга по сравнению с протрузией диска II типа по Хансену, которая протекает менее тяжело и воздействие которой на спинной мозг происходит медленнее и с меньшей силой (то есть, фокус смещён на компрессионную составляющую).
У хондродистрофичных пород примерно 75 % грыж МПД обнаруживают на уровне от Th12 до L2. Грыжи МПД в шейном отделе встречаются реже и составляют примерно 14–35 % от всех грыж МПД.
Некоторые клинические случаи нельзя отнести к грыже МПД ни I, ни II типа по Хансену, поскольку у части нехондродистрофичных пород клинические признаки могут развиваться быстро, с острым началом, а у некоторых собак с грыжей МПД I типа по Хансену симптомы могут прогрессировать медленно. О разных типах БМПД мы подробно говорили в первой части обзора.
Независимо от типа грыжи МПД чаще всего возникают в дорсальном направлении, то есть внутрь спинномозгового канала. В выдавленном веществе диска находят моноциты и макрофаги, а также в нём происходит активация киназы p38, регулируемой внеклеточными сигналами. IVDE в грудопоясничном отделе связана с повышенной экспрессией генов и белков ключевых цитокинов, таких как IL-6 и TNF-α, а также со снижением экспрессии IL-1β.
Патофизиология травмы спинного мозга, вызванной грыжей межпозвоночного диска, у собак
Общая морфология
В основном данные о патологических поражениях спинного мозга получают от пациентов с острой или подострой тяжёлой SCI (с параплегией с или без болевой чувствительности), поэтому есть значительная нехватка гистопатологических описаний хронических или менее тяжёлых травм. Это происходит из-за того, что в неэкспериментальных исследованиях естественно возникающего спонтанного заболевания материал для гистопатологического исследования в основном поступает от эвтаназированных особей с острым началом тяжёлых клинических симптомов и плохим прогнозом. Поэтому гистопатологические описания отчасти необъективны, поскольку в основном отражают граничные случаи из широкого спектра по времени и тяжести поражений.
Причины IVDE предполагают, хотя и с высокой степенью вариабельности, патологические изменения в соответствующих сегментах спинного мозга и на его отдалённых участках. При аутопсии после удаления пластинки позвонка с дорсальной стороны виден спинномозговой канал, в котором может быть вещество дегенерировавшего межпозвоночного диска, которое находится близко и часто крепко прикреплено к контуженному и сжатому сегменту спинного мозга. Макроскопические изменения спинного мозга могут варьировать от недетектируемых до дисколорации, обширного очевидного кровоизлияния, сильных разрывов спинного мозга и твёрдой оболочки или атрофии спинного мозга в случае хронических поражений.
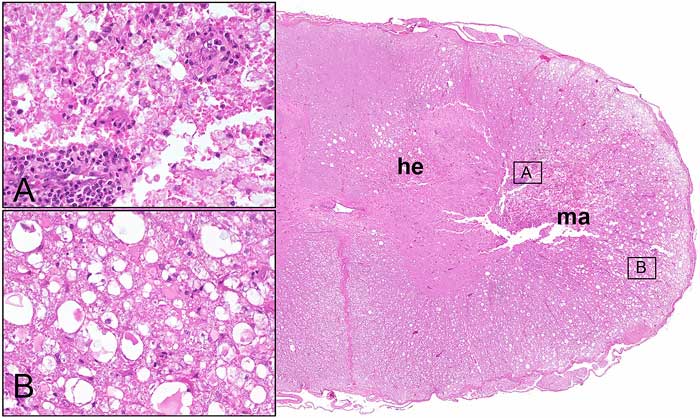
При гистологическом исследовании изменения тоже могут быть разными — разная степень некроза, кровоизлияния на ранних стадиях (илл. 1). Ультраструктурно, во всех случаях SCI, которые возникли естественным путём, наблюдаются кровоизлияния, образование аксональных сфероидов, набухание глиальных клеток, отёк белого вещества и демиелинизация. Более того, с помощью электронной микроскопии была установлена ремиелинизация как олигодендроцитами, так и шванновскими клетками в случаях долго протекающей болезни. В зависимости от степени первоначальной травмы вторичный травматический процесс может в конце концов переходить в разжижающийся некроз (маляцию) сегмента спинного мозга и в глиальный рубец с образованием полостей и кист в нейропаренхиме. Хронические интрамедуллярные поражения и полости связаны с тяжёлой первоначальной SCI и с плохим клиническим прогнозом. Восходящая и нисходящая миеломаляция — это очень тяжёлое осложнение, которое развивается у части собак с SCI. Мы его обсудим в конце этой части обзора.
Клиническая неврологическая оценка собак с грудопоясничной SCI, вызванной IVDE, коррелирует со степенью поражения белого вещества. Но при этом клиническая оценка тяжести травмы не всегда коррелирует с тяжестью гистопатологических изменений, поэтому необходимы дополнительные исследования патофизиологии SCI, вызванной IVDE, у собак. Кроме того, некоторые клинические симптомы — длительность самих симптомов, поза Шиффа–Шеррингтона, потеря рефлексов и болевой чувствительности при пальпации спины — также не связаны с гистопатологической оценкой тяжести поражения спинного мозга. Эти результаты говорят о том, что часть клинических симптомов скорее связана с функциональными неврологическими нарушениями, такими как блок проведения сигнала из-за нехватки энергии, которые не обязательно отражаются в гистологических изменениях.
Поскольку иммунный ответ и патология аксонов — это главные показатели SCI, эти патогенетические факторы являются основными целями для разработки будущих схем лечения.
Патология аксонов и миелина при SCI, вызванной IVDE, у собак
Повреждение аксонов — это главный отличительный признак всех форм эндогенной или экзогенной травмы ЦНС. Повреждение аксонов очевиднее всего коррелирует с клиническим двигательным дефицитом, поэтому неудивительно, что признаки повреждения аксонов — это основная гистопатологическая характеристика SCI, вызванной IVDE. При гистологическом исследовании повреждение аксонов чаще всего представлено набуханием аксонов и появлением гиперэозинофильных увеличенных сферических аксонов (сфероидов, илл. 1) в пределах расширенных миелиновых оболочек. У такого типа повреждения аксонов есть много сходных патогенетических черт с валлеровой дегенерацией, но он не ограничивается очагом поражения в месте возникновения грыжи МПД, но может наблюдаться и в других сегментах спинного мозга, краниальнее или каудальнее первичного очага.
Ультраструктурно изменения в цитоплазме аксонов спинного мозга у собак с SCI, вызванной IVDE, включают образование периаксонального пространства, нарушения в строении миелина, гранулярное разрушение нейрофиламентов и скучивание органелл. Можно наблюдать гигантские аксоны. В пределах реактивных участков увеличенных аксонов видны ахоплазматические везикулы, митохондрии и электронноплотные тела. В патогенезе повреждения аксонов при SCI, вызванной IVDE, играют роль и дефицит механизмов быстрого антероградного транспорта в аксонах, и недостаточное фосфорилирование аксональных нейрофиламентов. С помощью иммуногистохимии в здоровых аксонах не обнаруживается белок-предшественник β-амилоида (APP), поскольку при нормальных физиологических состояниях в аксонах идёт очень быстрый транспорт и этот белок не успевают детектировать. Но при патологических состояниях идёт быстрое накопление APP из-за нарушений аксонального транспорта. Соответственно, APP — это хороший иммуногистологический маркер повреждения аксонов. Ранее его использовали для обнаружения повреждения аксонов при экспериментальной SCI у собак. В этих исследованиях его экспрессия коррелировала с тяжестью и длительностью компрессии.
У собак с естественно возникшей SCI, вызванной IVDE, APP обнаруживают в эпицентре поражения как при острой, так и при подострой форме течения. При этом экспрессию APP можно также наблюдать на протяжении 3 см каудальнее от очага поражения во время подострой фазы травмы. Можно предположить, что нарушения в быстром аксональном транспорте распространяются постепенно на протяжении спинного мозга. Ахонопатия — это не простой процесс, который возникает только в момент травмы, но скорее прогрессирующий феномен, длящийся во времени и пространстве, который отражает механизмы вторичного повреждения тканей.
Параллельно с аксональной иммунореактивностью APP в предыдущих иммуногистохимических исследованиях SCI, вызванной IVDE, у собак обнаружили, что в аксонах при острой и подострой SCI увеличивается экспрессия нефосфорилированных нейрофиламентов (n-NF). Так же как и APP, экспрессия n-NF возникает и в аксонах, которые расположены на расстоянии нескольких сантиметров от очага травмы. Но при этом, в отличие от APP, который обнаруживается в основном в набухших аксонах, n-NF есть и в аксонах нормального диаметра. Эти данные говорят о том, что оба вещества можно использовать, хотя бы частично, в качестве маркеров для оценки распространённости процесса повреждения аксонов.
В дополнение к травматическому поражению ЦНС, повышенная экспрессия n-NF и APP в аксонах продемонстрирована в модельных исследованиях демиелинизирующих заболеваний. Это может говорить о том, что изменения в фосфорилировании нейрофиламентов и нарушения в быстром аксональном транспорте — это консервативные элементы аксонопатии, которые возникают вне зависимости от причины подлежащего заболевания.
Хотя повреждение аксонов преобладает при SCI, вызванной IVDE, получены данные о том, что в аксонах есть попытки внутренней регенерации — обнаружена экспрессия GAP-43 (growth-associated protein). Иммунореактивность GAP-43 отмечается в небольшом количестве в аксонах собак с острой или подострой SCI. Ультраструктурно иммунная реакция была замечена в набухших аксонах без плотного скопления тел, но наполненных большим количеством митохондрий. Аксоны экспрессируют GAP-43 во время развития и регенерации. При съёмке аксонов в реальном времени при исследовании экспериментальной SCI видно, что есть попытки ранней регенерации аксонов, но этого оказалось недостаточно для полного восстановления функции. Предполагают, что причина неудачных попыток регенерации состоит в том, что аксонам не удаётся прийти к правильной цели. Отчасти это может происходить из-за экспрессии молекул, которые подавляют регенерацию — Nogo и MAG. Есть гипотеза о том, что фармакологическая модуляция этих молекул — это многообещающая цель для разработки лечения, которое позволит обеспечить регенерацию аксонов до восстановления функциональности.
О патологиях миелина при SCI у собак сообщается нечасто, хотя это фокус экспериментального изучения SCI. Несмотря на то что при подострой SCI, вызванной IVDE, у собак в белом веществе происходит снижение иммунореактивности основного белка миелина (MBP — myelin basic protein), его обычно объясняют отёком миелина и набуханием миелиновой оболочки, а не настоящей демиелинизацией. В исследовании ультраструктур при SCI у собак, включая разные причины, такие как переломы, сублюксации и IVDE, демиелинизированные аксоны появлялись спустя 2 недели после первичной травмы, и, что интересно, на более поздних стадиях заболевания и в шванновских клетках, и в олигодендроцитах наблюдалась ремиелинизация. Более того, ультраструктурно наблюдались небольшие частичные и паранодальные аномалии миелина. Морфологически детектируемые аномалии миелина обычно обнаруживают после раннего повреждения аксонов, подытоживая основной процесс во время валлеровой дегенерации. Более того, демиелинизация во время SCI отчасти может отражать патологические процессы, которые описываются теорией inside-out про нейродегенеративные заболевания. Эта концепция предполагает, что повреждение аксонов является механизмом, запускающим вторичную демиелинизацию. Несколько уровней доказательств подтверждают сходство, касающееся этой триггерной функции первичной аксонопатии, между нейродегенеративными и вирусными заболеваниями ЦНС с одной стороны и SCI с другой. В контексте клинического проявления у собак с грудопоясничной IVDE и потерей способности к самостоятельному хождению концентрация MBP в спинномозговой жидкости была выше по сравнению с контрольной группой. На основании этих данных можно предположить, что повышенный уровень MBP в спинномозговой жидкости связан с плохим прогнозом.
Данные, что у собак с хронической травмой происходит демиелинизация, получены в ходе клинических исследований. 4-аминопиридин (4-AP) — это вещество, про которое известно, что оно улучшает функции нервной ткани при демиелинизации. Собаки с травмой спинного мозга, которые получали 4-АР, показали значительные улучшения по шкалам оценки передвижения с поддержкой. Можно предполагать, что демиелинизация играет роль в хронически протекающих SCI. Патологические данные о естественно возникающей SCI обычно получают от собак с острой или подострой формой, поэтому гистопатологических данных о хронических формах мало. Хронические случаи SCI, вызванной IVDE, характеризуются прогрессирующей потерей белого и серого вещества, с или без образования цист, и прогрессирующим замещением тканей обширным глиозом. Гистопатологически при хронических поражениях обнаруживают маляцию серого вещества, сильный глиоз и инфильтрацию фагоцитарными клетками разной степени выраженности. Можно увидеть большое количество аксональных сфероидов, что говорит о продолжающемся повреждении аксонов. Миелиновые оболочки в пределах белого вещества расширены, в них могут встречаться редкие миелинофаги. В некоторых случаях может происходить панмиеломаляция с полной потерей органотипичных структур, которые замещаются диффузным глиозом. Макроскопические изменения в спинном мозге при хронической травме — это атрофия в виде песочных часов соответствующего сегмента спинного мозга.
Воспаление и реакции глиальных клеток при SCI, вызванной IVDE, у собак
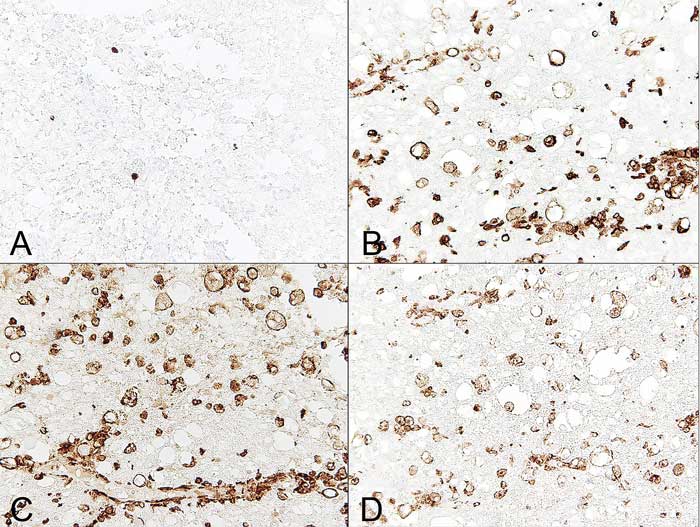
При тяжёлой острой форме SCI первый тип клеток, который появляется в тканях — это нейтрофилы, в спинномозговой жидкости собак с SCI, вызванной IVDE, обычно обнаруживают большое количество нейтрофилов. Гистопатологически нейтрофилы обычно связаны с областями кровоизлияния. Параллельно с этим происходят инфильтрация MAC-387-положительными макрофагами, которые развиваются из моноцитов, и периваскулярное скопление лейкоцитов. Реактивные изменения в клетках становятся более заметными в подострых случаях, при которых развивается фагоцитарный ответ с преобладанием микроглии или макрофагов. У собак микроглиальные клетки были подробно изучены при исследовании различных неврологических заболеваний, например, инфекции вируса чумы собак и SCI. У здоровых собак микроглия, которая происходит из спинного мозга, имеет относительно высокую способность к фагоцитозу и образованию активных форм кислорода (ROS — reactive oxygen species) по сравнению со здоровыми клетками головного мозга. У собак с SCI в микроглии повышается экспрессия поверхностных молекул — B7–1, B7–2, MHS класса II, CD1c, ICAM1, CD14, CD44 и CD45. Также у собак с SCI в микроглии идут активный фагоцитоз и образование ROS.
На основании относительно новой концепции микроглия (или макрофаги нервной ткани) может быть поляризована либо в сторону провоспалительных и нейротоксичных клеток (М1), либо альтернативно активирована, антивоспалительна и способствует регенерации (М2) клеток. Было проведено множество экспериментальных исследований, которые сфокусировались на этой роли клеток в развитии SCI. Одна из возможных целей разработки терапии — смещение микроглии в сторону M2-доминирующей.
На сегодняшний день не проводили исследований, которые бы показали, происходит ли поляризация микроглии при естественно возникающей SCI. Но несколько линий доказательств говорят о том, что ответ микроглии/макрофагов связан с поляризацией макрофагов в сторону провоспалительного фенотипа. Подострая SCI, вызванная IVDE, связана с преобладающим ответом фагоцитарной микроглии/макрофагов, которые экспрессируют MHS класса II, и сопровождается провоспалительной микросредой. Более того, микроглия/макрофаги — это основной источник ROS, металлопротеиназ, разрушающих ткани, и нейротоксичных медиаторов.
Недавно поляризованные макрофаги собак удалось описать in vitro. Нестимулированные (М0), М1- (GM–CSF, LPS, IFN-γ стимулированные) и М2- (M–CSF, IL-4-стимулированные) поляризованные макрофаги крови имеют разную ультраструктурную морфологию. Нужно разработать иммуногистохимические маркеры, которые позволят различать М1- и М2-макрофаги у собак, чтобы классифицировать микроглию/макрофагов на фенотипы при естественно возникающей травме спинного мозга.
У собак с SCI, вызванной IVDE, происходит образование глиальных рубцов и развивается обширная глиальная пролиферация (глиоз). Это показано как при экспериментальной, так и при естественно возникающей SCI.
Недавно обнаружили, что в клеточной реакции, которая следует за SCI, участвуют эпендимальные клетки. Из-за их функции как источника нейрональных прекурсоров слой эпендимальных клеток спинного мозга может быть способным к регенерации, и, соответственно, сейчас это стало областью активных исследований, особенно в контексте SCI. С помощью иммуногистохимии выявили большое количество GFAP-положительных клеток в очаге поражения и в областях проксимально от центра поражения у собак с SCI, вызванной IVDE. Предполагается, что слой эпендимальных клеток спинного мозга может способствовать дифференциации астроцитов при естественно возникающей SCI у собак. Также острая SCI, вызванная IVDE, характеризуется изменёнными паттернами экспрессии Е-кадгерина, что говорит о том, что потеря полярности клеток может стимулировать миграцию эпендимальных клеток в место травмы.
Потребность в неинвазивных биомаркерах при SCI, вызванной IVDE, у собак
С клинической точки зрения необходимы неинвазивные биомаркеры, которые позволили бы прогнозировать исход, особенно у собак с особо тяжёлой SCI.
До сегодняшнего дня в качестве кандидатов на роль биомаркеров при SCI, вызванной IVDE, которые можно получить из спинномозговой жидкости или из сыворотки крови, рассматривали металлопротеиназы, нейрональные/аксональные молекулы цитоскелета, количество воспалительных клеток, белки острой фазы, цитокины, метаболиты арахидоновой кислоты и компоненты глиального цитоскелета.
Сообщается, что повышенная активность MMP-9 в спинномозговой жидкости поясничного отдела позвоночника говорит о тяжёлой SCI с плохим прогнозом. Обнаружение с помощью ELISA белка тау, связанного с микротрубочками, в спинномозговой жидкости, взятой из подпаутинной цистерны, связано с неблагоприятным исходом у собак с параплегией вследствие IVDE в грудопоясничном или шейном отделе. Концентрацию в сыворотке крови тяжёлых цепей фосфорилированных нейрофиламентов (pNF-H) связывают с тяжестью IVDE в грудопоясничном отделе, и она может говорить о неблагоприятном прогнозе. Повышенное общее количество клеток в спинномозговой жидкости из подпаутинных цистерн коррелирует с тяжестью травмы, но при этом изученные параметры оценки спинномозговой жидкости не позволяют отличить SCI, вызванную IVDE, от других заболеваний спинного мозга. Концентрации С-реактивных белков острой фазы и гаптоглобина в спинномозговой жидкости связаны с тяжестью травмы, вызванной IVDE, но при этом не коррелируют с исходом, который оценивают через 42 дня после травмы (по моторной функции). Концентрации метаболитов арахидоновой кислоты PLA2 и PGE2 в спинномозговой жидкости выше у собак с SCI по сравнению с контрольной группой, а концентрация LCT4, наоборот, ниже. Более того, концентрация PGE2 положительно коррелирует со степенью тяжести SCI. В течение первого дня SCI, вызванной IVDE, сывороточные уровни GFAP и S100β быстро повышаются, а pNF-H достигает своего пика на 14-й день после травмы. Уровень GFAP в сыворотке крови можно использовать в качестве биомаркера в первые 3 дня, чтобы предсказать вероятность выздоровления в случае тяжёлой SCI.
Матриксные металлопротеиназы при SCI, вызванной IVDE, у собак
В нескольких исследованиях показано, что матриксные металлопротеиназы (ММPs — matrix metalloproteinases) участвуют в патогенезе SCI, вызванной IVDE, у собак. ММPs играют плеотропную роль при многих неврологических заболеваниях. Они участвуют и в дегенерации, и в отрастании аксонов, а их сигналинг необходим для реорганизации и стабилизации синапсов после травмы. Более того, ММPs — это ключевой медиатор вторичной травмы, они участвуют в разрушении гематоэнцефалического барьера (и в головном, и в спинном мозге). Параллельно с этим их сигналинг необходим для процессов заживления, таких как ангиогенез, но, с другой стороны, экспрессия ММPs усиливает образование глиальных рубцов, которые мешают заживлению.
Например, желатиназы ММР-2 и ММР-9 экспрессируются в зависимости от времени при SCI, причём как в экспериментальном, так и естественно возникшем. Модуляция экспрессии ММР-9 может уменьшить образование глиальных рубцов после SCI.
В отличие от ММР-9, недостаточная экспрессия ММР-2 связана с ухудшением локомоции. Поэтому предполагают, что ММР-2 скорее играет полезную роль после SCI, отчасти регулируя те функции, которые отвечают за пластичность аксонов и сохранение белого вещества.
В предыдущих работах сообщали о нарушении регуляции желатиназ ММР-2 и ММР-9 у собак с SCI, вызванной IVDE. С помощью RT-qПЦР тканей спинного мозга установили, что у этих собак при острой SCI транскрипты MMP-9 синтезируются в большем количестве, чем обычно, а для MMP-2 происходит транзиторное подавление синтеза по сравнению с концентрациями в тканях спинного мозга неврологически здоровых собак. Также активность MMP-9 повышается и в спинномозговой жидкости, и в сыворотке крови собак с острой БМПД. Повышенные уровни MMP-9 связывают с плохим прогнозом у собак с SCI, вызванной IVDE. На основании этих данных и гипотезы о том, что ранний сигналинг MMP-9 играет разрушающую роль у собак с SCI, вызванной IVDE, было проведено рандомизированное, слепое, плацебо-контролируемое исследование, чтобы оценить эффективность ингибитора MMPs широкого спектра действия GM6001. В этом исследовании собаки получали GM6001, растворённый в диметилсульфоксиде (ДМСО), только ДМСО и физиологический раствор (физраствор). GM6001 снизило сывороточную активность MMP-9 по сравнению с остальными двумя группами. При этом у собак, которые получали физраствор, функциональные оценки были значительно ниже, чем у собак, получавших ДМСО или GM6001. Это показывает, что независимого эффекта только от GM6001 не наблюдалось. Авторы сделали вывод, что ДМСО может иметь терапевтический эффект на спинной мозг при острой травме. Также недавние клинические испытания, в которых использовали то же вещество, показали, что у собак, которые получали лечение GM6001 и ДМСО, была лучше эластичность мочевого пузыря по сравнению с контрольной группой.
Цитокины при SCI, вызванной IVDE, у собак
В одной из работ исследовали спинномозговую жидкость собак с острой IVDE в грудопоясничном отделе после хирургического лечения, чтобы оценить уровень экспрессии интерлейкинов (IL)-2,-6,-7,-8,-10,-15,-18, гранулоцитарно-макрофагального колониестимулирующего фактора (GM–CSF), интерферона гамма (IFN-γ), хемокина CXCL1, IFN-γ-индуцируемого белка-10 (IP-10), хемокина CCL-2 (MCP-1, monocyte chemotactic protein-1) и фактора некроза опухолей альфа (TNF-γ). Концентрация IL-8 оказалась значительно выше при SCI по сравнению с контрольной группой, и была обнаружена отрицательная корреляция с длительностью SCI. Более того, оказалось, что концентрация MCP-1 отрицательно связана с исходом, который оценивается через 42 дня после травмы. Также у собак с острой SCI, вызванной IVDE, в тканях спинного мозга через 1–4 дня после экструзии обнаружили раннее усиление синтеза мРНК провоспалительных цитокинов (IL-6, IL-8 и TNF). Усиление синтеза мРНК IL-8 также обнаружили и у собак спустя более чем 4 дня после IVDE. По этим данным можно предположить, что этот цитокин играет пролонгированную роль в патогенезе SCI, вызванной IVDE, у собак. В то время как нет разницы в экспрессии IL-10 между контрольной группой и собаками с SCI, экспрессия TNF-β усиливается только в тканях спинного мозга у собак с подострой SCI более чем на 4 дня. Все результаты говорят о том, что у собак острая SCI, вызванная IVDE, протекает и управляется провоспалительным микроокружением.
Если обобщить, то у собак во время острой SCI, вызванной IVDE, происходит нарушение экспрессии цитокинов с отсутствием или отсрочкой синтеза антивоспалительных и доминированием провоспалительных цитокинов. Считается, что эти факторы вносят свой вклад в образование повреждений и вторичные травматические процессы, которые возникают при SCI.
У собак с SCI, вызванной IVDE, наблюдается значительное изменение соотношения белков острой фазы в спинномозговой жидкости. В одном из исследований измеряли концентрацию С-реактивного белка (CRP), гаптоглобина (Hp), альфа-1-гликопротеина и сывороточного амилоида А. По сравнению со здоровыми собаками контрольной группы у собак с SCI был повышен Hp. Более высокие концентрации CRP и Hp были связаны с тяжестью травмы, но при этом не коррелировали с концентрацией APP в спинномозговой жидкости и исходом, который оценивался на 42-й день после травмы (по моторной функции).
Восходящая и нисходящая миеломаляция
У небольшой, но значимой части собак после IVDE может развиваться одно из самых тяжёлых осложнений — прогрессирующая миеломаляция (PMM, progressive myelomalacia). PMM — это уникальное явление, которое наблюдается у людей и собак с тяжёлой травмой спинного мозга и развивается позже, чем первоначальная SCI. Несмотря на то что PMM может возникать после разных видов SCI, включая внешние травмы, например, переломы, у собак IVDE — это самый распространённый тип травм, после которого может возникнуть PMM. Это состояние характеризуется прогрессирующим геморрагическим некрозом спинного мозга, который диффузно спускается и/или поднимается по прилегающим сегментам спинного мозга. PMM часто развивается довольно рано в течение IVDE, и в основном собак с PMM эвтаназируют спустя 3 дня от начала симптомов из-за прогрессирующего дыхательного паралича. Общая распространённость PMM составляет 2 % от популяции собак с IVDE в грудопоясничном отделе, но значительно чаще встречается у собак с отсутствующей болевой чувствительностью. У собак с параплегией и отсутствием глубокой ноцицепции вероятность развития PMM возрастает до 10–12 %. Есть данные, которые говорят о том, что у французских бульдогов может быть породная предрасположенность к развитию этого катастрофического осложнения. PMM чаще диагностируется у собак с Т2-взвешенным гиперинтенсивным сигналом от спинного мозга на магнитно-резонансной томографии, у собак < 6 лет, с грыжами МПД на уровне L5–6 и у собак с быстро прогрессирующими клиническими симптомами. IVDE в области пояснично-крестцового утолщения — это значительный фактор риска развития PMM. Операция, проведённая более чем через 12 часов после потери способности передвигаться, положительно коррелирует с развитием PMM, а лечение кортикостероидами — отрицательно. Предполагают, что сывороточный уровень GFAP может быть биомаркером для PMM. Чувствительность и специфичность GFAP для прогнозирования PMM составляет 75 и 97,7 % соответственно.
Знаний о патогенезе PMM крайне мало. В гистологическом исследовании отмечали иммунореактивность эндотелина-1 (ET-1) в астроцитах, макрофагах и нейронах, но очень редко в эндотелиальных клетках. В эпицентре поражения — кровоизлияния в спинном мозге — иммунореактивность ET-1 была значительно выше в астроцитах и ниже в нейронах по сравнению с контрольной группой. Более того, повышенная иммунореактивность ET-1 в астроцитах и нейронах наблюдалась в сегментах спинного мозга, удалённых от очага поражения, и была выше по сравнению с эпицентром. Авторы сделали вывод, что повышенная экспрессия ET-1 после IVDE в нескольких сегментах спинного мозга может участвовать в патогенезе PMM.
Гистопатологические изменения при PMM в целом характеризуются тяжёлым ликвифицирующим некрозом спинного мозга, который распространяется на несколько сегментов (илл. 2). Предполагают, что PMM представляет собой вариант чрезмерного вторичного ответа на травму и возникает из-за нарушения регуляции. В поражённых тканях спинного мозга развиваются обширное кровоизлияние и некроз как в сером, так и в белом веществе, нарушается структура миелина, появляются некротизированные и хроматолитические нейроны, видны набухшие эндотелиальные клетки, выстилающие оставшиеся кровеносные сосуды (илл. 2). Сообщается о том, что паренхимные и менингеальные кровеносные сосуды некротизируются, периваскулярно откладывается фибрин. В некоторых сосудах могут быть тромбы. Тяжёлые поражения характеризуются аморфной смесью тканевого дебриса, макрофагов и крови. В некоторых случаях рядом с мозговыми оболочками можно обнаружить вещество МПД. Процесс некроза сопровождается реактивным воспалительным ответом с преобладанием нейтрофилов, поскольку эти патологические изменения имеют острую природу. Более того, для поражений характерна инфильтрация CD18-положительной фагоцитарной микроглией/макрофагами. Геморрагический и некротический дебрис также можно найти в пределах центрального канала в сегментах спинного мозга, которые удалены от очага поражения. Интрамедуллярные и субдуральные кровотечения в значительной степени связаны со степенью повреждения серого и белого вещества. Считается, что прогрессивная природа PMM отчасти связана с высоким интрамедуллярным давлением.
Предполагают, что в патогенезе PMM участвует оксидативный стресс, поскольку PMM связана с повышенным уровнем 8-изопростанов и акролеина и сопровождается уменьшением эндогенного антиоксидантного эффекта глутатиона в спинномозговой жидкости и моче у собак с PMM. PMM — это патологическое состояние, которое представляет собой крайнюю форму вторичной травмы, при которой защитные механизмы организма не способны прекратить распространение оксидативной травмы. Снижение антиоксидантного эффекта связано с усилением фагоцитоза в очаге поражения. Это говорит о том, что макрофаги, которые появляются во время PMM, могут играть ключевую роль в её развитии. Ещё не изучена точная роль макрофагов в этом процессе и в особенности их возможная поляризация в сторону нейротоксичного фенотипа. Но при этом сама по себе инфильтрация нейтрофилами и макрофагами считается сторонним феноменом, она не запускает развитие PMM.
Выводы и дальнейшие направления исследований
Морфологический, аксональный, глиальный и иммунный ответ при SCI у собак в основном отражает изменения, которые наблюдают у животных моделей для SCI и у людей. Но, несмотря на то что доля SCI в ветеринарной клинической практике высока, до сих пор относительно мало известно о точном течении во времени процессов вторичных травм, которые происходят в спинном мозге у собак с SCI. Иммунные процессы, особенно роль микроглии/макрофагов — хорошая цель для разработки новых методов терапии. Важно разработать иммуногистохимические маркеры, которые позволят различать разные стадии поляризации макрофагов (М1- и М2-макрофаги). Углубление знаний о течении иммунного ответа и аксонопатии обеспечит возможность точнее прогнозировать исход заболевания и найти возможные методы таргетной терапии. То же справедливо и в отношении исследования биомаркеров. И наконец, важно исследовать патогенез PMM, разрушающего осложнения SCI у собак.
СВМ № 6/2021
Вам также могут быть интересны статьи:
Болезнь межпозвоночных дисков у собак, ч. 1
Хирургическое лечение синдрома конского хвоста, вызванного травмой, у кошки