Аннотация
Геморрагический шок представляет собой клинический синдром, который проявляется в уменьшении перфузии жизненно важных органов. Несмотря на многочисленные работы по лечению геморрагического шока, вопрос о выборе раствора для инфузии и алгоритма его введения остаётся открытым. Ранние гемодинамические эффекты, нейроэндокринные реакции и почечная функция при быстрой нагрузке организма натрием в результате инфузии гипертонического раствора натрия хлорида (ГР) или раствора Рингера лактата (РРЛ) изучались в модели контролируемого геморрагического шока. Кровопотеря составила 30% рассчитанного объёма, т. е. 27 мл/кг массы тела, за 15 мин. По истечении 30 мин начинали инфузию ГР в дозе 4 мл/кг или РРЛ (81 мл/кг) с последующим введением цельной крови. Гемодинамику, почечную функцию и нейроэндокринные реакции оценивали во время шока и через 15, 30, 45 и 60 мин после введения ГР или РРЛ, а также через 30 и 60 мин после переливания цельной крови. При введении РРЛ отмечены достоверно более высокое давление сердечного наполнения и увеличение показателей сердечной функции по сравнению с ГР, но после инфузии цельной крови исчезли все различия кроме более высокого давления в концевых лёгочных капиллярах. Объём мочи и индекс гломерулярной фильтрации восстанавливались до нормы при введении обоих растворов, причём до инфузии цельной крови они были достоверно выше у собак, которым вводили РРЛ. Оба раствора одинаково восстанавливали исходный уровень норадреналина в плазме крови, а также улучшали гемодинамику и почечную функцию, но эффект был кратковременным, и для успешного лечения требовалось переливание цельной крови независимо от применявшегося раствора. В отличие от РРЛ, ГР не вызывал перегрузки сердечно-сосудистой системы.
Введение
Геморрагический шок представляет собой клинический синдром, который проявляется в уменьшении перфузии жизненно важных органов, что ведёт к их неадекватному снабжению кислородом и питательными веществами, необходимыми для нормального функционирования клеток и тканей [22]. Данный синдром развивается в результате как минимум 30% кровопотери. Падение венозного возврата к миокарду приводит к уменьшению сердечного выброса и активации ряда механизмов регуляции гомеостаза, включая гормональные модуляции и сердечно-сосудистые нейрологические рефлексы. Благодаря компенсаторным механизмам восстанавливается объём крови, поддерживаются кровяное давление и перфузия жизненно важных органов: сердца, мозга и почек. Перфузия может поддерживаться в течение короткого периода времени после слабой или умеренной кровопотери, однако в отсутствие лечения функционирование компенсаторных механизмов прекращается, и развиваются осложнения, индуцированные шоком. Основная цель при лечении геморрагического шока — улучшение перфузии и оксигенации тканей, при этом все усилия направляются на увеличение внутрисосудистого объёма путём внутривенной жидкостной терапии [24].
В настоящее время изотонические кристаллоидные растворы — например раствор Рингера лактата — рекомендуются в качестве начальной реанимирующей жидкости при лечении геморрагического шока. Так как не более пятой части объёма введённого изотонического кристаллоидного раствора остаётся в кровяном русле, для эффективного увеличения объёма плазмы и предварительной нагрузки необходимы значительные объёмы таких растворов [47]. В результате недостаточной задержки растворов солей в кровеносном русле внутрисосудистый объём восстанавливается на короткий промежуток времени и впоследствии возможно развитие отёка с нарушением снабжения тканей кислородом [3].
Показано, что гипертонические растворы хлорида натрия (ГР) с добавлением или без коллоидных веществ обеспечивают трёх- или четырёхкратное увеличение объёма плазмы относительно введённого объёма раствора за счёт эндогенного перераспределения жидкостей в организме [14; 3]. Положительный инотропный эффект может рассматриваться как ещё одно следствие введения ГР [49; 40; 5; 48]. Увеличение сердечного выброса опосредовано, вероятно, рефлекторной дугой, включающей блуждающий нерв и лёгочные рецепторы [49; 34; 40]. Восстанавливается среднее артериальное давление, а периферическое и лёгочное сосудистое сопротивление уменьшаются [42; 40; 32; 2; 31]. Улучшение функционирования сердечно-сосудистой системы при кровопотере у животных может быть одним из проявлений неспецифической реакции, включая влияние катехоламинов, по мере того, как в результате инфузии гиперосмотического раствора падает их концентрация в плазме параллельно со значительным подъёмом среднего артериального давления и сердечного выброса [28; 41].
В данном исследовании определялась эффективность 7,5% раствора NaCl в сравнении с раствором Рингера лактата при кровопотере у собак под наркозом с последующей гемотрансфузией. Исследовали раннее влияние на сердечно-сосудистую систему, нейроэндокринные реакции и почечную функцию после быстрой нагрузки организма натрием. Методика исследования имитировала ситуацию, при которой отсутствует возможность немедленной гемотрансфузии.
Материалы и методы
Животные
Работа выполнена на 6 взрослых собаках (кобели породы бигль) весом 13,0–18,5 кг. Состояние здоровья животных оценивали по результатам клинических исследований, аускультации сердца и грудной клетки, а также анализа крови, включая общий анализ, лейкоцитарную формулу и биохимический анализ: азот мочевины, креатинин, фосфор, общий белок, альбумин и электролиты, калий, натрий и хлориды (данные не приводятся).
Эксперимент проводили под общей анестезией с повтором через 30 дней, поменяв растворы в группах. Собак произвольно делили на 2 группы для введения 7,5% раствора хлорида натрия или Рингера лактата при геморрагическом шоке. В период между экспериментами проводили ежедневное обследование животных и сделали анализ крови. Не отмечено никаких клинических аномалий и отклонений в параметрах крови (данные не приводятся). Перед экспериментом собаки не ели в течение 12 часов и до премедикации имели неограниченный доступ к воде. Все процедуры проводились в соответствии с правительственными актами Словении (Animal Protection Act UL RS, 43/2007) и были согласованы с Министерством сельского хозяйства, лесной и пищевой промышленности, а также Ветеринарным управлением Словении; лицензия №326-07-118/97.
Анестезия
Премедикацию проводили внутривенно смесью кетамина (Ketanest 10%; Parke-Davis, Германия) в дозе 2 мг/кг и мидазолама (Dormicum; F. Hoffmann — La Roche, Швейцария) в дозе 0,3 мг/кг. Через 1–2 мин внутривенно вводили пропофол (Diprivan; Zeneca Pharmaceuticals, США) в дозе 3–4 мг/кг и делали эндотрахельную интубацию, наркоз поддерживался кетамином (2 мг/кг), который вводили через шприцевый насос (Perfusor®fm; B Braun, Melsungen AG, Германия) и изофлураном (Forane; Abbott Laboratories, Швейцария) в 100% кислороде до концентрации 1,5% при спокойном выдохе (FE’ISO), которая снижалась до 1,1% при геморрагическом шоке и возвращалась до начального значения (1,5%) после инфузии цельной крови. Аппарат для наркоза (Dräger Tiberius 800, Германия) подсоединяли по одноконтурной схеме. Мышечное расслабление достигалось при помощи внутривенного введения атракурия (Tracrium; Glaxo Wellcome SpA, Италия) в дозе 0,4 мг/кг с повторным введением каждые 45–60 мин в дозе 0,2 мг/кг. Проводили искусственную вентиляцию лёгких на аппарате Ventilog (Dräger, Германия): дыхательный объём 15–20 мл/кг веса тела и максимальное давление в дыхательных путях — 10 см H2O в контуре аппарата. Конечное давление выдоха равнялось нулю. Перед началом измерений конечное напряжение СО2 при выдохе (PE’CO2) составляло 35–45 мм рт. ст. и оставалось неизменным до окончания эксперимента.
FE’ISO, PE’CO2 и насыщение артериальной крови кислородом определяли методом пульсоксиметрии (SpO2). При наркозе вели постоянный мониторинг частоты дыхания и давления в дыхательных путях (монитор RGM 5250, Ohmeda, США). Дыхательный и минутный объём определяли методом механической волюметрии (Dräger Tiberius 800, Германия). Частоту сердечного ритма и температуру тела регистрировали при помощи электрокардиографа (второе отведение) и термометра, введённого в пищевод (аппарат HP Model 78354A; Hewlett Packard GmbH, Германия).
Собакам внутривенно вводили цефазолин (Cefamezin; Krka, Словения) в дозе 20 мг/кг сразу же после начала наркоза. Препарат вводили повторно через 4 часа. В качестве поддерживающего раствора использовали Рингера лактат (Sestavljen natrijev laktat; B Braun Melsungen AG, Германия).
Собак укладывали на спину на подогреваемый хирургический стол (33°C). Температура воздуха в операционной поддерживалась на уровне 20–24°C. Наркоз длился в среднем 4 ч 50 мин (от 4 ч 30 мин до 5 ч 15 мин) — в зависимости от времени, необходимого для проведения всех процедур.
В конце эксперимента проводили оксигенацию и экстубацию, и собак помещали на подогреваемые коврики в послеоперационной палате. Так как у животных, которым вводили РРЛ, развивалась одышка с серозными выделениями из носа, оксигенацию не прекращали до тех пор, пока они могли самостоятельно стоять. Серьёзная одышка отмечалась только у одной собаки, ей внутривенно ввели фуросемид (Edemid; Lek, Словения) в дозе 2 мг/кг. В течение двух часов после окончания эксперимента все собаки, за исключением одной из группы РРЛ, которой вводили фуросемид, начинали передвигаться, есть и пить. Затем их перемещали в вольеры с водой и кормом (Hill's a/d; Hill's Pet Nutrition Inc, США).
Инструментарий
Анестетики и поддерживающие растворы вводили через катетер (калибр 20), установленный в головной вене. Катетер ставили под наркозом. Аналогичные катетеры вводили чрескожно в обе бедренные артерии. Систолическое (SАP), диастолическое (DAP) и среднее артериальное давление (MАP) измеряли в левой бедренной артерии (HP Model 78354A; Hewlett Packard GmbH, Германия). Забор крови и кровопотерю осуществляли через правую бедренную артерию. Катетер (калибр 17) в правой наружной яремной вене устанавливали для забора венозной крови, введения жидкостей и гемотрансфузии. Катетер Свана-Ганза (7-F, 110 см, 131HF7; Baxter Healthcare Corporation, США) был введён чрескожно в правую наружную яремную вену и продвинут в лёгочную артерию; его положение корректировали по форме кривой давления крови. Этот катетер использовали для измерения давления в лёгочной артерии: систолического (PAP/S), диастолического (PAP/D) и среднего (PAP/M), давления в краевых лёгочных капиллярах (PCWP), центрального венозного давления (CVP) и сердечного индекса (CI) при помощи монитора HP Model 66S (Hewlett Packard GmbH, Германия). Катетер Свана-Ганза использовали для забора смешанной венозной крови. Забор мочи для анализа и измерения объёма осуществляли через катетер. Все катетеры удаляли в конце эксперимента.
Методика эксперимента
Эксперимент состоял из 12 этапов (таблица 1). После катетеризации и подключения к монитору не производили никаких манипуляций в течение 30 мин для стабилизации показателей, после чего записывали исходные данные (1-й этап). Затем вызывали потерю 30% рассчитанного общего объёма крови, т. е. 27 мг/кг массы тела в течение 15 мин (2-й этап — окончание кровопотери). Кровь собирали в 60-мл шприцы с ЦФДА-1 для предотвращения коагуляции, из шприцев переливали в мешки для крови (Teruflex, Terumo corp., Япония) и удаляли антикоагулянт. Для гемотрансфузии кровь в мешках оставляли при комнатной температуре. В течение 30 мин не проводили никаких процедур (3-й этап — 5 мин после окончания кровопотери; 4-й этап — 30 мин после окончания кровотечения). Затем собак делили на две группы (случайная выборка) для введения гипертонического раствора NaCl (ГР) или раствора Рингера лактата (РРЛ). ГР готовили из 10% раствора NaCl (Solutio natrii chloridi 10%, Zavod za transfuzijo krvi, Словения), добавляя дистиллированную воду (Aqua redestilata, Pliva, Хорватия). Объём для инфузии при реанимации определяли согласно натриевой нагрузке, т. е. ГР — 4 мл/кг массы тела и РРЛ — 40 мл/кг массы тела (одинаковое количество натрия), длительность инфузии — 4 мин. Проводили измерения (5-й этап), оставшийся РРЛ (41 мл/кг) вводили в течение 10 мин; окончание инфузии РРЛ — 6-й этап. Показатели снимали через 30 (7-й этап), 45 (8-й этап) и 60 мин (9-й этап). В обеих группах собранную кровь переливали в течение 15 мин (10-й этап — окончание гемотрансфузии). В течение следующего часа не производили никаких манипуляций (11-й этап — 30 мин и 12-й этап — 60 мин после окончания гемотрансфузии). В конце часового периода наблюдения животных выводили из наркоза.
Таблица 1. Этапы эксперимента
| Этап | Производимое действие | Время от начала измерения (мин) | |
| Базальный уровень | Предыдущее значение | ||
| 1 | Определение базального уровня | 0 | 0 |
| Начало кровотечения | |||
| 2 | Окончание кровотечения | 15 | 15 |
| 3 | Шок (15 мин) | 30 | 15 |
| 4 | Шок (30 мин) | 45 | 15 |
| Начало жидкостной терапии | |||
| 5 | Окончание введения ГР (4 мл/кг) или РРЛ (40 мл/кг) | 50 | 5 |
| 6 | Окончание введения РРЛ (суммарно) | 60 | 10 |
| 7 | 30 мин после начала введения раствора | 75 | 15 |
| 8 | 45 мин после начала введения раствора | 90 | 15 |
| 9 | Начало гемотрансфузии | 105 | 15 |
| 10 | Окончание гемотрансфузии | 120 | 15 |
| 11 | 30 мин после окончания гемотрансфузии | 150 | 30 |
| 12 | 60 мин после окончания гемотрансфузии | 180 | 30 |
| Прекращение анестезии | |||
Забор крови и мочи для анализа
На всех этапах эксперимента брали кровь на общий анализ и лейкоциты, биохимический состав сыворотки и состав газов. Мочу собирали на всех этапах, кроме пятого. Определяли креатинин и электролиты. Для определения содержания норэпинефрина в плазме кровь брали на 1-м, 4-м, 5-м, 6-м и 12-м этапах.
Венозную кровь на общий анализ и лейкоциты собирали в пробирки Microtainer с антикоагулянтом K2EDTA (Becton Dickinson, США) и сразу же помещали в автоматический лазерный анализатор крови Technicon H*l (Siemens Bayer, Германия).
Венозную кровь для биохимического анализа собирали в пробирки Vacutainer (Becton Dickinson, США), оставляли при комнатной температуре на 15 мин до образования сгустка, центрифугировали 10 мин при 4°C (1300g), отделяли сыворотку и хранили при –20°C. Концентрацию электролитов измеряли на анализаторе Ilyte (США). Другие показатели сыворотки крови: азот мочевины, креатинин, фосфор, общий белок и альбумин — определяли на автоматическом анализаторе Technicon RA-XT (Siemens Bayer, Германия).
Артериальную и смешанную кровь для анализа газового состава собирали в анаэробных условиях в шприцы с гепарином и сразу же помещали в анализатор (AVL Compact 3, Австрия). Значения pH и газовый состав определяли при 37°C с последующей коррекцией с учётом температуры тела и концентрации гемоглобина. Определяли pH, парциальное давление CO2 (PCO2), кислорода (PO2), фактическая концентрация бикарбоната (HCO3–), избыток оснований (BEесf) и насыщение кислородом (SO2). Значения PCO2, PO2 и pH получены с прибора, остальные параметры были рассчитаны.
Мочу собирали в 15-мл пробирки, затем центрифугировали 10 мин при комнатной температуре (2000g). Отбирали супернатант и сразу же замеряли креатинин и электролиты. Для определения креатинина образцы разводили 1:20 или 1:40 и помещали в автоматический анализатор Technicon RA-XT (Siemens Bayer, Германия). Электролиты определяли в анализаторе Ilyte (США).
Концентрацию креатинина в моче измеряли для расчёта эндогенного клиренса креатинина и индекса скорости гломерулярной фильтрации (GFRI). Концентрацию креатинина в сыворотке крови и моче определяли в автоматическом анализаторе Technicon RA-XT (Siemens Bayer, Германия) кинетическим методом Яффе.
Индекс GFRI (мл/мин/кг массы тела) рассчитывали как скорость гломерулярной фильтрации (GFR; мл/мин) / вес тела (кг), а скорость гломерулярной фильтрации (GFR) — как (V × Ucrea)/Screa , где V — объём мочи, собранной между двумя фазами, Ucrea — концентрация креатинина в моче (мкмоль/л) и Screa — концентрация креатинина в сыворотке крови (мкмоль/л). Screa рассчитывали как среднее концентрации креатинина в сыворотке крови двух образцов, взятых в двух последовательных фазах.
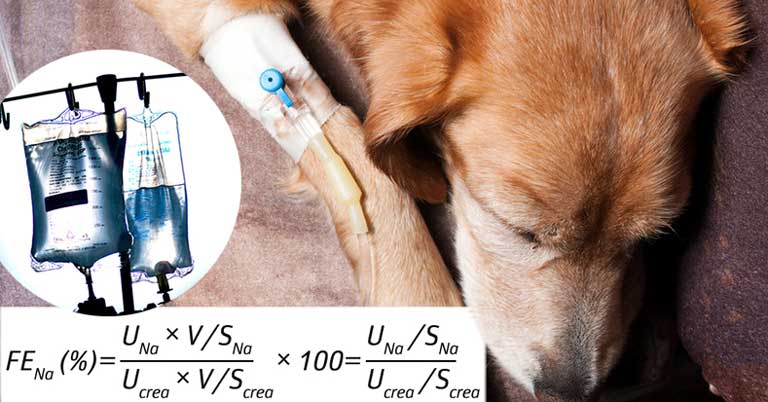
Фракционную экскрецию натрия с мочой (FENa) рассчитывали как отношение к клиренсу креатинина, где U означает параметры, измеренные в моче, S — в сыворотке крови:
Венозную кровь для определения концентрации норадреналина собирали в пробирки с K3EDTA (Greiner Bio-One GmbH, Австрия), охлаждённые на ледяной бане, и сразу же центрифугировали 10 мин при 4 °C (1500g). Отбирали плазму и хранили при –20°C. Концентрацию норадреналина определяли методом радиоиммунного анализа [26].
Мониторинг гемодинамики и транспорта кислорода
Показатели гемодинамики, включая ЧСС, давление крови, CVP, PAP, PCWP и сердечный индекс (CI), определяли на всех этапах эксперимента. CI (сердечный выброс/вес тела) замеряли троекратно при 23 °C методом термоделюции 3 мл изотонического раствора и рассчитывали среднее значение. Ударный объём (SVI) рассчитывали как CI/ЧСС. Системное сопротивление кровяного русла (SVR) рассчитывали как (MAP – CVP)/CI, и сопротивление лёгочного кровяного русла (PVR) — как (PAP/M – PCWP)/CI.
Содержание кислорода в артериальной и смешанной крови (CaO2 и CmvO2, соответственно) рассчитывали как (SO2 × Hb × 1,39) + 0,00314 × PO2. Системный индекс объёмной скорости доставки кислорода (DO2I) рассчитывали как CI × CaO2 × 10, и системный индекс потребления кислорода (VO2I) как CI × (A–VdO2) × 10, где A – VdO2 представляет собой артериовенозую разницу содержания кислорода: (CaO2–CmvO2).
Статистический анализ
Статистическую обработку данных проводили с помощью программы SPSS 15.0 для Windows (США). Все данные, кроме показателей функции почек (UO, GFRI и FENa), анализировали параметрическими методами. В обеих группах (ГР и РРЛ) достоверность различий определяли при помощи ANOVA. Рассчитывали разницу между двумя разными параметрами в группах ГР и РРЛ и сравнивали с базальным уровнем при помощи ANOVA. Все данные, которые анализировали параметрическими методами, представлены как средняя величина ± СО (стандартное отклонение).
Так как формальными методами анализа данных трудно определить форму распределения в малой выборке (6 собак в нашем случае) [36], показатели почечной функции, которые варьировали в значительных пределах, анализировали непараметрическими методами. В обеих группах применяли критерий Фридмана; непараметрический эквивалент повторных измерений ANOVA использовали для глобальных взаимодействий, и знаковый регулярный критерий Уилкоксона применяли для детальных сравнений c тем, чтобы определить достоверные изменения показателей почечной функции. Рассчитывали различия между показателями функции почек в группе ГР и РРЛ, после чего проводили аналогичный непараметрический анализ, используя критерий Фридмана и знаковый регулярный критерий Уилкоксона. Показатели функции почек представлены как медиана и область значений. При проведении всех статистических анализов р<0,05 была принята как значимая.
Таблица 2. Гемодинамические параметры (средняя величина ± СО) базального уровня при геморрагическом шоке и после введения раствора Рингера лактата (РРЛ; n=6) и цельной крови (ЦК), или 7,5% раствора NaCl (ГР; n=6) и цельной крови (ЦК)
| Переменная | Фаза эксперимента | ||||||
| 1 | 4 | 5 | 6 | 9 | 10 | 12 | |
| Базальный уровень | Шок | ГР 4 мл/кг или РРЛ 40 мл/кг конец введения | РРЛ конец введения | Начало гемо-трансфузии |
Конец гемо-трансфузии |
Конец экспери-мента |
|
| ЧСС (уд/мин) | |||||||
| РРЛ | 121 ± 6 | 118 ± 11 | 114 ± 8 | 116 ± 8 | 124 ± 14 | 117 ± 9 | 122 ± 17 |
| ГР | 128 ± 13 | 130 ± 15 | 133 ± 16• | 121 ± 19• | 127 ± 18 | 123 ± 13 | 126 ± 11 |
| Сердечный индекс (мл/мин/кг) | * | * | |||||
| РРЛ | 221,9 ± 47,9• | 95,8 ± 27,0• | 263,9 ± 74,8† | 326,4 ± 51,6 | 273,1 ± 68,7 | 303,8 ± 67,5 | 309,4 ± 89,5 |
| ГР | 21 0,4 ± 34,5• | 108,0 ± 29,6• | 226,7 ± 60,6• | 162,7 ± 40,5 | 175,8 ± 28,8• | 311,6 ± 61,6 | 327,8 ± 82,3 |
| Ударный объём (мл/уд/кг) | * | * | |||||
| РРЛ | 1,83 ± 0,36• | 0,82 ± 0,26• | 2,31 ± 0,66 | 2,81 ± 0,50• | 2,18 ± 0,37• | 2,58 ± 0,49 | 2,49 ± 0,44 |
| ГР | 1,66 ± 0,32• | 0,84 ± 0,25• | 1,72 ± 0,52 | 1,35 ± 0,31 | 1,41 ± 0,33• | 2,56 ± 0,55 | 2,61 ± 0,69 |
| Общее сопротивление сосудистого русла (мм рт. ст./мл/кг) | |||||||
| РРЛ | 0,309 ± 0,048• | 0,579 ± 0,129• | 0,334 ± 0,057• | 0,236 ± 0,052 | 0,229 ± 0,040 | 0,225 ± 0,029 | 0,231 ± 0,045 |
| ГР | 0,388 ± 0,147• | 0,547 ± 0,205• | 0,321 ± 0,155 | 0,353 ± 0,134 | 0,373 ± 0,197• | 0,232 ± 0,091 | 0,254 ± 0,086 |
| Сопротивление лёгочного русла (мм рт. ст.) |
* | ||||||
| РРЛ | 0,041 ± 0,012• | 0,064 ±0,027• | 0,035 ± 0,017 | 0,026 ± 0,008 | 0,027 ± 0,007 | 0,026 ± 0,007 | 0,029 ± 0,013 |
| ГР | 0,034 ± 0,008• | 0,056 ± 0,015• | 0,032 ± 0,005 | 0,037 ± 0,014 | 0,034 ± 0,005 | 0,024 ± 0,005 | 0,025 ± 0,006 |
| Доставка кислорода (мл O2/кг/мин) | |||||||
| РРЛ | 39,44 ± 10,64• | 16,35 ± 5,29• | 30,25 ± 11,33 | 31,17 ± 8,59 | 35,54 ± 13,09ø | 44,57 ± 12,84 | 47,40 ± 17,30 |
| ГР | 39,28 ± 7,27• | 18,72 ± 5,28• | 33,16 ± 8,97• | 24,00 ± 5,34 | 25,84 ± 4,08• | 48,81 ± 8,37 | 53,11 ± 13,77 |
| Потребление кислорода (мл O2/кг/мин) |
* | ||||||
| РРЛ | 4,82 ± 1,15• | 4,29 ± 0,88• | 4,72 ± 1,34• | 5,67 ± 0,46 | 5,14 ± 1,25 | 5,69 ± 0,82 | 5,22 ± 1,22 |
| ГР | 5,14 ± 1,17• | 5,70 ± 1,03• | 5,84 ± 1,57 | 5,36 ± 1,88 | 6,33 ± 1,59 | 6,67 ± 1,18 | 7,30 ± 2,25 |
| DO2 : VO2 * | * | ||||||
| РРЛ | 8,1 ± 1,1 : 1 | 3,8 ± 0,7 : 1 | 6,4 ± 1,6 : 1 | 5,6 ± 1,7 : 1 | 6,9 ± 2,1 : 1 | 7,8 ± 2,2 : 1 | 8,8 ± 2,4 : 1 |
| ГР | 7,8 ± 1,3 : 1 | 3,3 ± 0,6 : 1 | 5,8 ± 1,0 : 1 | 5,1 ± 2,5 : 1 | 4,2 ± 0,7 : 1 | 7,4 ± 0,9 : 1 | 7,4 ± 1,0 : 1 |
| * Межгрупповые различия достоверны (р<0,05) по сравнению с базальным уровнем (повторные измерения, ANOVA). • Достоверная разница (р<0,05) между двумя последовательными этапами эксперимента. ø Околодостоверная разница (р=0,051) между двумя последовательными этапами эксперимента. † Околодостоверная разница (р=0,054) между двумя последовательными этапами эксперимента. |
|||||||
Результаты
Отмечены значительные изменения гемодинамики после кровотечения (таблица 2, рис. 1–4). В обеих группах CI, SVI, DO2, MAP, CVP, PAP/M (за исключением 15 мин геморрагического шока) и PCWP уменьшались, в то время как ЧСС, SVR и PVR возрастали во время кровотечения без достоверных межгрупповых различий по сравнению с базальным уровнем. Показатель VO2 уменьшился в группе РРЛ и увеличился в группе ГР, но эти изменения были недостоверны.
В конце первой фазы реанимации, т. е. после одинаковой нагрузки организма натрием (4 мг/кг в группе ГР и 40 мг/кг в группе РРЛ, 5-й этап), МАР в обеих группах увеличилось без достоверных различий между группами. Однако в группе РРЛ MAP установилось до уровня выше, чем до кровотечения, а в группе ГР — ниже. С другой стороны, CI и SVI увеличились до значения выше, чем до кровотечения, но межгрупповые различия были недостоверны. CVP, PAP/M и PCWP в большей степени увеличились в группе РРЛ по сравнению с группой ГР при достоверной межгрупповой разнице. SVR и PVR уменьшились, а DO2 и VO2 увеличились после введения ГР и РРЛ, без достоверной разницы между группами.
В конце второй фазы реанимации, то есть когда вводили оставшийся объём РРЛ (6-й этап), межгрупповые различия были достоверны по сравнению с разницей базальных уровней в случае CI, SVI, MAP, CVP, PAP/M и PCWP, причём все параметры, за исключением MAP, достигали пиковых значений в группе РРЛ. В группе ГР значения СI и SVI уменьшились по сравнению со значениями в первой фазе реанимации, оставаясь на уровне ниже чем до кровотечения. В группе собак, которым вводили РРЛ, SVR и PVR уменьшились, а DО2 и VО2 увечились. С другой стороны, SVR и PVR увеличились, а DО2 и VО2 уменьшились в группе собак, которым вводили ГР. Межгрупповые различия по сравнению с базальными межгрупповыми различиями были недостоверны.
После введения цельной крови (10-й этап) в обеих группах величины гемодинамических показателей, таких как CI, SVI, DO2, VO2, MAP, CVP, PAP/M и PCWP, превосходили уровень до кровотечения, причём только для PCWP межгрупповые различия были достоверны по сравнению с разницей базальных уровней.
В конце эксперимента (12-й этап) достоверные межгрупповые различия отмечались только для VO2 и PCWP при сравнении с базальной межгрупповой разницей. В группе ГР значение VO2 было выше, а значение PCWP было выше в группе РРЛ.
Соотношение доставки и потребления кислорода (DO2:VO2) при геморрагическом шоке уменьшаются до уровня ниже нормы (4:1) [White, 1987]. После введения ГР или РРЛ во время реанимации это соотношение восстанавливалось до нормы и оставалось не выше значения 4:1 до окончания эксперимента. Соотношение DO2:VO2 было ниже и продолжительность эффекта была короче в группе ГР. Межгрупповые различия, по сравнению с базальными различиями, были достоверны до начала гемотрансфузии (9-й этап). В конце эксперимента достоверных отличий между группами не отмечено.
Параметры функции почек представлены в таблице 3. При геморрагическом шоке объём выделяемой мочи уменьшился ниже уровня 1–2 мл/кг/час, который необходим для нормального функционирования почек [27]. При введении обоих растворов этот показатель возрастал, причём разница была достоверной в группе РРЛ. Хотя в группе РРЛ объём выделенной мочи увеличился в большей степени по сравнению с группой ГР, межгрупповое различие было недостоверным по сравнению с базальным различием. Статистически значимое различие между группами наблюдалось только в периоде между первым и вторым кровотечением (6–9 этапы). Межгрупповые различия в конце эксперимента были недостоверны (второй период покоя, 10–12 этапы).
Индекс клубочковой фильтрации возрастал в обеих группах, при этом межгрупповая разница по этому показателю была достоверной при инфузии соответствующего раствора (4–6 этапы) и в ходе первого периода покоя (6–9 этапы). При гемотрансфузии (9–10 этапы) значение GFRI уменьшилось в группе РРЛ и увеличилось в группе ГР, но различия между группами по этому показателю были недостоверны. Значение GFRI было выше в группе ГР в течение второго периода покоя (10–12 этапы), но разница была недостоверной по сравнению с базальным уровнем.
Фракционная экскреция натрия достоверно увеличилась в группе РРЛ (4–6 этапы). При сравнении с базальным уровнем различий, межгрупповая разница была достоверна только во время гемотрансфузии (9–10 этапы), при этом данный показатель достигал более высоких значений в группе РРЛ.
Содержание норадреналина в плазме крови достоверно не изменялось в обеих группах, не отмечено также межгрупповых различий по этому параметру по сравнению с базальным уровнем (таблица 4).
В ходе эксперимента в группе РРЛ не отмечено существенных изменений по концентрации натрия в сыворотке крови, однако этот показатель достоверно увеличивался после введения ГР и постепенно уменьшался в последующие периоды эксперимента. Межгрупповая разница по этому показателю оставалась достоверной до конца эксперимента (таблица 4).
Значение гематокрита (рис. 5) в большей степени уменьшалось в группе РРЛ. Межгрупповая разница была достоверной во время введения РРЛ и ГР, при этом в группе РРЛ гематокрит увеличился при гемотрансфузии, после чего межгрупповая разница стала недостоверной.
Таблица 3. Показатели функции почек (медиана, разброс) у собак при геморрагическом шоке и после введения раствора Рингера лактата (РРЛ, n=6) и цельной крови (ЦК), или 7,5% раствора NaCl (ГР, n=6) и цельной крови
| Переменная | Этап эксперимента | ||||
| 1–4 | 4–6 | 6–9 | 9–10 | 11–12 | |
| Шок | Инфузия ГР или РРЛ | Первый период покоя |
Гемотрансфузия | Второй период покоя |
|
| Объём выделяемой мочи (мг/кг/час) | * | ||||
| РРЛ | 0,175 (0–0,66)• |
5,255 (0,82–11.46)• |
9,210 (4,46–11,68)• |
5,715 (1,64–8.89) |
6,485 (2,73–12,96) |
| ГР | 0,26 Э (0,15–0,47) |
1,351 (0–5,33) |
2,335 (0,09–4,82)• |
4,81 (0,76–7,93) |
7,205 (1,54–13,60) |
| Индекс скорости клубочковой фильтрации (мл/мин/кг) |
* | * | |||
| РРЛ | 0,884 (0–1,72)• |
3,097 (0,78–10,28) |
3,989 (2,05–5,47)ø |
2,443 (0,88–3,33)• |
2,798 (2,25–3,40) |
| ГР | 0,557 (0,32–0,83) |
1,53 (0–3,58) |
1,846 (0,02–2,71)• |
3,371 (1,22–3,95) |
3,410 (1,78–10,39) |
| Фракционная экскреция натрия (%) | * | ||||
| РРЛ | 0,24 (0–0,70)• |
1,077 (0,85–4,13) |
2,948 (2,47–6,62) |
3,963 (2,07–4,34) |
2,545 (1,44–6,40) |
| ГР | 0,904 (0,22–1,32) |
0,863 (0–6,27) |
3,225 (2,47–7,38) |
3,44 (0,47–5,09) |
3,568 (0,76–5,96) |
| * Межгрупповые различия достоверны (р<0,05) по сравнению с различиями во время шока (критерий Фридмана, знаковый регулярный критерий Уилкоксона). • Достоверная разница (р<0,05) между двумя последовательными периодами измерений. ø Околодостоверная разница (р=0,058) между двумя последовательными периодами измерений. |
|||||
Таблица 4. Норадреналин и концентрация натрия в сыворотке крови (среднее значение ± СО) у собак на базальном уровне, при геморрагическом шоке и после введения раствора Рингера лактата (РРЛ, n=6) и цельной крови (ЦК), или 7,5% раствора NaCl (ГР, n=6) и цельной крови
| Переменная |
Этап эксперимента |
||||
| 1 | 4 | 5 | 6 | 12 | |
| Базальный уровень | Шок | Инфузия ГР или РРЛ | Окончание введения суммарного объёма РРЛ |
Окончание эксперимента |
|
| Норадреналин (нмоль/л) | |||||
| РРЛ | 0,092 ± 0,019 | 0,108 ± 0,023 | 0,095 ± 0,018 | 0,095 ± 0,031 | 0,098 ± 0,045 |
| ГР | 0,118 ± 0,045 | 0,157 ± 0,063 | 0,120 ± 0,027 | 0,108 ± 0,035 | 0,128 ± 0,042 |
| Концентрация натрия в сыворотке крови ммоль/л | * | * | * | ||
| РРЛ | 146,2 ± 4,6 | 145,6 ± 1,7 | 144,1 ± 1,7 | 143,8 ± 2,0 | 144,0 ± 1,8 |
| ГР | 143,3 ± 1,9 | 143,8 ± 1,4 | 164,6 ± 1,8• | 156,9 ± 4,2• | 149,9 ± 1,7 |
| * Межгрупповые различия достоверны (р<0,05) по сравнению с базальным уровнем (повторные измерения, ANOVA). • Достоверная разница (р<0,05) между двумя последовательными этапами эксперимента. |
|||||
Обсуждение
Кратковременные эффекты болюсного введения Рингера лактата или 7,5% раствора NaCl в сочетании с цельной кровью изучались с использованием модели контролируемого геморрагического шока у собак в состоянии наркоза и анализа параметров гемодинамики и функции почек. Объём вводимого кристаллоидного раствора подбирался соответственно объёму раствора, вводимого при реанимации после геморрагического шока. Гипертонический раствор с декстраном или без него в начале реанимации быстро восстанавливает центральную гемодинамику и тканевую перфузию на короткий период [49; 23; 40]. Гемодинамика и кишечный кровоток не поддерживаются до тех пор, пока ГР не вводится в сочетании с кровью. Раннее введение крови с ГР необходимо для полного восстановления центральной гемодинамики и тканевой перфузии [52]; соответственно, в данной работе цельную кровь переливали в начале реанимации, при введении кристаллоидных растворов.
Объёмы вводимых растворов подбирали соответственно нагрузке натрием, т. е. в течение определённого периода (4 мин) вводили объём жидкости, содержащий эквивалентное количество натрия. Скорость инфузии ГР составила 1 мл/кг/мин, так как введение с большей скоростью может вызвать гипотонию [19; 21], опосредованную уменьшением общего сопротивления сосудистого русла. Введение собакам изотонического кристаллоидного раствора со скоростью 6 мл/кг/мин при кровотечении в объёме троекратно превышающем кровопотерю [11] приводит к подъёму сердечного индекса, в то вpемя как CVP и PCWP остаются на оптимальном уровне. При скорости инфузии равной 15 мл/кг/мин наблюдается нагрузка сердечно-сосудистой системы: CVP=23,2 мм рт. ст. и PCWP=31 мм рт. ст. С другой стороны, при скорости инфузии равной 4 мл/кг/мин отмечено субоптимальное увеличение давления наполнения и показателей сердечной функции [11]. В нашем исследовании первичное введение РРЛ со скоростью 10 мл/кг/мин вызывало перегрузку сердечно-сосудистой системы, судя по увеличению CVP, PAP/M и PCWP выше нормы. Значение сердечного индекса превысило уровень до кровотечения, при этом небольшой объём ГР эффективно восстанавливал этот показатель. По данным рентгенографии при пиковых значениях CVP, PAP/M и PCWP лёгочный застой развивался только у собак, которым вводили РРЛ. Одной собаке в конце эксперимента потребовалось введение фуросемида, у остальных лёгочный застой спонтанно исчез, и все животные хорошо восстанавливались после шока, получая кислород. Лёгочный застой может иметь неблагоприятные последствия у собак с сердечно-лёгочными патологиями, организм которых, вероятно, не сможет компенсировать значительный подъём давления наполнения, обусловленный высокой скоростью введения большого объёма изотонического кристаллоидного раствора. С другой стороны, сердечно-сосудистая система не перегружается при введении собакам небольшого объёма ГР или РРЛ, так как, за исключением возросшего сердечного индекса, CVP, PAP/M и PCWP остаются в оптимальных пределах.
При введении ГР отмечался умеренный подъём MAP выше порогового уровня, при котором развивается повреждение почек [8]. При введении РРЛ тоже наблюдалось увеличение MAP, но межгрупповое различие, хотя и достоверное из-за более высокого MAP в группе РРЛ, было кратковременным, так как РРЛ в течение часа перераспределяется из кровеносных сосудов в ткани [44; 30; 29]. Другое увеличение MAP при отсутствии межгрупповых различий наблюдалось в обеих группах после переливания цельной крови. Эти данные согласуются с результатами Zakaria и колл. [2006], которые осуществляли гемотрансфузию через час после начала введения ГР, при этом у наркотизированных собак после кровотечения быстро восстанавливались MAP и кишечный кровоток.
В оптимальных условиях количество доставляемого кислорода превышает его потребление в 4 раза — соответственно, соотношение доставка/потребление (DO2:VO2) равно 4:1. Учитывая, что 25% доставленного кислорода экстрагируется тканями, SvO2=75% отражает баланс 4:1 и 25% тканевую экстракцию [35]. В нашем исследовании при геморрагическом шоке соотношение DO2:VO2 опустилось до уровня ниже 4:1. В обеих группах оно успешно восстанавливалось выше этого уровня, однако эффект ГР был кратковременным, и межгрупповое различие значительно изменилось до начала гемотрансфузии в результате падения DO2 в группе ГР. Тем не менее, при введении ГР соотношение DO2:VO2 не уменьшалось ниже уровня 4:1 в течение всего периода реанимации.
Было показано, что гемоглобин снижает сопротивление сосудистого русла в результате уменьшения вязкости крови, которое сопровождается снижением гематокрита [17; 6; 37; 38]. Мы наблюдали достоверное снижение гематокрита (р<0,05) после введения обоих растворов, причём это снижение было более выражено при введении РРЛ. Так как изотонические растворы свободно проходят через стенки капилляров, в течение часа после внутривенного введения около 75–80% объёма выходит в интерстициальное пространство [16; 7], что соответствует постепенному увеличению гематокрита, которое мы наблюдали в группе собак после введения РРЛ. Высокая проницаемость стенок кровеносных сосудов для изотонических растворов не позволяет поддерживать внутрисосудистый объём на постоянном уровне, поэтому для поддержания циркуляции крови объём вводимого кристаллоидного раствора должен в 3–4 раза превышать объём кровопотери [16; 7]. С другой стороны, действие ГР опосредовано эндогенным перераспределением жидкостей [14; 10] и ведёт к трёх- или четырёхкратному увеличению объёма плазмы по сравнению с вводимым объёмом раствора. Показано, что гематокрит и общий белок уменьшаются после введения ГР собакам [49; 40; 43], свиньям, как с наркозом, так и без него [25], или овцам [33; 45; 51]. В работе Nakayama и колл. [1984] при замещении 10% объёма кровопотери 7% раствором NaCl (3–4 мл/кг массы тела) в течение 30 мин реанимации гематокрит снижался от 0,27 до 0,23. Через 90 мин он начинал увеличиваться, оставаясь при этом ниже уровня после кровотечения. Причиной таких колебаний может быть не только разбавление циркулирующей крови вводимым раствором, но и его осмотическое воздействие. Наши результаты соответствуют опубликованным данным, т. е. мы наблюдали уменьшение гематокрита с 0,38 (4-й этап) до 0,33 (5-й этап) после введения ГР и отсутствие достоверных изменений при гемотрансфузии.
Серьёзное кровотечение с падением артериального давления и сосудистого объёма, что прежде всего сказывается на функции барорецепторов, является сильным стимулом выделения катехоламинов [41]. Пониженные уровни вазопрессина и норадреналина могут быть одной из причин уменьшения сосудистого сопротивления в организме животных после введения гипертонического раствора [21]. Gala и колл. [1991] наблюдали подъём уровня норадреналина при геморрагическом шоке у собак без наркоза, который быстро снижался до уровня состояния покоя у собак, которым вводили 0,9% NaCl (полная реанимация) или 3,0% NaCl (полная реанимация) в течение 40 мин, и в течение 150 мин у собак, которым вводили небольшой объём 0,9% NaCl (эквивалентный вводимому 3% раствору NaCl). Уровень норадреналина не снижался у собак, которых не реанимировали. Введение 7,5% ГР с 6% декстраном 70 приводило к быстрому улучшению функционирования сердечно-сосудистой системы и резко снижало уровни адреналина и норадреналина при кровотечении у свиней без наркоза [50]. В нашем исследовании уровень норадреналина, который незначительно поднялся во время шока, снижался после введения обоих кристаллоидных растворов, что согласуется с опубликованными данными. Сравнивая эффекты изотонического и гипертонического кристаллоидного раствора, следует отметить, что эти растворы должны вводиться в соответствующих объёмах, так как они обладают разными механизмами действия. В данном исследовании РРЛ вводился в объёме, троекратно превышающем объём кровопотери; ГР вводился в объёме 4 мл/кг массы тела. Ronning и колл. [1995] использовали равные небольшие объёмы гипертонического и изотонического кристаллоидного раствора при гипертоническом шоке под наркозом у свиней. После инфузии гипертонического раствора повышенные концентрации норадреналина и адреналина плазмы крови снизились до базального уровня в течение 20 мин, оставаясь достоверно ниже по сравнению с группой животных, которым вводили изотонический раствор. Сопротивление лёгочного сосудистого русла и PAP/M оставались повышенными через 10 мин после инфузии гипертонического раствора по сравнению со значениями после введения изотонического раствора, что, по мнению авторов, может быть обусловлено нейрогенными рефлексами или секрецией нейрогормонов, способствующих развитию сердечной инотропии [23; 41]. В нашем исследовании уровень норадреналина незначительно увеличился в конце эксперимента в обеих группах животных, что, вероятно, связано с введением цельной крови с повышенным содержанием норадреналина как результата геморрагического шока или распада тромбоцитов при сборе и манипуляциях с кровью, так как известно, что они активно накапливают катехоламины [18].
При геморрагическом шоке снижаются объём выделенной мочи и скорость гломерулярной фильтрации. Объём выделенной мочи восстанавливается до нормы [51] или, по крайней мере, до троекратного превышения базального уровня [33] после введения 7–7,5% раствора NaCl при геморрагическом шоке у овец. Данный эффект, по мнению авторов, является результатом улучшения почечного кровотока. При геморрагическом шоке у собак почечный кровоток повышается после введения 7,5% раствора NaCl в дозе 4–5 мл/кг массы тела, оставаясь ниже базального уровня [39; 20]. Введение 7,5% NaCl с 6% декстраном при геморрагическом шоке у свиней без наркоза оказывало временное повышающее воздействие на выведение мочи и электролитов [46]. В нашей работе объём выделенной мочи и скорость клубочковой фильтрации увеличивались в обеих группах. Объём выделенной мочи увеличился в большей степени под воздействием РРЛ по сравнению с ГР (р<0,05), но в обоих случаях он достигал уровня намного превышающего минимальное значение, равное 1–2 мл/кг/ч, которое необходимо для нормального функционирования почек [27]. Следует отметить отсутствие межгрупповых различий по этим показателям в конце эксперимента, что предполагает необходимость введения цельной крови на ранних стадиях геморрагического шока независимо от типа применяемого кристаллоидного раствора.
Значение эндогенного клиренса креатинина, используемое для оценки индекса скорости клубочковой фильтрации, у собак составляет приблизительно 2–5 мл/кг массы тела [12; 4; 13]. В большинстве лабораторий концентрацию креатинина измеряют с использованием щелочного пикрата, который специфичен не только к креатинину, но и к группе других веществ — так называемых некреатининовых хроматогенов. Так как в нашей лаборатории применяется пикратный метод, полученные результаты можно сравнивать со стандартными значениями для эндогенного клиренса креатинина. После введения РРЛ и ГР значение GFRI увеличилось, в большей степени в группе РРЛ, без достоверного различия между группами. После переливания цельной крови собакам, которым вводили ГР, значение GFRI увеличилось до верхнего предела нормы, что ещё раз подтверждает необходимость гемотрансфузии вместе с предварительным введением ГР.
Преренальные факторы, в том числе и циркуляторный шок, снижающие почечный кровоток, могут привести к острой почечной недостаточности. Эти факторы не являются причиной постоянного повреждения почек, т. е. они обратимы при условии, что гипоперфузия не достигает уровня, при котором развивается ишемия и острый некроз почечных канальцев. Гипоперфузия почек с нарушенной функцией ведёт к усилению реабсорбции натрия и воды с последующей олигурией, низкой концентрацией натрия в моче и её высокой осмолярности [11]. Фракционная экскреция натрия является одним из показателей, используемых в дифференциальной диагностике преренальной азотемии и острого некроза почечных канальцев: значение <1% говорит о преренальной азотемии, >1% — о повреждении канальцев [15]. У здоровых собак породы грейхаунд данный показатель экскреции натрия с мочой колеблется в пределах 0–0,77%, а его стандартное значение равно 0,72% или ниже [1]. Для собак других пород разброс составляет 0,019–0,793% [9]. В нашем исследовании в обеих группах фракционная экскреция натрия, как и предполагалось, была ниже 1% из-за гипоперфузии почек. После введения РРЛ его значение колебалось в пределах 0,85–4,13% (медиана 1,077%). В группе собак, которым вводили ГР, пределы колебания были шире: 0–6,27% (медиана 0,863%). Значения фракционной экскреции натрия, полученные после введения ГР или РРЛ, вероятно, бесполезны для дифференциальной диагностики преренальной азотемии и острого некроза почечных канальцев, так как введение жидкостей и диуретиков ведёт к изменению выделения натрия [15].
В заключение следует отметить, что оба используемых раствора улучшали гемодинамику и функцию почек у собак в течение короткого периода времени от начала геморрагического шока. Быстрое введение большого объёма раствора Рингера лактата вызывало лёгочный застой, в то время как малый объём гипертонического раствора NaCl не перегружал сердечно-сосудистую систему. Так как большие объёмы изотонических кристаллоидных растворов следует вводить в течение более длительного промежутка времени, малые объёмы гипертонических растворов могут быть предпочтительны потому, что сравнимые результаты достигаются намного раньше. Однако эффекты гипотонических растворов кратковременны, что требует введения цельной крови как можно раньше. При введении цельной крови в сочетании с жидкостями в конце эксперимента не отмечено разницы по показателям гемодинамики и функции почек между животными, которым вводили ГР или РРЛ, на основании чего можно предположить, что переливание цельной крови необходимо для достижения положительного эффекта независимо от типа используемого кристаллоидного раствора.
Список литературы
- Bennett SL, Abraham LA, Anderson GA, Holloway SA, Parry BW, 2006. Reference limits for urinary fractional excretion of electrolytes in adult non-racing Greyhound dogs. Australian Veterinary Journal 84, 393–397.
- Bertone JJ, Gossett KA, Shoemaker KE, Bertone AL, Schneiter HL, 1990. Effect of hypertonic vs isotonic saline solution on responses to sublethal Escherichia coli endotoxemia in horses. American Journal of Veterinary Research 51, 999–1007.
- Boldt J.2000. Volume replacement in the surgical patient: does the type of solution make a difference? British Journal of Anaesthesia 84, 783–793.
- Bovee KC, Joyce Z, 1979. Clinical evaluation of glomerular function: 24-hour creatinine clearance in dogs. Journal of the American Veterinary Medical Association 174, 488–491.
- Constable PD, Schmall LM, Muir WW III, Hoffsis GF, 1991. Respiratory, renal, hematologic, and serum biochemical effects of hypertonic saline solution in endotoxemic calves. American Journal of Veterinary Research 52, 990–998.
- Cowley AW Jr, 1992. Long-term regulation of arterial pressure. Physiological Reviews 72, 231–300.
- Day TK, Bateman S, 2006. Shock syndromes. In: Di Bartola SP. ed.. Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice. 3rd ed. Saunders Elsevier, St Louis, Missouri. 540–564.
- Di Bartola SP, 2006. Applied renal physiology. In: Di Bartola SP. ed.. Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice, 3rd ed. Saunders Elsevier, St Louis, Missouri. 26–44.
- Di Bartola SP, Chew DJ, Jacobs G, 1980. Quantitative urinalysis including 24-hour protein excretion in the dog. Journal of American Animal Hospital Association 16, 537–545.
- Dubick MA, Wade CE. 1994. A review of the efficacy and safety of 7.5% NaCl/6% dextran 70 in experimental animals and humans. Journal of Trauma 36, 323–330.
- Dula DJ, Lutz P, Vogel MF, Weaver BN, 1985. Rapid flow rates for the resuscitation of hypovolemic shock. Annals of Emergency Medicine 14, 303–306.
- Elliot J, 1996, Emergency treatment of acute renal failure. In: Bainbridge J, Elliot J. eds.. BSAVA Manual of Canine and Feline Nephrology and Urology, 1st ed. BSAVA, Gloucestershire. 185–194.
- Finco DR, 1971. Simultaneous determination of phe-nosulfonphtalein excretion and endogenous creatinine clearance in the normal dog. Journal of the American Veterinary Medical Association 159, 336–340.
- Finco DR, Tabaru H, Brown SA, Barsanti JA, 1993. Endogenous creatinine clearance measurement of glomerular filtration rate in dogs. American Journal of Veterinary Research 54, 1575–1578.
- Gala GJ, Lilly MP, Thomas SE, Gann DS, 1991. Interaction of sodium and volume in fluid resuscitation after hemorrhage. Journal of Trauma 31, 545–555.
- Gleadhill A, Michell AR, 1996. Clinical measurement of renal function. In: Bainbridge J, Elliot J (eds.. BSAVA Manual of Canine and Feline Nephrology and Urology. 1st ed. BSAVA, Gloucestershire. 107–116.
- Griffel MI, Kaufman BS, 1992. Pharmacology of colloids and crystalloids. Critical Care Clinics 8, 235–253.
- Jan K-M, Heldman J, Chien S, 1980. Coronary hemodynamics and oxygen utilization after hematocrit variations in hemorrhage. American Journal of Physiology 239, H326–H332.
- Katoh H, Kondo U, Yamamoto T, Wakamatsu M, 1992. The catecholamine concentrations of collected autologous blood during adrenalectomy for pheochromocytoma. Masui 41, 992–994.
- Kien ND, Kramer GC, White DA, 1991a. Acute hypotension caused by rapid hypertonic saline infusion in anesthetized dogs. Anesthesia Analgesia 73, 597–602.
- Kien ND, Reitan JA, White DA, Chih-Hsiung W, Eisele JH. 1991b. Cardiac contractility and blood flow distribution following resuscitation with 7.5% hypertonic saline in anesthetized dogs. Circulatory Shock 35, 109–116.
- Kramer GC, Perron PR, Lindsey DG, Ho HS, Gunther RA, Boyle WA, Holcroft J, 1986. Small-volume resuscitation with hypertonic saline dextran solution. Surgery 100, 239–247.
- Krausz MM, 2006. Initial resuscitation of hemorrhagic shock. World Journal of Emergency Surgery 1, 14.
- Lopes OU, Pontieri V, Rocha e Silva M, Velasco IT, 1981. Hyperosmotic NaCl and severe hemorrhagic shock: role of the innervated lung. American Journal of Physiology. Heart and Circulatory Physiology 241, H833–H890.
- Mandell DC, King LG, 1998. Fluid therapy in shock. Veterinary Clinics of North America, Small Animal Practice 28, 623–644.
- Maningas PA, De Guzman LR, Tillman FJ, Hinson CS, Priegnitz KJ, Volk KA, Bellamy RF, 1986. Small-volume infusion of 7.5% NaCl in 6% dextran 70R for the treatment of severe hemorrhagic shock in swine. Annals of Emergency Medicine 15, 1131–1137.
- Manz B, Lorey M, Heyn S, Jacobs R, Krause U, Pollow K, 1990. New radioimmunoassay for epinephrine and norepinephrine in plasma and urine as well as metanephrines and normetanephrines in urine. GIT Labor-Medizin 5, 245–253.
- 27. Mathews KA, 2006. Monitoring fluid therapy and complications of fluid therapy. In: Di Bartola SP (ed.): Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice. 3rd ed. Saunders Elsevier, St Louis, Missouri. 377–391.
- Mermel GW, Boyle WA III, 1986. Hypertonic saline resuscitation following prolonged hemorrhage in the awake dog. Anesthesiology 65, A91.
- Modig J, 1986. Effectiveness of dextran 70 versus Ringerʼs acetate in traumatic shock and acute respiratory distress syndrome. Critical Care Medicine 14, 454–457.
- Moss GS, Lowe RJ, Jilek J, Levine HD, 1981. Colloid or crystalloid in the resuscitation of hemorrhagic shock: a controlled clinical trial. Surgery 89, 434–438.
- Muir WW III, 1990. Small volume resuscitation using hypertonic saline. Cornell Veterinarian 80, 7–12.
- Muir WW III, Sally J, 1989. Small-volume resuscitation with hypertonic saline solution in hypovolemic cats. American Journal of Veterinary Research 50, 1883–1888.
- Nakayama S, Sibley L, Gunther RA, Holcroft JW, Kramer GC, 1984. Small-volume resuscitation with hypertonic saline (2400 mOsm/liter) during hemorrhagic shock. Circulatory Shock 13, 149–159.
- Nerlich M, Gunther R, Demling RH, 1983. Resuscitation from hemorrhagic shock with hypertonic saline or lactated Ringerʼs (effect of the pulmonary and systemic microcirculations). Circulatory Shock 10, 179–188.
- Oblouk Darovic G, Yacone-Morton LA, 1987. Monitoring cardiac output. In: Oblouk Darovic G (ed.): Hemodynamic Monitoring: Invasive and Noninvasive Clinical Application. 2nd ed. WB Saunders Company, Philadelphia. 323–346.
- Petrie A, Watson P, 1999. Statistics for Veterinary and small Animal Science. Blackwell Science Ltd, Oxford. 138–152.
- Pries AR, Neuhaus D, Gaehtgens P, 1992. Blood viscosity in tube flow: dependence on diameter and hematocrit. American Journal of Physiology 263, H1770–H1778.
- Pries AR, Secomb TW, Gebner T, Sperandio MB, Gross JF, Gaehtgens P, 1994. Resistance to blood flow in macrovessels in vivo. Circulation Research 75, 904–915. Veterinarni Medicina, 56, 2011 (4): 187–201.
- Rocha e Silva M, Negraes GA, Soares AM, Pontieri V, Loppnow L, 1986. Hypertonic resuscitation form severe hemorrhagic shock: patterns of regional circulation. Circulatory Shock 19, 165–175.
- Rocha e Silva M, Velasco IT, Nogueira da Silva RI, Oliveira MA, Negraes GA, Oliveira MA, 1987. Hyperosmotic sodium salts reverse severe hemorrhagic shock: other solutes do not. American Journal of Physiology 253, H751–H762.
- Ronning G, Sager G, Revhaug A, 1995. Intraosseus infusion of small volume of hyperosmotic fluid increases mean arterial pressure and lessens the catecholamine response in pigs with haemorrhagic shock. European Journal of Surgery 161, 715–720.
- Rowe GG, McKenna DH, Corliss RJ, Silver S, 1972. Hemodynamic effects of hypertonic sodium chloride. Journal of Applied Physiology 32, 182–184.
- Schertel ER, Valentine AK, Rademakers AM, Muir WW, 1990. Influence of 7% NaCl on the mechanical properties of the systemic circulation in the hypovolemic dog. Circulatory Shock 31, 203–214.
- Shoemaker WC, 1976. Comparisons of the relative effectiveness of whole blood transfusions and various types of fluid therapy in resuscitation. Critical Care Medicine 4, 71–78.
- Smith GJ, Kramer GC, Perron P, Nakyama S, Gunther R A, Holcroft JW, 1985. A comparison of several hypertonic solutions for resuscitation of bled sheep. Journal of Surgical Research 39, 517–528.
- Sondeen JL, Gonzaludo JA, Loveday JA, Rodkey WG, Wade CE, 1990. Hypertonic saline/dextran improves renal function after hemorrhage in conscious swine. Resuscitation 20, 231–241.
- Svensen C, Hahn RG, 1997. Volume kinetics of Ringer solution, dextran 70, and hypertonic saline in male volunteers. Anesthesiology 87, 204–212.
- Tyler JW, DeGraves FJ, Erskine RJ, Riddell MG, Lin HC, Kirk JH, 1994. Milk production in cows with endotoxin-induced mastitis treated with isotonic or hypertonic sodium chloride solution. Journal of the American Veterinary Medicine Association 204, 1949–1952.
- Velasco IT, Pontieri V, Rocha e Silva M, Lopes OU, 1980. Hyperosmotic NaCl and severe hemorrhagic shock. American Journal of Physiology 239, H664–H673.
- Wade CE, Hannon JP, Bossone CA, Hunt MM, Loveday JA, Coppes RI Jr, Gildengorin VL, 1991. Neuroendocrine responses to hypertonic saline/dextran resuscitation following hemorrhage. Circulatory Shock 35, 37–43.
- Walsh JC, Kramer GC, 1991. Resuscitation of hypovolemic sheep with hypertonic saline/dextran: the role of dextran. Circulatory Shock 34, 336–343. White KM. 1987. Continuous monitoring of mixed venous oxygen saturation (SvO2). In: Oblouk Darovic G (ed.): Hemodynamic Monitoring: Invasive and Non-invasive Clinical Application. 2nd ed. WB Saunders Company, Philadelphia. 347–367.
- Zakaria ER, Tsakadze NL, Garrison RN, 2006. Hypertonic saline resuscitation improves intestinal micro-circulation in a rat model of hemorrhagic shock. Surgery 140, 579–587.
Источник: Veterinarni Medicina, 56, 2011 (4): 187–201. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
СВМ № 6/2012
Вам также могут быть интересны статьи:
Диагностика и лечение синдрома диссеминированного внутрисосудистого свертывания (ДВС)
EVECCS. Прогноз ответа на инфузионную терапию: тест с пассивным подъёмом ног (ТППН)